Πρόκειται για υψηλού μοριακού χαρακτήρα οργανικές ενώσεις, βιοπολυμερή, κατασκευασμένα από 20 τύπους υπολειμμάτων L-α-αμινοξέων συνδεδεμένα σε μια συγκεκριμένη αλληλουχία σε μακριές αλυσίδες. Το μοριακό βάρος των πρωτεϊνών κυμαίνεται από 5 χιλιάδες έως 1 εκατομμύριο. Το όνομα «λευκά» δόθηκε για πρώτη φορά στην ουσία των αυγών πτηνών, τα οποία πήζουν όταν θερμαίνονται σε μια λευκή αδιάλυτη μάζα. Ο όρος αργότερα επεκτάθηκε και σε άλλες ουσίες με παρόμοιες ιδιότητες που απομονώθηκαν από ζώα και φυτά.
Ρύζι. 1. Τα πιο πολύπλοκα βιοπολυμερή είναι οι πρωτεΐνες. Τα μακρομόριά τους αποτελούνται από μονομερή, τα οποία είναι αμινοξέα. Κάθε αμινοξύ έχει δύο λειτουργικές ομάδες: μια καρβοξυλική ομάδα και μια αμινομάδα. Όλη η ποικιλομορφία των πρωτεϊνών δημιουργείται ως αποτέλεσμα διαφορετικών συνδυασμών 20 αμινοξέων.
Οι πρωτεΐνες κυριαρχούν έναντι όλων των άλλων ενώσεων που υπάρχουν στους ζωντανούς οργανισμούς, και συνήθως αντιπροσωπεύουν περισσότερο από το μισό του ξηρού βάρους τους. Υποτίθεται ότι υπάρχουν πολλά δισεκατομμύρια μεμονωμένες πρωτεΐνες στη φύση (για παράδειγμα, περισσότερες από 3 χιλιάδες διαφορετικές πρωτεΐνες υπάρχουν μόνο στο βακτήριο E. coli).
Οι πρωτεΐνες παίζουν βασικό ρόλο στις διαδικασίες ζωής οποιουδήποτε οργανισμού. Οι πρωτεΐνες περιλαμβάνουν ένζυμα, με τη συμμετοχή των οποίων συμβαίνουν όλοι οι χημικοί μετασχηματισμοί στο κύτταρο (μεταβολισμός). ελέγχουν τη δράση των γονιδίων. με τη συμμετοχή τους, πραγματοποιείται η δράση των ορμονών, πραγματοποιείται διαμεμβρανική μεταφορά, συμπεριλαμβανομένης της δημιουργίας νευρικών ερεθισμάτων. Αποτελούν αναπόσπαστο μέρος του ανοσοποιητικού συστήματος (ανοσοσφαιρίνες) και του συστήματος πήξης, αποτελούν τη βάση των οστών και του συνδετικού ιστού και εμπλέκονται στον μετασχηματισμό και τη χρήση της ενέργειας.
Ιστορία της έρευνας πρωτεϊνών
Οι πρώτες προσπάθειες απομόνωσης πρωτεϊνών έγιναν τον 18ο αιώνα. Στις αρχές του 19ου αιώνα, εμφανίστηκαν οι πρώτες εργασίες για τη χημική μελέτη των πρωτεϊνών. Οι Γάλλοι επιστήμονες Joseph Louis Gay-Lussac και Louis Jacques Thénard προσπάθησαν να καθορίσουν τη στοιχειακή σύνθεση πρωτεϊνών από διαφορετικές πηγές, γεγονός που σηματοδότησε την αρχή συστηματικών αναλυτικών μελετών, χάρη στις οποίες συνήχθη το συμπέρασμα ότι όλες οι πρωτεΐνες είναι παρόμοιες στο σύνολο των στοιχείων που περιλαμβάνονται στο τη σύνθεσή τους. Το 1836, ο Ολλανδός χημικός G. J. Mulder πρότεινε την πρώτη θεωρία για τη δομή των πρωτεϊνικών ουσιών, σύμφωνα με την οποία όλες οι πρωτεΐνες έχουν μια ορισμένη υποθετική ρίζα (C 40 H 62 N 10 O 12), που σχετίζεται σε διάφορες αναλογίες με άτομα θείου και φωσφόρου. Ονόμασε αυτή τη ρίζα «πρωτεΐνη» (από την ελληνική πρωτεΐνη - πρώτα, κύρια). Η θεωρία του Mulder συνέβαλε στην αύξηση του ενδιαφέροντος για τη μελέτη των πρωτεϊνών και στη βελτίωση των μεθόδων της χημείας των πρωτεϊνών. Αναπτύχθηκαν τεχνικές για την απομόνωση πρωτεϊνών με εκχύλιση με διαλύματα ουδέτερων αλάτων και ελήφθησαν πρωτεΐνες σε κρυσταλλική μορφή για πρώτη φορά (ορισμένες φυτικές πρωτεΐνες). Για να αναλύσουν τις πρωτεΐνες, άρχισαν να χρησιμοποιούν την προκαταρκτική πέψη τους με οξέα και αλκάλια.
Ταυτόχρονα, άρχισε να δίνεται αυξανόμενη προσοχή στη μελέτη της πρωτεϊνικής λειτουργίας. Ο Jens Jakob Berzelius ήταν ο πρώτος που πρότεινε το 1835 να παίξουν το ρόλο των βιοκαταλυτών. Σύντομα, ανακαλύφθηκαν πρωτεολυτικά ένζυμα - πεψίνη (T. Schwann, 1836) και θρυψίνη (L. Corvisart, 1856), τα οποία τράβηξαν την προσοχή στη φυσιολογία της πέψης και στην ανάλυση των προϊόντων που σχηματίζονται κατά τη διάσπαση των θρεπτικών συστατικών. Περαιτέρω μελέτες της δομής των πρωτεϊνών και η εργασία για τη χημική σύνθεση των πεπτιδίων οδήγησαν στην εμφάνιση της υπόθεσης του πεπτιδίου, σύμφωνα με την οποία όλες οι πρωτεΐνες είναι κατασκευασμένες από αμινοξέα. Μέχρι το τέλος του 19ου αιώνα, μελετήθηκαν τα περισσότερα από τα αμινοξέα που συνθέτουν τις πρωτεΐνες.
Στις αρχές του 20ου αιώνα, ο Γερμανός χημικός Emil Hermann Fischer ήταν ο πρώτος που χρησιμοποίησε τις μεθόδους της οργανικής χημείας για τη μελέτη των πρωτεϊνών και απέδειξε ότι οι πρωτεΐνες αποτελούνται από β-αμινοξέα συνδεδεμένα μεταξύ τους με έναν αμιδικό (πεπτιδικό) δεσμό. Αργότερα, χάρη στη χρήση φυσικοχημικών μεθόδων ανάλυσης, προσδιορίστηκε η μοριακή μάζα πολλών πρωτεϊνών, καθορίστηκε το σφαιρικό σχήμα των σφαιρικών πρωτεϊνών, πραγματοποιήθηκε ανάλυση περίθλασης ακτίνων Χ αμινοξέων και πεπτιδίων και μέθοδοι χρωματογραφικής ανάλυσης αναπτύχθηκε (βλ. χρωματογραφία).
Η πρώτη πρωτεϊνική ορμόνη απομονώθηκε (Frederick Grant Banting, John James Rickard McLeod, 1922), αποδείχθηκε η παρουσία γ-σφαιρινών στα αντισώματα και περιγράφηκε η ενζυματική λειτουργία της μυϊκής πρωτεΐνης μυοσίνης (Vladimir Aleksandrovich Engelhardt, M. N. Lyubimova, 1939). . Για πρώτη φορά, ελήφθησαν ένζυμα σε κρυσταλλική μορφή - ουρεάση (J.B. Saliner, 1926), πεψίνη (J.H. Nortron, 1929), λυσοζύμη (E.P. Abraham, Robert Robinson, 1937).

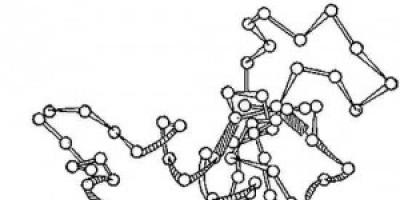
Ρύζι. 2. Σχήμα της τρισδιάστατης δομής του ενζύμου λυσοζύμη. Κύκλοι - αμινοξέα; κλώνοι - πεπτιδικοί δεσμοί. τα σκιασμένα ορθογώνια είναι δισουλφιδικοί δεσμοί. Σπειροειδή και επιμήκη τμήματα της πολυπεπτιδικής αλυσίδας είναι ορατά.
Στη δεκαετία του 1950, αποδείχθηκε η οργάνωση τριών επιπέδων των μορίων πρωτεΐνης - η παρουσία μιας πρωτογενούς, δευτερογενούς και τριτογενούς δομής. δημιούργησε έναν αυτόματο αναλυτή αμινοξέων (Stanford Moore, William Howard Stein, 1950). Στη δεκαετία του '60, έγιναν προσπάθειες για χημική σύνθεση πρωτεϊνών (ινσουλίνη, ριβονουκλεάση). Οι μέθοδοι ανάλυσης περίθλασης ακτίνων Χ έχουν βελτιωθεί σημαντικά. δημιουργήθηκε μια συσκευή - ένας προσδιοριστής αλληλουχίας (P. Edman, G. Begg, 1967), ο οποίος κατέστησε δυνατό τον προσδιορισμό της αλληλουχίας των αμινοξέων σε μια πολυπεπτιδική αλυσίδα. Συνέπεια αυτού ήταν η δημιουργία της δομής πολλών εκατοντάδων πρωτεϊνών από διάφορες πηγές. Μεταξύ αυτών είναι πρωτεολυτικά ένζυμα (πεψίνη, θρυψίνη, χυμοθρυψίνη, σουμπτιλισίνη, καρβοξυπεπτιδάσες), μυοσφαιρίνες, αιμοσφαιρίνες, κυτοχρώματα, λυσοζύμες, ανοσοσφαιρίνες, ιστόνες, νευροτοξίνες, πρωτεΐνες ιικού φακέλου, πρωτεΐνες-πρωτεΐνες. Ως αποτέλεσμα, προέκυψαν προϋποθέσεις για την επίλυση πιεστικών προβλημάτων στην ενζυμολογία, την ανοσολογία, την ενδοκρινολογία και άλλους τομείς της βιολογικής χημείας.
Στα τέλη του 20ου αιώνα, σημειώθηκε σημαντική πρόοδος στη μελέτη του ρόλου των πρωτεϊνών στη σύνθεση μήτρας των βιοπολυμερών, στην κατανόηση των μηχανισμών δράσης τους σε διάφορες διαδικασίες ζωής των οργανισμών και στη δημιουργία της σύνδεσης μεταξύ της δομής και της λειτουργίας τους. Η βελτίωση των μεθόδων έρευνας και η εμφάνιση νέων μεθόδων διαχωρισμού πρωτεϊνών και πεπτιδίων είχαν μεγάλη σημασία.
Η ανάπτυξη μιας αποτελεσματικής μεθόδου για την ανάλυση της αλληλουχίας των νουκλεοτιδίων στα νουκλεϊκά οξέα κατέστησε δυνατή τη σημαντική απλοποίηση και επιτάχυνση του προσδιορισμού της αλληλουχίας αμινοξέων στις πρωτεΐνες. Αυτό αποδείχθηκε ότι είναι δυνατό επειδή η σειρά των αμινοξέων σε μια πρωτεΐνη καθορίζεται από την αλληλουχία των νουκλεοτιδίων στο γονίδιο που κωδικοποιεί αυτήν την πρωτεΐνη (θραύσμα). Κατά συνέπεια, γνωρίζοντας τη διάταξη των νουκλεοτιδίων σε αυτό το γονίδιο και τον γενετικό κώδικα, μπορεί κανείς να προβλέψει με ακρίβεια με ποια σειρά βρίσκονται τα αμινοξέα στην πολυπεπτιδική αλυσίδα μιας πρωτεΐνης. Μαζί με την πρόοδο στη δομική ανάλυση των πρωτεϊνών, έχουν επιτευχθεί σημαντικά αποτελέσματα στη μελέτη της χωρικής τους οργάνωσης, μηχανισμών σχηματισμού και δράσης υπερμοριακών συμπλεγμάτων, συμπεριλαμβανομένων ριβοσωμάτων και άλλων κυτταρικών οργανιδίων, χρωματίνης, ιών κ.λπ.
Δομή πρωτεΐνης
Σχεδόν όλες οι πρωτεΐνες είναι κατασκευασμένες από 20 α-αμινοξέα που ανήκουν στη σειρά L και είναι ίδιες σε όλους σχεδόν τους οργανισμούς. Τα αμινοξέα στις πρωτεΐνες συνδέονται μεταξύ τους με έναν πεπτιδικό δεσμό -CO-NH-, ο οποίος σχηματίζεται από την καρβοξυλική και -αμινο ομάδα των γειτονικών υπολειμμάτων αμινοξέων: δύο αμινοξέα σχηματίζουν ένα διπεπτίδιο στο οποίο το τελικό καρβοξυλικό (-COOH) και η αμινομάδα (Η2Ν-) παραμένει ελεύθερη, στην οποία μπορούν να προστεθούν νέα αμινοξέα για να σχηματίσουν μια πολυπεπτιδική αλυσίδα.
Το τμήμα της αλυσίδας στο οποίο βρίσκεται η τερματική ομάδα H 2 N ονομάζεται Ν-τερματικό και το τμήμα απέναντι από αυτό ονομάζεται C-τερματικό. Η τεράστια ποικιλία των πρωτεϊνών καθορίζεται από την αλληλουχία της διάταξης και τον αριθμό των υπολειμμάτων αμινοξέων που περιέχουν. Αν και δεν υπάρχει σαφής διάκριση, οι κοντές αλυσίδες συνήθως ονομάζονται πεπτίδια ή ολιγοπεπτίδια (από το oligo...), και τα πολυπεπτίδια (πρωτεΐνες) συνήθως νοούνται ως αλυσίδες που αποτελούνται από 50 ή περισσότερες. Οι πιο κοινές πρωτεΐνες είναι αυτές που περιέχουν 100-400 υπολείμματα αμινοξέων, αλλά υπάρχουν και εκείνες των οποίων τα μόρια σχηματίζονται από 1000 ή περισσότερα υπολείμματα. Οι πρωτεΐνες μπορεί να αποτελούνται από πολλές πολυπεπτιδικές αλυσίδες. Σε τέτοιες πρωτεΐνες, κάθε πολυπεπτιδική αλυσίδα ονομάζεται υπομονάδα.
Χωρική δομή πρωτεϊνών

Ρύζι. 3. Η πρωτεΐνη σε όλους τους οργανισμούς αποτελείται από 20 είδη αμινοξέων. Κάθε πρωτεΐνη χαρακτηρίζεται από μια συγκεκριμένη ποικιλία και ποσοτική αναλογία αμινοξέων. Στα πρωτεϊνικά μόρια, τα αμινοξέα συνδέονται μεταξύ τους με πεπτιδικούς δεσμούς (-CO-NH-) σε γραμμική αλληλουχία, αποτελώντας τη λεγόμενη πρωτογενή δομή της πρωτεΐνης. Κορυφαία γραμμή - ελεύθερα αμινοξέα με πλευρικές ομάδες R1, R2, R3. κατώτατη γραμμή - τα αμινοξέα συνδέονται με πεπτιδικούς δεσμούς.
Η πολυπεπτιδική αλυσίδα είναι ικανή να σχηματίζει και να διατηρεί αυθόρμητα μια ειδική χωρική δομή. Με βάση το σχήμα των μορίων πρωτεΐνης, οι πρωτεΐνες χωρίζονται σε ινώδεις και σφαιρικές. Στις σφαιρικές πρωτεΐνες, μία ή περισσότερες πολυπεπτιδικές αλυσίδες διπλώνονται σε μια συμπαγή σφαιρική δομή ή σφαιρίδιο. Συνήθως αυτές οι πρωτεΐνες είναι πολύ διαλυτές στο νερό. Αυτά περιλαμβάνουν σχεδόν όλα τα ένζυμα, πρωτεΐνες μεταφοράς αίματος και πολλές πρωτεΐνες αποθήκευσης. Οι ινιδώδεις πρωτεΐνες είναι μόρια που μοιάζουν με νήματα που συγκρατούνται μεταξύ τους με διασταυρούμενες συνδέσεις και σχηματίζουν μακριές ίνες ή στρώσεις. Έχουν υψηλή μηχανική αντοχή, είναι αδιάλυτα στο νερό και επιτελούν κυρίως δομικές και προστατευτικές λειτουργίες. Τυπικοί εκπρόσωποι τέτοιων πρωτεϊνών είναι οι κερατίνες μαλλιών και μαλλιού, το ινώδες μετάξι και το κολλαγόνο των τενόντων.
Η σειρά των ομοιοπολικά συνδεδεμένων αμινοξέων σε μια πολυπεπτιδική αλυσίδα ονομάζεται αλληλουχία αμινοξέων ή η πρωτογενής δομή των πρωτεϊνών. Η πρωτογενής δομή κάθε πρωτεΐνης, που κωδικοποιείται από το αντίστοιχο γονίδιο, είναι σταθερή και φέρει όλες τις απαραίτητες πληροφορίες για το σχηματισμό δομών υψηλότερου επιπέδου. Ο πιθανός αριθμός πρωτεϊνών που μπορούν να σχηματιστούν από 20 αμινοξέα είναι πρακτικά απεριόριστος.
Ως αποτέλεσμα της αλληλεπίδρασης πλευρικών ομάδων υπολειμμάτων αμινοξέων, μεμονωμένα σχετικά μικρά τμήματα της πολυπεπτιδικής αλυσίδας λαμβάνουν τη μία ή την άλλη διαμόρφωση (τύπος αναδίπλωσης), γνωστή ως δευτερογενής δομή πρωτεϊνών. Τα πιο χαρακτηριστικά στοιχεία του είναι η περιοδικά επαναλαμβανόμενη α-έλικα και β-δομή. Η δευτερεύουσα δομή είναι πολύ σταθερή. Δεδομένου ότι καθορίζεται σε μεγάλο βαθμό από την αλληλουχία αμινοξέων της αντίστοιχης περιοχής πρωτεΐνης, καθίσταται δυνατή η πρόβλεψή της με έναν ορισμένο βαθμό πιθανότητας. Ο όρος «α-έλικα» εισήχθη από τον Αμερικανό βιοχημικό, φυσικό και χημικό Linus Carl Pauling, ο οποίος περιέγραψε τη διάταξη της πολυπεπτιδικής αλυσίδας στην πρωτεΐνη α-κερατίνη με τη μορφή δεξιόστροφης έλικας (η α-έλικα μπορεί να συγκριθεί με ένα καλώδιο τηλεφώνου). Για κάθε στροφή μιας τέτοιας έλικας σε μια πρωτεΐνη υπάρχουν 3,6 υπολείμματα αμινοξέων. Αυτό σημαίνει ότι η ομάδα -C=O ενός πεπτιδικού δεσμού σχηματίζει έναν δεσμό υδρογόνου με την ομάδα -NH ενός άλλου πεπτιδικού δεσμού, τέσσερα υπολείμματα αμινοξέων μακριά από τον πρώτο. Κατά μέσο όρο, κάθε α-ελικοειδές περιοχή περιλαμβάνει έως και 15 αμινοξέα, τα οποία αντιστοιχούν σε 3-4 στροφές της έλικας. Αλλά σε κάθε μεμονωμένη πρωτεΐνη, το μήκος της έλικας μπορεί να διαφέρει πολύ από αυτήν την τιμή. Σε διατομή, η α-έλικα έχει σχήμα δίσκου, από τον οποίο οι πλευρικές αλυσίδες αμινοξέων δείχνουν προς τα έξω.
Δομή ή; -διπλωμένο στρώμα, μπορεί να σχηματιστεί από διάφορα τμήματα της πολυπεπτιδικής αλυσίδας. Αυτά τα τμήματα τεντώνονται και τοποθετούνται παράλληλα μεταξύ τους, συνδέονται μεταξύ τους με δεσμούς υδρογόνου που εμφανίζονται μεταξύ πεπτιδικών δεσμών. Μπορούν να προσανατολιστούν προς τις ίδιες ή αντίθετες κατευθύνσεις (η κατεύθυνση της κίνησης κατά μήκος της πολυπεπτιδικής αλυσίδας συνήθως θεωρείται ότι είναι από το Ν-άκρο προς το C-άκρο). Στην πρώτη περίπτωση, το διπλωμένο στρώμα ονομάζεται παράλληλο, στη δεύτερη - αντιπαράλληλο. Το τελευταίο σχηματίζεται όταν η πεπτιδική αλυσίδα κάνει μια απότομη στροφή προς τα πίσω, σχηματίζοντας μια κάμψη (α-κάμψη). Οι πλευρικές αλυσίδες αμινοξέων είναι προσανατολισμένες κάθετες στο επίπεδο; -στρώμα.
Σχετικό περιεχόμενο; -σπιράλ τομές και; -Οι δομές μπορεί να ποικίλλουν ευρέως μεταξύ διαφορετικών πρωτεϊνών. Υπάρχουν πρωτεΐνες με κυριαρχία των α-έλικων (περίπου το 75% των αμινοξέων στη μυοσφαιρίνη και την αιμοσφαιρίνη) και ο κύριος τύπος αναδίπλωσης αλυσίδας σε πολλές ινώδεις πρωτεΐνες (συμπεριλαμβανομένης της ινώδους μεταξιού, της β-κερατίνης) είναι η α-έλικα. -δομή. Οι περιοχές της πολυπεπτιδικής αλυσίδας που δεν μπορούν να ταξινομηθούν σε καμία από τις παραπάνω περιγραφείσες διαμορφώσεις ονομάζονται συνδετικοί βρόχοι. Η δομή τους καθορίζεται κυρίως από τις αλληλεπιδράσεις μεταξύ των πλευρικών αλυσίδων αμινοξέων και στο μόριο οποιασδήποτε πρωτεΐνης ταιριάζει με αυστηρά καθορισμένο τρόπο.
Η τριτογενής δομή ονομάζεταιχωρική δομή των σφαιρικών πρωτεϊνών. Συχνά όμως αυτή η έννοια αναφέρεται στη μέθοδο αναδίπλωσης της πολυπεπτιδικής αλυσίδας στο χώρο, χαρακτηριστική για κάθε συγκεκριμένη πρωτεΐνη. Η τριτοταγής δομή σχηματίζεται από την πολυπεπτιδική αλυσίδα μιας πρωτεΐνης αυθόρμητα, προφανώς, κατά μήκος μιας ορισμένης διαδρομής(ών) πήξης με τον προκαταρκτικό σχηματισμό στοιχείων δευτερεύουσας δομής. Εάν η σταθερότητα της δευτερεύουσας δομής οφείλεται σε δεσμούς υδρογόνου, τότε η τριτοταγής δομή καθορίζεται από ένα ποικίλο σύστημα μη ομοιοπολικών αλληλεπιδράσεων: υδρογόνο, ιοντικές, διαμοριακές αλληλεπιδράσεις, καθώς και υδρόφοβες επαφές μεταξύ των πλευρικών αλυσίδων μη πολικών αμινοξέων. υπολείμματα οξέος.
Σε ορισμένες πρωτεΐνες, η τριτοταγής δομή σταθεροποιείται περαιτέρω με το σχηματισμό δισουλφιδικών δεσμών (-S-S-δεσμών) μεταξύ των υπολειμμάτων κυστεΐνης. Κατά κανόνα, μέσα στο πρωτεϊνικό σφαιρίδιο υπάρχουν πλευρικές αλυσίδες υδρόφοβων αμινοξέων που συναρμολογούνται στον πυρήνα (η μεταφορά τους μέσα στο πρωτεϊνικό σφαιρίδιο είναι θερμοδυναμικά ευνοϊκή) και στην περιφέρεια υπάρχουν υδρόφιλα υπολείμματα και μερικά υδρόφοβα. Το πρωτεϊνικό σφαιρίδιο περιβάλλεται από αρκετές εκατοντάδες μόρια νερού ενυδάτωσης, το οποίο είναι απαραίτητο για τη σταθερότητα του μορίου πρωτεΐνης και συχνά εμπλέκεται στη λειτουργία του. Η τριτογενής δομή είναι κινητή, τα επιμέρους τμήματα της μπορούν να μετατοπιστούν, γεγονός που οδηγεί σε διαμορφωτικές μεταβάσεις που παίζουν σημαντικό ρόλο στην αλληλεπίδραση της πρωτεΐνης με άλλα μόρια.
Η τριτογενής δομή είναι η βάση των λειτουργικών ιδιοτήτων μιας πρωτεΐνης. Καθορίζει τον σχηματισμό συνόλων λειτουργικών ομάδων στα πρωτεϊνικά ενεργά κέντρα και ζώνες δέσμευσης, τους δίνει την απαραίτητη γεωμετρία, επιτρέπει τη δημιουργία ενός εσωτερικού περιβάλλοντος, που είναι προϋπόθεση για την εμφάνιση πολλών αντιδράσεων και διασφαλίζει την αλληλεπίδραση με άλλες πρωτεΐνες. .
Η τριτοταγής δομή των πρωτεϊνών αντιστοιχεί σαφώς στην πρωτογενή δομή της. υπάρχει πιθανώς ένας ακόμη μη αποκρυπτογραφημένος στερεοχημικός κώδικας που καθορίζει τη φύση της αναδίπλωσης των πρωτεϊνών. Ωστόσο, μια και η ίδια μέθοδος χωρικής διάταξης συνήθως δεν αντιστοιχεί σε μια πρωτογενή δομή, αλλά σε μια ολόκληρη οικογένεια δομών στις οποίες μόνο ένα μικρό κλάσμα (έως 20-30%) των υπολειμμάτων αμινοξέων μπορεί να συμπίπτει, αλλά σε ορισμένες θέσεις στην αλυσίδα διατηρείται η ομοιότητα των υπολειμμάτων αμινοξέων. Το αποτέλεσμα είναι ο σχηματισμός μεγάλων οικογενειών πρωτεϊνών που χαρακτηρίζονται από παρόμοια τριτοταγή και περισσότερο ή λιγότερο παρόμοια πρωτογενή δομή και, κατά κανόνα, κοινή λειτουργία. Αυτές είναι, για παράδειγμα, πρωτεΐνες οργανισμών διαφορετικών ειδών που έχουν την ίδια λειτουργία και σχετίζονται εξελικτικά: μυοσφαιρίνες και αιμοσφαιρίνες, θρυψίνη, χυμοθρυψίνη, ελαστάση και άλλες ζωικές πρωτεϊνάσες.

Ρύζι. 4. Ως αποτέλεσμα του συνδυασμού πολλών μακρομορίων πρωτεΐνης με τριτοταγή δομή, μια δομή τεταρτοταγούς πρωτεΐνης σχηματίζεται σε ένα σύμπλοκο σύμπλοκο. Ένα παράδειγμα τέτοιων πολύπλοκων πρωτεϊνών είναι η αιμοσφαιρίνη, που αποτελείται από τέσσερα μακρομόρια.
Συχνά, ειδικά σε μεγάλες πρωτεΐνες, η αναδίπλωση μιας πολυπεπτιδικής αλυσίδας συμβαίνει μέσω του σχηματισμού από μεμονωμένα τμήματα της αλυσίδας περισσότερο ή λιγότερο αυτόνομων στοιχείων χωρικής δομής - τομέων που μπορούν να έχουν λειτουργική αυτονομία, υπεύθυνες για τη μία ή την άλλη βιολογική δραστηριότητα του πρωτεΐνη. Έτσι, οι Ν-τερματικές περιοχές των πρωτεϊνών πήξης του αίματος εξασφαλίζουν την πρόσδεσή τους στην κυτταρική μεμβράνη.
Υπάρχουν πολλές πρωτεΐνες των οποίων τα μόρια είναι ένα σύνολο σφαιριδίων (υπομονάδων) που συγκρατούνται μαζί με υδρόφοβες αλληλεπιδράσεις, υδρογόνο ή ιοντικούς δεσμούς. Τέτοια σύμπλοκα ονομάζονται ολιγομερείς, πολυμερείς ή υπομονάδες πρωτεΐνες. Η διάταξη των υπομονάδων σε ένα λειτουργικά ενεργό σύμπλεγμα πρωτεΐνης ονομάζεται τεταρτοταγής δομή της πρωτεΐνης. Ορισμένες πρωτεΐνες είναι ικανές να σχηματίζουν δομές υψηλότερης τάξης, για παράδειγμα, πολυενζυμικά σύμπλοκα, εκτεταμένες δομές (πρωτεΐνες περιβλήματος βακτηριοφάγου), υπερμοριακά σύμπλοκα που λειτουργούν ως ενιαίο σύνολο (για παράδειγμα, ριβοσώματα ή συστατικά της μιτοχονδριακής αναπνευστικής αλυσίδας).
Η τεταρτοταγής δομή επιτρέπει τη δημιουργία μορίων με ασυνήθιστες γεωμετρίες. Έτσι, η φερριτίνη, που σχηματίζεται από 24 υπομονάδες, έχει μια εσωτερική κοιλότητα, χάρη στην οποία η πρωτεΐνη καταφέρνει να δεσμεύσει έως και 3000 ιόντα σιδήρου. Επιπλέον, η τεταρτοταγής δομή επιτρέπει να εκτελούνται πολλές διαφορετικές λειτουργίες σε ένα μόριο. Η συνθετάση τρυπτοφάνης συνδυάζει ένζυμα υπεύθυνα για πολλά διαδοχικά στάδια της σύνθεσης του αμινοξέος τρυπτοφάνη.
Μέθοδοι για τη μελέτη της δομής των πρωτεϊνών
Η πρωτογενής δομή των πρωτεϊνών καθορίζει όλα τα άλλα επίπεδα οργάνωσης του μορίου πρωτεΐνης. Επομένως, κατά τη μελέτη της βιολογικής λειτουργίας διαφόρων πρωτεϊνών, η γνώση αυτής της δομής είναι σημαντική. Η πρώτη πρωτεΐνη για την οποία καθιερώθηκε η αλληλουχία αμινοξέων ήταν η παγκρεατική ορμόνη, η ινσουλίνη. Αυτή η εργασία, η οποία διήρκεσε 11 χρόνια, πραγματοποιήθηκε από τον Άγγλο βιοχημικό Frederick Sanger (1954). Προσδιόρισε τη θέση 51 αμινοξέων στο μόριο της ορμόνης και έδειξε ότι αποτελείται από 2 αλυσίδες που συνδέονται με δισουλφιδικούς δεσμούς. Αργότερα, το μεγαλύτερο μέρος της εργασίας για τη δημιουργία της πρωτογενούς δομής των πρωτεϊνών αυτοματοποιήθηκε.
Με την ανάπτυξη μεθόδων γενετικής μηχανικής, κατέστη δυνατή η περαιτέρω επιτάχυνση αυτής της διαδικασίας με τον προσδιορισμό της πρωτογενούς δομής των πρωτεϊνών σύμφωνα με τα αποτελέσματα της ανάλυσης της αλληλουχίας νουκλεοτιδίων στα γονίδια που κωδικοποιούν αυτές τις πρωτεΐνες. Η δευτερογενής και τριτογενής δομή των πρωτεϊνών μελετάται χρησιμοποιώντας αρκετά πολύπλοκες φυσικές μεθόδους, για παράδειγμα, κυκλική διχρωμία ή ανάλυση περίθλασης ακτίνων Χ πρωτεϊνικών κρυστάλλων. Η τριτογενής δομή καθιερώθηκε για πρώτη φορά από τον Άγγλο βιοχημικό John Cowdery Kendrew (1957) για τη μυϊκή πρωτεΐνη μυοσφαιρίνη.

Ρύζι. 5. Μοντέλο του μορίου της μυοσφαιρίνης (χωρική διαμόρφωση του μορίου)
Μετουσίωσης πρωτεϊνών
Οι σχετικά αδύναμοι δεσμοί που είναι υπεύθυνοι για τη σταθεροποίηση των δευτερογενών, τριτοταγών και τεταρτοταγών δομών της πρωτεΐνης καταστρέφονται εύκολα, γεγονός που συνοδεύεται από απώλεια της βιολογικής της δραστηριότητας. Η καταστροφή της αρχικής (εγγενούς) πρωτεϊνικής δομής, που ονομάζεται μετουσίωση, συμβαίνει παρουσία οξέων και βάσεων, με θέρμανση, αλλαγές στην ιοντική ισχύ και άλλες επιδράσεις. Κατά κανόνα, οι μετουσιωμένες πρωτεΐνες είναι ελάχιστα ή καθόλου διαλυτές στο νερό. Με βραχυπρόθεσμη επίδραση και ταχεία εξάλειψη των μετουσιωτικών παραγόντων, είναι δυνατή η επαναδιάταξη πρωτεΐνης με πλήρη ή μερική αποκατάσταση της αρχικής δομής και των βιολογικών ιδιοτήτων.
Ταξινόμηση πρωτεϊνών
Η πολυπλοκότητα της δομής των πρωτεϊνικών μορίων και η εξαιρετική ποικιλία λειτουργιών που εκτελούν καθιστούν δύσκολη τη δημιουργία μιας ενοποιημένης και ξεκάθαρης ταξινόμησης τους, αν και έχουν γίνει επανειλημμένες προσπάθειες από τα τέλη του 19ου αιώνα. Με βάση τη χημική τους σύσταση, οι πρωτεΐνες χωρίζονται σε απλές και σύνθετες (μερικές φορές ονομάζονται πρωτεΐδες). Τα μόρια του πρώτου αποτελούνται μόνο από αμινοξέα. Εκτός από την ίδια την πολυπεπτιδική αλυσίδα, οι σύνθετες πρωτεΐνες περιέχουν μη πρωτεϊνικά συστατικά που αντιπροσωπεύονται από υδατάνθρακες (γλυκοπρωτεΐνες), λιπίδια (λιποπρωτεΐνες), νουκλεϊκά οξέα (νουκλεοπρωτεΐνες), μεταλλικά ιόντα (μεταλλοπρωτεΐνες), φωσφορική ομάδα (φωσφοπρωτεΐνες), χρωστικές ουσίες (χρωμοπρωτεΐνες), και τα λοιπά. .
Ανάλογα με τις λειτουργίες που επιτελούν, διακρίνονται διάφορες κατηγορίες πρωτεϊνών. Η πιο ποικιλόμορφη και πιο εξειδικευμένη κατηγορία αποτελείται από πρωτεΐνες με καταλυτική λειτουργία - ένζυμα που έχουν την ικανότητα να επιταχύνουν τις χημικές αντιδράσεις που συμβαίνουν σε ζωντανούς οργανισμούς. Με αυτή την ιδιότητα, οι πρωτεΐνες συμμετέχουν σε όλες τις διαδικασίες σύνθεσης και διάσπασης διαφόρων ενώσεων κατά το μεταβολισμό, στη βιοσύνθεση πρωτεϊνών και νουκλεϊκών οξέων, στη ρύθμιση της κυτταρικής ανάπτυξης και διαφοροποίησης. Οι πρωτεΐνες μεταφοράς έχουν την ικανότητα να δεσμεύουν επιλεκτικά λιπαρά οξέα, ορμόνες και άλλες οργανικές και ανόργανες ενώσεις και ιόντα και στη συνέχεια να τα μεταφέρουν με ρεύμα στην επιθυμητή θέση (για παράδειγμα, η αιμοσφαιρίνη εμπλέκεται στη μεταφορά οξυγόνου από τους πνεύμονες σε όλα τα κύτταρα το σώμα). Οι πρωτεΐνες μεταφοράς πραγματοποιούν επίσης ενεργή μεταφορά ιόντων, λιπιδίων, σακχάρων και αμινοξέων μέσω των βιολογικών μεμβρανών.
Οι δομικές πρωτεΐνες εκτελούν υποστηρικτική ή προστατευτική λειτουργία. συμμετέχουν στο σχηματισμό του κυτταρικού σκελετού. Τα πιο κοινά μεταξύ αυτών είναι το κολλαγόνο του συνδετικού ιστού, η κερατίνη, τα νύχια και τα φτερά, η ελαστίνη των αγγειακών κυττάρων και πολλά άλλα. Σε συνδυασμό με τα λιπίδια, αποτελούν τη δομική βάση των κυτταρικών και ενδοκυτταρικών μεμβρανών.
Ένας αριθμός πρωτεϊνών εκτελεί προστατευτική λειτουργία. Για παράδειγμα, οι ανοσοσφαιρίνες (αντισώματα) των σπονδυλωτών, που έχουν την ικανότητα να δεσμεύουν ξένους παθογόνους μικροοργανισμούς και ουσίες, να εξουδετερώνουν τις παθογόνες επιδράσεις τους στον οργανισμό και να εμποδίζουν τον πολλαπλασιασμό των κυττάρων. Το ινωδογόνο και η θρομβίνη εμπλέκονται στη διαδικασία πήξης του αίματος. Πολλές πρωτεϊνικές ουσίες που εκκρίνονται από βακτήρια, καθώς και συστατικά ορισμένων ασπόνδυλων, ταξινομούνται ως τοξίνες.
Ορισμένες πρωτεΐνες (ρυθμιστικές) εμπλέκονται στη ρύθμιση της φυσιολογικής δραστηριότητας του σώματος ως συνόλου, μεμονωμένων οργάνων, κυττάρων ή διεργασιών. Ελέγχουν τη γονιδιακή μεταγραφή και τη σύνθεση πρωτεϊνών. Αυτές περιλαμβάνουν πεπτιδικές-πρωτεϊνικές ορμόνες που εκκρίνονται από τους ενδοκρινείς αδένες. Οι πρωτεΐνες αποθήκευσης σπόρων παρέχουν θρεπτικά συστατικά για τα αρχικά στάδια ανάπτυξης του εμβρύου. Αυτά περιλαμβάνουν επίσης καζεΐνη, λευκωματίνη ασπράδι αυγού (ωοαλβουμίνη) και πολλά άλλα. Χάρη στις πρωτεΐνες, τα μυϊκά κύτταρα αποκτούν την ικανότητα να συστέλλονται και τελικά να παρέχουν κίνηση στο σώμα. Παραδείγματα τέτοιων συσταλτικών πρωτεϊνών είναι η ακτίνη και η μυοσίνη των σκελετικών μυών, καθώς και η τουμπουλίνη, που είναι συστατικά των βλεφαρίδων και των μαστιγίων των μονοκύτταρων οργανισμών. Εξασφαλίζουν επίσης την απόκλιση των χρωμοσωμάτων κατά την κυτταρική διαίρεση.
Οι πρωτεΐνες των υποδοχέων είναι ο στόχος των ορμονών και άλλων βιολογικά ενεργών ενώσεων. Με τη βοήθειά τους, το κύτταρο αντιλαμβάνεται πληροφορίες σχετικά με την κατάσταση του εξωτερικού περιβάλλοντος. Παίζουν σημαντικό ρόλο στη μετάδοση της νευρικής διέγερσης και στην προσανατολισμένη κυτταρική κίνηση (χημειοτάξη). Ο μετασχηματισμός και η χρήση της ενέργειας που εισέρχεται στο σώμα, καθώς και της ενέργειας, συμβαίνει επίσης με τη συμμετοχή πρωτεϊνών του συστήματος βιοενέργειας (για παράδειγμα, η οπτική χρωστική ουσία ροδοψίνη, κυτοχρώματα της αναπνευστικής αλυσίδας). Υπάρχουν επίσης πολλές πρωτεΐνες με άλλες, μερικές φορές μάλλον ασυνήθιστες λειτουργίες (για παράδειγμα, το πλάσμα ορισμένων ψαριών της Ανταρκτικής περιέχει πρωτεΐνες που έχουν αντιψυκτικές ιδιότητες).
Βιοσύνθεση πρωτεϊνών
Όλες οι πληροφορίες σχετικά με τη δομή μιας συγκεκριμένης πρωτεΐνης «αποθηκεύονται» στα αντίστοιχα γονίδια με τη μορφή μιας ακολουθίας νουκλεοτιδίων και υλοποιούνται στη διαδικασία σύνθεσης προτύπου. Αρχικά, οι πληροφορίες μεταφέρονται (διαβάζονται) από το μόριο DNA στο αγγελιοφόρο RNA (mRNA) χρησιμοποιώντας το ένζυμο εξαρτώμενο από το DNA RNA πολυμεράση και στη συνέχεια στο ριβόσωμα στο mRNA, όπως σε μια μήτρα σύμφωνα με τον γενετικό κώδικα, με τη συμμετοχή των RNA μεταφοράς που παρέχουν αμινοξέα, ο σχηματισμός λαμβάνει χώρα πολυπεπτιδική αλυσίδα.
Οι συντιθέμενες πολυπεπτιδικές αλυσίδες που αναδύονται από το ριβόσωμα, αναδιπλώνονται αυθόρμητα, παίρνουν το χαρακτηριστικό διαμόρφωσης της πρωτεΐνης και μπορούν να υποβληθούν σε μετα-μεταφραστική τροποποίηση. Οι πλευρικές αλυσίδες των μεμονωμένων αμινοξέων μπορούν να υποστούν τροποποιήσεις (υδροξυλίωση, φωσφορυλίωση κ.λπ.). Γι' αυτό, για παράδειγμα, η υδροξυπρολίνη και η υδροξυλυσίνη βρίσκονται στο κολλαγόνο (βλ.). Η τροποποίηση μπορεί επίσης να συνοδεύεται από ρήξη πολυπεπτιδικών δεσμών. Με αυτόν τον τρόπο, για παράδειγμα, συμβαίνει ο σχηματισμός ενός ενεργού μορίου ινσουλίνης, που αποτελείται από δύο αλυσίδες που συνδέονται με δισουλφιδικούς δεσμούς.

Ρύζι. 6. Γενικό σχήμα βιοσύνθεσης πρωτεϊνών.
Η σημασία των πρωτεϊνών στη διατροφή
Οι πρωτεΐνες είναι τα πιο σημαντικά συστατικά της τροφής των ζώων και των ανθρώπων. Η θρεπτική αξία των πρωτεϊνών καθορίζεται από την περιεκτικότητά τους σε απαραίτητα αμινοξέα, τα οποία δεν παράγονται στον ίδιο τον οργανισμό. Από αυτή την άποψη, οι φυτικές πρωτεΐνες είναι λιγότερο πολύτιμες από τις ζωικές πρωτεΐνες: είναι φτωχότερες σε λυσίνη, μεθειονίνη και τρυπτοφάνη και είναι πιο δύσκολο να αφομοιωθούν στο γαστρεντερικό σωλήνα. Η έλλειψη απαραίτητων αμινοξέων στα τρόφιμα οδηγεί σε σοβαρές διαταραχές του μεταβολισμού του αζώτου.
Οι πρωτεΐνες διασπώνται σε ελεύθερα αμινοξέα, τα οποία, μετά την απορρόφηση στο έντερο, εισέρχονται και κατανέμονται σε όλα τα κύτταρα. Μερικά από αυτά διασπώνται σε απλές ενώσεις με την απελευθέρωση ενέργειας, που χρησιμοποιείται για διάφορες ανάγκες από το κύτταρο, και μερικά πηγαίνουν στη σύνθεση νέων πρωτεϊνών χαρακτηριστικών ενός δεδομένου οργανισμού. (R. A. Matveeva, Encyclopedia Cyril and Methodius)
Αριθμός πρωτεϊνών
- αμυλοειδές - αμυλοειδές;
- ανιονικό - ανιονικό;
- antivirus - antivirus?
- αυτοάνοσο - αυτοάνοσο;
- αυτόλογη - αυτόλογη;
- βακτηριακό - βακτηριακό;
- Bence Jones πρωτεΐνη;
- που προκαλείται από ιούς - προκαλείται από ιό;
- ιογενής - ιός;
- Viral nonstructural - virus nonstructural;
- Viral structural - virus structural;
- ειδικά για ιούς - ειδικά για ιούς;
- υψηλό μοριακό βάρος - υψηλό μοριακό βάρος.
- που περιέχει αίμη - αίμη;
- ετερόλογος - ξένος;
- υβριδικό - υβριδικό;
- γλυκοζυλιωμένο - γλυκοζυλιωμένο;
- σφαιρικό - σφαιρικό?
- μετουσιωμένη - μετουσιωμένη;
- που περιέχει σίδηρο - σίδηρος;
- κρόκος - κρόκος?
- ζωική πρωτεΐνη - ζωική πρωτεΐνη;
- προστατευτικό - αμυντικό?
- ανοσοποιητικό - ανοσοποιητικό?
- ανοσογονικό - ανοσολογικά σχετικό.
- δέσμευση ασβεστίου?
- ξινό - όξινο;
- corpuscular - σωματιδιακή;
- μεμβράνη - μεμβράνη?
- μυέλωμα - μυέλωμα;
- μικροσωμικό - μικροσωμικό;
- πρωτεΐνη γάλακτος - πρωτεΐνη γάλακτος;
- μονοκλωνική - μονοκλωνική ανοσοσφαιρίνη;
- μυϊκή πρωτεΐνη - μυϊκή πρωτεΐνη;
- εγγενής - εγγενής;
- nonhistone - nonhistone;
- ελαττωματικό - μερικό?
- αδιάλυτο - αδιάλυτο;
- άπεπτο - αδιάλυτο;
- μη ενζυματικό - μη ενζυματικό;
- χαμηλό μοριακό βάρος - χαμηλό μοριακό βάρος.
- νέα πρωτεΐνη - νέα πρωτεΐνη?
- γενικό - ολόκληρο;
- ογκογόνος - ογκοπρωτεΐνη;
- πρωτεΐνη κύριας φάσης - ανιονική.
- πρωτεΐνη οξείας φάσης (φλεγμονή) - πρωτεΐνη οξείας φάσης.
- τρόφιμα - τρόφιμα?
- πρωτεΐνη πλάσματος αίματος - πρωτεΐνη πλάσματος;
- πλακούντας - πλακούντας;
- αποσύνδεση - αποσύνδεση;
- πρωτεΐνη του αναγεννητικού νεύρου?
- ρυθμιστικό - ρυθμιστικό;
- ανασυνδυασμός - ανασυνδυασμένος;
- υποδοχέας - υποδοχέας;
- ριβοσωμικό - ριβοσωμικό;
- δεσμευτικό - δεσμευτικό;
- εκκριτική πρωτεΐνη - εκκριτική πρωτεΐνη;
- C-reactive - C-reactive;
- πρωτεΐνη ορού γάλακτος - πρωτεΐνη ορού γάλακτος, λακτοπρωτεΐνη.
- ιστός - ιστός;
- τοξικό - τοξικό;
- χιμαιρικό - χιμαιρικό;
- ολόκληρο - ολόκληρο;
- cytosolic - cytosolic;
- αλκαλική πρωτεΐνη - ανιονική πρωτεΐνη.
- εξωγενής - εξωγενής;
- ενδογενής - ενδογενής πρωτεΐνη.
Διαβάστε περισσότερα για τις πρωτεΐνες στη βιβλιογραφία:
- Volkenshtein M.V., Molecules and, Μ., 1965, κεφ. 3 - 5;
- Gaurowitz F., Chemistry and functions of proteins, trans. από τα αγγλικά, Μόσχα, 1965;
- Sissakyan N. M. and Gladilin K. L., Biochemical aspects of protein synthesis, στο βιβλίο: Advances in biological chemistry, τόμος 7, Μ., 1965, σελ. 3;
- Stepanov V. M. Μοριακή βιολογία. Δομή και λειτουργία των πρωτεϊνών. Μ., 1996;
- Shamin Α. Ν., Development of protein chemistry, Μ., 1966;
- Πρωτεΐνες και πεπτίδια. Μ., 1995-2000. Τ. 1-3;
- Biosynthesis of protein and nucleic acids, ed. A. S. Spirina, Μ., 1965;
- Εισαγωγή στη μοριακή βιολογία, μτφρ. από τα αγγλικά, Μ., 1967
- Μόρια και κύτταρα. [Σάββ. Art.], μετάφρ. από τα αγγλικά, Μ., 1966, σελ. 7 - 27, 94 - 106;
- Fundamentals of biochemistry: Translation from English M., 1981. T. 1;
- Το πρόβλημα της πρωτεΐνης. Μ., 1995. Τ. 1-5;
- Οι Πρωτεΐνες. Νέα Υόρκη, 1975-79. 3 ed. V. 1-4.
Βρείτε κάτι άλλο ενδιαφέρον:
σκίουροι- οργανικές ενώσεις υψηλού μοριακού βάρους που αποτελούνται από υπολείμματα α-αμινοξέων.
ΣΕ πρωτεϊνική σύνθεσηπεριλαμβάνει άνθρακα, υδρογόνο, άζωτο, οξυγόνο, θείο. Ορισμένες πρωτεΐνες σχηματίζουν σύμπλοκα με άλλα μόρια που περιέχουν φώσφορο, σίδηρο, ψευδάργυρο και χαλκό.
Οι πρωτεΐνες έχουν μεγάλο μοριακό βάρος: αλβουμίνη αυγού - 36.000, αιμοσφαιρίνη - 152.000, μυοσίνη - 500.000. Για σύγκριση: το μοριακό βάρος της αλκοόλης είναι 46, το οξικό οξύ - 60, το βενζόλιο - 78.
Σύνθεση αμινοξέων πρωτεϊνών
σκίουροι- μη περιοδικά πολυμερή, τα μονομερή των οποίων είναι α-αμινοξέα. Τυπικά, 20 τύποι α-αμινοξέων ονομάζονται μονομερή πρωτεΐνης, αν και πάνω από 170 από αυτά βρίσκονται σε κύτταρα και ιστούς.
Ανάλογα με το αν τα αμινοξέα μπορούν να συντεθούν στο σώμα των ανθρώπων και άλλων ζώων, διακρίνονται: μη απαραίτητα αμινοξέα- μπορεί να συντεθεί. απαραίτητα αμινοξέα- δεν μπορεί να συντεθεί. Τα απαραίτητα αμινοξέα πρέπει να παρέχονται στον οργανισμό μέσω της τροφής. Τα φυτά συνθέτουν όλους τους τύπους αμινοξέων.
Ανάλογα με τη σύνθεση των αμινοξέων, οι πρωτεΐνες είναι: πλήρεις- περιέχει ολόκληρο το σύνολο των αμινοξέων. ελαττωματικός- ορισμένα αμινοξέα λείπουν στη σύνθεσή τους. Εάν οι πρωτεΐνες αποτελούνται μόνο από αμινοξέα, ονομάζονται απλός. Εάν οι πρωτεΐνες περιέχουν, εκτός από τα αμινοξέα, ένα μη αμινοξικό συστατικό (προσθετική ομάδα), ονομάζονται συγκρότημα. Η προσθετική ομάδα μπορεί να αντιπροσωπεύεται από μέταλλα (μεταλλοπρωτεΐνες), υδατάνθρακες (γλυκοπρωτεΐνες), λιπίδια (λιποπρωτεΐνες), νουκλεϊκά οξέα (νουκλεοπρωτεΐνες).
Ολα αμινοξέα περιέχουν: 1) καρβοξυλική ομάδα (-COOH), 2) αμινομάδα (-ΝΗ 2), 3) ρίζα ή ομάδα R (το υπόλοιπο μόριο). Η δομή της ρίζας είναι διαφορετική για διαφορετικούς τύπους αμινοξέων. Ανάλογα με τον αριθμό των αμινομάδων και των καρβοξυλομάδων που περιλαμβάνονται στη σύνθεση των αμινοξέων, διακρίνονται: ουδέτερα αμινοξέαέχοντας μία καρβοξυλομάδα και μία αμινομάδα. βασικά αμινοξέαέχουν περισσότερες από μία αμινομάδες. όξινα αμινοξέαέχουν περισσότερες από μία καρβοξυλομάδες.
Τα αμινοξέα είναι αμφοτερικές ενώσεις, αφού στο διάλυμα μπορούν να λειτουργήσουν και ως οξέα και ως βάσεις. Σε υδατικά διαλύματα, τα αμινοξέα υπάρχουν σε διαφορετικές ιοντικές μορφές.
Πεπτιδικός δεσμός
Πεπτίδια- οργανικές ουσίες που αποτελούνται από υπολείμματα αμινοξέων που συνδέονται με πεπτιδικούς δεσμούς.
Ο σχηματισμός πεπτιδίων συμβαίνει ως αποτέλεσμα της αντίδρασης συμπύκνωσης των αμινοξέων. Όταν η αμινομάδα ενός αμινοξέος αλληλεπιδρά με την καρβοξυλική ομάδα ενός άλλου, δημιουργείται μεταξύ τους ένας ομοιοπολικός δεσμός αζώτου-άνθρακα, ο οποίος ονομάζεται πεπτίδιο. Ανάλογα με τον αριθμό των υπολειμμάτων αμινοξέων που περιλαμβάνονται στο πεπτίδιο, υπάρχουν διπεπτίδια, τριπεπτίδια, τετραπεπτίδιακαι τα λοιπά. Ο σχηματισμός ενός πεπτιδικού δεσμού μπορεί να επαναληφθεί πολλές φορές. Αυτό οδηγεί στο σχηματισμό πολυπεπτίδια. Στο ένα άκρο του πεπτιδίου υπάρχει μια ελεύθερη αμινομάδα (που ονομάζεται Ν-άκρο), και στο άλλο υπάρχει μια ελεύθερη καρβοξυλική ομάδα (που ονομάζεται C-άκρο).

Χωρική οργάνωση πρωτεϊνικών μορίων
Η απόδοση ορισμένων ειδικών λειτουργιών από τις πρωτεΐνες εξαρτάται από τη χωρική διαμόρφωση των μορίων τους· επιπλέον, είναι ενεργειακά δυσμενές για το κύτταρο να διατηρεί τις πρωτεΐνες σε μη αναδιπλωμένη μορφή, με τη μορφή αλυσίδας, επομένως οι πολυπεπτιδικές αλυσίδες αναδιπλώνονται, αποκτώντας ορισμένη τρισδιάστατη δομή ή διαμόρφωση. Υπάρχουν 4 επίπεδα χωρική οργάνωση των πρωτεϊνών.
Δομή πρωτογενούς πρωτεΐνης- την αλληλουχία της διάταξης των υπολειμμάτων αμινοξέων στην πολυπεπτιδική αλυσίδα που συνθέτει το μόριο της πρωτεΐνης. Ο δεσμός μεταξύ των αμινοξέων είναι ένας πεπτιδικός δεσμός.

Εάν ένα μόριο πρωτεΐνης αποτελείται από μόνο 10 υπολείμματα αμινοξέων, τότε ο αριθμός των θεωρητικά πιθανών παραλλαγών των μορίων πρωτεΐνης που διαφέρουν ως προς τη σειρά εναλλαγής των αμινοξέων είναι 10 20. Έχοντας 20 αμινοξέα, μπορείτε να κάνετε ακόμα πιο διαφορετικούς συνδυασμούς από αυτά. Περίπου δέκα χιλιάδες διαφορετικές πρωτεΐνες έχουν βρεθεί στο ανθρώπινο σώμα, οι οποίες διαφέρουν τόσο μεταξύ τους όσο και από τις πρωτεΐνες άλλων οργανισμών.
Είναι η πρωταρχική δομή του μορίου πρωτεΐνης που καθορίζει τις ιδιότητες των μορίων πρωτεΐνης και τη χωρική του διαμόρφωση. Η αντικατάσταση μόνο ενός αμινοξέος με ένα άλλο σε μια πολυπεπτιδική αλυσίδα οδηγεί σε αλλαγή στις ιδιότητες και τις λειτουργίες της πρωτεΐνης. Για παράδειγμα, η αντικατάσταση του έκτου γλουταμινικού αμινοξέος με βαλίνη στη β-υπομονάδα της αιμοσφαιρίνης οδηγεί στο γεγονός ότι το μόριο της αιμοσφαιρίνης στο σύνολό του δεν μπορεί να εκτελέσει την κύρια λειτουργία του - μεταφορά οξυγόνου. Σε τέτοιες περιπτώσεις, το άτομο αναπτύσσει μια ασθένεια που ονομάζεται δρεπανοκυτταρική αναιμία.
Δευτερεύουσα δομή- διατεταγμένη αναδίπλωση της πολυπεπτιδικής αλυσίδας σε μια σπείρα (μοιάζει με εκτεταμένο ελατήριο). Οι στροφές της έλικας ενισχύονται από δεσμούς υδρογόνου που προκύπτουν μεταξύ καρβοξυλομάδων και αμινομάδων. Σχεδόν όλες οι ομάδες CO και NH συμμετέχουν στο σχηματισμό δεσμών υδρογόνου. Είναι πιο αδύναμα από τα πεπτιδικά, αλλά, επαναλαμβανόμενα πολλές φορές, προσδίδουν σταθερότητα και ακαμψία σε αυτή τη διαμόρφωση. Στο επίπεδο της δευτερογενούς δομής, υπάρχουν πρωτεΐνες: ινώδες (μετάξι, ιστός αράχνης), κερατίνη (μαλλιά, νύχια), κολλαγόνο (τένοντες).



Τριτογενής δομή- συσσώρευση πολυπεπτιδικών αλυσίδων σε σφαιρίδια, που προκύπτουν από το σχηματισμό χημικών δεσμών (υδρογόνο, ιοντικό, δισουλφίδιο) και τη δημιουργία υδρόφοβων αλληλεπιδράσεων μεταξύ των ριζών των υπολειμμάτων αμινοξέων. Τον κύριο ρόλο στο σχηματισμό της τριτογενούς δομής παίζουν οι υδρόφιλες-υδρόφοβες αλληλεπιδράσεις. Σε υδατικά διαλύματα, οι υδρόφοβες ρίζες τείνουν να κρύβονται από το νερό, ομαδοποιούνται μέσα στο σφαιρίδιο, ενώ οι υδρόφιλες ρίζες, ως αποτέλεσμα της ενυδάτωσης (αλληλεπίδραση με δίπολα νερού), τείνουν να εμφανίζονται στην επιφάνεια του μορίου. Σε ορισμένες πρωτεΐνες, η τριτοταγής δομή σταθεροποιείται από δισουλφιδικούς ομοιοπολικούς δεσμούς που σχηματίζονται μεταξύ των ατόμων θείου δύο υπολειμμάτων κυστεΐνης. Σε επίπεδο τριτογενούς δομής υπάρχουν ένζυμα, αντισώματα και ορισμένες ορμόνες.

Τεταρτογενής δομήχαρακτηριστικό των σύνθετων πρωτεϊνών των οποίων τα μόρια σχηματίζονται από δύο ή περισσότερα σφαιρίδια. Οι υπομονάδες διατηρούνται στο μόριο με ιοντικές, υδρόφοβες και ηλεκτροστατικές αλληλεπιδράσεις. Μερικές φορές, κατά το σχηματισμό μιας τεταρτοταγούς δομής, εμφανίζονται δισουλφιδικοί δεσμοί μεταξύ των υπομονάδων. Η πιο μελετημένη πρωτεΐνη με τεταρτοταγή δομή είναι αιμοσφαιρίνη. Σχηματίζεται από δύο α-υπομονάδες (141 υπολείμματα αμινοξέων) και δύο β-υπομονάδες (146 υπολείμματα αμινοξέων). Με κάθε υπομονάδα συνδέεται ένα μόριο αίμης που περιέχει σίδηρο.
Εάν για κάποιο λόγο η χωρική διαμόρφωση των πρωτεϊνών αποκλίνει από το φυσιολογικό, η πρωτεΐνη δεν μπορεί να εκτελέσει τις λειτουργίες της. Για παράδειγμα, η αιτία της «νόσος των τρελών αγελάδων» (σπογγώδης εγκεφαλοπάθεια) είναι η ανώμαλη διαμόρφωση των πριόντων, των επιφανειακών πρωτεϊνών των νευρικών κυττάρων.
Ιδιότητες πρωτεϊνών
Η σύνθεση και η δομή των αμινοξέων του μορίου της πρωτεΐνης το καθορίζουν ιδιότητες. Οι πρωτεΐνες συνδυάζουν βασικές και όξινες ιδιότητες, που καθορίζονται από τις ρίζες αμινοξέων: όσο περισσότερα όξινα αμινοξέα σε μια πρωτεΐνη, τόσο πιο έντονες είναι οι όξινες ιδιότητες της. Καθορίζεται η δυνατότητα δωρεάς και προσθήκης H+ ρυθμιστικές ιδιότητες των πρωτεϊνών; Ένα από τα πιο ισχυρά ρυθμιστικά διαλύματα είναι η αιμοσφαιρίνη στα ερυθρά αιμοσφαίρια, η οποία διατηρεί το pH του αίματος σε σταθερό επίπεδο. Υπάρχουν διαλυτές πρωτεΐνες (ινωδογόνο), και υπάρχουν αδιάλυτες πρωτεΐνες που εκτελούν μηχανικές λειτουργίες (ινώδες, κερατίνη, κολλαγόνο). Υπάρχουν πρωτεΐνες που είναι χημικά ενεργές (ένζυμα), υπάρχουν χημικά ανενεργές πρωτεΐνες που είναι ανθεκτικές σε διάφορες περιβαλλοντικές συνθήκες και αυτές που είναι εξαιρετικά ασταθείς.
Εξωτερικοί παράγοντες (θερμότητα, υπεριώδης ακτινοβολία, βαρέα μέταλλα και τα άλατά τους, αλλαγές pH, ακτινοβολία, αφυδάτωση)
μπορεί να προκαλέσει διαταραχή της δομικής οργάνωσης του μορίου της πρωτεΐνης. Η διαδικασία απώλειας της τρισδιάστατης διαμόρφωσης που είναι εγγενής σε ένα δεδομένο μόριο πρωτεΐνης ονομάζεται μετουσίωση. Η αιτία της μετουσίωσης είναι το σπάσιμο των δεσμών που σταθεροποιούν μια ορισμένη δομή πρωτεΐνης. Αρχικά σπάνε οι πιο αδύναμοι δεσμοί και όσο οι συνθήκες γίνονται πιο αυστηρές, σπάνε ακόμα πιο δυνατοί. Επομένως, χάνονται πρώτα οι τεταρτοταγείς, μετά οι τριτογενείς και δευτερεύουσες δομές. Μια αλλαγή στη χωρική διαμόρφωση οδηγεί σε αλλαγή των ιδιοτήτων της πρωτεΐνης και, ως αποτέλεσμα, καθιστά αδύνατη για την πρωτεΐνη να εκτελέσει τις εγγενείς βιολογικές της λειτουργίες. Εάν η μετουσίωση δεν συνοδεύεται από καταστροφή της πρωτογενούς δομής, τότε μπορεί να είναι αναστρεπτός, σε αυτή την περίπτωση, λαμβάνει χώρα αυτο-ανάκτηση του χαρακτηριστικού της διαμόρφωσης της πρωτεΐνης. Για παράδειγμα, οι πρωτεΐνες υποδοχέα της μεμβράνης υφίστανται τέτοια μετουσίωση. Η διαδικασία αποκατάστασης της δομής της πρωτεΐνης μετά τη μετουσίωση ονομάζεται αναγέννηση. Εάν η αποκατάσταση της χωρικής διαμόρφωσης της πρωτεΐνης είναι αδύνατη, τότε ονομάζεται μετουσίωση μη αναστρεψιμο.
Λειτουργίες πρωτεϊνών
| Λειτουργία | Παραδείγματα και εξηγήσεις |
|---|---|
| Κατασκευή | Οι πρωτεΐνες συμμετέχουν στο σχηματισμό κυτταρικών και εξωκυτταρικών δομών: αποτελούν μέρος των κυτταρικών μεμβρανών (λιποπρωτεΐνες, γλυκοπρωτεΐνες), των μαλλιών (κερατίνη), των τενόντων (κολλαγόνο) κ.λπ. |
| Μεταφορά | Η πρωτεΐνη του αίματος αιμοσφαιρίνη προσδίδει οξυγόνο και το μεταφέρει από τους πνεύμονες σε όλους τους ιστούς και τα όργανα και από αυτούς μεταφέρει διοξείδιο του άνθρακα στους πνεύμονες. Η σύνθεση των κυτταρικών μεμβρανών περιλαμβάνει ειδικές πρωτεΐνες που εξασφαλίζουν την ενεργό και αυστηρά επιλεκτική μεταφορά ορισμένων ουσιών και ιόντων από το κύτταρο στο εξωτερικό περιβάλλον και πίσω. |
| Ρυθμιστική | Οι πρωτεϊνικές ορμόνες συμμετέχουν στη ρύθμιση των μεταβολικών διεργασιών. Για παράδειγμα, η ορμόνη ινσουλίνη ρυθμίζει τα επίπεδα γλυκόζης στο αίμα, προάγει τη σύνθεση γλυκογόνου και αυξάνει τον σχηματισμό λιπών από υδατάνθρακες. |
| Προστατευτικός | Ως απάντηση στη διείσδυση ξένων πρωτεϊνών ή μικροοργανισμών (αντιγόνων) στο σώμα, σχηματίζονται ειδικές πρωτεΐνες - αντισώματα που μπορούν να τις δεσμεύσουν και να τις εξουδετερώσουν. Το ινώδες, που σχηματίζεται από ινωδογόνο, βοηθά στη διακοπή της αιμορραγίας. |
| Μοτέρ | Οι συσταλτικές πρωτεΐνες ακτίνη και μυοσίνη παρέχουν μυϊκή σύσπαση σε πολυκύτταρα ζώα. |
| Σήμα | Στην επιφανειακή μεμβράνη του κυττάρου είναι ενσωματωμένα μόρια πρωτεΐνης που είναι ικανά να αλλάζουν την τριτοταγή δομή τους ως απόκριση σε περιβαλλοντικούς παράγοντες, λαμβάνοντας έτσι σήματα από το εξωτερικό περιβάλλον και μεταδίδοντας εντολές στο κύτταρο. |
| Αποθήκευση | Στο σώμα των ζώων, οι πρωτεΐνες, κατά κανόνα, δεν αποθηκεύονται, με εξαίρεση την αλβουμίνη αυγού και την καζεΐνη γάλακτος. Αλλά χάρη στις πρωτεΐνες, ορισμένες ουσίες μπορούν να αποθηκευτούν στο σώμα· για παράδειγμα, κατά τη διάσπαση της αιμοσφαιρίνης, ο σίδηρος δεν απομακρύνεται από το σώμα, αλλά αποθηκεύεται, σχηματίζοντας ένα σύμπλεγμα με την πρωτεΐνη φερριτίνη. |
| Ενέργεια | Όταν 1 g πρωτεΐνης διασπάται σε τελικά προϊόντα, απελευθερώνονται 17,6 kJ. Πρώτα, οι πρωτεΐνες διασπώνται σε αμινοξέα και στη συνέχεια στα τελικά προϊόντα - νερό, διοξείδιο του άνθρακα και αμμωνία. Ωστόσο, οι πρωτεΐνες χρησιμοποιούνται ως πηγή ενέργειας μόνο όταν εξαντληθούν άλλες πηγές (υδατάνθρακες και λίπη). |
| Καταλυτικός | Μία από τις πιο σημαντικές λειτουργίες των πρωτεϊνών. Παρέχεται από πρωτεΐνες - ένζυμα που επιταχύνουν τις βιοχημικές αντιδράσεις που συμβαίνουν στα κύτταρα. Για παράδειγμα, η διφωσφορική καρβοξυλάση της ριβουλόζης καταλύει τη στερέωση του CO 2 κατά τη φωτοσύνθεση. |
Ένζυμα
Ένζυμα, ή ένζυμα, είναι μια ειδική κατηγορία πρωτεϊνών που είναι βιολογικοί καταλύτες. Χάρη στα ένζυμα, οι βιοχημικές αντιδράσεις συμβαίνουν με τρομερή ταχύτητα. Η ταχύτητα των ενζυματικών αντιδράσεων είναι δεκάδες χιλιάδες φορές (και μερικές φορές εκατομμύρια) μεγαλύτερη από την ταχύτητα των αντιδράσεων που συμβαίνουν με τη συμμετοχή ανόργανων καταλυτών. Η ουσία στην οποία δρα το ένζυμο ονομάζεται υπόστρωμα.
Τα ένζυμα είναι σφαιρικές πρωτεΐνες, δομικά χαρακτηριστικάΤα ένζυμα μπορούν να χωριστούν σε δύο ομάδες: απλά και σύνθετα. Απλά ένζυμαείναι απλές πρωτεΐνες, δηλ. αποτελείται μόνο από αμινοξέα. Σύνθετα ένζυμαείναι σύνθετες πρωτεΐνες, δηλ. Εκτός από το μέρος της πρωτεΐνης, περιέχουν μια ομάδα μη πρωτεϊνικής φύσης - συμπαράγοντας. Ορισμένα ένζυμα χρησιμοποιούν βιταμίνες ως συμπαράγοντες. Το μόριο του ενζύμου περιέχει ένα ειδικό τμήμα που ονομάζεται ενεργό κέντρο. Ενεργό κέντρο- ένα μικρό τμήμα του ενζύμου (από τρία έως δώδεκα υπολείμματα αμινοξέων), όπου η δέσμευση του υποστρώματος ή των υποστρωμάτων λαμβάνει χώρα για να σχηματίσει ένα σύμπλοκο ενζύμου-υποστρώματος. Με την ολοκλήρωση της αντίδρασης, το σύμπλοκο ενζύμου-υποστρώματος διασπάται στο ένζυμο και στο προϊόν(α) της αντίδρασης. Ορισμένα ένζυμα έχουν (εκτός από τα ενεργά) αλλοστερικά κέντρα- περιοχές στις οποίες είναι συνδεδεμένοι ρυθμιστές ταχύτητας ενζύμου ( αλλοστερικά ένζυμα).

Οι αντιδράσεις της ενζυματικής κατάλυσης χαρακτηρίζονται από: 1) υψηλή απόδοση, 2) αυστηρή επιλεκτικότητα και κατεύθυνση δράσης, 3) ειδικότητα υποστρώματος, 4) λεπτή και ακριβή ρύθμιση. Η εξειδίκευση του υποστρώματος και της αντίδρασης των αντιδράσεων ενζυματικής κατάλυσης εξηγείται από τις υποθέσεις των E. Fischer (1890) και D. Koshland (1959).
E. Fisher (υπόθεση κλειδώματος κλειδιού)πρότεινε ότι οι χωρικές διαμορφώσεις της ενεργού θέσης του ενζύμου και του υποστρώματος πρέπει να αντιστοιχούν ακριβώς μεταξύ τους. Το υπόστρωμα συγκρίνεται με το «κλειδί», το ένζυμο με το «κλείδωμα».
D. Koshland (υπόθεση για το χέρι-γάντι)πρότεινε ότι η χωρική αντιστοιχία μεταξύ της δομής του υποστρώματος και του ενεργού κέντρου του ενζύμου δημιουργείται μόνο τη στιγμή της αλληλεπίδρασής τους μεταξύ τους. Αυτή η υπόθεση ονομάζεται επίσης υπόθεση επαγόμενης αντιστοιχίας.
Ο ρυθμός των ενζυματικών αντιδράσεων εξαρτάται από: 1) θερμοκρασία, 2) συγκέντρωση ενζύμου, 3) συγκέντρωση υποστρώματος, 4) pH. Πρέπει να τονιστεί ότι εφόσον τα ένζυμα είναι πρωτεΐνες, η δραστηριότητά τους είναι υψηλότερη υπό φυσιολογικά φυσιολογικές συνθήκες.
Τα περισσότερα ένζυμα μπορούν να λειτουργήσουν μόνο σε θερμοκρασίες μεταξύ 0 και 40°C. Εντός αυτών των ορίων, ο ρυθμός αντίδρασης αυξάνεται περίπου 2 φορές με κάθε αύξηση της θερμοκρασίας κατά 10 °C. Σε θερμοκρασίες άνω των 40 °C, η πρωτεΐνη υφίσταται μετουσίωση και η ενζυμική δραστηριότητα μειώνεται. Σε θερμοκρασίες κοντά στην κατάψυξη, τα ένζυμα αδρανοποιούνται.
Καθώς η ποσότητα του υποστρώματος αυξάνεται, ο ρυθμός της ενζυματικής αντίδρασης αυξάνεται έως ότου ο αριθμός των μορίων του υποστρώματος ισούται με τον αριθμό των μορίων του ενζύμου. Με περαιτέρω αύξηση της ποσότητας του υποστρώματος, η ταχύτητα δεν θα αυξηθεί, αφού τα ενεργά κέντρα του ενζύμου είναι κορεσμένα. Η αύξηση της συγκέντρωσης του ενζύμου οδηγεί σε αυξημένη καταλυτική δραστηριότητα, καθώς ένας μεγαλύτερος αριθμός μορίων υποστρώματος υφίσταται μετασχηματισμούς ανά μονάδα χρόνου.

Για κάθε ένζυμο, υπάρχει μια βέλτιστη τιμή pH στην οποία εμφανίζει μέγιστη δραστικότητα (πεψίνη - 2,0, αμυλάση σιέλου - 6,8, παγκρεατική λιπάση - 9,0). Σε υψηλότερες ή χαμηλότερες τιμές pH, η ενζυμική δραστηριότητα μειώνεται. Με ξαφνικές αλλαγές στο pH, το ένζυμο μετουσιώνεται.
Η ταχύτητα των αλλοστερικών ενζύμων ρυθμίζεται από ουσίες που συνδέονται με αλλοστερικά κέντρα. Εάν αυτές οι ουσίες επιταχύνουν μια αντίδραση, ονομάζονται ενεργοποιητές, αν επιβραδύνουν - αναστολείς.
Ταξινόμηση ενζύμων
Σύμφωνα με τον τύπο των χημικών μετασχηματισμών που καταλύουν, τα ένζυμα χωρίζονται σε 6 κατηγορίες:
- οξειρεδουκτάσες(μεταφορά ατόμων υδρογόνου, οξυγόνου ή ηλεκτρονίων από τη μια ουσία στην άλλη - αφυδρογονάση),
- τρανσφεράσες(μεταφορά μεθυλίου, ακυλίου, φωσφορικού ή αμινομάδας από τη μια ουσία στην άλλη - τρανσαμινάση),
- υδρολάσες(αντιδράσεις υδρόλυσης στις οποίες σχηματίζονται δύο προϊόντα από το υπόστρωμα - αμυλάση, λιπάση),
- λυάσες(μη υδρολυτική προσθήκη στο υπόστρωμα ή αποκόλληση μιας ομάδας ατόμων από αυτό, οπότε οι δεσμοί C-C, C-N, C-O, C-S μπορούν να σπάσουν - αποκαρβοξυλάση),
- ισομεράσες(ενδομοριακή αναδιάταξη - ισομεράση),
- λιγάσες(η σύνδεση δύο μορίων ως αποτέλεσμα του σχηματισμού δεσμών C-C, C-N, C-O, C-S - συνθετάση).
Οι κλάσεις με τη σειρά τους υποδιαιρούνται σε υποκατηγορίες και υποκατηγορίες. Στην τρέχουσα διεθνή ταξινόμηση, κάθε ένζυμο έχει έναν συγκεκριμένο κωδικό, που αποτελείται από τέσσερις αριθμούς που χωρίζονται με τελείες. Ο πρώτος αριθμός είναι η κλάση, ο δεύτερος είναι η υποκατηγορία, ο τρίτος είναι η υποκατηγορία, ο τέταρτος είναι ο σειριακός αριθμός του ενζύμου σε αυτήν την υποκατηγορία, για παράδειγμα, ο κωδικός αργινάσης είναι 3.5.3.1.
Παω σε διαλέξεις Νο 2"Δομή και λειτουργίες υδατανθράκων και λιπιδίων"
Παω σε διαλέξεις Νο 4"Δομή και λειτουργίες των νουκλεϊκών οξέων ATP"
Στο πρώτο μισό του 19ου αι. πολλοί χημικοί, και μεταξύ αυτών κυρίως ο J. von Liebig, κατέληξαν σταδιακά στο συμπέρασμα ότι οι πρωτεΐνες αντιπροσωπεύουν μια ειδική κατηγορία αζωτούχων ενώσεων. Το όνομα "πρωτεΐνες" (από τα ελληνικά.
πρωτός πρώτο) προτάθηκε το 1840 από τον Ολλανδό χημικό G. Mulder. ΦΥΣΙΚΕΣ ΙΔΙΟΤΗΤΕΣ Οι πρωτεΐνες είναι λευκές στη στερεά κατάσταση, αλλά άχρωμες στο διάλυμα, εκτός εάν φέρουν κάποιο είδος χρωμοφόρου (έγχρωμης) ομάδας, όπως η αιμοσφαιρίνη. Η διαλυτότητα στο νερό ποικίλλει πολύ μεταξύ των διαφορετικών πρωτεϊνών. Αλλάζει επίσης ανάλογα με το pH και τη συγκέντρωση των αλάτων στο διάλυμα, επομένως είναι δυνατό να επιλεγούν συνθήκες υπό τις οποίες μια πρωτεΐνη θα καθιζάνει επιλεκτικά παρουσία άλλων πρωτεϊνών. Αυτή η μέθοδος "αλατίσματος" χρησιμοποιείται ευρέως για την απομόνωση και τον καθαρισμό πρωτεϊνών. Η καθαρισμένη πρωτεΐνη συχνά καθιζάνει εκτός διαλύματος ως κρύσταλλοι.Σε σύγκριση με άλλες ενώσεις, το μοριακό βάρος των πρωτεϊνών είναι πολύ μεγάλο και κυμαίνεται από πολλές χιλιάδες έως πολλά εκατομμύρια dalton. Επομένως, κατά τη διάρκεια της υπερφυγοκέντρησης, οι πρωτεΐνες καθιζάνουν και με διαφορετικούς ρυθμούς. Λόγω της παρουσίας θετικά και αρνητικά φορτισμένων ομάδων στα μόρια πρωτεΐνης, κινούνται με διαφορετικές ταχύτητες και σε ηλεκτρικό πεδίο. Αυτή είναι η βάση της ηλεκτροφόρησης, μιας μεθόδου που χρησιμοποιείται για την απομόνωση μεμονωμένων πρωτεϊνών από πολύπλοκα μείγματα. Οι πρωτεΐνες καθαρίζονται επίσης με χρωματογραφία.
ΧΗΜΙΚΕΣ ΙΔΙΟΤΗΤΕΣ Δομή. Οι πρωτεΐνες είναι πολυμερή, δηλ. μόρια κατασκευασμένα σαν αλυσίδες από επαναλαμβανόμενες μονομερείς μονάδες ή υπομονάδες, τον ρόλο των οποίων παίζουν ένα -αμινοξέα. Γενικός τύπος αμινοξέωνόπου ο Ρ ένα άτομο υδρογόνου ή κάποια οργανική ομάδα.Ένα μόριο πρωτεΐνης (πολυπεπτιδική αλυσίδα) μπορεί να αποτελείται μόνο από ένα σχετικά μικρό αριθμό αμινοξέων ή αρκετές χιλιάδες μονάδες μονομερούς. Ο συνδυασμός αμινοξέων σε μια αλυσίδα είναι δυνατός επειδή το καθένα από αυτά έχει δύο διαφορετικές χημικές ομάδες: μια αμινομάδα με βασικές ιδιότητες,
NH 2 και μια όξινη καρβοξυλομάδα, COOH. Και οι δύο αυτές ομάδες είναι συνδεδεμένες με ένα - άτομο άνθρακα. Η καρβοξυλική ομάδα ενός αμινοξέος μπορεί να σχηματίσει έναν αμιδικό (πεπτιδικό) δεσμό με την αμινομάδα ενός άλλου αμινοξέος: Αφού συνδεθούν δύο αμινοξέα με αυτόν τον τρόπο, η αλυσίδα μπορεί να επεκταθεί προσθέτοντας ένα τρίτο στο δεύτερο αμινοξύ και ούτω καθεξής. Όπως φαίνεται από την παραπάνω εξίσωση, όταν σχηματίζεται ένας πεπτιδικός δεσμός, απελευθερώνεται ένα μόριο νερού. Παρουσία οξέων, αλκαλίων ή πρωτεολυτικών ενζύμων, η αντίδραση προχωρά προς την αντίθετη κατεύθυνση: η πολυπεπτιδική αλυσίδα χωρίζεται σε αμινοξέα με την προσθήκη νερού. Αυτή η αντίδραση ονομάζεται υδρόλυση. Η υδρόλυση λαμβάνει χώρα αυθόρμητα και απαιτείται ενέργεια για τη σύνδεση αμινοξέων σε μια πολυπεπτιδική αλυσίδα.
Αφού συνδεθούν δύο αμινοξέα με αυτόν τον τρόπο, η αλυσίδα μπορεί να επεκταθεί προσθέτοντας ένα τρίτο στο δεύτερο αμινοξύ και ούτω καθεξής. Όπως φαίνεται από την παραπάνω εξίσωση, όταν σχηματίζεται ένας πεπτιδικός δεσμός, απελευθερώνεται ένα μόριο νερού. Παρουσία οξέων, αλκαλίων ή πρωτεολυτικών ενζύμων, η αντίδραση προχωρά προς την αντίθετη κατεύθυνση: η πολυπεπτιδική αλυσίδα χωρίζεται σε αμινοξέα με την προσθήκη νερού. Αυτή η αντίδραση ονομάζεται υδρόλυση. Η υδρόλυση λαμβάνει χώρα αυθόρμητα και απαιτείται ενέργεια για τη σύνδεση αμινοξέων σε μια πολυπεπτιδική αλυσίδα. Μια καρβοξυλομάδα και μια αμιδική ομάδα (ή μια παρόμοια ιμιδική ομάδα στην περίπτωση του αμινοξέος προλίνη) υπάρχουν σε όλα τα αμινοξέα, αλλά οι διαφορές μεταξύ των αμινοξέων καθορίζονται από τη φύση της ομάδας ή την «πλευρική αλυσίδα». που υποδεικνύεται παραπάνω με το γράμμα
R . Ο ρόλος της πλευρικής αλυσίδας μπορεί να διαδραματιστεί από ένα άτομο υδρογόνου, όπως στο αμινοξύ γλυκίνη, ή από κάποια ογκώδη ομάδα, όπως στην ιστιδίνη και την τρυπτοφάνη. Ορισμένες πλευρικές αλυσίδες είναι χημικά αδρανείς, ενώ άλλες είναι εμφανώς αντιδραστικές.Πολλές χιλιάδες διαφορετικά αμινοξέα μπορούν να συντεθούν και πολλά διαφορετικά αμινοξέα υπάρχουν στη φύση, αλλά μόνο 20 τύποι αμινοξέων χρησιμοποιούνται για τη σύνθεση πρωτεϊνών: αλανίνη, αργινίνη, ασπαραγίνη, ασπαρτικό οξύ, βαλίνη, ιστιδίνη, γλυκίνη, γλουταμίνη, γλουταμικό οξύ, ισολευκίνη, λευκίνη, λυσίνη, μεθειονίνη, προλίνη, σερίνη, τυροσίνη, θρεονίνη, τρυπτοφάνη, φαινυλαλανίνη και κυστεΐνη (στις πρωτεΐνες, η κυστεΐνη μπορεί να υπάρχει ως διμερές
κυστίνη). Είναι αλήθεια ότι ορισμένες πρωτεΐνες περιέχουν άλλα αμινοξέα εκτός από τα είκοσι που απαντώνται τακτικά, αλλά σχηματίζονται ως αποτέλεσμα της τροποποίησης μιας από τις είκοσι που αναφέρονται αφού συμπεριληφθεί στην πρωτεΐνη.Οπτική δραστηριότητα. Όλα τα αμινοξέα, με εξαίρεση τη γλυκίνη, έχουν ένα Το άτομο άνθρακα έχει τέσσερις διαφορετικές ομάδες συνδεδεμένες με αυτό. Από την άποψη της γεωμετρίας, τέσσερις διαφορετικές ομάδες μπορούν να συνδεθούν με δύο τρόπους, και κατά συνέπεια υπάρχουν δύο πιθανές διαμορφώσεις, ή δύο ισομερή, που σχετίζονται μεταξύ τους όπως ένα αντικείμενο είναι με την κατοπτρική του εικόνα, δηλ. όπως το αριστερό χέρι προς τα δεξιά. Μία διαμόρφωση ονομάζεται αριστερός ή αριστερόχειρας (μεγάλο ), και το άλλο δεξιό, ή δεξιόστροφο (ρε ), αφού δύο τέτοια ισομερή διαφέρουν ως προς την κατεύθυνση περιστροφής του επιπέδου του πολωμένου φωτός. Βρίσκεται μόνο σε πρωτεΐνεςμεγάλο -αμινοξέα (η εξαίρεση είναι η γλυκίνη· μπορεί να αναπαρασταθεί σε μία μόνο μορφή, αφού δύο από τις τέσσερις ομάδες της είναι ίδιες) και όλα είναι οπτικά ενεργά (αφού υπάρχει μόνο ένα ισομερές).ρε -Τα αμινοξέα είναι σπάνια στη φύση. βρίσκονται σε ορισμένα αντιβιοτικά και στο κυτταρικό τοίχωμα των βακτηρίων.Αλληλουχία αμινοξέων. Τα αμινοξέα σε μια πολυπεπτιδική αλυσίδα δεν είναι διατεταγμένα τυχαία, αλλά σε μια ορισμένη σταθερή σειρά, και αυτή η σειρά είναι που καθορίζει τις λειτουργίες και τις ιδιότητες της πρωτεΐνης. Μεταβάλλοντας τη σειρά των 20 τύπων αμινοξέων, μπορείτε να δημιουργήσετε έναν τεράστιο αριθμό διαφορετικών πρωτεϊνών, όπως μπορείτε να δημιουργήσετε πολλά διαφορετικά κείμενα από τα γράμματα του αλφαβήτου.Στο παρελθόν, ο προσδιορισμός της αλληλουχίας αμινοξέων μιας πρωτεΐνης χρειαζόταν συχνά αρκετά χρόνια. Ο άμεσος προσδιορισμός εξακολουθεί να είναι μια εργασία έντασης εργασίας, αν και έχουν δημιουργηθεί συσκευές που επιτρέπουν την αυτόματη εκτέλεσή του. Συνήθως είναι ευκολότερο να προσδιοριστεί η νουκλεοτιδική αλληλουχία του αντίστοιχου γονιδίου και να συναχθεί η αλληλουχία αμινοξέων της πρωτεΐνης από αυτό. Μέχρι σήμερα, οι αλληλουχίες αμινοξέων πολλών εκατοντάδων πρωτεϊνών έχουν ήδη προσδιοριστεί. Οι λειτουργίες των αποκρυπτογραφημένων πρωτεϊνών είναι συνήθως γνωστές και αυτό βοηθά να φανταστούμε τις πιθανές λειτουργίες παρόμοιων πρωτεϊνών που σχηματίζονται, για παράδειγμα, σε κακοήθη νεοπλάσματα.
Σύνθετες πρωτεΐνες. Οι πρωτεΐνες που αποτελούνται μόνο από αμινοξέα ονομάζονται απλές. Συχνά, ωστόσο, ένα άτομο μετάλλου ή κάποια χημική ένωση που δεν είναι αμινοξύ συνδέεται με την πολυπεπτιδική αλυσίδα. Τέτοιες πρωτεΐνες ονομάζονται σύνθετες. Ένα παράδειγμα είναι η αιμοσφαιρίνη: περιέχει σίδηρο πορφυρίνη, η οποία καθορίζει το κόκκινο χρώμα της και της επιτρέπει να λειτουργεί ως φορέας οξυγόνου.Τα ονόματα των πιο πολύπλοκων πρωτεϊνών υποδεικνύουν τη φύση των συνδεδεμένων ομάδων: οι γλυκοπρωτεΐνες περιέχουν σάκχαρα, οι λιποπρωτεΐνες περιέχουν λίπη. Εάν η καταλυτική δραστηριότητα ενός ενζύμου εξαρτάται από την συνδεδεμένη ομάδα, τότε ονομάζεται προσθετική ομάδα. Συχνά μια βιταμίνη παίζει το ρόλο μιας προσθετικής ομάδας ή αποτελεί μέρος μιας. Η βιταμίνη Α, για παράδειγμα, συνδεδεμένη με μια από τις πρωτεΐνες στον αμφιβληστροειδή, καθορίζει την ευαισθησία της στο φως.
Τριτογενής δομή. Αυτό που είναι σημαντικό δεν είναι τόσο η αλληλουχία αμινοξέων της ίδιας της πρωτεΐνης (η πρωταρχική δομή), αλλά ο τρόπος με τον οποίο βρίσκεται στο διάστημα. Σε όλο το μήκος της πολυπεπτιδικής αλυσίδας, τα ιόντα υδρογόνου σχηματίζουν κανονικούς δεσμούς υδρογόνου, που της δίνουν το σχήμα έλικας ή στρώματος (δευτερεύουσα δομή). Από τον συνδυασμό τέτοιων ελίκων και στρωμάτων, προκύπτει μια συμπαγής μορφή της επόμενης τάξης: η τριτοταγής δομή της πρωτεΐνης. Γύρω από τους δεσμούς που συγκρατούν τις μονομερείς μονάδες της αλυσίδας, είναι δυνατές περιστροφές σε μικρές γωνίες. Επομένως, από καθαρά γεωμετρική άποψη, ο αριθμός των πιθανών διαμορφώσεων για οποιαδήποτε πολυπεπτιδική αλυσίδα είναι απείρως μεγάλος. Στην πραγματικότητα, κάθε πρωτεΐνη υπάρχει κανονικά σε μία μόνο διαμόρφωση, που καθορίζεται από την αλληλουχία αμινοξέων της. Αυτή η δομή δεν είναι άκαμπτη, είναι σαν « αναπνέει» κυμαίνεται γύρω από μια συγκεκριμένη μέση διαμόρφωση. Το κύκλωμα διπλώνεται σε μια διαμόρφωση στην οποία η ελεύθερη ενέργεια (η ικανότητα παραγωγής έργου) είναι ελάχιστη, όπως ένα απελευθερωμένο ελατήριο συμπιέζεται μόνο σε μια κατάσταση που αντιστοιχεί στην ελάχιστη ελεύθερη ενέργεια. Συχνά ένα μέρος της αλυσίδας συνδέεται άκαμπτα με ένα άλλο με δισουλφίδιο ( SS) δεσμούς μεταξύ δύο υπολειμμάτων κυστεΐνης. Αυτός είναι εν μέρει ο λόγος που η κυστεΐνη παίζει έναν ιδιαίτερα σημαντικό ρόλο μεταξύ των αμινοξέων.Η πολυπλοκότητα της δομής των πρωτεϊνών είναι τόσο μεγάλη που δεν είναι ακόμη δυνατός ο υπολογισμός της τριτοταγούς δομής μιας πρωτεΐνης, ακόμα κι αν είναι γνωστή η αλληλουχία αμινοξέων της. Αλλά εάν είναι δυνατό να ληφθούν πρωτεϊνικοί κρύσταλλοι, τότε η τριτοταγής δομή της μπορεί να προσδιοριστεί με περίθλαση ακτίνων Χ.
Σε δομικές, συσταλτικές και σε ορισμένες άλλες πρωτεΐνες, οι αλυσίδες είναι επιμήκεις και αρκετές ελαφρώς διπλωμένες αλυσίδες που βρίσκονται κοντά σχηματίζουν ινίδια. τα ινίδια, με τη σειρά τους, διπλώνουν σε μεγαλύτερους σχηματισμούς ινών. Ωστόσο, οι περισσότερες πρωτεΐνες σε διάλυμα έχουν σφαιρικό σχήμα: οι αλυσίδες τυλίγονται σε ένα σφαιρίδιο, όπως το νήμα σε μια μπάλα. Η ελεύθερη ενέργεια με αυτή τη διαμόρφωση είναι ελάχιστη, καθώς υδρόφοβα ("υδατοαπωθητικά") αμινοξέα είναι κρυμμένα μέσα στο σφαιρίδιο και υδρόφιλα ("προσέλκυση νερού") αμινοξέα βρίσκονται στην επιφάνειά του.
Πολλές πρωτεΐνες είναι σύμπλοκα πολλών πολυπεπτιδικών αλυσίδων. Αυτή η δομή ονομάζεται τεταρτοταγής δομή της πρωτεΐνης. Το μόριο της αιμοσφαιρίνης, για παράδειγμα, αποτελείται από τέσσερις υπομονάδες, καθεμία από τις οποίες είναι μια σφαιρική πρωτεΐνη.
Οι δομικές πρωτεΐνες, λόγω της γραμμικής τους διαμόρφωσης, σχηματίζουν ίνες που έχουν πολύ υψηλή αντοχή εφελκυσμού, ενώ η σφαιρική διαμόρφωση επιτρέπει στις πρωτεΐνες να εισέλθουν σε συγκεκριμένες αλληλεπιδράσεις με άλλες ενώσεις. Στην επιφάνεια του σφαιριδίου, όταν οι αλυσίδες είναι σωστά τοποθετημένες, εμφανίζονται κοιλότητες συγκεκριμένου σχήματος στις οποίες βρίσκονται αντιδραστικές χημικές ομάδες. Εάν μια δεδομένη πρωτεΐνη είναι ένα ένζυμο, τότε ένα άλλο, συνήθως μικρότερο, μόριο κάποιας ουσίας εισέρχεται σε μια τέτοια κοιλότητα, όπως ένα κλειδί εισέρχεται σε μια κλειδαριά. Σε αυτή την περίπτωση, η διαμόρφωση του νέφους ηλεκτρονίων του μορίου αλλάζει υπό την επίδραση των χημικών ομάδων που βρίσκονται στην κοιλότητα και αυτό το αναγκάζει να αντιδράσει με έναν ορισμένο τρόπο. Με αυτόν τον τρόπο, το ένζυμο καταλύει την αντίδραση. Τα μόρια αντισωμάτων έχουν επίσης κοιλότητες στις οποίες συνδέονται διάφορες ξένες ουσίες και έτσι καθίστανται αβλαβείς. Το μοντέλο «lock and key», το οποίο εξηγεί την αλληλεπίδραση των πρωτεϊνών με άλλες ενώσεις, μας επιτρέπει να κατανοήσουμε την ειδικότητα των ενζύμων και των αντισωμάτων, δηλ. την ικανότητά τους να αντιδρούν μόνο με ορισμένες ενώσεις.
Πρωτεΐνες σε διάφορους τύπους οργανισμών. Οι πρωτεΐνες που επιτελούν την ίδια λειτουργία σε διαφορετικά είδη φυτών και ζώων και επομένως φέρουν το ίδιο όνομα έχουν επίσης παρόμοια διαμόρφωση. Ωστόσο, διαφέρουν κάπως στην αλληλουχία αμινοξέων τους. Καθώς τα είδη αποκλίνουν από έναν κοινό πρόγονο, ορισμένα αμινοξέα σε ορισμένες θέσεις αντικαθίστανται από μεταλλάξεις από άλλα. Οι επιβλαβείς μεταλλάξεις που προκαλούν κληρονομικές ασθένειες εξαλείφονται με τη φυσική επιλογή, αλλά οι ωφέλιμες ή τουλάχιστον ουδέτερες μπορεί να επιμείνουν. Όσο πιο κοντά είναι δύο είδη μεταξύ τους, τόσο λιγότερες διαφορές βρίσκονται στις πρωτεΐνες τους.Ορισμένες πρωτεΐνες αλλάζουν σχετικά γρήγορα, άλλες είναι πολύ διατηρημένες. Το τελευταίο περιλαμβάνει, για παράδειγμα, κυτόχρωμα Μεένα αναπνευστικό ένζυμο που βρίσκεται στους περισσότερους ζωντανούς οργανισμούς. Στους ανθρώπους και τους χιμπατζήδες, οι αλληλουχίες αμινοξέων του είναι πανομοιότυπες και στο κυτόχρωμα ΜεΣτο σιτάρι, μόνο το 38% των αμινοξέων ήταν διαφορετικά. Ακόμη και συγκρίνοντας ανθρώπους και βακτήρια, η ομοιότητα των κυτοχρωμάτων Με(οι διαφορές επηρεάζουν το 65% των αμινοξέων εδώ) μπορούν ακόμα να φανούν, αν και ο κοινός πρόγονος των βακτηρίων και του ανθρώπου ζούσε στη Γη πριν από περίπου δύο δισεκατομμύρια χρόνια. Σήμερα, η σύγκριση των αλληλουχιών αμινοξέων χρησιμοποιείται συχνά για την κατασκευή ενός φυλογενετικού (οικογενειακού) δέντρου, που αντικατοπτρίζει τις εξελικτικές σχέσεις μεταξύ διαφορετικών οργανισμών.
Μετουσίωσης. Το συντιθέμενο μόριο πρωτεΐνης, αναδιπλούμενο, αποκτά τη χαρακτηριστική του διαμόρφωση. Αυτή η διαμόρφωση, ωστόσο, μπορεί να καταστραφεί με θέρμανση, με αλλαγή του pH, με έκθεση σε οργανικούς διαλύτες, ακόμη και με απλή ανακίνηση του διαλύματος μέχρι να εμφανιστούν φυσαλίδες στην επιφάνειά του. Μια πρωτεΐνη που τροποποιείται με αυτόν τον τρόπο ονομάζεται μετουσιωμένη. χάνει τη βιολογική του δραστηριότητα και συνήθως γίνεται αδιάλυτο. Γνωστά παραδείγματα μετουσιωμένης πρωτεΐνης είναι τα βραστά αυγά ή η σαντιγί. Μικρές πρωτεΐνες που περιέχουν μόνο περίπου εκατό αμινοξέα είναι ικανές για επαναδιάταξη, δηλ. αποκτήσετε ξανά την αρχική διαμόρφωση. Αλλά οι περισσότερες πρωτεΐνες απλώς μετατρέπονται σε μια μάζα μπερδεμένων πολυπεπτιδικών αλυσίδων και δεν αποκαθιστούν την προηγούμενη διαμόρφωσή τους.Μία από τις κύριες δυσκολίες στην απομόνωση των ενεργών πρωτεϊνών είναι η εξαιρετική ευαισθησία τους στη μετουσίωση. Αυτή η ιδιότητα των πρωτεϊνών βρίσκει χρήσιμη εφαρμογή στη συντήρηση των τροφίμων: η υψηλή θερμοκρασία μετουσιώνει μη αναστρέψιμα τα ένζυμα των μικροοργανισμών και οι μικροοργανισμοί πεθαίνουν.
ΠΡΩΤΕΪΝΗ ΣΥΝΘΕΣΗ Για να συνθέσει πρωτεΐνη, ένας ζωντανός οργανισμός πρέπει να έχει ένα σύστημα ενζύμων ικανό να ενώνει ένα αμινοξύ με ένα άλλο. Απαιτείται επίσης μια πηγή πληροφοριών για να καθοριστεί ποια αμινοξέα πρέπει να συνδυαστούν. Δεδομένου ότι υπάρχουν χιλιάδες τύποι πρωτεϊνών στο σώμα και καθένας από αυτούς αποτελείται κατά μέσο όρο από αρκετές εκατοντάδες αμινοξέα, οι απαιτούμενες πληροφορίες πρέπει να είναι πραγματικά τεράστιες. Αποθηκεύεται (παρόμοια με τον τρόπο που αποθηκεύεται μια εγγραφή σε μια μαγνητική ταινία) στα μόρια νουκλεϊκού οξέος που αποτελούν τα γονίδια. Εκ . επίσης ΚΛΗΡΟΝΟΜΙΚΟ? ΝΟΥΚΛΕΪΚΑ ΟΞΕΑ.Ενεργοποίηση ενζύμου. Μια πολυπεπτιδική αλυσίδα που συντίθεται από αμινοξέα δεν είναι πάντα πρωτεΐνη στην τελική της μορφή. Πολλά ένζυμα συντίθενται πρώτα ως ανενεργοί πρόδρομοι και γίνονται ενεργά μόνο αφού ένα άλλο ένζυμο αφαιρέσει αρκετά αμινοξέα στο ένα άκρο της αλυσίδας. Μερικά από τα πεπτικά ένζυμα, όπως η θρυψίνη, συντίθενται σε αυτήν την ανενεργή μορφή. Αυτά τα ένζυμα ενεργοποιούνται στην πεπτική οδό ως αποτέλεσμα της αφαίρεσης του τερματικού θραύσματος της αλυσίδας. Η ορμόνη ινσουλίνη, το μόριο της οποίας στην ενεργή του μορφή αποτελείται από δύο μικρές αλυσίδες, συντίθεται με τη μορφή μιας αλυσίδας, η λεγόμενη. προϊνσουλίνη. Στη συνέχεια αφαιρείται το μεσαίο τμήμα αυτής της αλυσίδας και τα υπόλοιπα θραύσματα συνδέονται μεταξύ τους για να σχηματίσουν το μόριο της ενεργού ορμόνης. Οι σύνθετες πρωτεΐνες σχηματίζονται μόνο αφού μια συγκεκριμένη χημική ομάδα προσκολληθεί στην πρωτεΐνη και αυτή η προσκόλληση συχνά απαιτεί επίσης ένα ένζυμο.Μεταβολική κυκλοφορία. Μετά την τροφοδοσία ενός ζώου με αμινοξέα επισημασμένα με ραδιενεργά ισότοπα άνθρακα, αζώτου ή υδρογόνου, η ετικέτα ενσωματώνεται γρήγορα στις πρωτεΐνες του. Εάν τα επισημασμένα αμινοξέα σταματήσουν να εισέρχονται στο σώμα, η ποσότητα της ετικέτας στις πρωτεΐνες αρχίζει να μειώνεται. Αυτά τα πειράματα δείχνουν ότι οι πρωτεΐνες που προκύπτουν δεν διατηρούνται στο σώμα μέχρι το τέλος της ζωής. Όλα αυτά, με ελάχιστες εξαιρέσεις, βρίσκονται σε δυναμική κατάσταση, διασπώνται συνεχώς σε αμινοξέα και στη συνέχεια συντίθενται ξανά.Ορισμένες πρωτεΐνες διασπώνται όταν τα κύτταρα πεθαίνουν και καταστρέφονται. Αυτό συμβαίνει συνεχώς, για παράδειγμα, με τα ερυθρά αιμοσφαίρια και τα επιθηλιακά κύτταρα που επενδύουν την εσωτερική επιφάνεια του εντέρου. Επιπλέον, η διάσπαση και η επανασύνθεση των πρωτεϊνών συμβαίνει επίσης σε ζωντανά κύτταρα. Παραδόξως, είναι λιγότερα γνωστά για τη διάσπαση των πρωτεϊνών παρά για τη σύνθεσή τους. Είναι σαφές, ωστόσο, ότι η διάσπαση περιλαμβάνει πρωτεολυτικά ένζυμα παρόμοια με εκείνα που διασπούν τις πρωτεΐνες σε αμινοξέα στον πεπτικό σωλήνα.
Ο χρόνος ημιζωής διαφορετικών πρωτεϊνών ποικίλλει από αρκετές ώρες έως πολλούς μήνες. Η μόνη εξαίρεση είναι το μόριο κολλαγόνου. Μόλις σχηματιστούν, παραμένουν σταθερά και δεν ανανεώνονται ή αντικαθίστανται. Με την πάροδο του χρόνου, ωστόσο, ορισμένες από τις ιδιότητές τους αλλάζουν, ιδίως η ελαστικότητα, και επειδή δεν ανανεώνονται, αυτό έχει ως αποτέλεσμα ορισμένες αλλαγές που σχετίζονται με την ηλικία, όπως η εμφάνιση ρυτίδων στο δέρμα.
Συνθετικές πρωτεΐνες. Οι χημικοί έχουν μάθει από καιρό να πολυμερίζουν τα αμινοξέα, αλλά τα αμινοξέα συνδυάζονται με ακατάστατο τρόπο, έτσι ώστε τα προϊόντα αυτού του πολυμερισμού να έχουν ελάχιστη ομοιότητα με τα φυσικά. Είναι αλήθεια ότι είναι δυνατός ο συνδυασμός αμινοξέων με μια δεδομένη σειρά, γεγονός που καθιστά δυνατή τη λήψη ορισμένων βιολογικά ενεργών πρωτεϊνών, ιδιαίτερα της ινσουλίνης. Η διαδικασία είναι αρκετά περίπλοκη και με αυτόν τον τρόπο είναι δυνατό να ληφθούν μόνο εκείνες οι πρωτεΐνες των οποίων τα μόρια περιέχουν περίπου εκατό αμινοξέα. Είναι προτιμότερο να συντεθεί ή να απομονωθεί η νουκλεοτιδική αλληλουχία ενός γονιδίου που αντιστοιχεί στην επιθυμητή αλληλουχία αμινοξέων, και στη συνέχεια να εισαχθεί αυτό το γονίδιο σε ένα βακτήριο, το οποίο θα παράγει μεγάλες ποσότητες του επιθυμητού προϊόντος με αντιγραφή. Αυτή η μέθοδος, ωστόσο, έχει και τα μειονεκτήματά της. Εκ . επίσης ΓΕΝΕΤΙΚΗ ΜΗΧΑΝΙΚΗ. ΠΡΩΤΕΪΝΗ ΚΑΙ ΔΙΑΤΡΟΦΗ Όταν οι πρωτεΐνες στο σώμα διασπώνται σε αμινοξέα, αυτά τα αμινοξέα μπορούν να χρησιμοποιηθούν ξανά για τη σύνθεση πρωτεϊνών. Ταυτόχρονα, τα ίδια τα αμινοξέα υπόκεινται σε διάσπαση, επομένως δεν επαναχρησιμοποιούνται πλήρως. Είναι επίσης σαφές ότι κατά τη διάρκεια της ανάπτυξης, της εγκυμοσύνης και της επούλωσης των πληγών, η πρωτεϊνοσύνθεση πρέπει να υπερβαίνει τη διάσπαση. Το σώμα χάνει συνεχώς κάποιες πρωτεΐνες. Αυτές είναι οι πρωτεΐνες των μαλλιών, των νυχιών και του επιφανειακού στρώματος του δέρματος. Επομένως, για να συνθέσει πρωτεΐνες, κάθε οργανισμός πρέπει να λαμβάνει αμινοξέα από τις τροφές. Τα πράσινα φυτά συνθέτουν από CO 2 , το νερό και η αμμωνία ή τα νιτρικά είναι και τα 20 αμινοξέα που βρίσκονται στις πρωτεΐνες. Πολλά βακτήρια είναι επίσης ικανά να συνθέτουν αμινοξέα παρουσία ζάχαρης (ή κάποιου ισοδύναμου) και σταθερού αζώτου, αλλά η ζάχαρη τελικά παρέχεται από τα πράσινα φυτά. Τα ζώα έχουν περιορισμένη ικανότητα να συνθέτουν αμινοξέα. λαμβάνουν αμινοξέα τρώγοντας πράσινα φυτά ή άλλα ζώα. Στον πεπτικό σωλήνα, οι απορροφούμενες πρωτεΐνες διασπώνται σε αμινοξέα, τα τελευταία απορροφώνται και από αυτά δημιουργούνται πρωτεΐνες χαρακτηριστικές ενός δεδομένου οργανισμού. Καμία από τις απορροφούμενες πρωτεΐνες δεν ενσωματώνεται στις δομές του σώματος. Η μόνη εξαίρεση είναι ότι σε πολλά θηλαστικά, ορισμένα μητρικά αντισώματα μπορούν να περάσουν άθικτα μέσω του πλακούντα στην κυκλοφορία του αίματος του εμβρύου και μέσω του μητρικού γάλακτος (ειδικά στα μηρυκαστικά) μπορούν να μεταφερθούν στο νεογέννητο αμέσως μετά τη γέννηση.Απαίτηση σε πρωτεΐνη. Είναι σαφές ότι για να διατηρήσει τη ζωή το σώμα πρέπει να λαμβάνει μια ορισμένη ποσότητα πρωτεΐνης από τα τρόφιμα. Ωστόσο, η έκταση αυτής της ανάγκης εξαρτάται από διάφορους παράγοντες. Το σώμα χρειάζεται τροφή τόσο ως πηγή ενέργειας (θερμίδες) όσο και ως υλικό για την κατασκευή των δομών του. Η ανάγκη για ενέργεια έρχεται πρώτη. Αυτό σημαίνει ότι όταν υπάρχουν λίγοι υδατάνθρακες και λίπη στη διατροφή, οι διατροφικές πρωτεΐνες χρησιμοποιούνται όχι για τη σύνθεση των δικών τους πρωτεϊνών, αλλά ως πηγή θερμίδων. Κατά τη διάρκεια παρατεταμένης νηστείας, ακόμη και οι δικές σας πρωτεΐνες χρησιμοποιούνται για την ικανοποίηση ενεργειακών αναγκών. Εάν υπάρχουν αρκετοί υδατάνθρακες στη διατροφή, τότε η κατανάλωση πρωτεΐνης μπορεί να μειωθεί.Ισοζύγιο αζώτου. Κατά μέσο όρο περίπου. Το 16% της συνολικής μάζας της πρωτεΐνης είναι άζωτο. Όταν τα αμινοξέα που περιέχονται στις πρωτεΐνες διασπώνται, το άζωτο που περιέχουν αποβάλλεται από το σώμα με τα ούρα και (σε μικρότερο βαθμό) με τα κόπρανα με τη μορφή διαφόρων αζωτούχων ενώσεων. Είναι επομένως βολικό να χρησιμοποιείται ένας δείκτης όπως το ισοζύγιο αζώτου για την αξιολόγηση της ποιότητας της πρωτεϊνικής διατροφής, π.χ. η διαφορά (σε γραμμάρια) μεταξύ της ποσότητας αζώτου που εισέρχεται στο σώμα και της ποσότητας αζώτου που εκκρίνεται ανά ημέρα. Με την κανονική διατροφή σε έναν ενήλικα, αυτές οι ποσότητες είναι ίσες. Σε έναν αναπτυσσόμενο οργανισμό, η ποσότητα του αζώτου που εκκρίνεται είναι μικρότερη από την ποσότητα που λαμβάνεται, δηλ. το ισοζύγιο είναι θετικό. Εάν υπάρχει έλλειψη πρωτεΐνης στη διατροφή, το ισοζύγιο είναι αρνητικό. Εάν υπάρχουν αρκετές θερμίδες στη διατροφή, αλλά δεν υπάρχουν πρωτεΐνες σε αυτήν, το σώμα εξοικονομεί πρωτεΐνες. Ταυτόχρονα, ο μεταβολισμός των πρωτεϊνών επιβραδύνεται και η επαναλαμβανόμενη χρήση των αμινοξέων στη σύνθεση πρωτεϊνών γίνεται με την υψηλότερη δυνατή αποτελεσματικότητα. Ωστόσο, οι απώλειες είναι αναπόφευκτες και οι αζωτούχες ενώσεις εξακολουθούν να απεκκρίνονται με τα ούρα και εν μέρει με τα κόπρανα. Η ποσότητα αζώτου που εκκρίνεται από το σώμα την ημέρα κατά τη διάρκεια της νηστείας πρωτεΐνης μπορεί να χρησιμεύσει ως μέτρο της καθημερινής ανεπάρκειας πρωτεΐνης. Είναι φυσικό να υποθέσουμε ότι με την εισαγωγή στη διατροφή μιας ποσότητας πρωτεΐνης ισοδύναμης με αυτή την ανεπάρκεια, η ισορροπία αζώτου μπορεί να αποκατασταθεί. Ωστόσο, δεν είναι. Μετά τη λήψη αυτής της ποσότητας πρωτεΐνης, το σώμα αρχίζει να χρησιμοποιεί τα αμινοξέα λιγότερο αποτελεσματικά, επομένως απαιτείται κάποια πρόσθετη πρωτεΐνη για την αποκατάσταση της ισορροπίας του αζώτου.Εάν η ποσότητα πρωτεΐνης στη διατροφή υπερβαίνει αυτό που είναι απαραίτητο για τη διατήρηση της ισορροπίας του αζώτου, τότε δεν φαίνεται να υπάρχει βλάβη. Η περίσσεια αμινοξέων χρησιμοποιούνται απλώς ως πηγή ενέργειας. Ως ένα ιδιαίτερα εντυπωσιακό παράδειγμα, οι Εσκιμώοι καταναλώνουν λίγους υδατάνθρακες και περίπου δέκα φορές την ποσότητα πρωτεΐνης που απαιτείται για τη διατήρηση της ισορροπίας του αζώτου. Στις περισσότερες περιπτώσεις, ωστόσο, η χρήση πρωτεΐνης ως πηγή ενέργειας δεν είναι ωφέλιμη επειδή μια δεδομένη ποσότητα υδατανθράκων μπορεί να παράγει πολύ περισσότερες θερμίδες από την ίδια ποσότητα πρωτεΐνης. Στις φτωχές χώρες, οι άνθρωποι παίρνουν τις θερμίδες τους από τους υδατάνθρακες και καταναλώνουν ελάχιστες ποσότητες πρωτεΐνης.
Εάν το σώμα λαμβάνει τον απαιτούμενο αριθμό θερμίδων με τη μορφή μη πρωτεϊνικών προϊόντων, τότε η ελάχιστη ποσότητα πρωτεΐνης για τη διασφάλιση της διατήρησης της ισορροπίας του αζώτου είναι περίπου. 30 g την ημέρα. Περίπου αυτή η ποσότητα πρωτεΐνης περιέχεται σε τέσσερις φέτες ψωμί ή 0,5 λίτρο γάλα. Ένας ελαφρώς μεγαλύτερος αριθμός θεωρείται συνήθως βέλτιστος. Συνιστώνται 50 έως 70 γρ.
Απαραίτητα αμινοξέα. Μέχρι τώρα, η πρωτεΐνη θεωρούνταν ως σύνολο. Εν τω μεταξύ, για να γίνει η πρωτεϊνοσύνθεση πρέπει να υπάρχουν στον οργανισμό όλα τα απαραίτητα αμινοξέα. Το ίδιο το σώμα του ζώου είναι ικανό να συνθέσει μερικά από τα αμινοξέα. Ονομάζονται αντικαταστάσιμα επειδή δεν είναι απαραίτητο να υπάρχουν στη διατροφή, είναι σημαντικό μόνο η συνολική παροχή πρωτεΐνης ως πηγή αζώτου να είναι επαρκής. τότε, εάν υπάρχει έλλειψη μη απαραίτητων αμινοξέων, το σώμα μπορεί να τα συνθέσει σε βάρος αυτών που υπάρχουν σε περίσσεια. Τα υπόλοιπα, «απαραίτητα» αμινοξέα δεν μπορούν να συντεθούν και πρέπει να παρέχονται στον οργανισμό μέσω της τροφής. Απαραίτητα για τον άνθρωπο είναι η βαλίνη, η λευκίνη, η ισολευκίνη, η θρεονίνη, η μεθειονίνη, η φαινυλαλανίνη, η τρυπτοφάνη, η ιστιδίνη, η λυσίνη και η αργινίνη. (Αν και η αργινίνη μπορεί να συντεθεί στον οργανισμό, ταξινομείται ως βασικό αμινοξύ επειδή δεν παράγεται σε επαρκείς ποσότητες σε νεογέννητα και παιδιά που μεγαλώνουν. Από την άλλη πλευρά, ορισμένα από αυτά τα αμινοξέα από τα τρόφιμα μπορεί να γίνουν περιττά για έναν ενήλικα πρόσωπο.)Αυτή η λίστα των απαραίτητων αμινοξέων είναι περίπου η ίδια σε άλλα σπονδυλωτά και ακόμη και έντομα. Η θρεπτική αξία των πρωτεϊνών καθορίζεται συνήθως με τη διατροφή τους σε αναπτυσσόμενους αρουραίους και την παρακολούθηση της αύξησης βάρους των ζώων.
Διατροφική αξία πρωτεϊνών. Η θρεπτική αξία μιας πρωτεΐνης καθορίζεται από το απαραίτητο αμινοξύ που είναι πιο ελλιπές. Ας το επεξηγήσουμε αυτό με ένα παράδειγμα. Οι πρωτεΐνες στο σώμα μας περιέχουν κατά μέσο όρο περίπου. 2% τρυπτοφάνη (κατά βάρος). Ας πούμε ότι η δίαιτα περιλαμβάνει 10 g πρωτεΐνης που περιέχει 1% τρυπτοφάνη, και ότι υπάρχουν αρκετά άλλα απαραίτητα αμινοξέα σε αυτήν. Στην περίπτωσή μας, 10 g αυτής της ατελούς πρωτεΐνης είναι ουσιαστικά ισοδύναμα με 5 g πλήρους πρωτεΐνης. τα υπόλοιπα 5 g μπορούν να χρησιμεύσουν μόνο ως πηγή ενέργειας. Σημειώστε ότι επειδή τα αμινοξέα πρακτικά δεν αποθηκεύονται στο σώμα και για να συμβεί η πρωτεϊνοσύνθεση, όλα τα αμινοξέα πρέπει να υπάρχουν ταυτόχρονα, η επίδραση της πρόσληψης βασικών αμινοξέων μπορεί να ανιχνευθεί μόνο εάν όλα αυτά εισέρχονται στο σώμα ταυτόχρονα. Η μέση σύνθεση των περισσότερων ζωικών πρωτεϊνών είναι κοντά στη μέση σύνθεση των πρωτεϊνών στο ανθρώπινο σώμα, επομένως είναι απίθανο να αντιμετωπίσουμε ανεπάρκεια αμινοξέων εάν η διατροφή μας είναι πλούσια σε τροφές όπως κρέας, αυγά, γάλα και τυρί. Ωστόσο, υπάρχουν πρωτεΐνες, όπως η ζελατίνη (προϊόν μετουσίωσης του κολλαγόνου), που περιέχουν πολύ λίγα απαραίτητα αμινοξέα. Οι φυτικές πρωτεΐνες, αν και είναι καλύτερες από τη ζελατίνη από αυτή την άποψη, είναι επίσης φτωχές σε απαραίτητα αμινοξέα. Έχουν ιδιαίτερα χαμηλή περιεκτικότητα σε λυσίνη και τρυπτοφάνη. Παρόλα αυτά, μια αμιγώς χορτοφαγική διατροφή δεν μπορεί να θεωρηθεί καθόλου επιβλαβής, εκτός και αν καταναλώνει ελαφρώς μεγαλύτερη ποσότητα φυτικών πρωτεϊνών, αρκετή για να παρέχει στον οργανισμό απαραίτητα αμινοξέα. Τα φυτά περιέχουν την περισσότερη πρωτεΐνη στους σπόρους τους, ιδιαίτερα στους σπόρους του σιταριού και των διαφόρων οσπρίων. Οι νεαροί βλαστοί, όπως τα σπαράγγια, είναι επίσης πλούσιοι σε πρωτεΐνη.Συνθετικές πρωτεΐνες στη διατροφή. Με την προσθήκη μικρών ποσοτήτων συνθετικών απαραίτητων αμινοξέων ή πρωτεϊνών πλούσιων σε αμινοξέα σε ελλιπείς πρωτεΐνες, όπως πρωτεΐνες καλαμποκιού, η θρεπτική αξία των τελευταίων μπορεί να αυξηθεί σημαντικά, δηλ. αυξάνοντας έτσι την ποσότητα της πρωτεΐνης που καταναλώνεται. Μια άλλη δυνατότητα είναι να αναπτυχθούν βακτήρια ή ζυμομύκητες σε υδρογονάνθρακες πετρελαίου με την προσθήκη νιτρικών αλάτων ή αμμωνίας ως πηγή αζώτου. Η μικροβιακή πρωτεΐνη που λαμβάνεται με αυτόν τον τρόπο μπορεί να χρησιμεύσει ως τροφή για πουλερικά ή ζώα ή μπορεί να καταναλωθεί απευθείας από τον άνθρωπο. Η τρίτη, ευρέως χρησιμοποιούμενη μέθοδος χρησιμοποιεί τη φυσιολογία των μηρυκαστικών. Στα μηρυκαστικά, στο αρχικό τμήμα του στομάχου, τα λεγόμενα. Η μεγάλη κοιλία κατοικείται από ειδικές μορφές βακτηρίων και πρωτόζωων που μετατρέπουν τις ατελείς φυτικές πρωτεΐνες σε πληρέστερες μικροβιακές πρωτεΐνες και αυτές με τη σειρά τους μετά την πέψη και την απορρόφηση μετατρέπονται σε ζωικές πρωτεΐνες. Η ουρία, μια φθηνή συνθετική ένωση που περιέχει άζωτο, μπορεί να προστεθεί στις ζωοτροφές. Οι μικροοργανισμοί που ζουν στην κοιλιά χρησιμοποιούν το άζωτο της ουρίας για να μετατρέψουν τους υδατάνθρακες (από τους οποίους υπάρχουν πολύ περισσότεροι στην τροφή) σε πρωτεΐνη. Περίπου το ένα τρίτο του συνόλου του αζώτου στις ζωοτροφές μπορεί να έρθει με τη μορφή ουρίας, που ουσιαστικά σημαίνει, σε κάποιο βαθμό, τη χημική σύνθεση της πρωτεΐνης. Στις ΗΠΑ, αυτή η μέθοδος παίζει σημαντικό ρόλο ως ένας από τους τρόπους λήψης πρωτεΐνης.ΒΙΒΛΙΟΓΡΑΦΙΑ Murray R., Grenner D., Mayes P., Rodwell W. Ανθρώπινη βιοχημεία, τόμ. 12. Μ., 1993Alberts B, Bray D, Lewis J, et al. Μοριακή κυτταρική βιολογία, τόμ. 13. Μ., 1994
Εισιτήριο 2. 1. Βασικοί διατροφικοί παράγοντες λιπιδικής φύσης.Ορισμένα λιπίδια δεν συντίθενται στο ανθρώπινο σώμα και ως εκ τούτου είναι απαραίτητοι διατροφικοί παράγοντες. Αυτά περιλαμβάνουν λιπαρά οξέα με δύο ή περισσότερους διπλούς δεσμούς (πολυένιο) - απαραίτητα λιπαρά οξέα.Μερικά από αυτά τα οξέα είναι υποστρώματα για τη σύνθεση τοπικών ορμονών - εικοσανοειδών (θέμα 8.10).
Λιποδιαλυτές βιταμίνεςεκτελεί διάφορες λειτουργίες: Βιταμίνη ΑΣυμμετέχει στη διαδικασία της όρασης, καθώς και στην ανάπτυξη και διαφοροποίηση των κυττάρων. Η ικανότητά του να αναστέλλει την ανάπτυξη ορισμένων τύπων όγκων έχει αποδειχθεί. βιταμίνη ΚΣυμμετέχει στην πήξη του αίματος. βιταμίνη DΣυμμετέχει στη ρύθμιση του μεταβολισμού του ασβεστίου. βιταμίνη Ε- αντιοξειδωτικό, αναστέλλει τον σχηματισμό ελεύθερων ριζών και έτσι εξουδετερώνει τη βλάβη των κυττάρων ως αποτέλεσμα της υπεροξείδωσης των λιπιδίων.
Εγγραφο
2.Δομή και επίπεδα δομικής οργάνωσης πρωτεϊνών
Υπάρχουν τέσσερα επίπεδα δομικής οργάνωσης των πρωτεϊνών: πρωτογενές, δευτερογενές, τριτογενές και τεταρτοταγές. Κάθε επίπεδο έχει τα δικά του χαρακτηριστικά.
Δομή πρωτογενούς πρωτεΐνης
Η κύρια δομή των πρωτεϊνών είναι μια γραμμική πολυπεπτιδική αλυσίδα αμινοξέων που συνδέονται με πεπτιδικούς δεσμούς. Η πρωτογενής δομή είναι το απλούστερο επίπεδο δομικής οργάνωσης ενός μορίου πρωτεΐνης. Του δίνεται υψηλή σταθερότητα από ομοιοπολικούς πεπτιδικούς δεσμούς μεταξύ της α-αμινο ομάδας ενός αμινοξέος και της α-καρβοξυλικής ομάδας ενός άλλου αμινοξέος. [προβολή].
Εάν η ιμινο ομάδα της προλίνης ή της υδροξυπρολίνης εμπλέκεται στο σχηματισμό ενός πεπτιδικού δεσμού, τότε έχει διαφορετική μορφή [προβολή].
Όταν σχηματίζονται πεπτιδικοί δεσμοί στα κύτταρα, η καρβοξυλική ομάδα ενός αμινοξέος ενεργοποιείται πρώτα και στη συνέχεια συνδυάζεται με την αμινομάδα ενός άλλου. Η εργαστηριακή σύνθεση πολυπεπτιδίων πραγματοποιείται με τον ίδιο περίπου τρόπο.
Ένας πεπτιδικός δεσμός είναι ένα επαναλαμβανόμενο θραύσμα μιας πολυπεπτιδικής αλυσίδας. Έχει μια σειρά από χαρακτηριστικά που επηρεάζουν όχι μόνο το σχήμα της πρωτογενούς δομής, αλλά και τα υψηλότερα επίπεδα οργάνωσης της πολυπεπτιδικής αλυσίδας:

ομοεπίπεδο - όλα τα άτομα που περιλαμβάνονται στην πεπτιδική ομάδα βρίσκονται στο ίδιο επίπεδο.
την ικανότητα ύπαρξης σε δύο μορφές συντονισμού (κετο ή ενόλη).
trans θέση των υποκαταστατών σε σχέση με τον δεσμό C-N.
την ικανότητα σχηματισμού δεσμών υδρογόνου και καθεμία από τις πεπτιδικές ομάδες μπορεί να σχηματίσει δύο δεσμούς υδρογόνου με άλλες ομάδες, συμπεριλαμβανομένων των πεπτιδικών.
Η εξαίρεση είναι οι πεπτιδικές ομάδες που περιλαμβάνουν την αμινομάδα της προλίνης ή της υδροξυπρολίνης. Είναι σε θέση να σχηματίσουν μόνο έναν δεσμό υδρογόνου (βλ. παραπάνω). Αυτό επηρεάζει το σχηματισμό της δευτερογενούς δομής της πρωτεΐνης. Η πολυπεπτιδική αλυσίδα στην περιοχή όπου βρίσκεται η προλίνη ή η υδροξυπρολίνη κάμπτεται εύκολα, αφού δεν συγκρατείται, ως συνήθως, από δεύτερο δεσμό υδρογόνου.
Ονοματολογία πεπτιδίων και πολυπεπτιδίων. Το όνομα των πεπτιδίων αποτελείται από τα ονόματα των αμινοξέων που τα αποτελούν. Δύο αμινοξέα κάνουν ένα διπεπτίδιο, τρία κάνουν ένα τριπεπτίδιο, τέσσερα κάνουν ένα τετραπεπτίδιο, κ.λπ. Κάθε πεπτίδιο ή πολυπεπτιδική αλυσίδα οποιουδήποτε μήκους έχει ένα αμινοξύ Ν-τερματικού που περιέχει μια ελεύθερη αμινομάδα και ένα Ο-τερματικό αμινοξύ που περιέχει ένα ελεύθερο καρβοξυλικό ομάδα. Κατά την ονομασία των πολυπεπτιδίων, όλα τα αμινοξέα παρατίθενται διαδοχικά, ξεκινώντας από το Ν-τερματικό, αντικαθιστώντας στα ονόματά τους, εκτός από το Ο-τερματικό, το επίθημα -in με -yl (καθώς τα αμινοξέα στα πεπτίδια δεν έχουν πλέον καρβοξυλική ομάδα, αλλά μια καρβονυλική). Για παράδειγμα, το όνομα που φαίνεται στο Σχ. 1 τριπεπτίδιο - λευκ λάσπηφαινυλαλάνιο λάσπηθρέον σε.
Χαρακτηριστικά της πρωτογενούς δομής της πρωτεΐνης. Στη ραχοκοκαλιά της πολυπεπτιδικής αλυσίδας, άκαμπτες δομές (επίπεδες πεπτιδικές ομάδες) εναλλάσσονται με σχετικά κινητές περιοχές (-CHR), οι οποίες είναι ικανές να περιστρέφονται γύρω από δεσμούς. Τέτοια δομικά χαρακτηριστικά της πολυπεπτιδικής αλυσίδας επηρεάζουν τη χωρική της διάταξη.
Δευτερεύουσα δομή πρωτεΐνης
Η δευτερογενής δομή είναι ένας τρόπος αναδίπλωσης μιας πολυπεπτιδικής αλυσίδας σε μια διατεταγμένη δομή λόγω του σχηματισμού δεσμών υδρογόνου μεταξύ πεπτιδικών ομάδων της ίδιας αλυσίδας ή γειτονικών πολυπεπτιδικών αλυσίδων. Σύμφωνα με τη διαμόρφωσή τους, οι δευτερεύουσες δομές χωρίζονται σε ελικοειδείς (α-έλικα) και σε στρώσεις-διπλωμένες (β-δομή και εγκάρσια-β-μορφή).


α-Έλικας. Αυτός είναι ένας τύπος δευτερογενούς πρωτεϊνικής δομής που μοιάζει με κανονική έλικα, που σχηματίζεται λόγω διαπεπτιδικών δεσμών υδρογόνου μέσα σε μία πολυπεπτιδική αλυσίδα. Το μοντέλο της δομής της α-έλικας (Εικ. 2), που λαμβάνει υπόψη όλες τις ιδιότητες του πεπτιδικού δεσμού, προτάθηκε από τους Pauling και Corey. Κύρια χαρακτηριστικά της α-έλικας:
ελικοειδής διαμόρφωση της πολυπεπτιδικής αλυσίδας που έχει ελικοειδή συμμετρία.
ο σχηματισμός δεσμών υδρογόνου μεταξύ των πεπτιδικών ομάδων κάθε πρώτου και τέταρτου υπολείμματος αμινοξέος.
κανονικότητα των σπειροειδών στροφών.
την ισοδυναμία όλων των υπολειμμάτων αμινοξέων στην α-έλικα, ανεξάρτητα από τη δομή των πλευρικών τους ριζών.
οι πλευρικές ρίζες των αμινοξέων δεν συμμετέχουν στο σχηματισμό της α-έλικας.
Εξωτερικά, η α-έλικα μοιάζει με μια ελαφρώς τεντωμένη σπείρα ηλεκτρικής κουζίνας. Η κανονικότητα των δεσμών υδρογόνου μεταξύ της πρώτης και της τέταρτης ομάδας πεπτιδίου καθορίζει την κανονικότητα των στροφών της πολυπεπτιδικής αλυσίδας. Το ύψος μιας στροφής, ή το βήμα της α-έλικας, είναι 0,54 nm. περιλαμβάνει 3,6 υπολείμματα αμινοξέων, δηλαδή, κάθε υπόλειμμα αμινοξέος κινείται κατά μήκος του άξονα (το ύψος ενός υπολείμματος αμινοξέος) κατά 0,15 nm (0,54:3,6 = 0,15 nm), γεγονός που μας επιτρέπει να μιλάμε για ισοδυναμία όλων των υπολειμμάτων αμινοξέων στην α-έλικα. Η περίοδος κανονικότητας μιας α-έλικας είναι 5 στροφές ή 18 υπολείμματα αμινοξέων. το μήκος μιας περιόδου είναι 2,7 nm. Ρύζι. 3. Μοντέλο Pauling-Corey a-helix
β-Δομή. Αυτός είναι ένας τύπος δευτερογενούς δομής που έχει μια ελαφρώς καμπύλη διαμόρφωση της πολυπεπτιδικής αλυσίδας και σχηματίζεται από διαπεπτιδικούς δεσμούς υδρογόνου εντός μεμονωμένων τμημάτων μιας πολυπεπτιδικής αλυσίδας ή γειτονικών πολυπεπτιδικών αλυσίδων. Ονομάζεται επίσης δομή με στρώσεις πτυχής. Υπάρχουν ποικιλίες β-δομών. Οι περιορισμένες στρωματοποιημένες περιοχές που σχηματίζονται από μια πολυπεπτιδική αλυσίδα μιας πρωτεΐνης ονομάζονται διασταυρούμενη β μορφή (μικρή δομή β). Μεταξύ των πεπτιδικών ομάδων των βρόχων της πολυπεπτιδικής αλυσίδας σχηματίζονται δεσμοί υδρογόνου στη μορφή διασταυρούμενης-β. Ένας άλλος τύπος - η πλήρης β-δομή - είναι χαρακτηριστικός ολόκληρης της πολυπεπτιδικής αλυσίδας, η οποία έχει επίμηκες σχήμα και συγκρατείται από διαπεπτιδικούς δεσμούς υδρογόνου μεταξύ γειτονικών παράλληλων πολυπεπτιδικών αλυσίδων (Εικ. 3). Αυτή η δομή μοιάζει με τη φυσούνα ενός ακορντεόν. Επιπλέον, είναι δυνατές παραλλαγές β-δομών: μπορούν να σχηματιστούν από παράλληλες αλυσίδες (τα Ν-τερματικά άκρα των πολυπεπτιδικών αλυσίδων κατευθύνονται προς την ίδια κατεύθυνση) και αντιπαράλληλες (τα Ν-τελικά άκρα κατευθύνονται σε διαφορετικές κατευθύνσεις). Οι πλευρικές ρίζες ενός στρώματος τοποθετούνται μεταξύ των πλευρικών ριζών ενός άλλου στρώματος.
Στις πρωτεΐνες, οι μεταβάσεις από τις α-δομές στις β-δομές και πίσω είναι δυνατές λόγω της αναδιάταξης των δεσμών υδρογόνου. Αντί για κανονικούς διαπεπτιδικούς δεσμούς υδρογόνου κατά μήκος της αλυσίδας (χάρη στους οποίους η πολυπεπτιδική αλυσίδα συστρέφεται σε μια σπείρα), τα ελικοειδή τμήματα ξετυλίγονται και οι δεσμοί υδρογόνου κλείνουν μεταξύ των επιμήκων τμημάτων των πολυπεπτιδικών αλυσίδων. Αυτή η μετάβαση βρίσκεται στην κερατίνη, την πρωτεΐνη των μαλλιών. Κατά το λούσιμο των μαλλιών με αλκαλικά απορρυπαντικά, η ελικοειδής δομή της β-κερατίνης καταστρέφεται εύκολα και μετατρέπεται σε α-κερατίνη (ισιώνουν τα σγουρά μαλλιά).
Η καταστροφή κανονικών δευτερογενών δομών πρωτεϊνών (α-έλικες και β-δομές), κατ' αναλογία με την τήξη ενός κρυστάλλου, ονομάζεται «τήξη» πολυπεπτιδίων. Σε αυτή την περίπτωση, οι δεσμοί υδρογόνου σπάνε και οι πολυπεπτιδικές αλυσίδες παίρνουν τη μορφή τυχαίου κουβάρι. Κατά συνέπεια, η σταθερότητα των δευτερογενών δομών προσδιορίζεται από διαπεπτιδικούς δεσμούς υδρογόνου. Άλλοι τύποι δεσμών δεν παίρνουν σχεδόν κανένα μέρος σε αυτό, με εξαίρεση τους δισουλφιδικούς δεσμούς κατά μήκος της πολυπεπτιδικής αλυσίδας στις θέσεις των υπολειμμάτων κυστεΐνης. Τα βραχέα πεπτίδια κλείνουν σε κύκλους λόγω των δισουλφιδικών δεσμών. Πολλές πρωτεΐνες περιέχουν και α-έλικες περιοχές και β-δομές. Δεν υπάρχουν σχεδόν φυσικές πρωτεΐνες που να αποτελούνται από 100% α-έλικα (η εξαίρεση είναι η παραμυοσίνη, μια μυϊκή πρωτεΐνη που είναι 96-100% α-έλικα), ενώ τα συνθετικά πολυπεπτίδια έχουν 100% έλικα.
Άλλες πρωτεΐνες έχουν διάφορους βαθμούς περιέλιξης. Μεγάλη συχνότητα α-ελικοειδών δομών παρατηρείται στην παραμυοσίνη, τη μυοσφαιρίνη και την αιμοσφαιρίνη. Αντίθετα, στην θρυψίνη, μια ριβονουκλεάση, ένα σημαντικό μέρος της πολυπεπτιδικής αλυσίδας διπλώνεται σε στρωματικές β-δομές. Πρωτεΐνες των υποστηρικτικών ιστών: κερατίνη (πρωτεΐνη μαλλιών, μαλλιού), κολλαγόνο (πρωτεΐνη τενόντων, δέρμα), ινώδες (πρωτεΐνη φυσικού μεταξιού) έχουν β-διάταξη πολυπεπτιδικών αλυσίδων. Οι διαφορετικοί βαθμοί ελίκωσης των πολυπεπτιδικών αλυσίδων των πρωτεϊνών υποδεικνύουν ότι, προφανώς, υπάρχουν δυνάμεις που διαταράσσουν εν μέρει την ελικότητα ή «σπάνε» την κανονική αναδίπλωση της πολυπεπτιδικής αλυσίδας. Ο λόγος για αυτό είναι μια πιο συμπαγής αναδίπλωση της πρωτεϊνικής πολυπεπτιδικής αλυσίδας σε έναν ορισμένο όγκο, δηλ. σε μια τριτοταγή δομή.
Τριτοταγής δομή πρωτεΐνης
Η τριτοταγής δομή μιας πρωτεΐνης είναι ο τρόπος με τον οποίο η πολυπεπτιδική αλυσίδα είναι διατεταγμένη στο διάστημα. Με βάση το σχήμα της τριτοταγούς δομής τους, οι πρωτεΐνες χωρίζονται κυρίως σε σφαιρικές και ινιδώδεις. Οι σφαιρικές πρωτεΐνες έχουν τις περισσότερες φορές ελλειψοειδές σχήμα και οι ινιδώδεις πρωτεΐνες (που μοιάζουν με νήματα) έχουν επίμηκες σχήμα (σχήμα ράβδου ή ατράκτου).
Ωστόσο, η διαμόρφωση της τριτοταγούς δομής των πρωτεϊνών δεν δίνει ακόμη λόγο να πιστεύουμε ότι οι ινιδώδεις πρωτεΐνες έχουν μόνο μια β-δομή και οι σφαιρικές πρωτεΐνες έχουν μια α-έλικα δομή. Υπάρχουν ινώδεις πρωτεΐνες που έχουν μια ελικοειδή, παρά με στρώσεις, διπλωμένη δευτερεύουσα δομή. Για παράδειγμα, η α-κερατίνη και η παραμυοσίνη (πρωτεΐνη του αποφρακτικού μυός των μαλακίων), οι τροπομυοσίνες (πρωτεΐνες των σκελετικών μυών) ανήκουν σε ινιδιακές πρωτεΐνες (έχουν σχήμα ράβδου) και η δευτερεύουσα δομή τους είναι η α-έλικα. Αντίθετα, οι σφαιρικές πρωτεΐνες μπορεί να περιέχουν μεγάλο αριθμό β-δομών.
Η σπειροειδοποίηση μιας γραμμικής πολυπεπτιδικής αλυσίδας μειώνει το μέγεθός της κατά περίπου 4 φορές. και η συσκευασία στην τριτογενή δομή το καθιστά δεκάδες φορές πιο συμπαγές από την αρχική αλυσίδα.
Δεσμοί που σταθεροποιούν την τριτοταγή δομή μιας πρωτεΐνης. Οι δεσμοί μεταξύ των πλευρικών ριζών των αμινοξέων παίζουν ρόλο στη σταθεροποίηση της τριτοταγούς δομής. Αυτές οι συνδέσεις μπορούν να χωριστούν σε:
ισχυρός (ομοιοπολικός) [προβολή].
αδύναμος (πολικός και van der Waals) [προβολή].
Πολυάριθμοι δεσμοί μεταξύ των πλευρικών ριζών των αμινοξέων καθορίζουν τη χωρική διαμόρφωση του μορίου της πρωτεΐνης.
Χαρακτηριστικά της οργάνωσης της πρωτεϊνικής τριτογενούς δομής. Η διαμόρφωση της τριτοταγούς δομής της πολυπεπτιδικής αλυσίδας καθορίζεται από τις ιδιότητες των πλευρικών ριζών των αμινοξέων που περιλαμβάνονται σε αυτήν (που δεν έχουν αξιοσημείωτη επίδραση στο σχηματισμό πρωτογενών και δευτερογενών δομών) και το μικροπεριβάλλον, δηλ. περιβάλλον. Όταν διπλώνεται, η πολυπεπτιδική αλυσίδα μιας πρωτεΐνης τείνει να πάρει μια ενεργειακά ευνοϊκή μορφή, που χαρακτηρίζεται από ελάχιστη ελεύθερη ενέργεια. Επομένως, οι μη πολικές ομάδες R, «αποφεύγοντας» το νερό, σχηματίζουν, σαν να λέγαμε, το εσωτερικό τμήμα της τριτοταγούς δομής της πρωτεΐνης, όπου βρίσκεται το κύριο μέρος των υδρόφοβων υπολειμμάτων της πολυπεπτιδικής αλυσίδας. Δεν υπάρχουν σχεδόν καθόλου μόρια νερού στο κέντρο του πρωτεϊνικού σφαιριδίου. Οι πολικές (υδρόφιλες) ομάδες R του αμινοξέος βρίσκονται έξω από αυτόν τον υδρόφοβο πυρήνα και περιβάλλονται από μόρια νερού. Η πολυπεπτιδική αλυσίδα είναι περίπλοκα λυγισμένη σε τρισδιάστατο χώρο. Όταν κάμπτεται, η δευτερεύουσα ελικοειδής διαμόρφωση διαταράσσεται. Η αλυσίδα «σπάει» σε αδύναμα σημεία όπου βρίσκεται η προλίνη ή η υδροξυπρολίνη, καθώς αυτά τα αμινοξέα είναι πιο κινητά στην αλυσίδα, σχηματίζοντας μόνο έναν δεσμό υδρογόνου με άλλες πεπτιδικές ομάδες. Μια άλλη θέση κάμψης είναι η γλυκίνη, η οποία έχει μια μικρή ομάδα R (υδρογόνο). Επομένως, οι ομάδες R άλλων αμινοξέων, όταν στοιβάζονται, τείνουν να καταλαμβάνουν τον ελεύθερο χώρο στη θέση της γλυκίνης. Ένας αριθμός αμινοξέων - αλανίνη, λευκίνη, γλουταμινικό, ιστιδίνη - συμβάλλουν στη διατήρηση σταθερών ελικοειδών δομών στην πρωτεΐνη και όπως η μεθειονίνη, η βαλίνη, η ισολευκίνη, το ασπαρτικό οξύ ευνοούν το σχηματισμό β-δομών. Σε ένα μόριο πρωτεΐνης με τριτογενή διαμόρφωση, υπάρχουν περιοχές με τη μορφή α-έλικων (ελικοειδής), β-δομών (στρωματικών) και τυχαίας σπείρας. Μόνο η σωστή χωρική διάταξη της πρωτεΐνης την καθιστά ενεργή. Η παραβίασή του οδηγεί σε αλλαγές στις πρωτεϊνικές ιδιότητες και απώλεια βιολογικής δραστηριότητας.
Δομή τεταρτοταγούς πρωτεΐνης
Οι πρωτεΐνες που αποτελούνται από μία πολυπεπτιδική αλυσίδα έχουν μόνο τριτοταγή δομή. Αυτές περιλαμβάνουν τη μυοσφαιρίνη - μια πρωτεΐνη του μυϊκού ιστού που εμπλέκεται στη δέσμευση του οξυγόνου, μια σειρά από ένζυμα (λυσοζύμη, πεψίνη, θρυψίνη κ.λπ.). Ωστόσο, ορισμένες πρωτεΐνες κατασκευάζονται από πολλές πολυπεπτιδικές αλυσίδες, καθεμία από τις οποίες έχει τριτοταγή δομή. Για τέτοιες πρωτεΐνες, έχει εισαχθεί η έννοια της τεταρτοταγούς δομής, η οποία είναι η οργάνωση πολλών πολυπεπτιδικών αλυσίδων με τριτοταγή δομή σε ένα μόνο λειτουργικό μόριο πρωτεΐνης. Μια τέτοια πρωτεΐνη με τεταρτοταγή δομή ονομάζεται ολιγομερές και οι πολυπεπτιδικές της αλυσίδες με τριτοταγή δομή ονομάζονται πρωτομερή ή υπομονάδες (Εικ. 4).

Στο τεταρτογενές επίπεδο οργάνωσης, οι πρωτεΐνες διατηρούν τη βασική διαμόρφωση της τριτογενούς δομής (σφαιρική ή ινιδωτή). Για παράδειγμα, η αιμοσφαιρίνη είναι μια πρωτεΐνη με τεταρτοταγή δομή και αποτελείται από τέσσερις υπομονάδες. Κάθε μία από τις υπομονάδες είναι μια σφαιρική πρωτεΐνη και, γενικά, η αιμοσφαιρίνη έχει επίσης μια σφαιρική διαμόρφωση. Οι πρωτεΐνες τρίχας και μαλλιού - κερατίνες, που σχετίζονται στην τριτοταγή δομή με τις ινιδιακές πρωτεΐνες, έχουν ινώδη διαμόρφωση και τεταρτοταγή δομή.
Σταθεροποίηση τεταρτοταγούς δομής πρωτεΐνης. Όλες οι πρωτεΐνες που έχουν τεταρτοταγή δομή απομονώνονται με τη μορφή μεμονωμένων μακρομορίων που δεν διασπώνται σε υπομονάδες. Οι επαφές μεταξύ των επιφανειών των υπομονάδων είναι δυνατές μόνο λόγω των πολικών ομάδων των υπολειμμάτων αμινοξέων, καθώς κατά τον σχηματισμό της τριτοταγούς δομής καθεμιάς από τις πολυπεπτιδικές αλυσίδες, οι πλευρικές ρίζες των μη πολικών αμινοξέων (που αποτελούν την πλειοψηφία των όλα τα πρωτεϊνογενή αμινοξέα) είναι κρυμμένα μέσα στην υπομονάδα. Μεταξύ των πολικών τους ομάδων σχηματίζονται πολυάριθμοι ιοντικοί (άλας), υδρογόνου και σε ορισμένες περιπτώσεις δισουλφιδικοί δεσμοί, οι οποίοι συγκρατούν σταθερά τις υπομονάδες με τη μορφή ενός οργανωμένου συμπλέγματος. Η χρήση ουσιών που διασπούν τους δεσμούς υδρογόνου ή ουσιών που μειώνουν τις δισουλφιδικές γέφυρες προκαλεί αποσύνθεση των πρωτομερών και καταστροφή της τεταρτοταγούς δομής της πρωτεΐνης. Στον πίνακα 1 συνοψίζει τα δεδομένα για τους δεσμούς που σταθεροποιούν διαφορετικά επίπεδα οργάνωσης του μορίου πρωτεΐνης [προβολή].
Χαρακτηριστικά της δομικής οργάνωσης ορισμένων ινιδιακών πρωτεϊνών
Η δομική οργάνωση των ινιδιακών πρωτεϊνών έχει μια σειρά από χαρακτηριστικά σε σύγκριση με τις σφαιρικές πρωτεΐνες. Αυτά τα χαρακτηριστικά φαίνονται στο παράδειγμα της κερατίνης, του ινώδους και του κολλαγόνου. Οι κερατίνες υπάρχουν σε α- και β-διαμορφώσεις. Οι α-κερατίνες και το ινώδες έχουν δευτερεύουσα δομή διπλωμένη σε στρώσεις, ωστόσο, στην κερατίνη οι αλυσίδες είναι παράλληλες και στο ινώδες είναι αντιπαράλληλες (βλ. Εικ. 3). Επιπλέον, η κερατίνη περιέχει δισουλφιδικούς δεσμούς μεταξύ των αλυσίδων, ενώ το ινώδες δεν τους έχει. Η θραύση των δισουλφιδικών δεσμών οδηγεί σε διαχωρισμό των πολυπεπτιδικών αλυσίδων στις κερατίνες. Αντίθετα, ο σχηματισμός του μέγιστου αριθμού δισουλφιδικών δεσμών στις κερατίνες μέσω της έκθεσης σε οξειδωτικά μέσα δημιουργεί μια ισχυρή χωρική δομή. Γενικά, στις ινιδιακές πρωτεΐνες, σε αντίθεση με τις σφαιρικές πρωτεΐνες, μερικές φορές είναι δύσκολο να γίνει αυστηρή διάκριση μεταξύ διαφορετικών επιπέδων οργάνωσης. Εάν δεχθούμε (όπως για μια σφαιρική πρωτεΐνη) ότι η τριτοταγής δομή πρέπει να σχηματίζεται με την τοποθέτηση μιας πολυπεπτιδικής αλυσίδας στο χώρο και η τεταρτοταγής δομή από πολλές αλυσίδες, τότε στις ινώδεις πρωτεΐνες εμπλέκονται αρκετές πολυπεπτιδικές αλυσίδες ήδη κατά τον σχηματισμό της δευτερογενούς δομής . Χαρακτηριστικό παράδειγμα ινιδιακής πρωτεΐνης είναι το κολλαγόνο, το οποίο είναι μια από τις πιο άφθονες πρωτεΐνες στο ανθρώπινο σώμα (περίπου το 1/3 της μάζας όλων των πρωτεϊνών). Βρίσκεται σε ιστούς που έχουν υψηλή αντοχή και χαμηλή εκτασιμότητα (οστά, τένοντες, δέρμα, δόντια κ.λπ.). Στο κολλαγόνο, το ένα τρίτο των υπολειμμάτων αμινοξέων είναι γλυκίνη και περίπου το ένα τέταρτο ή λίγο περισσότερο είναι προλίνη ή υδροξυπρολίνη.

Η απομονωμένη πολυπεπτιδική αλυσίδα του κολλαγόνου (πρωτογενής δομή) μοιάζει με σπασμένη γραμμή. Περιέχει περίπου 1000 αμινοξέα και έχει μοριακό βάρος περίπου 10 5 (Εικ. 5, α, β). Η πολυπεπτιδική αλυσίδα αποτελείται από ένα επαναλαμβανόμενο τρίο αμινοξέων (τριπλή) της ακόλουθης σύνθεσης: gly-A-B, όπου Α και Β είναι οποιαδήποτε αμινοξέα εκτός από τη γλυκίνη (συνήθως προλίνη και υδροξυπρολίνη). Οι πολυπεπτιδικές αλυσίδες κολλαγόνου (ή α-αλυσίδες) κατά τον σχηματισμό δευτερογενών και τριτοταγών δομών (Εικ. 5, γ και δ) δεν μπορούν να παράγουν τυπικές α-έλικες με ελικοειδή συμμετρία. Η προλίνη, η υδροξυπρολίνη και η γλυκίνη (αντιελικά αμινοξέα) παρεμβαίνουν σε αυτό. Επομένως, τρεις α-αλυσίδες σχηματίζουν, σαν να λέγαμε, στριμμένες σπείρες, σαν τρεις κλωστές που τυλίγονται γύρω από έναν κύλινδρο. Τρεις ελικοειδείς α αλυσίδες σχηματίζουν μια επαναλαμβανόμενη δομή κολλαγόνου που ονομάζεται τροποκολλαγόνο (Εικ. 5δ). Το τροποκολλαγόνο στην οργάνωσή του είναι η τριτογενής δομή του κολλαγόνου. Οι επίπεδοι δακτύλιοι προλίνης και υδροξυπρολίνης που εναλλάσσονται τακτικά κατά μήκος της αλυσίδας της προσδίδουν ακαμψία, όπως και οι δεσμοί μεταξύ των αλυσίδων μεταξύ των α-αλυσίδων του τροποκολλαγόνου (γι' αυτό το λόγο το κολλαγόνο είναι ανθεκτικό στο τέντωμα). Το τροποκολλαγόνο είναι ουσιαστικά μια υπομονάδα ινιδίων κολλαγόνου. Η τοποθέτηση των υπομονάδων τροποκολλαγόνου στην τεταρτοταγή δομή του κολλαγόνου λαμβάνει χώρα με σταδιακό τρόπο (Εικ. 5e).
Η σταθεροποίηση των δομών του κολλαγόνου συμβαίνει λόγω των δεσμών υδρογόνου, ιοντικών και van der Waals και ενός μικρού αριθμού ομοιοπολικών δεσμών.
Οι α-αλυσίδες του κολλαγόνου έχουν διαφορετικές χημικές δομές. Υπάρχουν διάφοροι τύποι αλυσίδων α 1 (I, II, III, IV) και α 2 αλυσίδες. Ανάλογα με το ποιες αλυσίδες α 1 και α 2 εμπλέκονται στο σχηματισμό της τρίκλωνης έλικας του τροποκολλαγόνου, διακρίνονται τέσσερις τύποι κολλαγόνου:
ο πρώτος τύπος - δύο α 1 (Ι) και μία αλυσίδα α 2.
ο δεύτερος τύπος - τρεις αλυσίδες α 1 (II).
τρίτος τύπος - τρεις αλυσίδες α 1 (III).
τέταρτος τύπος - τρεις αλυσίδες α 1 (IV).
Το πιο κοινό κολλαγόνο είναι ο πρώτος τύπος: βρίσκεται σε οστικό ιστό, δέρμα, τένοντες. Το κολλαγόνο τύπου 2 βρίσκεται στον ιστό χόνδρου κ.λπ. Ένας τύπος ιστού μπορεί να περιέχει διαφορετικούς τύπους κολλαγόνου.
Η διατεταγμένη συσσωμάτωση των δομών κολλαγόνου, η ακαμψία και η αδράνειά τους εξασφαλίζουν την υψηλή αντοχή των ινών κολλαγόνου. Οι πρωτεΐνες κολλαγόνου περιέχουν επίσης συστατικά υδατάνθρακα, δηλαδή είναι σύμπλοκα πρωτεΐνης-υδατάνθρακα.
Το κολλαγόνο είναι μια εξωκυτταρική πρωτεΐνη που σχηματίζεται από κύτταρα συνδετικού ιστού που βρίσκονται σε όλα τα όργανα. Επομένως, με βλάβη στο κολλαγόνο (ή διακοπή του σχηματισμού του), συμβαίνουν πολλαπλές παραβιάσεις των λειτουργιών υποστήριξης του συνδετικού ιστού των οργάνων.
Η άλφα πολυπεπτιδική αλυσίδα τελειώνει με το συνδυασμό αμινοξέων βαλίνη-λευκίνη και η βήτα πολυπεπτιδική αλυσίδα τελειώνει με το συνδυασμό βαλίνη-ιστιδίνη-λευκίνη. Οι αλφα και βήτα πολυπεπτιδικές αλυσίδες στο μόριο της αιμοσφαιρίνης δεν είναι διατεταγμένες γραμμικά· αυτή είναι η κύρια δομή. Λόγω της ύπαρξης ενδομοριακών δυνάμεων, οι πολυπεπτιδικές αλυσίδες συστρέφονται με τη μορφή μιας έλικας άλφα-έλικας (δευτερογενής δομή) τυπική των πρωτεϊνών. Η ίδια η έλικα άλφα-έλικας κάμπτεται χωρικά για κάθε άλφα και βήτα πολυπεπτιδική αλυσίδα, σχηματίζοντας πλέγματα ωοειδούς σχήματος (τριτογενής δομή). Μεμονωμένα μέρη των ελίκων άλφα-έλικας των πολυπεπτιδικών αλυσίδων σημειώνονται με λατινικά γράμματα από το Α έως το Η. Και οι τέσσερις τριτοταγείς καμπύλες αλφα και βήτα πολυπεπτιδικές αλυσίδες βρίσκονται χωρικά σε μια συγκεκριμένη σχέση - μια τεταρτοταγή δομή. Δεν συνδέονται με πραγματικούς χημικούς δεσμούς, αλλά με διαμοριακές δυνάμεις.
Αποδείχθηκε ότι οι άνθρωποι έχουν τρεις κύριους τύπους φυσιολογικής αιμοσφαιρίνης: εμβρυϊκή - U, εμβρυϊκή - F και ενήλικη αιμοσφαιρίνη - A. HbU (που πήρε το όνομά της από το αρχικό γράμμα της λέξης μήτρα) εμφανίζεται στο έμβρυο μεταξύ 7 και 12 εβδομάδων ζωής. τότε εξαφανίζεται και εμφανίζεται η εμβρυϊκή αιμοσφαιρίνη, η οποία μετά τον τρίτο μήνα είναι η κύρια αιμοσφαιρίνη του εμβρύου. Μετά από αυτό, εμφανίζεται σταδιακά η συνηθισμένη αιμοσφαιρίνη ενηλίκων, που ονομάζεται HbA, μετά το αρχικό γράμμα της αγγλικής λέξης «adult». Η ποσότητα της εμβρυϊκής αιμοσφαιρίνης μειώνεται σταδιακά, έτσι ώστε τη στιγμή της γέννησης το 80% της αιμοσφαιρίνης είναι HbA και μόνο το 20% HbF. Μετά τη γέννηση, η εμβρυϊκή αιμοσφαιρίνη συνεχίζει να μειώνεται και στα 2-3 χρόνια της ζωής είναι μόνο 1-2%. Η ίδια ποσότητα εμβρυϊκής αιμοσφαιρίνης είναι σε έναν ενήλικα. Ποσότητα HbF που υπερβαίνει το 2% θεωρείται παθολογική για έναν ενήλικα και για παιδιά άνω των 3 ετών.
Εκτός από τους φυσιολογικούς τύπους αιμοσφαιρίνης, επί του παρόντος είναι γνωστές περισσότερες από 50 παθολογικές παραλλαγές. Ονομάστηκαν αρχικά με λατινικά γράμματα. Το γράμμα Β απουσιάζει στον χαρακτηρισμό των τύπων αιμοσφαιρίνης, καθώς αρχικά ονομαζόταν HbS.
Αιμοσφαιρίνη (Hb)- μια χρωμοπρωτεΐνη που υπάρχει στα ερυθρά αιμοσφαίρια και συμμετέχει στη μεταφορά οξυγόνου στους ιστούς. Η αιμοσφαιρίνη στους ενήλικες ονομάζεται αιμοσφαιρίνη Α (Hb A). Το μοριακό του βάρος είναι περίπου 65.000 Da. Το μόριο Hb A έχει τεταρτοταγή δομή και περιλαμβάνει τέσσερις υπομονάδες - πολυπεπτιδικές αλυσίδες (που ονομάζονται α1, α2, β1 και β2, καθεμία από τις οποίες σχετίζεται με την αίμη.
Θυμηθείτε ότι η αιμοσφαιρίνη είναι μια αλλοστερική πρωτεΐνη· τα μόριά της μπορούν να αλλάξουν αναστρέψιμα από τη μια διαμόρφωση στην άλλη. Αυτό αλλάζει τη συγγένεια της πρωτεΐνης για τους συνδέτες. Η διαμόρφωση με τη μικρότερη συγγένεια για το πρόσδεμα ονομάζεται τεταμένη ή Τ-διαμόρφωση. Η διαμόρφωση με τη μεγαλύτερη συγγένεια για τον συνδέτη ονομάζεται χαλαρή ή R-διαμόρφωση.
Οι διαμορφώσεις R και T του μορίου της αιμοσφαιρίνης βρίσκονται σε κατάσταση δυναμικής ισορροπίας:
Διάφοροι περιβαλλοντικοί παράγοντες μπορούν να αλλάξουν αυτή την ισορροπία προς τη μία ή την άλλη κατεύθυνση. Οι αλλοστερικοί ρυθμιστές που επηρεάζουν τη συγγένεια της Hb για το O2 είναι: 1) οξυγόνο. 2) Συγκέντρωση Η+ (μέσο pH); 3) διοξείδιο του άνθρακα (CO2); 4) 2,3-διφωσφογλυκερικό (DPG). Η σύνδεση ενός μορίου οξυγόνου σε μία από τις υπομονάδες αιμοσφαιρίνης προάγει τη μετάβαση μιας τεταμένης διαμόρφωσης σε μια χαλαρή και αυξάνει τη συγγένεια για το οξυγόνο άλλων υπομονάδων του ίδιου μορίου αιμοσφαιρίνης. Αυτό το φαινόμενο ονομάζεται συνεργατικό αποτέλεσμα. Η πολύπλοκη φύση της δέσμευσης της αιμοσφαιρίνης με το οξυγόνο αντανακλάται από την καμπύλη κορεσμού αιμοσφαιρίνης O2, η οποία έχει σχήμα S (Εικόνα 3.1).

Εικόνα 3.1.Καμπύλες κορεσμού οξυγόνου μυοσφαιρίνης (1) και αιμοσφαιρίνης (2).
Μοριακές μορφέςη αιμοσφαιρίνη διαφέρουν μεταξύ τους ως προς τη δομή των πολυπεπτιδικών αλυσίδων. Ένα παράδειγμα τέτοιας ποικιλίας αιμοσφαιρίνης που υπάρχει υπό φυσιολογικές συνθήκες είναι εμβρυϊκή αιμοσφαιρίνη (HbF), που υπάρχει στο αίμα κατά το εμβρυϊκό στάδιο της ανθρώπινης ανάπτυξης. Σε αντίθεση με την HbA, το μόριο της περιέχει 2 α- και 2 γ-αλυσίδες (δηλαδή, οι β-αλυσίδες αντικαθίστανται από γ-αλυσίδες). Μια τέτοια αιμοσφαιρίνη έχει υψηλότερη συγγένεια για το οξυγόνο. Αυτό είναι που επιτρέπει στο έμβρυο να λαμβάνει οξυγόνο από το αίμα της μητέρας μέσω του πλακούντα. Αμέσως μετά τη γέννηση, η HbF στο αίμα του μωρού αντικαθίσταται από HbA.
Παράδειγμα μη φυσιολογικής ή παθολογικής αιμοσφαιρίνης είναι η ήδη αναφερθείσα (βλ. 2.4.) αιμοσφαιρίνη S, που βρίσκεται σε ασθενείς με δρεπανοκυτταρική αναιμία. Όπως ήδη γνωρίζετε, διαφέρει από την αιμοσφαιρίνη Α αντικαθιστώντας το γλουταμικό με βαλίνη στις β-αλυσίδες. Αυτή η υποκατάσταση αμινοξέος προκαλεί μείωση της διαλυτότητας του HbS στο νερό και μείωση της συγγένειάς του για το O2.
Όπως γνωρίζετε, οι πρωτεΐνες είναι η βάση για την προέλευση της ζωής στον πλανήτη μας. Αλλά ήταν το συνενωμένο σταγονίδιο, που αποτελείται από μόρια πεπτιδίου, που έγινε η βάση για την προέλευση των ζωντανών όντων. Αυτό είναι αναμφισβήτητο, επειδή η ανάλυση της εσωτερικής σύνθεσης οποιουδήποτε εκπροσώπου βιομάζας δείχνει ότι αυτές οι ουσίες υπάρχουν σε όλα: φυτά, ζώα, μικροοργανισμούς, μύκητες, ιούς. Επιπλέον, είναι πολύ διαφορετικοί και μακρομοριακού χαρακτήρα.
Αυτές οι δομές έχουν τέσσερα ονόματα, όλα είναι συνώνυμα:
- πρωτεΐνες;
- πρωτεΐνες;
- πολυπεπτίδια;
- πεπτίδια.
Μόρια πρωτεΐνης
Ο αριθμός τους είναι πραγματικά αμέτρητος. Σε αυτή την περίπτωση, όλα τα μόρια πρωτεΐνης μπορούν να χωριστούν σε δύο μεγάλες ομάδες:
- απλό - αποτελείται μόνο από αλληλουχίες αμινοξέων που συνδέονται με πεπτιδικούς δεσμούς.
- σύνθετο - η δομή και η δομή της πρωτεΐνης χαρακτηρίζονται από πρόσθετες πρωτολυτικές (προσθετικές) ομάδες, που ονομάζονται επίσης συμπαράγοντες.
Ταυτόχρονα, τα πολύπλοκα μόρια έχουν επίσης τη δική τους ταξινόμηση.
Διαβάθμιση σύνθετων πεπτιδίων
- Οι γλυκοπρωτεΐνες είναι στενά συγγενείς ενώσεις πρωτεΐνης και υδατανθράκων. Προσθετικές ομάδες βλεννοπολυσακχαριτών υφαίνονται στη δομή του μορίου.
- Οι λιποπρωτεΐνες είναι μια σύνθετη ένωση πρωτεΐνης και λιπιδίου.
- Μεταλλοπρωτεΐνες - ιόντα μετάλλων (σίδηρος, μαγγάνιο, χαλκός και άλλα) δρουν ως προσθετική ομάδα.
- Οι νουκλεοπρωτεΐνες είναι η σύνδεση μεταξύ πρωτεΐνης και νουκλεϊκών οξέων (DNA, RNA).
- Φωσφοπρωτεΐνες - διαμόρφωση μιας πρωτεΐνης και ενός υπολείμματος ορθοφωσφορικού οξέος.
- Οι χρωμοπρωτεΐνες μοιάζουν πολύ με τις μεταλλοπρωτεΐνες, ωστόσο, το στοιχείο που αποτελεί μέρος της προσθετικής ομάδας είναι ένα ολόκληρο έγχρωμο σύμπλεγμα (κόκκινο - αιμοσφαιρίνη, πράσινο - χλωροφύλλη κ.λπ.).
Σε κάθε εξεταζόμενη ομάδα, η δομή και οι ιδιότητες των πρωτεϊνών είναι διαφορετικές. Οι λειτουργίες που εκτελούν ποικίλλουν επίσης ανάλογα με τον τύπο του μορίου.

Χημική δομή πρωτεϊνών
Από αυτή την άποψη, οι πρωτεΐνες είναι μια μακρά, τεράστια αλυσίδα υπολειμμάτων αμινοξέων που συνδέονται μεταξύ τους με συγκεκριμένους δεσμούς που ονομάζονται πεπτιδικοί δεσμοί. Οι κλάδοι που ονομάζονται ρίζες εκτείνονται από τις πλευρικές δομές των οξέων. Αυτή η μοριακή δομή ανακαλύφθηκε από τον E. Fischer στις αρχές του 21ου αιώνα.
Αργότερα, οι πρωτεΐνες, η δομή και οι λειτουργίες των πρωτεϊνών μελετήθηκαν λεπτομερέστερα. Έγινε σαφές ότι υπάρχουν μόνο 20 αμινοξέα που σχηματίζουν τη δομή του πεπτιδίου, αλλά μπορούν να συνδυαστούν με διάφορους τρόπους. Εξ ου και η ποικιλία των πολυπεπτιδικών δομών. Επιπλέον, στη διαδικασία της ζωής και στην εκτέλεση των λειτουργιών τους, οι πρωτεΐνες είναι σε θέση να υποστούν έναν αριθμό χημικών μετασχηματισμών. Ως αποτέλεσμα, αλλάζουν τη δομή και εμφανίζεται ένας εντελώς νέος τύπος σύνδεσης.
Για να σπάσετε τον πεπτιδικό δεσμό, δηλαδή να διαταράξετε την πρωτεΐνη και τη δομή των αλυσίδων, πρέπει να επιλέξετε πολύ αυστηρές συνθήκες (υψηλές θερμοκρασίες, οξέα ή αλκάλια, καταλύτης). Αυτό οφείλεται στην υψηλή αντοχή στο μόριο, δηλαδή στην πεπτιδική ομάδα.

Η ανίχνευση της δομής της πρωτεΐνης στο εργαστήριο πραγματοποιείται χρησιμοποιώντας την αντίδραση διουρίας - έκθεση σε πρόσφατα καταβυθισμένο πολυπεπτίδιο (II). Το σύμπλεγμα της πεπτιδικής ομάδας και του ιόντος χαλκού δίνει ένα λαμπερό μωβ χρώμα.
Υπάρχουν τέσσερις κύριοι δομικοί οργανισμοί, καθένας από τους οποίους έχει τα δικά του δομικά χαρακτηριστικά πρωτεϊνών.
Επίπεδα οργάνωσης: πρωτογενής δομή
Όπως αναφέρθηκε παραπάνω, ένα πεπτίδιο είναι μια αλληλουχία υπολειμμάτων αμινοξέων με ή χωρίς εγκλείσματα, συνένζυμα. Έτσι, το πρωταρχικό είναι η δομή ενός μορίου που είναι φυσικά, φυσικά, αληθινά αμινοξέα συνδεδεμένα με πεπτιδικούς δεσμούς, και τίποτα περισσότερο. Δηλαδή ένα πολυπεπτίδιο με γραμμική δομή. Επιπλέον, τα δομικά χαρακτηριστικά των πρωτεϊνών αυτού του τύπου είναι ότι ένας τέτοιος συνδυασμός οξέων είναι καθοριστικός για την εκτέλεση των λειτουργιών του μορίου πρωτεΐνης. Χάρη στην παρουσία αυτών των χαρακτηριστικών, είναι δυνατό όχι μόνο να προσδιοριστεί ένα πεπτίδιο, αλλά και να προβλεφθούν οι ιδιότητες και ο ρόλος ενός εντελώς νέου, που δεν έχει ακόμη ανακαλυφθεί. Παραδείγματα πεπτιδίων με φυσική πρωτογενή δομή είναι η ινσουλίνη, η πεψίνη, η χυμοθρυψίνη και άλλα.

Δευτερεύουσα διαμόρφωση
Η δομή και οι ιδιότητες των πρωτεϊνών αυτής της κατηγορίας ποικίλλουν κάπως. Μια τέτοια δομή μπορεί να σχηματιστεί αρχικά από τη φύση ή όταν η κύρια εκτίθεται σε σοβαρή υδρόλυση, θερμοκρασία ή άλλες συνθήκες.
Αυτή η διαμόρφωση έχει τρεις ποικιλίες:
- Ομαλές, κανονικές, στερεοκανονικές στροφές, κατασκευασμένες από υπολείμματα αμινοξέων, που στρίβουν γύρω από τον κύριο άξονα της σύνδεσης. Διατηρούνται μαζί μόνο από αυτά που προκύπτουν μεταξύ του οξυγόνου μιας πεπτιδικής ομάδας και του υδρογόνου μιας άλλης ομάδας. Επιπλέον, η δομή θεωρείται σωστή λόγω του γεγονότος ότι οι στροφές επαναλαμβάνονται ομοιόμορφα κάθε 4 συνδέσμους. Μια τέτοια δομή μπορεί να είναι είτε αριστερόχειρας είτε δεξιόχειρας. Αλλά στις περισσότερες γνωστές πρωτεΐνες κυριαρχεί το δεξιοστροφικό ισομερές. Τέτοιες διαμορφώσεις ονομάζονται συνήθως δομές άλφα.
- Η σύνθεση και η δομή των πρωτεϊνών του επόμενου τύπου διαφέρει από την προηγούμενη στο ότι σχηματίζονται δεσμοί υδρογόνου όχι μεταξύ υπολειμμάτων δίπλα σε μια πλευρά του μορίου, αλλά μεταξύ πολύ απομακρυσμένων και σε αρκετά μεγάλη απόσταση. Για το λόγο αυτό, ολόκληρη η δομή παίρνει τη μορφή πολλών κυματιστών πολυπεπτιδικών αλυσίδων που μοιάζουν με φίδια. Υπάρχει ένα χαρακτηριστικό που πρέπει να παρουσιάζει μια πρωτεΐνη. Η δομή των αμινοξέων στα κλαδιά πρέπει να είναι όσο το δυνατόν πιο σύντομη, όπως η γλυκίνη ή η αλανίνη, για παράδειγμα. Αυτός ο τύπος δευτερεύουσας διαμόρφωσης ονομάζεται φύλλα βήτα για την ικανότητά τους να κολλούν μεταξύ τους για να σχηματίσουν μια κοινή δομή.
- Η βιολογία αναφέρεται στον τρίτο τύπο δομής πρωτεΐνης ως σύνθετα, ετερογενώς διάσπαρτα, διαταραγμένα θραύσματα που δεν έχουν στερεοκανονικότητα και είναι ικανά να αλλάζουν δομή υπό την επίδραση εξωτερικών συνθηκών.
Δεν έχουν εντοπιστεί παραδείγματα πρωτεϊνών που έχουν φυσικά δευτερεύουσα δομή.

Τριτοβάθμια εκπαίδευση
Αυτή είναι μια αρκετά περίπλοκη διαμόρφωση που ονομάζεται "σφαιρίδιο". Τι είναι αυτή η πρωτεΐνη; Η δομή του βασίζεται στη δευτερογενή δομή, ωστόσο, προστίθενται νέοι τύποι αλληλεπιδράσεων μεταξύ των ατόμων των ομάδων και ολόκληρο το μόριο φαίνεται να διπλώνεται, εστιάζοντας έτσι στο γεγονός ότι οι υδρόφιλες ομάδες κατευθύνονται στο σφαιρίδιο και οι υδρόφοβες τα εξωτερικά.
Αυτό εξηγεί το φορτίο του μορίου πρωτεΐνης σε κολλοειδή διαλύματα νερού. Τι είδους αλληλεπιδράσεις υπάρχουν εδώ;
- Δεσμοί υδρογόνου - παραμένουν αμετάβλητοι μεταξύ των ίδιων τμημάτων όπως στη δευτερεύουσα δομή.
- αλληλεπιδράσεις - συμβαίνουν όταν το πολυπεπτίδιο διαλύεται σε νερό.
- Οι ιοντικές έλξεις σχηματίζονται μεταξύ διαφορετικών φορτισμένων ομάδων υπολειμμάτων αμινοξέων (ρίζες).
- Ομοιοπολικές αλληλεπιδράσεις - μπορεί να δημιουργηθούν μεταξύ συγκεκριμένων όξινων θέσεων - μορίων κυστεΐνης, ή μάλλον, των ουρών τους.
Έτσι, η σύνθεση και η δομή των πρωτεϊνών με τριτοταγή δομή μπορεί να περιγραφεί ως πολυπεπτιδικές αλυσίδες διπλωμένες σε σφαιρίδια που διατηρούν και σταθεροποιούν τη διαμόρφωσή τους λόγω διαφόρων τύπων χημικών αλληλεπιδράσεων. Παραδείγματα τέτοιων πεπτιδίων: φωσφογλυκερική κενάση, tRNA, άλφα-κερατίνη, ινώδες μεταξιού και άλλα.
Τεταρτογενής δομή
Αυτό είναι ένα από τα πιο πολύπλοκα σφαιρίδια που σχηματίζουν οι πρωτεΐνες. Η δομή και οι λειτουργίες των πρωτεϊνών αυτού του τύπου είναι πολύ πολύπλευρες και συγκεκριμένες.
Ποια είναι αυτή η διαμόρφωση; Πρόκειται για αρκετές (σε ορισμένες περιπτώσεις δεκάδες) μεγάλες και μικρές πολυπεπτιδικές αλυσίδες που σχηματίζονται ανεξάρτητα η μία από την άλλη. Αλλά στη συνέχεια, λόγω των ίδιων αλληλεπιδράσεων που εξετάσαμε για την τριτογενή δομή, όλα αυτά τα πεπτίδια συστρέφονται και συμπλέκονται μεταξύ τους. Με αυτόν τον τρόπο, λαμβάνονται πολύπλοκα σφαιρίδια διαμόρφωσης, τα οποία μπορούν να περιέχουν άτομα μετάλλου, λιπιδικές ομάδες και υδατάνθρακες. Παραδείγματα τέτοιων πρωτεϊνών: πολυμεράση DNA, το πρωτεϊνικό κέλυφος του ιού του καπνού, αιμοσφαιρίνη και άλλα.

Όλες οι πεπτιδικές δομές που εξετάσαμε έχουν τις δικές τους μεθόδους ταυτοποίησης στο εργαστήριο, βασισμένες σε σύγχρονες δυνατότητες χρήσης χρωματογραφίας, φυγοκέντρησης, ηλεκτρονικής και οπτικής μικροσκοπίας και υψηλών τεχνολογιών υπολογιστών.
Λειτουργίες που εκτελούνται
Η δομή και οι λειτουργίες των πρωτεϊνών συσχετίζονται στενά μεταξύ τους. Δηλαδή, κάθε πεπτίδιο παίζει έναν συγκεκριμένο ρόλο, μοναδικό και συγκεκριμένο. Υπάρχουν επίσης εκείνα που είναι ικανά να εκτελούν πολλές σημαντικές λειτουργίες ταυτόχρονα σε ένα ζωντανό κύτταρο. Ωστόσο, είναι δυνατόν να εκφραστούν σε γενικευμένη μορφή οι κύριες λειτουργίες των μορίων πρωτεΐνης σε ζωντανούς οργανισμούς:
- Παροχή κίνησης. Οι μονοκύτταροι οργανισμοί ή τα οργανίδια ή ορισμένοι τύποι κυττάρων είναι ικανοί για κίνηση, συστολή και κίνηση. Αυτό εξασφαλίζεται από πρωτεΐνες που συνθέτουν τη δομή της κινητήριας συσκευής τους: βλεφαρίδες, μαστίγια και κυτταροπλασματική μεμβράνη. Αν μιλάμε για κύτταρα ανίκανα να κινηθούν, τότε οι πρωτεΐνες μπορούν να συμβάλλουν στη συστολή τους (μυοσίνη των μυών).
- Διατροφική ή εφεδρική λειτουργία. Είναι η συσσώρευση μορίων πρωτεΐνης στα αυγά, τα έμβρυα και τους σπόρους των φυτών για την περαιτέρω αναπλήρωση των θρεπτικών συστατικών που λείπουν. Όταν διασπώνται, τα πεπτίδια παράγουν αμινοξέα και βιολογικά δραστικές ουσίες που είναι απαραίτητες για την κανονική ανάπτυξη των ζωντανών οργανισμών.
- Ενεργειακή λειτουργία. Εκτός από τους υδατάνθρακες, οι πρωτεΐνες μπορούν επίσης να προσφέρουν δύναμη στον οργανισμό. Η διάσπαση 1 g πεπτιδίου απελευθερώνει 17,6 kJ χρήσιμης ενέργειας με τη μορφή τριφωσφορικού οξέος αδενοσίνης (ATP), η οποία δαπανάται σε ζωτικές διεργασίες.
- Η σηματοδότηση συνίσταται στην προσεκτική παρακολούθηση των συνεχιζόμενων διεργασιών και στη μετάδοση σημάτων από κύτταρα σε ιστούς, από αυτά σε όργανα, από τα τελευταία στα συστήματα κ.λπ. Χαρακτηριστικό παράδειγμα είναι η ινσουλίνη, η οποία καθορίζει αυστηρά την ποσότητα γλυκόζης στο αίμα.
- Λειτουργία υποδοχέα. Εκτελείται αλλάζοντας τη διαμόρφωση του πεπτιδίου στη μία πλευρά της μεμβράνης και εμπλέκοντας το άλλο άκρο στην αναδόμηση. Ταυτόχρονα, μεταδίδεται το σήμα και οι απαραίτητες πληροφορίες. Τις περισσότερες φορές, τέτοιες πρωτεΐνες είναι ενσωματωμένες στις κυτταροπλασματικές μεμβράνες των κυττάρων και ασκούν αυστηρό έλεγχο σε όλες τις ουσίες που διέρχονται από αυτές. Παρέχουν επίσης πληροφορίες για χημικές και φυσικές αλλαγές στο περιβάλλον.
- Λειτουργία μεταφοράς πεπτιδίων. Διεξάγεται από πρωτεΐνες καναλιού και πρωτεΐνες μεταφορέα. Ο ρόλος τους είναι προφανής - μεταφέρουν τα απαραίτητα μόρια σε μέρη με χαμηλή συγκέντρωση από μέρη με υψηλή συγκέντρωση. Χαρακτηριστικό παράδειγμα είναι η μεταφορά οξυγόνου και διοξειδίου του άνθρακα μέσω οργάνων και ιστών από την πρωτεΐνη αιμοσφαιρίνη. Πραγματοποιούν επίσης τη μεταφορά ενώσεων με χαμηλό μοριακό βάρος μέσω της κυτταρικής μεμβράνης στο εσωτερικό.
- Δομική λειτουργία. Μία από τις πιο σημαντικές λειτουργίες που εκτελούνται από την πρωτεΐνη. Η δομή όλων των κυττάρων και των οργανιδίων τους εξασφαλίζεται από πεπτίδια. Αυτοί, σαν πλαίσιο, καθορίζουν το σχήμα και τη δομή. Επιπλέον, το υποστηρίζουν και το τροποποιούν αν χρειαστεί. Επομένως, για την ανάπτυξη και την ανάπτυξη, όλοι οι ζωντανοί οργανισμοί απαιτούν πρωτεΐνες στη διατροφή τους. Τέτοια πεπτίδια περιλαμβάνουν ελαστίνη, τουμπουλίνη, κολλαγόνο, ακτίνη, κερατίνη και άλλα.
- Καταλυτική συνάρτηση. Εκτελείται από ένζυμα. Πολυάριθμα και ποικίλα, επιταχύνουν όλες τις χημικές και βιοχημικές αντιδράσεις στο σώμα. Χωρίς τη συμμετοχή τους, ένα συνηθισμένο μήλο στο στομάχι θα μπορούσε να χωνευτεί μόνο σε δύο ημέρες, πιθανότατα να σαπίσει στη διαδικασία. Υπό την επίδραση της καταλάσης, της υπεροξειδάσης και άλλων ενζύμων, αυτή η διαδικασία συμβαίνει σε δύο ώρες. Γενικά, χάρη σε αυτόν τον ρόλο των πρωτεϊνών πραγματοποιείται ο αναβολισμός και ο καταβολισμός, δηλαδή το πλαστικό και

Προστατευτικός ρόλος
Υπάρχουν διάφοροι τύποι απειλών από τους οποίους οι πρωτεΐνες έχουν σχεδιαστεί για να προστατεύουν το σώμα.
Πρώτον, τραυματικά αντιδραστήρια, αέρια, μόρια, ουσίες διαφόρων φασμάτων δράσης. Τα πεπτίδια είναι σε θέση να αλληλεπιδρούν χημικά με αυτά, μετατρέποντάς τα σε αβλαβή μορφή ή απλώς εξουδετερώνοντάς τα.
Δεύτερον, η φυσική απειλή από πληγές - εάν το πρωτεϊνικό ινωδογόνο δεν μετατραπεί έγκαιρα σε ινώδες στο σημείο του τραυματισμού, τότε το αίμα δεν θα πήξει, πράγμα που σημαίνει ότι δεν θα συμβεί απόφραξη. Στη συνέχεια, αντίθετα, θα χρειαστείτε το πεπτίδιο πλασμίνη, το οποίο μπορεί να διαλύσει τον θρόμβο και να αποκαταστήσει τη βατότητα του αγγείου.
Τρίτον, απειλή για την ανοσία. Η δομή και η σημασία των πρωτεϊνών που σχηματίζουν την άμυνα του ανοσοποιητικού είναι εξαιρετικά σημαντικές. Αντισώματα, ανοσοσφαιρίνες, ιντερφερόνες - όλα αυτά είναι σημαντικά και σημαντικά στοιχεία του ανθρώπινου λεμφικού και ανοσοποιητικού συστήματος. Οποιοδήποτε ξένο σωματίδιο, επιβλαβές μόριο, νεκρό μέρος ενός κυττάρου ή μια ολόκληρη δομή υπόκειται σε άμεση εξέταση από την πεπτιδική ένωση. Αυτός είναι ο λόγος για τον οποίο ένα άτομο μπορεί ανεξάρτητα, χωρίς τη βοήθεια φαρμάκων, να προστατεύεται καθημερινά από λοιμώξεις και απλούς ιούς.
Φυσικές ιδιότητες
Η δομή μιας κυτταρικής πρωτεΐνης είναι πολύ συγκεκριμένη και εξαρτάται από τη λειτουργία που εκτελείται. Αλλά οι φυσικές ιδιότητες όλων των πεπτιδίων είναι παρόμοιες και συνοψίζονται στα ακόλουθα χαρακτηριστικά.
- Το βάρος του μορίου είναι μέχρι 1.000.000 Daltons.
- Τα κολλοειδή συστήματα σχηματίζονται σε υδατικό διάλυμα. Εκεί η δομή αποκτά ένα φορτίο που μπορεί να ποικίλλει ανάλογα με την οξύτητα του περιβάλλοντος.
- Όταν εκτίθενται σε σκληρές συνθήκες (ακτινοβολία, οξύ ή αλκάλιο, θερμοκρασία κ.λπ.) μπορούν να μετακινηθούν σε άλλα επίπεδα διαμορφώσεων, δηλαδή μετουσίωση. Αυτή η διαδικασία είναι μη αναστρέψιμη στο 90% των περιπτώσεων. Υπάρχει όμως και μια αντίστροφη μετατόπιση - αναγέννηση.
Αυτές είναι οι κύριες ιδιότητες των φυσικών χαρακτηριστικών των πεπτιδίων.