Bunlar müəyyən ardıcıllıqla uzun zəncirlərə bağlanmış 20 növ L-?-amin turşusu qalıqlarından qurulmuş yüksək molekullu üzvi birləşmələr, biopolimerlərdir. Zülalların molekulyar çəkisi 5 mindən 1 milyona qədər dəyişir. “Ağlar” adı ilk dəfə qızdırıldıqda həll olunmayan ağ kütləyə çevrilən quş yumurtalarının maddəsinə verilmişdir. Bu termin daha sonra heyvan və bitkilərdən təcrid olunmuş oxşar xassələri olan digər maddələrə də şamil edilmişdir.
düyü. 1. Ən mürəkkəb biopolimerlər zülallardır. Onların makromolekulları amin turşuları olan monomerlərdən ibarətdir. Hər bir amin turşusunun iki funksional qrupu var: bir karboksil qrupu və bir amin qrupu. Zülalların bütün müxtəlifliyi 20 amin turşusunun müxtəlif birləşmələri nəticəsində yaranır.
Zülallar canlı orqanizmlərdə mövcud olan bütün digər birləşmələr üzərində üstünlük təşkil edir, adətən onların quru çəkisinin yarıdan çoxunu təşkil edir. Təbiətdə bir neçə milyard fərdi zülalın olduğu güman edilir (məsələn, təkcə E. coli bakteriyasında 3 mindən çox müxtəlif zülal mövcuddur).
Zülallar hər hansı bir orqanizmin həyat proseslərində əsas rol oynayır. Zülallara fermentlər daxildir, onların iştirakı ilə hüceyrədə bütün kimyəvi çevrilmələr baş verir (maddələr mübadiləsi); genlərin fəaliyyətinə nəzarət edirlər; onların iştirakı ilə hormonların hərəkəti həyata keçirilir, sinir impulslarının yaranması da daxil olmaqla transmembran nəqli həyata keçirilir. Onlar immun sisteminin (immunoqlobulinlərin) və laxtalanma sisteminin tərkib hissəsidir, sümük və birləşdirici toxumanın əsasını təşkil edir, enerjinin çevrilməsində və istifadəsində iştirak edir.
Protein tədqiqatının tarixi
Zülalları təcrid etmək üçün ilk cəhdlər 18-ci əsrdə edildi. 19-cu əsrin əvvəllərində zülalların kimyəvi tədqiqinə dair ilk əsərlər ortaya çıxdı. Fransız alimləri Joseph Louis Gay-Lussac və Louis Jacques Thénard, sistematik analitik tədqiqatların başlanğıcını qeyd edən müxtəlif mənbələrdən zülalların elementar tərkibini qurmağa çalışdılar, bunun sayəsində bütün zülalların daxil olan elementlər dəstində oxşar olduğu qənaətinə gəldilər. onların tərkibi. 1836-cı ildə holland kimyaçısı G. J. Mulder zülal maddələrinin quruluşunun ilk nəzəriyyəsini təklif etdi, ona görə bütün zülallar kükürd və fosfor atomları ilə müxtəlif nisbətlərdə əlaqəli müəyyən bir hipotetik radikala (C 40 H 62 N 10 O 12) malikdir. O, bu radikal "zülal" (yunan zülalından - birinci, əsas) adlandırdı. Mulder nəzəriyyəsi zülalların öyrənilməsinə marağın artmasına və zülal kimyası üsullarının təkmilləşdirilməsinə kömək etdi. Neytral duzların məhlulları ilə ekstraksiya yolu ilə zülalların təcrid edilməsi üsulları işlənib hazırlanmış, zülallar ilk dəfə kristal şəklində (bəzi bitki zülalları) alınmışdır. Zülalları təhlil etmək üçün ilkin həzmlərini turşular və qələvilərlə istifadə etməyə başladılar.
Eyni zamanda, zülal funksiyasının öyrənilməsinə artan diqqət yetirilməyə başlandı. Jens Jakob Berzelius ilk dəfə 1835-ci ildə onların biokatalizator rolunu oynamasını təklif etdi. Tezliklə proteolitik fermentlər - pepsin (T. Schwann, 1836) və tripsin (L. Corvisart, 1856) kəşf edildi, bu da həzm fiziologiyasına və qida maddələrinin parçalanması zamanı əmələ gələn məhsulların təhlilinə diqqət çəkdi. Protein strukturunun sonrakı tədqiqləri və peptidlərin kimyəvi sintezi üzərində aparılan işlər bütün zülalların amin turşularından qurulduğu peptid hipotezinin ortaya çıxması ilə nəticələndi. 19-cu əsrin sonlarında zülalları təşkil edən amin turşularının əksəriyyəti öyrənildi.
20-ci əsrin əvvəllərində alman kimyaçısı Emil Hermann Fişer ilk dəfə zülalları öyrənmək üçün üzvi kimya üsullarından istifadə etmiş və zülalların bir-biri ilə amid (peptid) bağı ilə bağlanmış β-amin turşularından ibarət olduğunu sübut etmişdir. Sonralar analizin fiziki-kimyəvi üsullarının tətbiqi sayəsində bir çox zülalların molekulyar kütləsi təyin edilmiş, kürəvari zülalların sferik forması müəyyən edilmiş, aminturşuların və peptidlərin rentgen difraksiya analizi aparılmış, xromatoqrafik analiz üsulları yaradılmışdır. inkişaf etmişdir (xromatoqrafiyaya baxın).
İlk protein hormonu təcrid olundu (Frederick Grant Banting, John James Rickard McLeod, 1922), antikorlarda qamma-qlobulinlərin olması sübut edildi və əzələ zülalı miozinin fermentativ funksiyası təsvir edildi (Vladimir Aleksandroviç Engelhardt, M. N. Lyubimova, 1939). . İlk dəfə olaraq fermentlər kristal formada - ureaza (J.B. Saliner, 1926), pepsin (J.H. Nortron, 1929), lizozim (E.P. Abraham, Robert Robinson, 1937) alınmışdır.

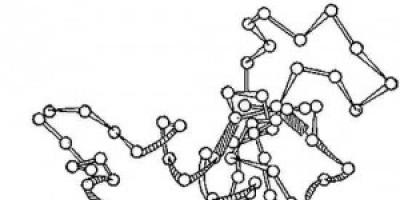
düyü. 2. Lizozim fermentinin üçölçülü quruluşunun sxemi. Dairələr - amin turşuları; iplər - peptid bağları; kölgəli düzbucaqlılar disulfid bağlarıdır. Polipeptid zəncirinin spirallaşmış və uzanmış hissələri görünür.
1950-ci illərdə zülal molekullarının üç səviyyəli təşkili sübut edildi - birincili, ikincili və üçüncü dərəcəli quruluşun olması; avtomatik amin turşusu analizatoru yaratdı (Stenford Moore, William Howard Stein, 1950). 60-cı illərdə zülalların (insulin, ribonukleaza) kimyəvi sintezinə cəhdlər edildi. rentgen şüalarının difraksiyasının təhlili üsulları əhəmiyyətli dərəcədə təkmilləşdirilmişdir; bir cihaz yaradıldı - bir polipeptid zəncirində amin turşularının ardıcıllığını təyin etməyə imkan verən sekvenser (P. Edman, G. Begg, 1967). Bunun nəticəsi müxtəlif mənbələrdən bir neçə yüz zülalın strukturunun yaradılması idi. Onların arasında proteolitik fermentlər (pepsin, tripsin, ximotripsin, subtilisin, karboksipeptidazalar), miyoqlobinlər, hemoglobinlər, sitoxromlar, lizozimlər, immunoqlobulinlər, histonlar, neyrotoksinlər, viral zərf zülalları, protein-peptid hormonları var. Nəticədə enzimologiya, immunologiya, endokrinologiya və bioloji kimyanın digər sahələrinin aktual problemlərinin həlli üçün ilkin şərtlər yarandı.
20-ci əsrin sonlarında biopolimerlərin matris sintezində zülalların rolunun öyrənilməsində, orqanizmlərin müxtəlif həyat proseslərində onların təsir mexanizmlərinin başa düşülməsində, strukturu ilə funksiyası arasında əlaqənin qurulmasında mühüm irəliləyişlər əldə edilmişdir. Tədqiqat üsullarının təkmilləşdirilməsi, zülalların və peptidlərin ayrılması üçün yeni üsulların yaranması böyük əhəmiyyət kəsb edirdi.
Nuklein turşularında nukleotidlərin ardıcıllığının təhlili üçün effektiv metodun işlənib hazırlanması zülallarda amin turşusu ardıcıllığının təyin edilməsini əhəmiyyətli dərəcədə sadələşdirməyə və sürətləndirməyə imkan vermişdir. Bunun mümkün olduğu ortaya çıxdı, çünki zülaldakı amin turşularının sırası bu zülalı (fraqment) kodlayan gendəki nukleotidlərin ardıcıllığı ilə müəyyən edilir. Deməli, bu gendəki nukleotidlərin düzülüşü və genetik kodu bilməklə zülalın polipeptid zəncirində amin turşularının hansı ardıcıllıqla yerləşdiyini dəqiq proqnozlaşdırmaq olar. Zülalların struktur analizində irəliləyişlərlə yanaşı, onların məkan təşkili, supramolekulyar komplekslərin, o cümlədən ribosomların və digər hüceyrə orqanoidlərinin, xromatinin, virusların və s. əmələ gəlmə və təsir mexanizmlərinin öyrənilməsində mühüm nəticələr əldə edilmişdir.
Protein quruluşu
Demək olar ki, bütün zülallar L seriyasına aid 20 α-amin turşusundan qurulur və demək olar ki, bütün orqanizmlərdə eynidir. Zülallardakı amin turşuları bir-birinə qonşu amin turşusu qalıqlarının karboksil və -amin qrupu tərəfindən əmələ gələn -CO-NH- peptid bağı ilə bağlanır: iki amin turşusu, terminal karboksil (-COOH) olan bir dipeptid əmələ gətirir. və amin qrupu (H 2 N-) sərbəst qalır, onlara polipeptid zəncirini yaratmaq üçün yeni amin turşuları əlavə edilə bilər.
H 2 N-qrupunun terminalının yerləşdiyi zəncirin bölməsi N-terminal, ona qarşı olan hissəsi isə C-terminal adlanır. Zülalların nəhəng çeşidi düzülmə ardıcıllığı və onların tərkibindəki amin turşusu qalıqlarının sayı ilə müəyyən edilir. Aydın bir fərq olmasa da, qısa zəncirlər adətən peptidlər və ya oliqopeptidlər (oliqodan...) adlanır və polipeptidlər (zülallar) adətən 50 və ya daha çoxdan ibarət zəncirlər kimi başa düşülür. Ən çox yayılmış zülallar tərkibində 100-400 amin turşusu qalığı olanlardır, lakin molekulları 1000 və ya daha çox qalıqdan əmələ gələnlər də var. Zülallar bir neçə polipeptid zəncirindən ibarət ola bilər. Belə zülallarda hər bir polipeptid zəncirinə subunit deyilir.
Zülalların məkan quruluşu

düyü. 3. Bütün orqanizmlərdə olan zülal 20 növ amin turşusundan ibarətdir. Hər bir protein amin turşularının müəyyən bir çeşidi və kəmiyyət nisbəti ilə xarakterizə olunur. Zülal molekullarında amin turşuları bir-birinə peptid bağları (- CO - NH -) ilə xətti ardıcıllıqla bağlanır və zülalın sözdə ilkin strukturunu təşkil edir. Üst xətt - R1, R2, R3 yan qrupları olan sərbəst amin turşuları; alt xətt - amin turşuları peptid bağları ilə bağlanır.
Polipeptid zənciri spontan olaraq xüsusi bir məkan quruluşu yaratmağa və saxlamağa qadirdir. Zülal molekullarının formasına görə zülallar fibrilyar və kürə şəklində bölünür. Qlobular zülallarda bir və ya daha çox polipeptid zəncirləri yığcam sferik quruluşa və ya kürəyə bükülür. Tipik olaraq bu zülallar suda çox həll olur. Bunlara demək olar ki, bütün fermentlər, qan nəqli zülalları və bir çox saxlama zülalları daxildir. Fibrilyar zülallar çarpaz bağlantılarla bir yerdə saxlanılan ip kimi molekullardır və uzun liflər və ya laylı strukturlar əmələ gətirirlər. Onlar yüksək mexaniki gücə malikdirlər, suda həll olunmurlar və əsasən struktur və qoruyucu funksiyaları yerinə yetirirlər. Belə zülalların tipik nümayəndələri saç və yun keratinləri, ipək fibroin və tendon kollagenidir.
Polipeptid zəncirində kovalent bağlı amin turşularının sırasına amin turşusu ardıcıllığı və ya zülalların ilkin quruluşu deyilir. Hər bir zülalın müvafiq gen tərəfindən kodlaşdırılan ilkin quruluşu sabitdir və daha yüksək səviyyəli strukturların formalaşması üçün lazım olan bütün məlumatları daşıyır. 20 amin turşusundan əmələ gələ bilən zülalların potensial sayı praktiki olaraq qeyri-məhduddur.
Amin turşusu qalıqlarının yan qruplarının qarşılıqlı təsiri nəticəsində polipeptid zəncirinin ayrı-ayrı nisbətən kiçik hissələri zülalların ikincil strukturu kimi tanınan bu və ya digər konformasiya (qatlanma növü) alır. Onun ən xarakterik elementləri vaxtaşırı təkrarlanan α-sarmal və β-strukturdur. İkinci dərəcəli quruluş çox sabitdir. Əsasən müvafiq zülal bölgəsinin amin turşusu ardıcıllığı ilə təyin olunduğundan, onu müəyyən bir ehtimal dərəcəsi ilə proqnozlaşdırmaq mümkün olur. “?-sarmal” termini amerikalı biokimyaçı, fizik və kimyaçı Linus Karl Paulinq tərəfindən təqdim edilmişdir və o, zülal-keratində polipeptid zəncirinin düzəlməsini sağ əlli spiral (?-sarmal bilər) şəklində təsvir etmişdir. telefon kabeli ilə müqayisə oluna bilər). Zülalda belə bir spiralın hər dönüşü üçün 3,6 amin turşusu qalığı var. Bu o deməkdir ki, bir peptid bağının -C=O qrupu, birincidən uzaq olan dörd amin turşusu qalığı olan digər peptid bağının -NH qrupu ilə hidrogen bağı əmələ gətirir. Orta hesabla, hər α-spiral bölgəyə 15-ə qədər amin turşusu daxildir ki, bu da spiralın 3-4 növbəsinə uyğundur. Ancaq hər bir fərdi zülalda spiral uzunluğu bu dəyərdən çox fərqlənə bilər. Kesitidə α-heliks amin turşularının yan zəncirlərinin xaricə yönəldiyi disk formasına malikdir.
Struktur, yoxsa? -qatlanmış təbəqə, polipeptid zəncirinin bir neçə bölməsindən əmələ gələ bilər. Bu bölmələr uzanır və bir-birinə paralel qoyulur, peptid bağları arasında meydana gələn hidrogen bağları ilə bir-birinə bağlıdır. Onlar eyni və ya əks istiqamətlərə yönəldilə bilər (polipeptid zənciri boyunca hərəkət istiqaməti adətən N-terminusdan C-terminusa qədər hesab olunur). Birinci halda, qatlanmış təbəqə paralel, ikincisində - antiparalel adlanır. Sonuncu, peptid zənciri kəskin geri dönmə etdikdə, əyilmə (?-əyilmə) əmələ gətirdikdə əmələ gəlir. Amin turşusu yan zəncirləri müstəviyə perpendikulyar yönəldilmişdir? -qat.
Nisbi məzmun? -spiral bölmələr və? -strukturlar müxtəlif zülallar arasında çox fərqli ola bilər. α-spiralların üstünlük təşkil etdiyi zülallar (mioqlobində və hemoglobində amin turşularının təxminən 75% -i) var və bir çox fibrilyar zülallarda (ipək fibroin, β-keratin daxil olmaqla) bükülmə zəncirinin əsas növü α-sarmaldır. -struktur. Polipeptid zəncirinin yuxarıda təsvir edilən konformasiyaların heç birinə təsnif edilə bilməyən bölgələrinə birləşdirici döngələr deyilir. Onların quruluşu əsasən amin turşularının yan zəncirləri arasındakı qarşılıqlı təsirlərlə müəyyən edilir və hər hansı bir zülalın molekulunda ciddi şəkildə müəyyən edilmiş şəkildə uyğunlaşır.
Üçüncü struktur deyilir qlobulyar zülalların məkan quruluşu. Ancaq tez-tez bu anlayış, hər bir xüsusi zülal üçün xarakterik olan polipeptid zəncirinin kosmosda qatlama üsuluna aiddir. Üçüncü struktur zülalın polipeptid zənciri ilə spontan olaraq, görünür, müəyyən laxtalanma yolu(lar)ı boyunca ikinci dərəcəli struktur elementlərinin ilkin formalaşması ilə əmələ gəlir. İkinci dərəcəli quruluşun sabitliyi hidrogen bağlarına bağlıdırsa, üçüncü quruluş müxtəlif kovalent olmayan qarşılıqlı təsirlər sistemi ilə sabitlənir: hidrogen, ion, molekullararası qarşılıqlı təsirlər, həmçinin qeyri-qütblü aminlərin yan zəncirləri arasında hidrofobik kontaktlar. turşu qalıqları.
Bəzi zülallarda üçüncü quruluş sistein qalıqları arasında disulfid bağlarının (-S-S- bağları) əmələ gəlməsi ilə daha da sabitləşir. Bir qayda olaraq, zülal kürəsinin içərisində nüvəyə yığılmış hidrofobik amin turşularının yan zəncirləri var (onların zülal qlobulunun içərisində ötürülməsi termodinamik cəhətdən əlverişlidir), periferiyada isə hidrofilik qalıqlar və bəzi hidrofobiklər var. Zülal globulu bir neçə yüz nəmləndirici su molekulu ilə əhatə olunmuşdur ki, bu da protein molekulunun sabitliyi üçün zəruridir və tez-tez onun fəaliyyətində iştirak edir. Üçüncü struktur mobildir, onun ayrı-ayrı bölmələri dəyişə bilər, bu da zülalın digər molekullarla qarşılıqlı təsirində əhəmiyyətli rol oynayan konformasiya keçidlərinə səbəb olur.
Üçüncü quruluş zülalın funksional xüsusiyyətlərinin əsasını təşkil edir. Zülalda funksional qrupların ansambllarının - aktiv mərkəzlərin və bağlanma zonalarının formalaşmasını müəyyən edir, onlara lazımi həndəsə verir, bir çox reaksiyaların baş verməsi üçün ilkin şərt olan daxili mühitin yaradılmasına imkan verir və digər zülallarla qarşılıqlı əlaqəni təmin edir. .
Zülalların üçüncü quruluşu onun ilkin quruluşuna aydın şəkildə uyğun gəlir; yəqin ki, zülal qatlanmasının təbiətini təyin edən hələ deşifrə edilməmiş stereokimyəvi kod var. Bununla belə, bir və eyni məkan tənzimləmə üsulu adətən tək bir ilkin quruluşa deyil, amin turşusu qalıqlarının yalnız kiçik bir hissəsinin (20-30% -ə qədər) üst-üstə düşə biləcəyi bütün strukturlar ailəsinə uyğundur, lakin müəyyən hallarda zəncirdəki yerlərdə amin turşusu qalıqlarının oxşarlığı qorunur. Nəticədə oxşar üçüncü və az və ya çox oxşar ilkin quruluşu və bir qayda olaraq, ümumi funksiyası ilə xarakterizə olunan böyük zülal ailələrinin formalaşmasıdır. Bunlar, məsələn, eyni funksiyaya malik olan və təkamüllə əlaqəli olan müxtəlif növ orqanizmlərin zülallarıdır: mioqlobinlər və hemoglobinlər, tripsin, kimotripsin, elastaz və digər heyvan proteinazları.

düyü. 4. Bir neçə zülal makromolekulunun üçüncü quruluşa malik birləşməsi nəticəsində dördüncü zülal strukturu mürəkkəb kompleksə çevrilir. Bu cür kompleks zülallara misal olaraq dörd makromolekuldan ibarət olan hemoglobini göstərmək olar.
Çox vaxt, xüsusən də böyük zülallarda polipeptid zəncirinin bükülməsi fəza quruluşunun az və ya çox muxtar elementlərinin zəncirinin ayrı-ayrı hissələrinin əmələ gəlməsi ilə baş verir - funksional muxtariyyətə malik olan, bu və ya digər bioloji fəaliyyətdən məsul olan domenlər. protein. Beləliklə, qan laxtalanma zülallarının N-terminal domenləri onların hüceyrə membranına bağlanmasını təmin edir.
Molekulları hidrofobik qarşılıqlı təsirlər, hidrogen və ya ion bağları ilə birləşən qlobullar (alt bölmələr) ansamblı olan bir çox zülal var. Belə komplekslər oliqomerik, multimerik və ya subunit zülallar adlanır. Funksional aktiv zülal kompleksində alt bölmələrin düzülüşü zülalın dördüncü strukturu adlanır. Bəzi zülallar daha yüksək dərəcəli strukturlar, məsələn, multiferment kompleksləri, uzadılmış strukturlar (bakteriofaq örtük zülalları), vahid bütövlükdə fəaliyyət göstərən supramolekulyar komplekslər (məsələn, ribosomlar və ya mitoxondrial tənəffüs zəncirinin komponentləri) əmələ gətirməyə qadirdir.
Dördüncü quruluş qeyri-adi həndəsi olan molekulların yaradılmasına imkan verir. Beləliklə, 24 alt bölmədən əmələ gələn ferritin daxili boşluğa malikdir, bunun sayəsində protein 3000-ə qədər dəmir ionunu bağlamağı bacarır. Bundan əlavə, dördüncü quruluş bir molekulda bir neçə fərqli funksiyanı yerinə yetirməyə imkan verir. Triptofan sintetaza amin turşusu triptofanın sintezinin bir neçə ardıcıl mərhələlərindən məsul olan fermentləri birləşdirir.
Protein quruluşunun öyrənilməsi üsulları
Zülalların ilkin quruluşu zülal molekulunun təşkilinin bütün digər səviyyələrini müəyyən edir. Buna görə də müxtəlif zülalların bioloji funksiyasını öyrənərkən bu quruluş haqqında biliklər vacibdir. Amin turşusu ardıcıllığının qurulduğu ilk zülal mədəaltı vəzi hormonu insulin idi. 11 il davam edən bu işi ingilis biokimyaçısı Frederik Sanqer (1954) həyata keçirmişdir. O, hormon molekulunda 51 amin turşusunun yerini təyin etdi və onun disulfid bağları ilə bağlı 2 zəncirdən ibarət olduğunu göstərdi. Sonralar zülalların ilkin strukturunun yaradılması üzrə işlərin çoxu avtomatlaşdırıldı.
Gen mühəndisliyi üsullarının inkişafı ilə bu zülalları kodlayan genlərdəki nukleotid ardıcıllığının təhlilinin nəticələrinə uyğun olaraq zülalların ilkin strukturunu təyin etməklə bu prosesi daha da sürətləndirmək mümkün olmuşdur. Zülalların ikinci və üçüncü strukturu kifayət qədər mürəkkəb fiziki üsullardan, məsələn, zülal kristallarının dairəvi dikroizm və ya rentgen difraksiya analizindən istifadə etməklə öyrənilir. Üçüncü quruluş ilk dəfə ingilis biokimyaçısı John Cowdery Kendrew (1957) tərəfindən əzələ zülalı mioqlobin üçün yaradılmışdır.

düyü. 5. Mioqlobin molekulunun modeli (molekulun məkan konfiqurasiyası)
Zülalların denaturasiyası
Zülalın ikinci, üçüncü və dördüncü strukturlarının sabitləşməsinə cavabdeh olan nisbətən zəif bağlar asanlıqla məhv edilir, bu da onun bioloji aktivliyinin itirilməsi ilə müşayiət olunur. Denaturasiya adlanan ilkin (doğma) zülal strukturunun məhv edilməsi turşuların və əsasların iştirakı ilə, qızdırma, ion gücünün dəyişməsi və digər təsirlərlə baş verir. Bir qayda olaraq, denatürləşdirilmiş zülallar suda zəif və ya heç həll olunmur. Qısamüddətli təsir və denaturasiya edən amillərin sürətlə aradan qaldırılması ilə zülal renaturasiyası orijinal strukturun və bioloji xüsusiyyətlərin tam və ya qismən bərpası ilə mümkündür.
Zülalların təsnifatı
Zülal molekullarının strukturunun mürəkkəbliyi və yerinə yetirdiyi funksiyaların hədsiz müxtəlifliyi onların vahid və aydın təsnifatını yaratmağı çətinləşdirir, baxmayaraq ki, bunu etmək cəhdləri 19-cu əsrin sonlarından bəri dəfələrlə edilib. Kimyəvi tərkibinə görə zülallar sadə və mürəkkəb (bəzən zülallar adlanır) bölünür. Birincinin molekulları yalnız amin turşularından ibarətdir. Polipeptid zəncirinin özündən əlavə, kompleks zülallar karbohidratlar (qlikoproteinlər), lipidlər (lipoproteinlər), nuklein turşuları (nukleoproteinlər), metal ionları (metalloproteinlər), fosfat qrupu (fosfoproteinlər), piqmentlər (xromoproteinlər) ilə təmsil olunan qeyri-zülal komponentləri ehtiva edir. və s.
Onların yerinə yetirdiyi funksiyalardan asılı olaraq zülalların bir neçə sinfi fərqləndirilir. Ən müxtəlif və ən ixtisaslaşmış sinif katalitik funksiyası olan zülallardan - canlı orqanizmlərdə baş verən kimyəvi reaksiyaları sürətləndirmək qabiliyyətinə malik fermentlərdən ibarətdir. Bu qabiliyyətdə zülallar maddələr mübadiləsi zamanı müxtəlif birləşmələrin bütün sintezi və parçalanması proseslərində, zülalların və nuklein turşularının biosintezində, hüceyrələrin inkişafının və differensiasiyasının tənzimlənməsində iştirak edir. Nəqliyyat zülalları yağ turşularını, hormonları və digər üzvi və qeyri-üzvi birləşmələri və ionları seçici şəkildə bağlamaq və sonra onları cərəyanla istədiyiniz yerə nəql etmək qabiliyyətinə malikdir (məsələn, hemoglobin ağciyərlərdən oksigenin bütün hüceyrələrinə ötürülməsində iştirak edir. Bədən). Nəqliyyat zülalları həmçinin bioloji membranlar vasitəsilə ionların, lipidlərin, şəkərlərin və amin turşularının aktiv daşınmasını həyata keçirir.
Struktur zülallar dəstəkləyici və ya qoruyucu funksiyanı yerinə yetirir; hüceyrə skeletinin formalaşmasında iştirak edirlər. Onların arasında ən çox yayılmışlar birləşdirici toxuma kollageni, keratin, dırnaq və lələklər, damar hüceyrələrinin elastini və bir çox başqalarıdır. Lipidlərlə birlikdə hüceyrə və hüceyrədaxili membranların struktur əsasını təşkil edirlər.
Bir sıra zülallar qoruyucu funksiyanı yerinə yetirir. Məsələn, yad patogen mikroorqanizmləri və maddələri bağlamaq qabiliyyətinə malik onurğalıların immunoqlobulinləri (antikorları), onların orqanizmə patogen təsirini neytrallaşdırır və hüceyrələrin çoxalmasının qarşısını alır. Fibrinogen və trombin qanın laxtalanma prosesində iştirak edir. Bakteriyalar tərəfindən ifraz olunan bir çox protein maddələri, həmçinin bəzi onurğasızların komponentləri toksinlər kimi təsnif edilir.
Bəzi zülallar (tənzimləyici) bütövlükdə orqanizmin, ayrı-ayrı orqanların, hüceyrələrin və ya proseslərin fizioloji fəaliyyətinin tənzimlənməsində iştirak edir. Onlar gen transkripsiyasına və zülal sintezinə nəzarət edir; bunlara endokrin bezlər tərəfindən ifraz olunan peptid-protein hormonları daxildir. Toxum saxlama zülalları embrionun inkişafının ilkin mərhələləri üçün qida maddələrini təmin edir. Bunlara həmçinin kazein, yumurta ağı albumin (ovalbumin) və bir çox başqaları daxildir. Zülallar sayəsində əzələ hüceyrələri büzülmə qabiliyyəti əldə edir və nəticədə bədənə hərəkəti təmin edir. Belə kontraktil zülallara misal olaraq birhüceyrəli orqanizmlərin kirpiklərinin və bayraqcıqlarının tərkib hissəsi olan skelet əzələsi aktini və miozini, həmçinin tubulini göstərmək olar; Onlar həmçinin hüceyrə bölünməsi zamanı xromosomların ayrılmasını təmin edirlər.
Reseptor zülalları hormonların və digər bioloji aktiv birləşmələrin hədəfidir. Onların köməyi ilə hüceyrə xarici mühitin vəziyyəti haqqında məlumatları qəbul edir. Onlar sinir həyəcanının ötürülməsində və hüceyrənin yönümlü hərəkətində (kemotaksis) mühüm rol oynayırlar. Bədənə daxil olan enerjinin, eləcə də enerjinin çevrilməsi və istifadəsi bioenerji sisteminin zülallarının (məsələn, vizual piqment rodopsin, tənəffüs zəncirinin sitoxromları) iştirakı ilə baş verir. Digər, bəzən olduqca qeyri-adi funksiyaları olan bir çox zülal da var (məsələn, bəzi Antarktika balıqlarının plazmasında antifriz xüsusiyyətləri olan zülallar var).
Protein biosintezi
Müəyyən bir zülalın quruluşu haqqında bütün məlumatlar nukleotidlərin ardıcıllığı şəklində müvafiq genlərdə "saxlanır" və şablon sintezi prosesində həyata keçirilir. Əvvəlcə məlumat DNT-dən asılı RNT polimeraza fermentindən istifadə etməklə DNT molekulundan messencer RNT-yə (mRNT), daha sonra isə genetik koda uyğun matrisdə olduğu kimi mRNT-də ribosomda iştirakla ötürülür (oxunur). amin turşularını çatdıran nəqliyyat RNT-lərinin meydana gəlməsi polipeptid zəncirində baş verir.
Ribosomdan yaranan sintez edilmiş polipeptid zəncirləri kortəbii şəkildə qatlanaraq zülalın konformasiya xarakteristikasını alır və translasiyadan sonrakı modifikasiyaya məruz qala bilər. Fərdi amin turşularının yan zəncirləri modifikasiyaya məruz qala bilər (hidroksilləşmə, fosforlaşma və s.). Buna görə də, məsələn, hidroksiprolin və hidroksilizin kollagenin tərkibində olur (bax). Modifikasiya polipeptid bağlarının qırılması ilə də müşayiət oluna bilər. Bu yolla, məsələn, disulfid bağları ilə bağlanmış iki zəncirdən ibarət aktiv insulin molekulunun əmələ gəlməsi baş verir.

düyü. 6. Zülal biosintezinin ümumi sxemi.
Qidalanmada zülalların əhəmiyyəti
Zülallar heyvan və insan qidasının ən vacib komponentləridir. Zülalların qida dəyəri onların orqanizmin özündə istehsal olunmayan əvəzolunmaz amin turşularının tərkibi ilə müəyyən edilir. Bu baxımdan bitki zülalları heyvan zülallarından daha az qiymətlidir: onlar lizin, metionin və triptofan baxımından daha zəifdirlər və mədə-bağırsaq traktında həzm olunması daha çətin olur. Qidada əvəzolunmaz amin turşularının olmaması azot mübadiləsinin ciddi pozulmasına gətirib çıxarır.
Zülallar sərbəst amin turşularına parçalanır, bağırsaqda sorulduqdan sonra daxil olur və bütün hüceyrələrə paylanır. Onların bəziləri enerjinin ayrılması ilə sadə birləşmələrə parçalanır, hüceyrə tərəfindən müxtəlif ehtiyaclar üçün istifadə olunur, bəziləri isə müəyyən bir orqanizm üçün xarakterik olan yeni zülalların sintezinə gedir. (R. A. Matveeva, Kiril və Methodius Ensiklopediyası)
Zülalların sadalanması
- amiloid - amiloid;
- anion - anion;
- antivirus - antiviral;
- otoimmün - otoimmün;
- otoloji - otoloji;
- bakterial - bakterial;
- Bence Jones proteini;
- virusun səbəb olduğu - virusun səbəb olduğu;
- viral - virus;
- virus qeyri-struktur - virus qeyri-struktur;
- viral struktur - virus strukturu;
- virusa xas - virusa xas;
- yüksək molekulyar çəki - yüksək molekulyar çəki;
- hem tərkibli - hem;
- heteroloji - xarici;
- hibrid - hibrid;
- qlikosilləşdirilmiş - qlikozilləşdirilmiş;
- kürə şəklində - kürə şəklində;
- denatürləşdirilmiş - denatürləşdirilmiş;
- dəmir tərkibli - dəmir;
- sarısı - sarısı;
- heyvan zülalı - heyvan zülalı;
- qoruyucu - müdafiə;
- immun - immun;
- immunogen - immunoloji cəhətdən uyğundur;
- kalsiumun bağlanması;
- turş - turşu;
- korpuskulyar - korpuskulyar;
- membran - membran;
- miyelom - miyelom;
- mikrosomal - mikrosomal;
- süd proteini - süd proteini;
- monoklonal - monoklonal immunoqlobulin;
- əzələ zülalı - əzələ zülalı;
- doğma - doğma;
- qeyri-histon - qeyri-histon;
- qüsurlu - qismən;
- həll olunmayan - həll olunmayan;
- həzm olunmayan - həll olunmayan;
- qeyri-fermentativ - ferment olmayan;
- aşağı molekulyar çəki - aşağı molekulyar çəki;
- yeni protein - yeni protein;
- ümumi - bütöv;
- onkogen - onkoprotein;
- əsas faza zülalı - anion;
- kəskin fazanın zülalı (iltihab) - kəskin fazanın zülalı;
- yemək - yemək;
- qan plazma proteini - plazma proteini;
- plasenta - plasenta;
- ayırmaq - ayırmaq;
- bərpaedici sinir proteini;
- tənzimləyici - tənzimləyici;
- rekombinasiya - rekombinant;
- reseptor - reseptor;
- ribosomal - ribosomal;
- bağlamaq - bağlamaq;
- ifrazat zülalı - ifrazat zülalı;
- C-reaktiv - C-reaktiv;
- zərdab proteini - zərdab proteini, laktoprotein;
- toxuma - toxuma;
- zəhərli - zəhərli;
- kimerik - kimerik;
- bütöv - bütöv;
- sitozolik - sitozolik;
- qələvi protein - anion protein;
- ekzogen - ekzogen;
- endogen - endogen protein.
Ədəbiyyatda zülallar haqqında daha çox oxuyun:
- Volkenshtein M.V., Molecules and, M., 1965, ch. 3 - 5;
- Gaurowitz F., Zülalların kimyası və funksiyaları, trans. ingilis dilindən, Moskva, 1965;
- Sissakyan N. M. və Gladilin K. L., Zülal sintezinin biokimyəvi aspektləri, kitabda: Bioloji kimyada irəliləyişlər, cild 7, M., 1965, səh. 3;
- Stepanov V. M. Molekulyar biologiya. Zülalların quruluşu və funksiyası. M., 1996;
- Şamin A. N., Zülal kimyasının inkişafı, M., 1966;
- Zülallar və peptidlər. M., 1995-2000. T. 1-3;
- Zülal və nuklein turşularının biosintezi, red. A. S. Spirina, M., 1965;
- Molekulyar biologiyaya giriş, trans. İngilis dilindən, M., 1967
- Molekullar və hüceyrələr. [Oturdu. Art.], çev. İngilis dilindən, M., 1966, s. 7 - 27, 94 - 106;
- Biokimyanın əsasları: İngilis dilindən tərcümə M., 1981. T. 1;
- Protein problemi. M., 1995. T. 1-5;
- Zülallar. Nyu York, 1975-79. 3 ed. V. 1-4.
Başqa maraqlı bir şey tapın:
dələlər- α-amin turşusu qalıqlarından ibarət yüksək molekulyar ağırlıqlı üzvi birləşmələr.
IN protein tərkibi karbon, hidrogen, azot, oksigen, kükürd daxildir. Bəzi zülallar tərkibində fosfor, dəmir, sink və mis olan digər molekullarla komplekslər əmələ gətirir.
Zülalların molekulyar çəkisi böyükdür: yumurta albumini - 36 000, hemoglobin - 152 000, miozin - 500 000. Müqayisə üçün: spirtin molekulyar çəkisi 46, sirkə turşusu - 60, benzol - 78.
Zülalların amin turşularının tərkibi
dələlər- monomerləri olan qeyri-dövri polimerlər α-amin turşuları. Tipik olaraq, 20 növ α-amin turşusu protein monomerləri adlanır, baxmayaraq ki, onların 170-dən çoxu hüceyrələrdə və toxumalarda olur.
Amin turşularının insan və digər heyvanların orqanizmində sintez oluna bilməsindən asılı olaraq, onlar fərqləndirilir: vacib olmayan amin turşuları- sintez edilə bilər; əsas amin turşuları- sintez edilə bilməz. Əsas amin turşuları bədənə qida ilə daxil edilməlidir. Bitkilər bütün növ amin turşularını sintez edir.
Amin turşularının tərkibindən asılı olaraq, zülallar bunlardır: tam- bütün amin turşularını ehtiva edir; qüsurlu- tərkibində bəzi amin turşuları yoxdur. Zülallar yalnız amin turşularından ibarətdirsə, onlara deyilir sadə. Əgər zülalların tərkibində amin turşularından başqa qeyri-aminturşu komponenti (protez qrupu) varsa, onlar adlanır. kompleks. Protez qrupu metallar (metalloproteinlər), karbohidratlar (qlikoproteinlər), lipidlər (lipoproteinlər), nuklein turşuları (nukleoproteinlər) ilə təmsil oluna bilər.
Hamısı amin turşuları ehtiva edir: 1) karboksil qrupu (-COOH), 2) amin qrupu (-NH 2), 3) radikal və ya R-qrupu (molekulun qalan hissəsi). Müxtəlif növ amin turşuları üçün radikalın quruluşu fərqlidir. Amin turşularının tərkibinə daxil olan amin qruplarının və karboksil qruplarının sayından asılı olaraq, onlar fərqləndirilir: neytral amin turşuları bir karboksil qrupu və bir amin qrupu olan; əsas amin turşuları birdən çox amin qrupunun olması; turşu amin turşuları birdən çox karboksil qrupuna malikdir.
Amin turşularıdır amfoter birləşmələr, çünki məhlulda həm turşular, həm də əsaslar kimi çıxış edə bilərlər. Sulu məhlullarda amin turşuları müxtəlif ion formalarında olur.
Peptid bağı
Peptidlər- peptid bağları ilə bağlanmış amin turşusu qalıqlarından ibarət üzvi maddələr.
Peptidlərin əmələ gəlməsi amin turşularının kondensasiya reaksiyası nəticəsində baş verir. Bir amin turşusunun amin qrupu digərinin karboksil qrupu ilə qarşılıqlı əlaqədə olduqda, onların arasında kovalent azot-karbon bağı yaranır ki, bu da adlanır. peptid. Peptidə daxil olan amin turşusu qalıqlarının sayından asılı olaraq, var dipeptidlər, tripeptidlər, tetrapeptidlər və s. Peptid bağının əmələ gəlməsi dəfələrlə təkrarlana bilər. Bu formalaşmasına gətirib çıxarır polipeptidlər. Peptidin bir ucunda sərbəst amin qrupu (N-terminus adlanır), digər ucunda isə sərbəst karboksil qrupu (C-terminus adlanır) var.

Zülal molekullarının məkan təşkili
Zülallar tərəfindən müəyyən spesifik funksiyaların yerinə yetirilməsi onların molekullarının məkan konfiqurasiyasından asılıdır; əlavə olaraq, hüceyrənin zülalları zəncir şəklində, bükülməmiş formada saxlaması enerji baxımından əlverişsizdir, buna görə də polipeptid zəncirləri bükülür, bükülür. müəyyən üçölçülü quruluş və ya uyğunluq. 4 səviyyəsi var zülalların məkan təşkili.
İlkin protein quruluşu- zülal molekulunu təşkil edən polipeptid zəncirində amin turşusu qalıqlarının düzülmə ardıcıllığı. Amin turşuları arasındakı bağ peptid bağıdır.

Əgər zülal molekulu cəmi 10 amin turşusu qalığından ibarətdirsə, onda amin turşularının növbə sırasına görə fərqlənən zülal molekullarının nəzəri cəhətdən mümkün variantlarının sayı 10 20-dir. 20 amin turşusuna sahib olmaqla, onlardan daha müxtəlif birləşmələr yarada bilərsiniz. İnsan orqanizmində həm bir-birindən, həm də digər orqanizmlərin zülallarından fərqlənən on minə yaxın müxtəlif zülal aşkar edilmişdir.
Zülal molekullarının xüsusiyyətlərini və onun məkan konfiqurasiyasını təyin edən zülal molekulunun ilkin quruluşudur. Polipeptid zəncirində yalnız bir amin turşusunun digəri ilə əvəz edilməsi zülalın xassələrinin və funksiyalarının dəyişməsinə səbəb olur. Məsələn, hemoglobinin β-alt bölməsində altıncı qlutamik amin turşusunun valinlə əvəz edilməsi ona gətirib çıxarır ki, bütövlükdə hemoglobin molekulu öz əsas funksiyasını - oksigen nəqlini yerinə yetirə bilmir; Belə hallarda insanda oraq hüceyrə anemiyası adlı xəstəlik yaranır.
İkinci dərəcəli quruluş- polipeptid zəncirinin spiral şəklində qatlanması (uzatılmış yaya bənzəyir). Spiralın növbələri karboksil qrupları və amin qrupları arasında yaranan hidrogen bağları ilə gücləndirilir. Demək olar ki, bütün CO və NH qrupları hidrogen bağlarının əmələ gəlməsində iştirak edir. Onlar peptidlərdən daha zəifdirlər, lakin dəfələrlə təkrarlanaraq bu konfiqurasiyaya sabitlik və sərtlik verirlər. İkinci dərəcəli quruluş səviyyəsində zülallar var: fibroin (ipək, hörümçək toru), keratin (saç, dırnaqlar), kollagen (tendonlar).



Üçüncü quruluş- kimyəvi bağların (hidrogen, ion, disulfid) əmələ gəlməsi və amin turşusu qalıqlarının radikalları arasında hidrofobik qarşılıqlı əlaqənin qurulması nəticəsində yaranan polipeptid zəncirlərinin globullara yığılması. Üçüncü strukturun formalaşmasında əsas rolu hidrofilik-hidrofobik qarşılıqlı təsirlər oynayır. Sulu məhlullarda hidrofobik radikallar qlobulun daxilində qruplaşaraq sudan gizlənməyə meyllidirlər, hidrofilik radikallar isə hidratasiya nəticəsində (su dipolları ilə qarşılıqlı əlaqədə) molekulun səthində görünməyə meyllidirlər. Bəzi zülallarda üçüncü quruluş iki sistein qalığının kükürd atomları arasında əmələ gələn disulfid kovalent bağlarla sabitləşir. Üçüncü struktur səviyyəsində fermentlər, antikorlar və bəzi hormonlar var.

Dördüncü quruluş molekulları iki və ya daha çox qlobuldan əmələ gələn mürəkkəb zülallar üçün xarakterikdir. Alt bölmələr molekulda ion, hidrofobik və elektrostatik qarşılıqlı təsirlərlə saxlanılır. Bəzən dördüncü quruluşun formalaşması zamanı subunitlər arasında disulfid bağları yaranır. Dördüncü quruluşa malik ən çox öyrənilmiş zülaldır hemoglobin. İki α-alt birlik (141 amin turşusu qalığı) və iki β-alt birlik (146 amin turşusu qalığı) tərəfindən əmələ gəlir. Hər bir alt bölmə ilə əlaqəli dəmir olan bir hem molekuludur.
Əgər nədənsə zülalların məkan konformasiyası normadan kənara çıxarsa, zülal öz funksiyalarını yerinə yetirə bilməz. Məsələn, “dəli dana xəstəliyinin” (süngər formalı ensefalopatiya) səbəbi sinir hüceyrələrinin səthi zülalları olan prionların anormal konformasiyasıdır.
Zülalların xassələri
Zülal molekulunun amin turşusu tərkibi və quruluşu onu müəyyən edir xassələri. Zülallar amin turşusu radikalları ilə müəyyən edilən əsas və turşu xassələri birləşdirir: zülalda nə qədər turşulu amin turşusu varsa, onun turşu xassələri bir o qədər aydın olur. Hədiyyə vermək və H + əlavə etmək qabiliyyəti müəyyən edilir zülalların tamponlama xüsusiyyətləri; Ən güclü tamponlardan biri qan pH-nı sabit səviyyədə saxlayan qırmızı qan hüceyrələrində olan hemoglobindir. Orada həll olunan zülallar (fibrinogen), mexaniki funksiyaları yerinə yetirən həll olunmayan zülallar (fibroin, keratin, kollagen) var. Kimyəvi cəhətdən aktiv olan zülallar (fermentlər), müxtəlif ekoloji şəraitə davamlı olan və son dərəcə qeyri-sabit olan kimyəvi cəhətdən aktiv olmayan zülallar var.
Xarici amillər (istilik, ultrabənövşəyi radiasiya, ağır metallar və onların duzları, pH dəyişiklikləri, radiasiya, susuzlaşdırma)
zülal molekulunun struktur təşkilatının pozulmasına səbəb ola bilər. Verilmiş zülal molekuluna xas olan üçölçülü konformasiyanın itirilməsi prosesi adlanır denaturasiya. Denatürasiyanın səbəbi müəyyən bir protein strukturunu sabitləşdirən bağların qırılmasıdır. Əvvəlcə ən zəif bağlar qırılır, şərtlər sərtləşdikcə daha güclü olanlar da qırılır. Buna görə də əvvəlcə dördüncü, sonra üçüncü və ikinci dərəcəli strukturlar itir. Məkan konfiqurasiyasının dəyişməsi zülalın xassələrinin dəyişməsinə gətirib çıxarır və nəticədə zülalın özünə xas olan bioloji funksiyalarını yerinə yetirməsini qeyri-mümkün edir. Denatürasiya ilkin strukturun məhvi ilə müşayiət olunmursa, ola bilər geri çevrilə bilən, bu zaman zülal üçün xarakterik olan konformasiyanın öz-özünə bərpası baş verir. Məsələn, membran reseptor zülalları belə denatürasiyaya məruz qalır. Denatürasiyadan sonra protein strukturunun bərpası prosesi deyilir renaturasiya. Zülalın məkan konfiqurasiyasının bərpası mümkün deyilsə, denaturasiya adlanır dönməz.
Zülalların funksiyaları
| Funksiya | Nümunələr və izahatlar |
|---|---|
| Tikinti | Zülallar hüceyrə və hüceyrədənkənar strukturların əmələ gəlməsində iştirak edir: hüceyrə membranlarının (lipoproteinlər, qlikoproteinlər), saçın (keratin), vətərlərin (kollagen) bir hissəsidir və s. |
| Nəqliyyat | Qan zülalı hemoglobin oksigeni birləşdirir və onu ağciyərlərdən bütün toxuma və orqanlara nəql edir və onlardan karbon qazını ağciyərlərə ötürür; Hüceyrə membranlarının tərkibinə müəyyən maddələrin və ionların hüceyrədən xarici mühitə və arxaya aktiv və ciddi seçici ötürülməsini təmin edən xüsusi zülallar daxildir. |
| Tənzimləyici | Protein hormonları metabolik proseslərin tənzimlənməsində iştirak edir. Məsələn, insulin hormonu qanda qlükoza səviyyəsini tənzimləyir, qlikogen sintezini təşviq edir və karbohidratlardan yağların əmələ gəlməsini artırır. |
| Qoruyucu | Xarici zülalların və ya mikroorqanizmlərin (antigenlərin) bədənə nüfuz etməsinə cavab olaraq, xüsusi zülallar əmələ gəlir - onları bağlaya və neytrallaşdıra bilən antikorlar. Fibrinogendən əmələ gələn fibrin qanaxmanı dayandırmağa kömək edir. |
| Motor | Aktin və miyozin daralma zülalları çoxhüceyrəli heyvanlarda əzələ daralmasını təmin edir. |
| Siqnal | Hüceyrənin səthi membranında ekoloji faktorlara cavab olaraq üçüncü quruluşunu dəyişməyə qadir olan, beləliklə də xarici mühitdən siqnalları qəbul edən və hüceyrəyə əmrlər ötürən zülal molekulları qurulmuşdur. |
| Saxlama | Heyvanların bədənində zülallar, bir qayda olaraq, yumurta albumini və süd kazeini istisna olmaqla, saxlanılmır. Ancaq zülallar sayəsində bəzi maddələr bədəndə saxlanıla bilər, məsələn, hemoglobinin parçalanması zamanı dəmir bədəndən çıxarılmır, lakin ferritin zülalı ilə bir kompleks meydana gətirərək saxlanılır. |
| Enerji | 1 q zülal son məhsullara parçalandıqda 17,6 kJ ayrılır. Əvvəlcə zülallar amin turşularına, sonra isə son məhsullara - su, karbon qazı və ammonyaklara parçalanır. Lakin zülallar enerji mənbəyi kimi yalnız digər mənbələr (karbohidratlar və yağlar) tükəndikdə istifadə olunur. |
| Katalitik | Zülalların ən vacib funksiyalarından biridir. Zülallar tərəfindən təmin edilir - hüceyrələrdə baş verən biokimyəvi reaksiyaları sürətləndirən fermentlər. Məsələn, ribuloza bifosfat karboksilaza fotosintez zamanı CO 2-nin fiksasiyasını katalizləşdirir. |
Fermentlər
Fermentlər, və ya fermentlər, bioloji katalizator olan zülalların xüsusi sinfidir. Fermentlər sayəsində biokimyəvi reaksiyalar böyük sürətlə baş verir. Enzimatik reaksiyaların sürəti qeyri-üzvi katalizatorların iştirakı ilə baş verən reaksiyaların sürətindən on minlərlə dəfə (bəzən də milyonlarla) yüksəkdir. Fermentin fəaliyyət göstərdiyi maddə deyilir substrat.
Fermentlər qlobular zülallardır, struktur xüsusiyyətləri fermentləri iki qrupa bölmək olar: sadə və mürəkkəb. Sadə fermentlər sadə zülallardır, yəni. yalnız amin turşularından ibarətdir. Kompleks fermentlər mürəkkəb zülallardır, yəni. Zülal hissəsinə əlavə olaraq, onların tərkibində zülal olmayan bir qrup var - kofaktor. Bəzi fermentlər vitaminləri kofaktor kimi istifadə edirlər. Ferment molekulunda aktiv mərkəz adlanan xüsusi bir hissə var. Aktiv mərkəz- fermentin kiçik bir hissəsi (üçdən on ikiyə qədər amin turşusu qalıqları), burada substratın və ya substratların bağlanması ferment-substrat kompleksi yaratmaq üçün baş verir. Reaksiya başa çatdıqdan sonra ferment-substrat kompleksi fermentə və reaksiya məhsul(lar)ına parçalanır. Bəzi fermentlər (aktiv istisna olmaqla) allosterik mərkəzlər- ferment sürət tənzimləyicilərinin bağlandığı sahələr ( allosterik fermentlər).

Enzimatik kataliz reaksiyaları aşağıdakılarla xarakterizə olunur: 1) yüksək effektivlik, 2) ciddi seçicilik və təsir istiqaməti, 3) substratın spesifikliyi, 4) incə və dəqiq tənzimləmə. Enzimatik kataliz reaksiyalarının substratı və reaksiya spesifikliyi E.Fişerin (1890) və D.Koşlandın (1959) fərziyyələri ilə izah olunur.
E. Fisher (açar kilidi hipotezi) təklif etdi ki, fermentin aktiv yerinin və substratın məkan konfiqurasiyaları bir-birinə tam uyğun olmalıdır. Substrat "açar", ferment "kilid" ilə müqayisə edilir.
D. Koşland (əl-əlcək hipotezi) substratın strukturu ilə fermentin aktiv mərkəzi arasında fəza uyğunluğunun yalnız onların bir-biri ilə qarşılıqlı əlaqəsi zamanı yarandığını irəli sürdü. Bu hipotez də adlanır induksiya edilmiş yazışma hipotezi.
Enzimatik reaksiyaların sürəti aşağıdakılardan asılıdır: 1) temperaturdan, 2) fermentin konsentrasiyasından, 3) substratın konsentrasiyasından, 4) pH. Vurğulamaq lazımdır ki, fermentlər zülal olduğundan onların aktivliyi fizioloji cəhətdən normal şəraitdə ən yüksək olur.
Əksər fermentlər yalnız 0 ilə 40°C arasında olan temperaturda işləyə bilər. Bu məhdudiyyətlər daxilində temperaturun hər 10 °C artması ilə reaksiya sürəti təxminən 2 dəfə artır. 40 °C-dən yuxarı temperaturda zülal denatürasiyaya məruz qalır və ferment aktivliyi azalır. Donmağa yaxın temperaturda fermentlər təsirsiz hala gəlir.
Substratın miqdarı artdıqca, substrat molekullarının sayı ferment molekullarının sayına bərabər olana qədər fermentativ reaksiyanın sürəti artır. Substrat miqdarının daha da artması ilə sürət artmayacaq, çünki fermentin aktiv mərkəzləri doymuşdur. Ferment konsentrasiyasının artması katalitik aktivliyin artmasına səbəb olur, çünki vahid vaxtda daha çox sayda substrat molekulu çevrilir.

Hər bir ferment üçün maksimum aktivlik nümayiş etdirdiyi optimal pH dəyəri var (pepsin - 2,0, tüpürcək amilazası - 6,8, pankreas lipazı - 9,0). Yüksək və ya aşağı pH dəyərlərində ferment aktivliyi azalır. PH-da qəfil dəyişikliklərlə ferment denatürasiya olunur.
Allosterik fermentlərin sürəti allosterik mərkəzlərə bağlanan maddələrlə tənzimlənir. Bu maddələr reaksiyanı sürətləndirirsə, deyilir aktivatorlar, əgər yavaşlayırlarsa - inhibitorları.
Fermentlərin təsnifatı
Kataliz etdikləri kimyəvi çevrilmələrin növünə görə fermentlər 6 sinfə bölünür:
- oksireduktazlar(hidrogen, oksigen və ya elektron atomlarının bir maddədən digərinə ötürülməsi - dehidrogenaz),
- transferazlar(metil, asil, fosfat və ya amin qrupunun bir maddədən digərinə ötürülməsi - transaminaza),
- hidrolazlar(substratdan iki məhsulun əmələ gəldiyi hidroliz reaksiyaları - amilaza, lipaz),
- lyases(substrata hidrolitik olmayan əlavə və ya ondan bir qrup atomun ayrılması, bu halda C-C, C-N, C-O, C-S bağları qırıla bilər - dekarboksilaza),
- izomerazalar(molekuldaxili yenidən qurulma - izomeraza),
- ligazalar(C-C, C-N, C-O, C-S rabitələrinin əmələ gəlməsi nəticəsində iki molekulun əlaqəsi - sintetaza).
Siniflər öz növbəsində alt siniflərə və alt siniflərə bölünür. Mövcud beynəlxalq təsnifatda hər bir fermentin nöqtələrlə ayrılmış dörd rəqəmdən ibarət xüsusi kodu var. Birinci nömrə sinif, ikinci alt sinif, üçüncü alt sinif, dördüncü bu alt sinifdə olan fermentin seriya nömrəsidir, məsələn, arginaza kodu 3.5.3.1-dir.
Getmək mühazirələr № 2"Karbohidratların və lipidlərin quruluşu və funksiyaları"
Getmək mühazirələr № 4"ATP nuklein turşularının quruluşu və funksiyaları"
19-cu əsrin birinci yarısında. bir çox kimyaçılar və onların arasında ilk növbədə J. von Liebig, tədricən zülalların azotlu birləşmələrin xüsusi sinfini təmsil etdiyi qənaətinə gəldi. Adı "zülallar" (yunan dilindən.
protos birinci) 1840-cı ildə holland kimyaçısı Q. Mulder tərəfindən təklif edilmişdir. FİZİKİ XÜSUSİYYƏTLƏRİ Zülallar bərk vəziyyətdə ağ, lakin məhlulda rəngsizdir, əgər onlar bir növ xromofor (rəngli) qrupu, məsələn, hemoglobin daşımırlar. Suda həllolma müxtəlif zülallar arasında çox dəyişir. O, həmçinin pH-dan və məhluldakı duzların konsentrasiyasından asılı olaraq dəyişir, buna görə də bir zülalın digər zülalların iştirakı ilə seçici olaraq çökəcəyi şərtləri seçmək mümkündür. Bu "tuzlama" üsulu zülalları təcrid etmək və təmizləmək üçün geniş istifadə olunur. Təmizlənmiş zülal çox vaxt məhluldan kristal şəklində çökür.Digər birləşmələrlə müqayisədə zülalların molekulyar çəkisi çox böyükdür, bir neçə mindən milyonlarla daltona qədər dəyişir. Buna görə də, ultrasentrifuqalama zamanı zülallar müxtəlif sürətlərdə çökür. Zülal molekullarında müsbət və mənfi yüklü qrupların olması səbəbindən onlar müxtəlif sürətlə və elektrik sahəsində hərəkət edirlər. Bu, elektroforezin əsasını təşkil edir, mürəkkəb qarışıqlardan fərdi zülalları təcrid etmək üçün istifadə olunan bir üsuldur. Zülallar da xromatoqrafiya ilə təmizlənir.
KİMYƏSİ XÜSUSİYYƏTLƏRİ Struktur. Zülallar polimerlərdir, yəni. rolunu oynadıqları təkrarlanan monomer vahidlərindən və ya alt bölmələrindən zəncir kimi qurulmuş molekullar a -amin turşuları. Amin turşularının ümumi formulası harada R hidrogen atomu və ya bəzi üzvi qrup.Zülal molekulu (polipeptid zənciri) yalnız nisbətən az sayda amin turşularından və ya bir neçə min monomer vahidindən ibarət ola bilər. Amin turşularının bir zəncirdə birləşməsi mümkündür, çünki onların hər biri iki fərqli kimyəvi qrupa malikdir: əsas xüsusiyyətlərə malik bir amin qrupu,
NH 2 , və turşulu karboksil qrupu, COOH. Bu qrupların hər ikisi ilə əlaqəlidir a - karbon atomu. Bir amin turşusunun karboksil qrupu başqa bir amin turşusunun amin qrupu ilə amid (peptid) bağı yarada bilər: İki amin turşusu bu şəkildə bağlandıqdan sonra ikinci amin turşusuna üçdə birini əlavə etməklə zəncir uzana bilər və s. Yuxarıdakı tənlikdən göründüyü kimi, peptid bağı yarandıqda su molekulu ayrılır. Turşuların, qələvilərin və ya proteolitik fermentlərin iştirakı ilə reaksiya əks istiqamətdə gedir: polipeptid zənciri su əlavə etməklə amin turşularına parçalanır. Bu reaksiya hidroliz adlanır. Hidroliz kortəbii şəkildə baş verir və amin turşularını bir polipeptid zəncirinə birləşdirmək üçün enerji tələb olunur.
İki amin turşusu bu şəkildə bağlandıqdan sonra ikinci amin turşusuna üçdə birini əlavə etməklə zəncir uzana bilər və s. Yuxarıdakı tənlikdən göründüyü kimi, peptid bağı yarandıqda su molekulu ayrılır. Turşuların, qələvilərin və ya proteolitik fermentlərin iştirakı ilə reaksiya əks istiqamətdə gedir: polipeptid zənciri su əlavə etməklə amin turşularına parçalanır. Bu reaksiya hidroliz adlanır. Hidroliz kortəbii şəkildə baş verir və amin turşularını bir polipeptid zəncirinə birləşdirmək üçün enerji tələb olunur. Bir karboksil qrupu və bir amid qrupu (və ya amin turşusu prolin vəziyyətində oxşar imid qrupu) bütün amin turşularında mövcuddur, lakin amin turşuları arasındakı fərqlər qrupun təbiəti və ya "yan zəncir" ilə müəyyən edilir. yuxarıda məktubla qeyd olunur
R . Yan zəncirin rolunu amin turşusu qlisindəki kimi bir hidrogen atomu və ya histidin və triptofanda olduğu kimi bəzi həcmli qruplar oynaya bilər. Bəzi yan zəncirlər kimyəvi cəhətdən təsirsizdir, digərləri isə nəzərəçarpacaq dərəcədə reaktivdir.Minlərlə müxtəlif amin turşuları sintez edilə bilər və təbiətdə çoxlu müxtəlif amin turşuları olur, lakin zülal sintezi üçün yalnız 20 növ amin turşusu istifadə olunur: alanin, arginin, asparagin, aspartik turşu, valin, histidin, qlisin, qlutamin, qlutamik. turşu, izolösin, lösin, lizin, metionin, prolin, serin, tirozin, treonin, triptofan, fenilalanin və sistein (zülallarda sistein dimer kimi ola bilər)
sistin). Düzdür, bəzi zülallarda müntəzəm olaraq meydana gələn iyirmidən başqa digər amin turşuları da var, lakin onlar zülalın tərkibinə daxil edildikdən sonra sadalanan iyirmidən birinin modifikasiyası nəticəsində əmələ gəlir.Optik fəaliyyət. Glisin istisna olmaqla, bütün amin turşuları var a -karbon atomunun ona bağlı dörd müxtəlif qrupu var. Həndəsə nöqteyi-nəzərindən dörd müxtəlif qrup iki yolla birləşdirilə bilər və müvafiq olaraq iki mümkün konfiqurasiya və ya bir cismin güzgü görüntüsü ilə bir-biri ilə əlaqəli iki izomer var, yəni. sol əl kimi sağa. Bir konfiqurasiya sol və ya solaxay adlanır ( L ) və digər hüquq və ya dekstrorotator ( D ), çünki iki belə izomer qütbləşmiş işığın müstəvisinin fırlanma istiqamətində fərqlənir. Yalnız zülallarda olur L -amin turşuları (istisna qlisindir; yalnız bir formada təmsil oluna bilər, çünki dörd qrupundan ikisi eynidir) və hamısı optik cəhətdən aktivdir (yalnız bir izomer olduğu üçün). D -amin turşuları təbiətdə nadirdir; onlar bəzi antibiotiklərdə və bakteriyaların hüceyrə divarında olur.Amin turşusu ardıcıllığı. Polipeptid zəncirindəki amin turşuları təsadüfi deyil, müəyyən sabit bir ardıcıllıqla düzülür və zülalın funksiyalarını və xassələrini təyin edən də məhz bu nizamdır. 20 növ amin turşusunun sırasını dəyişdirərək, əlifbanın hərflərindən çoxlu müxtəlif mətnlər yarada bildiyiniz kimi, çoxlu sayda müxtəlif zülallar yarada bilərsiniz.Keçmişdə bir zülalın amin turşusu ardıcıllığını təyin etmək çox vaxt bir neçə il çəkirdi. Birbaşa təyinetmə hələ də kifayət qədər əmək tələb edən bir işdir, baxmayaraq ki, onu avtomatik həyata keçirməyə imkan verən qurğular yaradılmışdır. Müvafiq genin nukleotid ardıcıllığını təyin etmək və ondan zülalın amin turşusu ardıcıllığını çıxarmaq adətən daha asandır. Bu günə qədər yüzlərlə zülalın amin turşusu ardıcıllığı artıq müəyyən edilmişdir. Deşifrə edilmiş zülalların funksiyaları adətən məlumdur və bu, məsələn, bədxassəli yenitörəmələrdə əmələ gələn oxşar zülalların mümkün funksiyalarını təsəvvür etməyə kömək edir.
Kompleks zülallar. Yalnız amin turşularından ibarət olan zülallara sadə deyilir. Ancaq çox vaxt polipeptid zəncirinə metal atomu və ya amin turşusu olmayan bəzi kimyəvi birləşmələr bağlanır. Belə zülallara kompleks deyilir. Buna misal olaraq hemoglobini göstərmək olar: onun qırmızı rəngini təyin edən və oksigen daşıyıcısı kimi çıxış etməyə imkan verən dəmir porfirini ehtiva edir.Ən mürəkkəb zülalların adları birləşdirilmiş qrupların təbiətini göstərir: qlikoproteinlərdə şəkər, lipoproteinlərdə yağlar var. Əgər fermentin katalitik aktivliyi ona qoşulmuş qrupdan asılıdırsa, ona protez qrup deyilir. Çox vaxt bir vitamin protez qrupunun rolunu oynayır və ya birinin bir hissəsidir. Məsələn, retinada olan zülallardan birinə bağlı olan A vitamini onun işığa qarşı həssaslığını təyin edir.
Üçüncü quruluş. Əhəmiyyətli olan zülalın özünün (əsas quruluş) amin turşusu ardıcıllığı deyil, kosmosda düzülüşüdür. Polipeptid zəncirinin bütün uzunluğu boyunca hidrogen ionları müntəzəm hidrogen bağları əmələ gətirir, bu da ona spiral və ya təbəqə (ikinci dərəcəli struktur) formasını verir. Bu cür spiral və təbəqələrin birləşməsindən növbəti nizamın yığcam forması meydana çıxır: zülalın üçüncü quruluşu. Zəncirin monomer vahidlərini tutan bağların ətrafında kiçik açılarda fırlanmalar mümkündür. Buna görə də, sırf həndəsi nöqteyi-nəzərdən hər hansı bir polipeptid zənciri üçün mümkün konfiqurasiyaların sayı sonsuz dərəcədə böyükdür. Əslində, hər bir zülal normal olaraq amin turşusu ardıcıllığı ilə təyin olunan yalnız bir konfiqurasiyada mövcuddur. Bu quruluş sərt deyil, sanki « nəfəs alır” müəyyən orta konfiqurasiya ətrafında dalğalanır. Dövrə sərbəst enerjinin (iş çıxarmaq qabiliyyətinin) minimal olduğu bir konfiqurasiyaya bükülür, necə ki, sərbəst buraxılan yay yalnız minimum sərbəst enerjiyə uyğun bir vəziyyətə sıxılır. Çox vaxt zəncirin bir hissəsi digərinə disulfidlə möhkəm bağlanır ( SS) iki sistein qalığı arasında bağlar. Qismən buna görə sistein amin turşuları arasında xüsusilə mühüm rol oynayır.Zülalların quruluşunun mürəkkəbliyi o qədər böyükdür ki, amin turşusu ardıcıllığı məlum olsa belə, zülalın üçüncü quruluşunu hesablamaq hələ mümkün deyil. Amma zülal kristallarını əldə etmək mümkündürsə, onda onun üçüncü quruluşunu rentgen şüalarının difraksiyası ilə təyin etmək olar.
Struktur, kontraktil və bəzi digər zülallarda zəncirlər uzanır və yaxınlıqda yerləşən bir neçə az bükülmüş zəncir fibrillər əmələ gətirir; fibrillər, öz növbəsində, daha böyük lif birləşmələrinə qatlanır. Bununla belə, məhluldakı zülalların əksəriyyəti kürə şəklindədir: zəncirlər topdakı iplik kimi kürə şəklində bükülür. Bu konfiqurasiya ilə sərbəst enerji minimaldır, çünki hidrofobik ("su itələyici") amin turşuları qlobulun içərisində gizlənir və hidrofilik ("su çəkən") amin turşuları onun səthindədir.
Bir çox zülallar bir neçə polipeptid zəncirinin kompleksləridir. Bu quruluşa zülalın dördüncü quruluşu deyilir. Hemoqlobin molekulu, məsələn, hər biri qlobulyar zülal olan dörd alt hissədən ibarətdir.
Struktur zülallar xətti konfiqurasiyasına görə çox yüksək dartılma gücünə malik liflər əmələ gətirir, qlobulyar konfiqurasiya isə zülalların digər birləşmələrlə spesifik qarşılıqlı əlaqəyə girməsinə imkan verir. Globulun səthində, zəncirlər düzgün yerləşdirildikdə, reaktiv kimyəvi qrupların yerləşdiyi müəyyən bir formalı boşluqlar görünür. Əgər verilmiş zülal fermentdirsə, o zaman hansısa maddənin başqa, adətən daha kiçik molekulu açarın kilidə girdiyi kimi, belə boşluğa daxil olur; bu zaman boşluqda yerləşən kimyəvi qrupların təsiri altında molekulun elektron buludunun konfiqurasiyası dəyişir və bu onu müəyyən şəkildə reaksiya verməyə məcbur edir. Bu şəkildə ferment reaksiyanı kataliz edir. Antikor molekullarında müxtəlif yad maddələrin bağlandığı və bununla da zərərsizləşdirildiyi boşluqlar da var. Zülalların digər birləşmələrlə qarşılıqlı təsirini izah edən "kilid və açar" modeli fermentlərin və antikorların spesifikliyini anlamağa imkan verir, yəni. onların yalnız müəyyən birləşmələrlə reaksiya vermə qabiliyyəti.
Müxtəlif növ orqanizmlərdə zülallar. Müxtəlif bitki və heyvan növlərində eyni funksiyanı yerinə yetirən və buna görə də eyni adı daşıyan zülallar da oxşar konfiqurasiyaya malikdirlər. Bununla birlikdə, amin turşusu ardıcıllığında bir qədər fərqlənirlər. Növlər ümumi əcdaddan ayrıldıqca, müəyyən mövqelərdə olan bəzi amin turşuları başqaları tərəfindən mutasiyalarla əvəz olunur. İrsi xəstəliklərə səbəb olan zərərli mutasiyalar təbii seçmə yolu ilə aradan qaldırılır, lakin faydalı və ya ən azı neytral olanlar davam edə bilər. İki bioloji növ bir-birinə nə qədər yaxındırsa, onların zülallarında bir o qədər az fərq olur.Bəzi zülallar nisbətən tez dəyişir, digərləri çox qorunur. Sonuncuya, məsələn, sitoxrom daxildir iləəksər canlı orqanizmlərdə olan tənəffüs fermenti. İnsanlarda və şimpanzelərdə onun amin turşusu ardıcıllığı eynidir və sitoxromda ilə Buğdada amin turşularının yalnız 38%-i fərqli idi. Hətta insan və bakteriyaların müqayisəsi, sitoxromların oxşarlığı ilə(fərqlər buradakı amin turşularının 65%-nə təsir edir) hələ də görünə bilər, baxmayaraq ki, bakteriyaların və insanların ortaq əcdadı təxminən iki milyard il əvvəl Yer kürəsində yaşamışdır. Hal-hazırda, müxtəlif orqanizmlər arasında təkamül əlaqələrini əks etdirən filogenetik (ailə) ağacının qurulması üçün amin turşusu ardıcıllığının müqayisəsi tez-tez istifadə olunur.
Denatürasiya. Sintezləşdirilmiş zülal molekulu, qatlanaraq, xarakterik konfiqurasiyanı əldə edir. Bununla belə, bu konfiqurasiya qızdırmaqla, pH-ı dəyişdirməklə, üzvi həlledicilərə məruz qalmaqla və hətta səthində baloncuklar görünənə qədər məhlulu sadəcə silkələməklə məhv edilə bilər. Bu şəkildə dəyişdirilmiş zülal denatürasiya adlanır; bioloji aktivliyini itirir və adətən həll olunmaz hala gəlir. Denatürləşdirilmiş zülalın tanınmış nümunələri qaynadılmış yumurta və ya çırpılmış kremdir. Yalnız yüzə yaxın amin turşusu olan kiçik zülallar renaturasiya qabiliyyətinə malikdir, yəni. orijinal konfiqurasiyanı yenidən əldə edin. Lakin əksər zülallar sadəcə olaraq dolaşıq polipeptid zəncirlərinin kütləsinə çevrilir və əvvəlki konfiqurasiyasını bərpa etmirlər.Aktiv zülalların təcrid edilməsində əsas çətinliklərdən biri onların denaturasiyaya qarşı həddindən artıq həssaslığıdır. Zülalların bu xüsusiyyəti qida konservlərində faydalı tətbiq tapır: yüksək temperatur mikroorqanizmlərin fermentlərini geri dönməz şəkildə denatürasiya edir və mikroorqanizmlər ölür.
ZÜLAL SİNTEZİ Zülal sintez etmək üçün canlı orqanizmdə bir amin turşusunu digərinə birləşdirə bilən fermentlər sistemi olmalıdır. Hansı amin turşularının birləşdirilməli olduğunu müəyyən etmək üçün də məlumat mənbəyi lazımdır. Bədəndə minlərlə zülal növü olduğundan və hər biri orta hesabla bir neçə yüz amin turşusundan ibarət olduğundan, tələb olunan məlumat həqiqətən çox böyük olmalıdır. O, genləri təşkil edən nuklein turşusu molekullarında (qeydiyyatın maqnit lentində saxlanmasına bənzər) saxlanılır. Santimetr . həmçinin İRSİ; NÜKLEİK TURŞULAR.Fermentlərin aktivləşdirilməsi. Amin turşularından sintez edilən polipeptid zənciri həmişə son formada zülal olmur. Bir çox fermentlər əvvəlcə qeyri-aktiv prekursorlar kimi sintez olunur və yalnız başqa bir ferment zəncirin bir ucunda bir neçə amin turşusunu çıxardıqdan sonra aktivləşir. Həzm fermentlərinin bəziləri, məsələn, tripsin, bu qeyri-aktiv formada sintez olunur; bu fermentlər zəncirin terminal fraqmentinin çıxarılması nəticəsində həzm sistemində aktivləşir. Aktiv formada molekulu iki qısa zəncirdən ibarət olan hormon insulin, sözdə bir zəncir şəklində sintez olunur. proinsulin. Sonra bu zəncirin orta hissəsi çıxarılır və qalan parçalar bir-birinə bağlanaraq aktiv hormon molekulunu əmələ gətirir. Mürəkkəb zülallar yalnız müəyyən bir kimyəvi qrup zülala bağlandıqdan sonra əmələ gəlir və bu birləşmə çox vaxt fermentə də ehtiyac duyur.Metabolik dövran. Karbon, azot və ya hidrogenin radioaktiv izotopları ilə etiketlənmiş heyvan amin turşuları ilə qidalandıqdan sonra etiket tez onun zülallarına daxil edilir. Əgər etiketli amin turşuları bədənə daxil olmağı dayandırarsa, zülallarda etiketin miqdarı azalmağa başlayır. Bu təcrübələr göstərir ki, yaranan zülallar ömrün sonuna qədər orqanizmdə saxlanılmır. Onların hamısı, bir neçə istisna olmaqla, dinamik vəziyyətdədir, daim amin turşularına parçalanır və sonra yenidən sintez olunur.Bəzi zülallar hüceyrələr ölüb məhv olduqda parçalanır. Bu, məsələn, qırmızı qan hüceyrələri və bağırsağın daxili səthini əhatə edən epitel hüceyrələri ilə hər zaman olur. Bundan əlavə, zülalların parçalanması və yenidən sintezi də canlı hüceyrələrdə baş verir. Qəribədir ki, zülalların parçalanması haqqında onların sintezindən daha az şey məlumdur. Bununla belə, aydındır ki, parçalanma həzm sistemində zülalları amin turşularına parçalayanlara bənzər proteolitik fermentləri əhatə edir.
Müxtəlif zülalların yarı ömrü bir neçə saatdan bir neçə aya qədər dəyişir. Yeganə istisna kollagen molekuludur. Yarandıqdan sonra onlar sabit qalır və yenilənmir və dəyişdirilmir. Lakin zaman keçdikcə onların bəzi xassələri, xüsusən də elastikliyi dəyişir və yenilənmədiyi üçün bu, dəridə qırışların yaranması kimi müəyyən yaşa bağlı dəyişikliklərlə nəticələnir.
Sintetik zülallar. Kimyaçılar amin turşularını polimerləşdirməyi çoxdan öyrəniblər, lakin amin turşuları nizamsız bir şəkildə birləşdirilir, belə ki, belə polimerləşmənin məhsulları təbii olanlara az bənzəyir. Doğrudur, amin turşularını müəyyən bir ardıcıllıqla birləşdirmək mümkündür ki, bu da bəzi bioloji aktiv zülalları, xüsusən də insulini əldə etməyə imkan verir. Proses kifayət qədər mürəkkəbdir və bu yolla yalnız molekullarında yüzə yaxın amin turşusu olan zülalları əldə etmək mümkündür. Bunun əvəzinə arzu olunan amin turşusu ardıcıllığına uyğun gələn genin nukleotid ardıcıllığını sintez etmək və ya təcrid etmək, sonra isə bu geni replikasiya yolu ilə böyük miqdarda istənilən məhsulu istehsal edəcək bakteriyaya daxil etmək daha məqsədəuyğundur. Bununla belə, bu metodun çatışmazlıqları da var. Santimetr . həmçinin GENETİK MÜHENDİSLİK. ZÜLAL VƏ QİDALANMA Bədəndəki zülallar amin turşularına parçalandıqda, bu amin turşuları yenidən zülalları sintez etmək üçün istifadə edilə bilər. Eyni zamanda, amin turşularının özləri parçalanmaya məruz qalırlar, buna görə də onlar tamamilə yenidən istifadə edilmir. Həm də aydındır ki, böyümə, hamiləlik və yaraların sağalması zamanı protein sintezi parçalanmanı aşmalıdır. Bədən davamlı olaraq bəzi zülalları itirir; Bunlar saçın, dırnaqların və dərinin səth qatının zülallarıdır. Buna görə də zülalları sintez etmək üçün hər bir orqanizm amin turşularını qidadan almalıdır. Yaşıl bitkilər CO-dan sintez edirlər 2 , su və ammonyak və ya nitratlar zülallarda olan 20 amin turşusudur. Bir çox bakteriya şəkərin (və ya bəzi ekvivalentinin) və sabit azotun iştirakı ilə amin turşularını sintez etməyə qadirdir, lakin şəkər son nəticədə yaşıl bitkilər tərəfindən təmin edilir. Heyvanların amin turşularını sintez etmək qabiliyyəti məhduddur; yaşıl bitkiləri və ya digər heyvanları yeyərək amin turşularını əldə edirlər. Həzm sistemində udulmuş zülallar amin turşularına parçalanır, sonuncular sorulur və onlardan müəyyən bir orqanizm üçün xarakterik olan zülallar qurulur. Udulmuş zülalların heç biri bədən quruluşlarına daxil edilmir. Yeganə istisna odur ki, bir çox məməlilərdə bəzi ana anticisimləri bütöv şəkildə plasenta vasitəsilə dölün qanına keçə bilər və ana südü ilə (xüsusilə gevişən heyvanlarda) doğuşdan dərhal sonra yeni doğulmuş körpəyə keçə bilər.Protein tələbatı. Aydındır ki, həyatı saxlamaq üçün orqanizm qidadan müəyyən miqdarda protein almalıdır. Lakin bu ehtiyacın həcmi bir sıra amillərdən asılıdır. Bədənin həm enerji mənbəyi (kalori), həm də strukturlarının qurulması üçün material kimi qidaya ehtiyacı var. Enerji ehtiyacı ilk növbədə gəlir. Bu o deməkdir ki, pəhrizdə karbohidratlar və yağlar az olduqda, pəhriz zülalları öz zülallarının sintezi üçün deyil, kalori mənbəyi kimi istifadə olunur. Uzun müddətli oruc zamanı enerji ehtiyaclarını ödəmək üçün hətta öz zülallarınız da istifadə olunur. Pəhrizdə kifayət qədər karbohidrat varsa, o zaman protein istehlakını azaltmaq olar.Azot balansı. Orta hesabla təqribən. Zülalın ümumi kütləsinin 16%-ni azot təşkil edir. Zülalların tərkibində olan amin turşuları parçalandıqda onların tərkibində olan azot orqanizmdən sidiklə və (daha az dərəcədə) nəcislə müxtəlif azotlu birləşmələr şəklində xaric olur. Buna görə protein qidasının keyfiyyətini qiymətləndirmək üçün azot balansı kimi bir göstəricidən istifadə etmək rahatdır, yəni. orqanizmə daxil olan azotun miqdarı ilə gün ərzində xaric edilən azotun miqdarı arasındakı fərq (qramla). Yetkinlərdə normal qidalanma ilə bu məbləğlər bərabərdir. Böyüyən bir orqanizmdə xaric edilən azotun miqdarı alınan miqdardan azdır, yəni. balans müsbətdir. Pəhrizdə protein çatışmazlığı varsa, balans mənfi olur. Pəhrizdə kifayət qədər kalori varsa, lakin tərkibində zülal yoxdursa, orqanizm zülallara qənaət edir. Eyni zamanda, protein metabolizması yavaşlayır və amin turşularının zülal sintezində təkrar istifadəsi mümkün olan ən yüksək effektivliklə baş verir. Bununla belə, itkilər qaçılmazdır və azotlu birləşmələr hələ də sidiklə və qismən nəcislə xaric olunur. Zülal orucu zamanı bədəndən gündə çıxarılan azot miqdarı gündəlik protein çatışmazlığının ölçüsü kimi xidmət edə bilər. Pəhrizdə bu çatışmazlığa bərabər miqdarda zülal daxil etməklə azot balansının bərpa oluna biləcəyini güman etmək təbiidir. Lakin, belə deyil. Bu miqdarda protein qəbul etdikdən sonra bədən amin turşularını daha az səmərəli istifadə etməyə başlayır, buna görə də azot balansını bərpa etmək üçün bəzi əlavə protein tələb olunur.Pəhrizdəki zülalın miqdarı azot balansını qorumaq üçün lazım olandan artıqdırsa, heç bir zərəri yoxdur. Həddindən artıq amin turşuları sadəcə enerji mənbəyi kimi istifadə olunur. Xüsusilə diqqətəlayiq bir nümunə olaraq, Eskimoslar azot balansını qorumaq üçün lazım olan az miqdarda karbohidrat və təxminən on qat çox protein istehlak edirlər. Əksər hallarda, zülaldan enerji mənbəyi kimi istifadə etmək faydalı deyil, çünki müəyyən bir miqdarda karbohidrat eyni miqdarda proteindən daha çox kalori istehsal edə bilər. Kasıb ölkələrdə insanlar kalorilərini karbohidratlardan alır və minimum miqdarda protein istehlak edirlər.
Bədən zülal olmayan məhsullar şəklində lazımi miqdarda kalori alırsa, azot balansının saxlanmasını təmin etmək üçün minimum protein miqdarı təqribəndir. Gündə 30 q. Dörd dilim çörəyin və ya 0,5 litr südün tərkibində bu qədər protein var. Bir az daha böyük rəqəm adətən optimal sayılır; 50-70 q tövsiyə olunur.
Əsas amin turşuları. İndiyə qədər zülal bütöv hesab olunurdu. Bu arada zülal sintezinin baş verməsi üçün bütün lazımi amin turşularının bədəndə olması lazımdır. Heyvanın bədəni özü bəzi amin turşularını sintez etməyə qadirdir. Onlar dəyişdirilə bilən adlanır, çünki onların mütləq pəhrizdə olması lazım deyil, yalnız azot mənbəyi kimi zülalın ümumi təchizatının kifayət qədər olması vacibdir; onda qeyri-əsas aminturşuların çatışmazlığı olarsa, orqanizm onları artıq olanların hesabına sintez edə bilər. Qalan, "əsas" amin turşuları sintez edilə bilməz və bədənə qida ilə təmin edilməlidir. İnsanlar üçün vacib olanlar valin, lösin, izolösin, treonin, metionin, fenilalanin, triptofan, histidin, lizin və arginindir. (Arginin orqanizmdə sintez oluna bilsə də, yeni doğulmuş və böyüyən uşaqlarda kifayət qədər miqdarda istehsal olunmadığı üçün əvəzolunmaz amin turşusu kimi təsnif edilir. Digər tərəfdən, qidadan alınan bu amin turşularının bəziləri böyüklər üçün lazımsız ola bilər. şəxs.)Əsas amin turşularının bu siyahısı digər onurğalılarda və hətta həşəratlarda təxminən eynidir. Zülalların qida dəyəri adətən onları böyüyən siçovullara vermək və heyvanların çəki artımını izləməklə müəyyən edilir.
Zülalların qida dəyəri. Zülalın qida dəyəri ən çox çatışmayan əsas amin turşusu ilə müəyyən edilir. Bunu bir misalla izah edək. Bədənimizdəki zülallar orta hesabla təqribən ehtiva edir. 2% triptofan (çəki ilə). Tutaq ki, pəhrizdə 1% triptofan olan 10 q protein var və onun tərkibində kifayət qədər başqa əvəzolunmaz amin turşuları var. Bizim vəziyyətimizdə bu natamam zülalın 10 qramı mahiyyətcə 5 q tam proteinə bərabərdir; qalan 5 q yalnız enerji mənbəyi kimi xidmət edə bilər. Nəzərə alın ki, amin turşuları praktiki olaraq bədəndə saxlanılmadığından və zülal sintezinin baş verməsi üçün bütün amin turşuları eyni vaxtda olmalıdır, əvəzolunmaz amin turşularının qəbulunun təsiri yalnız onların hamısı olduqda aşkar edilə bilər. eyni zamanda bədənə daxil olur. Heyvan zülallarının əksəriyyətinin orta tərkibi insan orqanizmindəki zülalların orta tərkibinə yaxındır, ona görə də pəhrizimiz ət, yumurta, süd və pendir kimi qidalarla zəngin olarsa, çətin ki, amin turşusu çatışmazlığı ilə üzləşək. Bununla belə, çox az vacib amin turşusu olan jelatin (kollagen denatürasiyası məhsulu) kimi zülallar var. Bitki zülalları, bu mənada jelatindən daha yaxşı olsalar da, əvəzolunmaz amin turşuları baxımından da zəifdirlər; Onların tərkibində lizin və triptofan xüsusilə azdır. Buna baxmayaraq, sırf vegetarian pəhriz, bədəni vacib amin turşuları ilə təmin etmək üçün kifayət qədər az miqdarda bitki zülalları istehlak etməsə, heç bir zərərli hesab edilə bilməz. Bitkilərin toxumlarında, xüsusən də buğda və müxtəlif paxlalı bitkilərin toxumlarında ən çox protein var. Qulançar kimi gənc tumurcuqlar da zülalla zəngindir.Pəhrizdə sintetik zülallar. Qarğıdalı zülalları kimi natamam zülallara az miqdarda sintetik əsas amin turşuları və ya amin turşusu ilə zəngin zülallar əlavə etməklə, sonuncunun qida dəyəri əhəmiyyətli dərəcədə artırıla bilər, yəni. bununla da istehlak edilən protein miqdarını artırır. Başqa bir imkan azot mənbəyi kimi nitrat və ya ammonyak əlavə etməklə neft karbohidrogenləri üzərində bakteriya və ya maya yetişdirməkdir. Bu yolla əldə edilən mikrob zülalı ev quşları və ya mal-qaralar üçün yem kimi xidmət edə bilər və ya insanlar tərəfindən birbaşa istehlak edilə bilər. Üçüncü, geniş istifadə olunan üsul gövşəyən heyvanların fiziologiyasından istifadə edir. Ruminantlarda, mədənin başlanğıc hissəsində, sözdə. Rumen natamam bitki zülallarını daha tam mikrob zülallarına çevirən bakteriya və protozoaların xüsusi formaları ilə yaşayır və bunlar da öz növbəsində həzm və udulduqdan sonra heyvan zülallarına çevrilir. Ucuz sintetik azot tərkibli birləşmə olan karbamid heyvan yeminə əlavə edilə bilər. Rumendə yaşayan mikroorqanizmlər karbohidratları (yemdə daha çox olan) proteinə çevirmək üçün karbamid azotundan istifadə edirlər. Heyvandarlıq yemindəki bütün azotun təxminən üçdə biri sidik cövhəri şəklində ola bilər ki, bu da müəyyən dərəcədə zülalın kimyəvi sintezi deməkdir. ABŞ-da bu üsul zülal əldə etməyin yollarından biri kimi mühüm rol oynayır.ƏDƏBİYYAT Murray R., Grenner D., Mayes P., Rodwell W. İnsan biokimyası, cild. 12. M., 1993Alberts B, Bray D, Lewis J, et al. Molekulyar hüceyrə biologiyası, cild. 13. M., 1994
Bilet 2. 1. Lipid təbiətin əsas qidalanma faktorları. Bəzi lipidlər insan orqanizmində sintez olunmur və buna görə də vacib qida faktorlarıdır. Bunlara iki və ya daha çox qoşa bağı olan yağ turşuları (polien) daxildir - əsas yağ turşuları. Bu turşuların bəziləri yerli hormonların - eikosanoidlərin sintezi üçün substratdır (mövzu 8.10).
Yağda həll olunan vitaminlər müxtəlif funksiyaları yerinə yetirir: vitamin A görmə prosesində, həmçinin hüceyrə böyüməsi və differensiasiyasında iştirak edir; müəyyən növ şişlərin böyüməsini maneə törətmək qabiliyyəti sübut edilmişdir; vitamin K qanın laxtalanmasında iştirak edir; vitamin D kalsium mübadiləsinin tənzimlənməsində iştirak edir; vitamin E- antioksidant, sərbəst radikalların əmələ gəlməsini maneə törədir və beləliklə, lipidlərin peroksidləşməsi nəticəsində hüceyrə zədələnməsinin qarşısını alır.
Sənəd
2.Zülalların strukturu və struktur təşkilinin səviyyələri
Zülalların struktur təşkilinin dörd səviyyəsi var: ibtidai, ikincil, üçüncü və dördüncü. Hər səviyyənin öz xüsusiyyətləri var.
İlkin protein quruluşu
Zülalların ilkin quruluşu peptid bağları ilə bağlanan amin turşularının xətti polipeptid zənciridir. İlkin quruluş zülal molekulunun struktur təşkilinin ən sadə səviyyəsidir. Yüksək sabitlik ona bir amin turşusunun α-amin qrupu ilə digər amin turşusunun α-karboksil qrupu arasında kovalent peptid bağları ilə verilir. [göstərmək].
Əgər prolin və ya hidroksiprolinin imino qrupu peptid bağının əmələ gəlməsində iştirak edirsə, o zaman başqa formaya malikdir. [göstərmək].
Hüceyrələrdə peptid bağları yarandıqda əvvəlcə bir amin turşusunun karboksil qrupu aktivləşir, sonra digərinin amin qrupu ilə birləşir. Polipeptidlərin laboratoriya sintezi təxminən eyni şəkildə həyata keçirilir.
Peptid bağı bir polipeptid zəncirinin təkrarlanan bir parçasıdır. Yalnız ilkin quruluşun formasına deyil, həm də polipeptid zəncirinin daha yüksək səviyyələrinə təsir edən bir sıra xüsusiyyətlərə malikdir:

coplanarity - peptid qrupuna daxil olan bütün atomlar eyni müstəvidədir;
iki rezonans şəklində (keto və ya enol şəklində) mövcud olma qabiliyyəti;
əvəzedicilərin C-N bağına nisbətən trans vəziyyəti;
hidrogen bağları yaratmaq qabiliyyəti və peptid qruplarının hər biri peptidlər də daxil olmaqla digər qruplarla iki hidrogen bağı yarada bilər.
İstisna, prolin və ya hidroksiprolinin amin qrupunu əhatə edən peptid qruplarıdır. Onlar yalnız bir hidrogen bağı yarada bilirlər (yuxarıya bax). Bu, zülalın ikincil strukturunun formalaşmasına təsir göstərir. Prolin və ya hidroksiprolinin yerləşdiyi bölgədəki polipeptid zənciri, həmişəki kimi ikinci bir hidrogen bağı ilə tutulmadığı üçün asanlıqla əyilir.
Peptidlərin və polipeptidlərin nomenklaturası. Peptidlərin adı onların tərkib hissəsi olan amin turşularının adlarından ibarətdir. İki amin turşusu dipeptid, üçü tripeptid, dördü tetrapeptid əmələ gətirir və s. İstənilən uzunluqdakı hər bir peptid və ya polipeptid zəncirində sərbəst amin qrupu olan N-terminal amin turşusu və sərbəst karboksil ehtiva edən C-terminal amin turşusu var. qrup. Polipeptidləri adlandırarkən, bütün amin turşuları N-terminalından başlayaraq, adlarında C-terminaldan başqa, -in şəkilçisini -yl ilə əvəz etməklə ardıcıl olaraq sadalanır (çünki peptidlərdəki amin turşularında artıq karboksil qrupu, lakin karbonil qrupu). Məsələn, Şəkildə göstərilən ad. 1 tripeptid - leyk lil fenilalan lil treon in.
Zülalın ilkin quruluşunun xüsusiyyətləri. Polipeptid zəncirinin onurğasında sərt strukturlar (düz peptid qrupları) bağlar ətrafında fırlanmağa qadir olan nisbətən mobil bölgələrlə (-CHR) növbələşir. Polipeptid zəncirinin bu cür struktur xüsusiyyətləri onun məkan düzülüşünə təsir göstərir.
Proteinin ikincil quruluşu
İkinci dərəcəli quruluş, eyni zəncirin peptid qrupları və ya bitişik polipeptid zəncirləri arasında hidrogen bağlarının meydana gəlməsi səbəbindən bir polipeptid zəncirinin nizamlı bir quruluşa qatlanması üsuludur. Konfiqurasiyasına görə, ikinci dərəcəli strukturlar spiral (α-sarmal) və laylı-qatlanmış (β-struktur və çarpaz β-forma) bölünür.


α-Heliks. Bu, bir polipeptid zəncirindəki interpeptid hidrogen bağları səbəbindən əmələ gələn müntəzəm spiral kimi görünən ikincil protein quruluşunun bir növüdür. Peptid bağının bütün xassələrini nəzərə alan α-spiralın strukturunun modeli (şək. 2) Polinq və Kori tərəfindən təklif edilmişdir. α-heliksin əsas xüsusiyyətləri:
spiral simmetriyaya malik polipeptid zəncirinin spiral konfiqurasiyası;
hər bir birinci və dördüncü amin turşusu qalıqlarının peptid qrupları arasında hidrogen bağlarının formalaşması;
spiral növbələrin müntəzəmliyi;
yan radikallarının strukturundan asılı olmayaraq α-heliksdəki bütün amin turşusu qalıqlarının ekvivalentliyi;
amin turşularının yan radikalları α-spiralın əmələ gəlməsində iştirak etmir.
Xarici olaraq, α-heliks elektrik sobasının bir qədər uzanmış spiralına bənzəyir. Birinci və dördüncü peptid qrupları arasında hidrogen bağlarının qanunauyğunluğu polipeptid zəncirinin növbələrinin qanunauyğunluğunu müəyyən edir. Bir döngənin hündürlüyü və ya α-spiralın hündürlüyü 0,54 nm-dir; ona 3,6 amin turşusu qalıqları daxildir, yəni hər bir amin turşusu qalığı ox boyunca (bir amin turşusu qalığının hündürlüyü) 0,15 nm (0,54:3,6 = 0,15 nm) hərəkət edir, bu da bütün amin turşusu qalıqlarının ekvivalentliyindən danışmağa imkan verir. α-heliksdə. α-spiralın qanunauyğunluq müddəti 5 növbə və ya 18 amin turşusu qalığıdır; bir dövrün uzunluğu 2,7 nm-dir. düyü. 3. Pauling-Corey a-helix modeli
β-struktur. Bu, polipeptid zəncirinin bir qədər əyri konfiqurasiyasına malik olan və bir polipeptid zəncirinin və ya bitişik polipeptid zəncirlərinin ayrı-ayrı bölmələri daxilində interpeptid hidrogen bağları ilə əmələ gələn ikinci dərəcəli quruluş növüdür. Buna laylı-qat struktur da deyilir. β-strukturların növləri var. Bir zülalın bir polipeptid zəncirindən əmələ gələn məhdud təbəqəli bölgələrə çarpaz β forması (qısa β strukturu) deyilir. Çarpaz β şəklində hidrogen bağları polipeptid zəncirinin döngələrinin peptid qrupları arasında əmələ gəlir. Başqa bir növ - tam β-struktur - uzanmış formaya malik olan və bitişik paralel polipeptid zəncirləri arasında interpeptid hidrogen bağları ilə saxlanılan bütün polipeptid zəncirinə xarakterikdir (şəkil 3). Bu quruluş akkordeonun körüklərinə bənzəyir. Üstəlik, β-quruluşların variantları mümkündür: onlar paralel zəncirlər (polipeptid zəncirlərinin N-terminal ucları eyni istiqamətə yönəldilir) və antiparalel (N-terminal ucları müxtəlif istiqamətlərə yönəldilir) ilə formalaşa bilər. Bir təbəqənin yan radikalları digər təbəqənin yan radikalları arasında yerləşdirilir.
Zülallarda α-quruluşlardan β-strukturlara və arxaya keçidlər hidrogen bağlarının yenidən təşkili hesabına mümkündür. Zəncir boyunca müntəzəm interpeptid hidrogen bağları əvəzinə (bunun sayəsində polipeptid zənciri spiral şəklində bükülür) spiral hissələr açılır və polipeptid zəncirlərinin uzunsov fraqmentləri arasında hidrogen bağları bağlanır. Bu keçid saçın proteini olan keratində olur. Saçları qələvi yuyucu vasitələrlə yuyarkən β-keratinin spiral quruluşu asanlıqla məhv olur və α-keratinə çevrilir (buruq saçlar düzəldir).
Zülalların müntəzəm ikincil strukturlarının (α-spirallar və β-strukturlar) kristalın əriməsi ilə oxşar şəkildə məhv edilməsi polipeptidlərin “əriməsi” adlanır. Bu zaman hidrogen bağları qırılır və polipeptid zəncirləri təsadüfi dolaşıq formasını alır. Nəticədə, ikincil strukturların sabitliyi interpeptid hidrogen bağları ilə müəyyən edilir. Sistein qalıqlarının yerləşdiyi yerlərdə polipeptid zənciri boyunca disulfid bağları istisna olmaqla, digər bağ növləri demək olar ki, heç bir rol oynamır. Qısa peptidlər disulfid bağlarına görə dövrlərə bağlanır. Bir çox zülalda həm α-spiral bölgələr, həm də β-strukturlar var. 100% α-spiraldan ibarət təbii zülallar demək olar ki, yoxdur (istisna 96-100% α-sarmal olan əzələ zülalı paramiozindir), sintetik polipeptidlərdə isə 100% spiral var.
Digər zülalların müxtəlif dərəcədə bükülmə dərəcəsi var. Paramiozin, miyoqlobin və hemoglobində α-spiral strukturların yüksək tezliyi müşahidə olunur. Bunun əksinə olaraq, tripsin, ribonukleazda, polipeptid zəncirinin əhəmiyyətli bir hissəsi qatlı β-strukturlara bükülür. Dəstəkləyici toxumaların zülalları: keratin (saç, yun proteini), kollagen (vətərlərin, dəri zülalı), fibroin (təbii ipək zülalı) polipeptid zəncirlərinin β-konfiqurasiyasına malikdir. Zülalların polipeptid zəncirlərinin müxtəlif sarmal dərəcələri göstərir ki, açıq-aydın, spirallığı qismən pozan və ya polipeptid zəncirinin müntəzəm qatlanmasını "qıran" qüvvələr var. Bunun səbəbi, protein polipeptid zəncirinin müəyyən bir həcmdə, yəni üçüncü dərəcəli bir quruluşa daha yığcam qatlanmasıdır.
Proteinin üçüncü quruluşu
Zülalın üçüncü quruluşu polipeptid zəncirinin kosmosda düzülmə üsuludur. Üçüncü quruluşunun formasına görə zülallar əsasən globular və fibrilyarlara bölünür. Qlobular zülallar ən çox ellipsoid formaya, fibrilyar (ip kimi) zülallar isə uzanmış forma (çubuq və ya mil forması) malikdirlər.
Lakin zülalların üçüncü strukturunun konfiqurasiyası hələ düşünməyə əsas vermir ki, fibrilyar zülallar yalnız β-struktur, qlobulyar zülallar isə α-spiral quruluşa malikdir. Qatlı, bükülmüş ikincil quruluşdan çox, spiralvari bir quruluşa malik olan fibrilyar zülallar var. Məsələn, α-keratin və paramiozin (mollyuskaların obturator əzələsinin zülalı), tropomiozinlər (skelet əzələlərinin zülalları) fibrilyar zülallara aiddir (çubuq formasına malikdir), onların ikinci dərəcəli quruluşu isə α-sarmaldır; əksinə, qlobulyar zülallarda çoxlu sayda β-struktur ola bilər.
Xətti polipeptid zəncirinin spirallaşması onun ölçüsünü təxminən 4 dəfə azaldır; və üçüncü struktura qablaşdırma onu orijinal zəncirdən onlarla dəfə daha yığcam edir.
Zülalın üçüncü strukturunu sabitləşdirən bağlar. Amin turşularının yan radikalları arasındakı bağlar üçüncü quruluşun sabitləşməsində rol oynayır. Bu əlaqələri aşağıdakılara bölmək olar:
güclü (kovalent) [göstərmək].
zəif (qütb və van der Waals) [göstərmək].
Amin turşularının yan radikalları arasındakı çoxsaylı bağlar zülal molekulunun məkan konfiqurasiyasını təyin edir.
Protein üçüncü quruluşunun təşkilinin xüsusiyyətləri. Polipeptid zəncirinin üçüncü strukturunun uyğunluğu ona daxil olan amin turşularının yan radikallarının (ilkin və ikincil strukturların əmələ gəlməsinə nəzərəçarpacaq təsir göstərməyən) və mikromühitin xüsusiyyətləri ilə müəyyən edilir, yəni. mühit. Büküldükdə, zülalın polipeptid zənciri minimum sərbəst enerji ilə xarakterizə olunan enerji baxımından əlverişli bir forma almağa meyllidir. Buna görə də, sudan "qaçaraq" qeyri-polar R qrupları, polipeptid zəncirinin hidrofobik qalıqlarının əsas hissəsinin yerləşdiyi zülalın üçüncü strukturunun daxili hissəsini meydana gətirir. Zülal qlobulunun mərkəzində demək olar ki, su molekulları yoxdur. Amin turşusunun polar (hidrofilik) R qrupları bu hidrofobik nüvədən kənarda yerləşir və su molekulları ilə əhatə olunmuşdur. Polipeptid zənciri üçölçülü məkanda mürəkkəb şəkildə bükülür. O, əyildikdə, ikinci dərəcəli spiral konformasiya pozulur. Zəncir prolin və ya hidroksiprolinin yerləşdiyi zəif nöqtələrdə "qırılır", çünki bu amin turşuları zəncirdə daha mobildir və digər peptid qrupları ilə yalnız bir hidrogen bağı yaradır. Başqa bir əyilmə yeri kiçik bir R qrupu (hidrogen) olan qlisindir. Buna görə də, digər amin turşularının R-qrupları yığıldıqda, qlisinin yerləşdiyi yerdə boş yer tutmağa meyllidirlər. Bir sıra amin turşuları - alanin, lösin, qlutamat, histidin - zülalda sabit spiral strukturların saxlanmasına kömək edir, metionin, valin, izolösin, aspartik turşu kimi isə β- strukturların əmələ gəlməsinə kömək edir. Üçüncü konfiqurasiyaya malik bir zülal molekulunda α-sarmal (spiral), β-strukturlar (laylı) və təsadüfi sarmal şəklində bölgələr var. Zülalın yalnız düzgün məkan düzülüşü onu aktiv edir; onun pozulması zülal xassələrinin dəyişməsinə və bioloji aktivliyin itirilməsinə səbəb olur.
Dördüncü zülal quruluşu
Bir polipeptid zəncirindən ibarət zülallar yalnız üçüncü dərəcəli quruluşa malikdir. Bunlara miyoqlobin - oksigenin, bir sıra fermentlərin (lizozim, pepsin, tripsin və s.) bağlanmasında iştirak edən əzələ toxuması zülalı daxildir. Bununla belə, bəzi zülallar hər biri üçüncü dərəcəli quruluşa malik olan bir neçə polipeptid zəncirindən qurulur. Belə zülallar üçün dördüncü quruluş anlayışı təqdim edilmişdir ki, bu da üçüncü quruluşa malik bir neçə polipeptid zəncirinin vahid funksional zülal molekuluna təşkili deməkdir. Dördüncü quruluşa malik belə bir zülal oliqomer, üçüncü quruluşa malik polipeptid zəncirləri isə protomerlər və ya subunitlər adlanır (şək. 4).

Dördüncü təşkilat səviyyəsində zülallar üçüncü strukturun əsas konfiqurasiyasını (qlobulyar və ya fibrilyar) saxlayır. Məsələn, hemoglobin dördüncü quruluşa malik bir zülaldır və dörd alt hissədən ibarətdir. Alt bölmələrin hər biri qlobulyar zülaldır və ümumiyyətlə, hemoglobinin də qlobulyar konfiqurasiyası var. Saç və yun zülalları - üçüncü quruluşda fibrilyar zülallara aid olan keratinlər fibrilyar konformasiyaya və dördüncü quruluşa malikdir.
Protein dördüncü strukturunun sabitləşməsi. Dördüncü quruluşa malik olan bütün zülallar subunitlərə parçalanmayan fərdi makromolekullar şəklində təcrid olunur. Alt bölmələrin səthləri arasında təmaslar yalnız amin turşusu qalıqlarının qütb qrupları sayəsində mümkündür, çünki polipeptid zəncirlərinin hər birinin üçüncü strukturunun formalaşması zamanı qütb olmayan amin turşularının yan radikalları (əksəriyyət təşkil edir). bütün proteinogen amin turşuları) alt bölmənin içərisində gizlənir. Onların qütb qrupları arasında çoxlu sayda ion (duz), hidrogen və bəzi hallarda disulfid rabitələri əmələ gəlir ki, bu da mütəşəkkil kompleks şəklində alt bölmələri möhkəm tutur. Hidrogen bağlarını pozan maddələrin və ya disulfid körpülərini azaldan maddələrin istifadəsi protomerlərin parçalanmasına və zülalın dördüncü strukturunun məhvinə səbəb olur. Cədvəldə 1 zülal molekulunun müxtəlif səviyyələrdə təşkilini sabitləşdirən bağlar haqqında məlumatları ümumiləşdirir [göstərmək].
Bəzi fibrilyar zülalların struktur təşkilinin xüsusiyyətləri
Fibrilyar zülalların struktur təşkili qlobulyar zülallarla müqayisədə bir sıra xüsusiyyətlərə malikdir. Bu xüsusiyyətləri keratin, fibroin və kollagen nümunəsində görmək olar. Keratinlər α- və β-konformasiyalarda mövcuddur. α-keratinlər və fibroin qat-qatlanmış ikincil struktura malikdir, lakin keratində zəncirlər paralel, fibroində isə antiparaleldir (bax. Şəkil 3); Bundan əlavə, keratində zəncirlərarası disulfid bağları var, fibroində isə yoxdur. Disulfid bağlarının qırılması keratinlərdə polipeptid zəncirlərinin ayrılmasına səbəb olur. Əksinə, oksidləşdirici maddələrin təsiri ilə keratinlərdə maksimum sayda disulfid bağlarının formalaşması güclü məkan quruluşu yaradır. Ümumiyyətlə, fibrilyar zülallarda, qlobulyar zülallardan fərqli olaraq, müxtəlif təşkilat səviyyələrini ciddi şəkildə ayırd etmək bəzən çətin olur. Əgər (qlobulyar zülal üçün olduğu kimi) kosmosda bir polipeptid zəncirinin salınması ilə üçüncü quruluşun, dördüncü quruluşun isə bir neçə zəncirlə əmələ gəlməsini qəbul etsək, onda fibrilyar zülallarda artıq ikincili strukturun formalaşması zamanı bir neçə polipeptid zənciri iştirak edir. . Fibrilyar zülalın tipik nümunəsi insan orqanizmində ən çox yayılmış zülallardan biri olan kollagendir (bütün zülalların kütləsinin təxminən 1/3 hissəsi). Yüksək möhkəmliyə və aşağı uzanma qabiliyyətinə malik olan toxumalarda (sümüklər, vətərlər, dəri, dişlər və s.) rast gəlinir. Kollagendə amin turşusu qalıqlarının üçdə biri qlisin, dörddə biri və ya bir qədər çoxu prolin və ya hidroksiprolindir.

Kollagenin təcrid olunmuş polipeptid zənciri (ilkin struktur) qırıq xətt kimi görünür. Tərkibində 1000-ə yaxın amin turşusu var və molekulyar çəkisi təxminən 10 5-dir (şəkil 5, a, b). Polipeptid zənciri aşağıdakı tərkibli amin turşularının təkrarlanan üçlüyündən (üçlü) qurulur: gly-A-B, burada A və B qlisindən başqa hər hansı amin turşularıdır (ən çox prolin və hidroksiprolin). Kollagen polipeptid zəncirləri (və ya α-zəncirləri) ikincili və üçüncü dərəcəli strukturların (şək. 5, c və d) formalaşması zamanı spiral simmetriyaya malik tipik α-sarmalları yarada bilməz. Prolin, hidroksiprolin və qlisin (antihelik amin turşuları) buna mane olur. Buna görə də, üç α-zəncir, silindrin ətrafına dolanan üç ip kimi, bükülmüş spirallər əmələ gətirir. Üç spiral α zəncirləri tropokollagen adlanan təkrarlanan kollagen strukturu əmələ gətirir (şək. 5d). Təşkilatındakı tropokollagen kollagenin üçüncü quruluşudur. Zəncir boyu mütəmadi olaraq növbələşən prolin və hidroksiprolinin yastı halqaları ona sərtlik verir, həmçinin tropokollagenin α-zəncirləri arasındakı zəncirlərarası bağlar (buna görə də kollagen dartılmaya davamlıdır). Tropokollagen əslində kollagen fibrillərinin alt bölməsidir. kollagenin dördüncü strukturuna tropokollagen subunits çəkilməsi mərhələli şəkildə baş verir (Şəkil. 5e).
Kollagen strukturlarının sabitləşməsi zəncirlərarası hidrogen, ion və van der Waals bağları və az sayda kovalent bağlar hesabına baş verir.
Kollagen α-zəncirləri müxtəlif kimyəvi quruluşa malikdir. Müxtəlif növ α 1 zəncirləri (I, II, III, IV) və α 2 zəncirləri var. Tropokollagenin üç zəncirli spiralının formalaşmasında hansı α 1 - və α 2 zəncirlərinin iştirak etməsindən asılı olaraq dörd növ kollagen fərqlənir:
birinci növ - iki α 1 (I) və bir α 2 zəncir;
ikinci növ - üç α 1 (II) zəncir;
üçüncü növ - üç α 1 (III) zəncir;
dördüncü növ - üç α 1 (IV) zəncir.
Ən çox yayılmış kollagen birinci növdür: sümük toxumasında, dəridə, tendonlarda olur; tip 2 kollagen qığırdaq toxumasında və s. olur. Bir növ toxuma müxtəlif növ kollageni ehtiva edə bilər.
Kollagen strukturlarının nizamlı yığılması, onların sərtliyi və hərəkətsizliyi kollagen liflərinin yüksək möhkəmliyini təmin edir. Kollagen zülallarında karbohidrat komponentləri də var, yəni zülal-karbohidrat kompleksləridir.
Kollagen bütün orqanlarda olan birləşdirici toxuma hüceyrələrindən əmələ gələn hüceyrədənkənar bir proteindir. Buna görə də, kollagenin zədələnməsi (və ya onun formalaşmasının pozulması) orqanların birləşdirici toxumasının dəstəkləyici funksiyalarının çoxsaylı pozulması baş verir.
Alfa polipeptid zənciri valin-leysin amin turşusu birləşməsi ilə, beta polipeptid zənciri isə valin-histidin-leysin kombinasiyası ilə bitir. Hemoqlobin molekulunda alfa və beta polipeptid zəncirləri xətti düzülmür, bu, ilkin quruluşdur. Molekuldaxili qüvvələrin mövcudluğuna görə, polipeptid zəncirləri zülallara xas olan alfa-spiral spiral (ikinci dərəcəli quruluş) şəklində bükülür. Alfa-spiral spiral özü hər bir alfa və beta polipeptid zənciri üçün məkan olaraq əyilir və ovoid formalı pleksuslar əmələ gətirir (üçüncü quruluş). Polipeptid zəncirlərinin alfa-spiral spirallarının ayrı-ayrı hissələri A-dan H-ə qədər latın hərfləri ilə qeyd olunur. Bütün dörd üçüncü əyri alfa və beta polipeptid zəncirləri müəyyən bir əlaqədə məkanda yerləşir - dördüncü quruluş. Onlar həqiqi kimyəvi bağlarla deyil, molekullararası qüvvələrlə bağlıdır.
İnsanlarda normal hemoglobinin üç əsas növü olduğu ortaya çıxdı: embrion - U, fetal - F və yetkin hemoglobin - A. HbU (uşaqlıq sözünün ilk hərfindən sonra adlandırılır) rüşeymdə həyatın 7 ilə 12 həftəsi arasında baş verir, sonra yox olur və üçüncü aydan sonra dölün əsas hemoglobini olan fetal hemoglobin görünür. Bunun ardınca ingiliscə “adult” sözünün başlanğıc hərfindən sonra HbA adlanan adi yetkin hemoglobin tədricən görünür. Dölün hemoglobinin miqdarı tədricən azalır, beləliklə, doğum anında hemoglobinin 80% -i HbA, yalnız 20% -i HbF təşkil edir. Doğuşdan sonra fetal hemoglobin azalmağa davam edir və həyatın 2-3 ilində yalnız 1-2% -dir. Yetkinlərdə eyni miqdarda fetal hemoglobin var. HbF-nin 2%-dən çox olması böyüklər və 3 yaşdan yuxarı uşaqlar üçün patoloji hesab olunur.
Normal hemoglobinin növləri ilə yanaşı, hazırda 50-dən çox patoloji variantı məlumdur. Onlar ilk dəfə Latın hərfləri ilə adlandırılmışlar. Hemoqlobin növlərinin təyinində B hərfi yoxdur, çünki əvvəlcə HbS-ni təyin edirdi.
Hemoqlobin (Hb)- qırmızı qan hüceyrələrində olan və oksigenin toxumalara daşınmasında iştirak edən xromoprotein. Yetkinlərdə hemoglobin hemoglobin A (Hb A) adlanır. Onun molekulyar çəkisi təxminən 65.000 Da-dır. Hb A molekulu dördüncü quruluşa malikdir və dörd alt bölməni - polipeptid zəncirlərini (a1, α2, β1 və β2 təyin edir, hər biri heme ilə əlaqələndirilir) ehtiva edir.
Unutmayın ki, hemoglobin allosterik zülaldır, onun molekulları bir konformasiyadan digərinə tərsinə dəyişə bilər. Bu, zülalın liqandlara yaxınlığını dəyişir. Liqanda ən az yaxınlığı olan uyğunluq zaman və ya T uyğunluğu adlanır. Liqanda ən böyük yaxınlığa malik olan uyğunluq rahat və ya R-konformasiya adlanır.
Hemoqlobin molekulunun R- və T-konformasiyaları dinamik tarazlıq vəziyyətindədir:
Müxtəlif ekoloji amillər bu tarazlığı bu və ya digər istiqamətə dəyişə bilər. Hb-nin O2-yə yaxınlığına təsir edən allosterik tənzimləyicilər bunlardır: 1) oksigen; 2) H+ konsentrasiyası (orta pH); 3) karbon qazı (CO2); 4) 2,3-difosfogliserat (DPG). Oksigen molekulunun hemoglobinin alt bölmələrindən birinə bağlanması gərgin bir konformasiyanın rahat olana keçməsini təşviq edir və eyni hemoglobin molekulunun digər alt bölmələrinin oksigeninə yaxınlığını artırır. Bu fenomen kooperativ effekt adlanır. Hemoqlobinin oksigenlə bağlanmasının mürəkkəb təbiəti, S formasına malik olan hemoglobinin O2 doyma əyrisi ilə əks olunur (Şəkil 3.1).

Şəkil 3.1. Mioqlobin (1) və hemoglobinin (2) oksigenlə doyma əyriləri.
Molekulyar formalar hemoglobin bir-birindən polipeptid zəncirlərinin quruluşuna görə fərqlənir. Fizioloji şəraitdə mövcud olan bu cür müxtəlif hemoglobinə misal ola bilər fetal hemoglobin (HbF), insan inkişafının embrion mərhələsində qanda mövcuddur. HbA-dan fərqli olaraq onun molekulunda 2 α- və 2 γ-zəncirləri var (yəni β-zəncirləri γ-zəncirləri ilə əvəz olunur). Belə hemoglobinin oksigenə daha yüksək yaxınlığı var. Bu, embrionun plasenta vasitəsilə ana qanından oksigen almasına imkan verir. Doğuşdan dərhal sonra körpənin qanında HbF HbA ilə əvəz olunur.
Anormal və ya patoloji hemoglobinə misal olaraq oraqvari hüceyrə anemiyası olan xəstələrdə tapılan artıq qeyd olunan (bax 2.4.) hemoglobin S-ni göstərmək olar. Artıq bildiyiniz kimi, o, β-zəncirlərində qlutamatı valinlə əvəz etməklə hemoglobin A-dan fərqlənir. Bu amin turşusu əvəzlənməsi HbS-nin suda həllolma qabiliyyətinin azalmasına və onun O2-yə yaxınlığının azalmasına səbəb olur.
Bildiyiniz kimi, zülallar planetimizdə həyatın yaranması üçün əsasdır. Lakin canlıların mənşəyi üçün əsas olan peptid molekullarından ibarət olan koaservat damcısı oldu. Bu, şübhəsizdir, çünki biokütlənin hər hansı bir nümayəndəsinin daxili tərkibinin təhlili göstərir ki, bu maddələr hər şeydə mövcuddur: bitkilər, heyvanlar, mikroorqanizmlər, göbələklər, viruslar. Üstəlik, onlar çox müxtəlifdir və təbiətdə makromolekulyardır.
Bu strukturların dörd adı var, hamısı sinonimdir:
- zülallar;
- zülallar;
- polipeptidlər;
- peptidlər.
Protein molekulları
Onların sayı həqiqətən saysız-hesabsızdır. Bu vəziyyətdə bütün protein molekullarını iki böyük qrupa bölmək olar:
- sadə - yalnız peptid bağları ilə əlaqəli amin turşusu ardıcıllığından ibarətdir;
- kompleks - zülalın strukturu və quruluşu əlavə protolitik (protez) qruplarla xarakterizə olunur, kofaktorlar da deyilir.
Eyni zamanda, mürəkkəb molekulların da öz təsnifatı var.
Kompleks peptidlərin gradasiyası
- Qlikoproteinlər zülal və karbohidratın sıx əlaqəli birləşmələridir. Mukopolisaxaridlərin protez qrupları molekulun quruluşuna toxunur.
- Lipoproteinlər zülal və lipidlərin kompleks birləşməsidir.
- Metalloproteinlər - metal ionları (dəmir, manqan, mis və başqaları) protez qrup kimi çıxış edir.
- Nukleoproteinlər zülal və nuklein turşuları (DNT, RNT) arasındakı əlaqədir.
- Fosfoproteinlər - zülalın və ortofosfor turşusu qalığının uyğunlaşması.
- Xromoproteinlər metalloproteinlərə çox bənzəyir, lakin protez qrupuna daxil olan element bütöv rəngli kompleksdir (qırmızı - hemoglobin, yaşıl - xlorofil və s.).
Nəzərə alınan hər bir qrupda zülalların quruluşu və xassələri fərqlidir. Onların yerinə yetirdiyi funksiyalar da molekulun növündən asılı olaraq dəyişir.

Zülalların kimyəvi quruluşu
Bu nöqteyi-nəzərdən zülallar peptid bağları adlanan xüsusi bağlarla bir-birinə bağlanan uzun, kütləvi amin turşusu qalıqları zənciridir. Radikal adlanan budaqlar turşuların yan strukturlarından uzanır. Bu molekulyar quruluş 21-ci əsrin əvvəllərində E. Fişer tərəfindən kəşf edilmişdir.
Daha sonra zülallar, zülalların quruluşu və funksiyaları daha ətraflı öyrənilmişdir. Məlum oldu ki, peptidin strukturunu təşkil edən cəmi 20 amin turşusu var, lakin onlar müxtəlif yollarla birləşdirilə bilər. Beləliklə, polipeptid strukturlarının müxtəlifliyi. Bundan əlavə, həyat prosesində və öz funksiyalarını yerinə yetirərkən zülallar bir sıra kimyəvi çevrilmələrə məruz qala bilirlər. Nəticədə quruluşu dəyişirlər və tamamilə yeni bir əlaqə növü meydana çıxır.
Peptid bağını qırmaq, yəni zülal və zəncirlərin strukturunu pozmaq üçün çox sərt şərtləri (yüksək temperatur, turşular və ya qələvilər, katalizator) seçmək lazımdır. Bu, molekulun, yəni peptid qrupunun yüksək gücü ilə bağlıdır.

Laboratoriyada zülal strukturunun aşkarlanması biuret reaksiyası - təzə çökdürülmüş polipeptidin (II) məruz qalmasından istifadə etməklə həyata keçirilir. Peptid qrupunun və mis ionunun kompleksi parlaq bənövşəyi rəng verir.
Zülalların hər biri öz struktur xüsusiyyətlərinə malik olan dörd əsas struktur təşkilatı var.
Təşkilat səviyyələri: ilkin struktur
Yuxarıda qeyd edildiyi kimi, peptid daxilolmaları, koenzimləri olan və ya olmayan amin turşusu qalıqlarının ardıcıllığıdır. Beləliklə, ilkin təbii, təbii, peptid bağları ilə bağlanan həqiqətən amin turşuları olan bir molekulun quruluşudur və başqa heç nə yoxdur. Yəni xətti struktura malik polipeptid. Üstəlik, bu tip zülalların struktur xüsusiyyətləri ondan ibarətdir ki, turşuların belə birləşməsi zülal molekulunun funksiyalarını yerinə yetirmək üçün həlledicidir. Bu xüsusiyyətlərin olması sayəsində nəinki peptidin identifikasiyası, həm də tamamilə yeni, hələ kəşf edilməmiş birinin xassələrini və rolunu proqnozlaşdırmaq mümkündür. Təbii ilkin quruluşa malik peptidlərə misal olaraq insulin, pepsin, kimotripsin və başqalarını göstərmək olar.

İkinci dərəcəli uyğunlaşma
Bu kateqoriyadakı zülalların quruluşu və xassələri bir qədər fərqlidir. Belə bir quruluş əvvəlcə təbiətə görə və ya birincil olan ağır hidroliz, temperatur və ya digər şərtlərə məruz qaldıqda yarana bilər.
Bu uyğunlaşmanın üç növü var:
- Bağlantının əsas oxu ətrafında fırlanan amin turşusu qalıqlarından qurulmuş hamar, müntəzəm, stereoregular növbələr. Onlar yalnız bir peptid qrupunun oksigeni ilə digərinin hidrogeni arasında əmələ gələnlər tərəfindən bir yerdə saxlanılır. Üstəlik, növbələrin hər 4 keçiddə bərabər şəkildə təkrarlanması səbəbindən struktur düzgün hesab olunur. Belə bir quruluş həm sol, həm də sağ əlli ola bilər. Lakin ən məşhur zülallarda dekstrorotator izomeri üstünlük təşkil edir. Belə konformasiyalar adətən alfa strukturları adlanır.
- Növbəti növ zülalların tərkibi və quruluşu əvvəlkindən fərqlidir ki, hidrogen bağları molekulun bir tərəfinə bitişik qalıqlar arasında deyil, əhəmiyyətli dərəcədə uzaq olanlar arasında və kifayət qədər böyük məsafədə əmələ gəlir. Bu səbəbdən bütün quruluş bir neçə dalğavari, ilana bənzər polipeptid zəncirləri şəklini alır. Bir zülalın nümayiş etdirməli olduğu bir xüsusiyyət var. Budaqlardakı amin turşularının quruluşu, məsələn, qlisin və ya alanin kimi mümkün qədər qısa olmalıdır. Bu tip ikinci dərəcəli uyğunlaşma, ümumi bir quruluş yaratmaq üçün bir-birinə yapışmaq qabiliyyətinə görə beta vərəqləri adlanır.
- Biologiya zülal quruluşunun üçüncü növünə stereoregularity olmayan və xarici şəraitin təsiri altında strukturu dəyişməyə qadir olan mürəkkəb, heterojen səpələnmiş, nizamsız fraqmentlər kimi aid edilir.
Təbii olaraq ikinci dərəcəli quruluşa malik olan zülalların heç bir nümunəsi müəyyən edilməmişdir.

Ali təhsil
Bu, "qlobul" adlanan olduqca mürəkkəb bir uyğunlaşmadır. Bu protein nədir? Onun strukturu ikinci dərəcəli quruluşa əsaslanır, lakin qrupların atomları arasında qarşılıqlı təsirlərin yeni növləri əlavə olunur və bütün molekul bükülür, beləliklə hidrofilik qrupların qlobula yönəldilməsinə və hidrofobik xarici olanlar.
Bu, suyun kolloid məhlullarında zülal molekulunun yükünü izah edir. Burada hansı növ qarşılıqlı əlaqə mövcuddur?
- Hidrogen bağları - ikinci dərəcəli quruluşda olduğu kimi eyni hissələr arasında dəyişməz qalır.
- qarşılıqlı təsirlər - polipeptid suda həll edildikdə baş verir.
- İon cazibələri amin turşusu qalıqlarının (radikalların) müxtəlif yüklü qrupları arasında əmələ gəlir.
- Kovalent qarşılıqlı təsirlər - xüsusi asidik yerlər - sistein molekulları, daha doğrusu, quyruqları arasında yarana bilər.
Beləliklə, üçüncü dərəcəli quruluşa malik zülalların tərkibini və quruluşunu müxtəlif növ kimyəvi qarşılıqlı təsirlərə görə öz konformasiyasını saxlayan və sabitləşdirən qlobullara bükülmüş polipeptid zəncirləri kimi təsvir etmək olar. Belə peptidlərə misal olaraq: fosfogliserat kenaz, tRNT, alfa-keratin, ipək fibroini və s.
Dördüncü quruluş
Bu, zülalların əmələ gətirdiyi ən mürəkkəb globullardan biridir. Bu tip zülalların quruluşu və funksiyaları çoxşaxəli və spesifikdir.
Bu uyğunlaşma nədir? Bunlar bir-birindən asılı olmayaraq əmələ gələn bir neçə (bəzi hallarda onlarla) iri və kiçik polipeptid zəncirləridir. Lakin sonra, üçüncü quruluş üçün nəzərdən keçirdiyimiz eyni qarşılıqlı təsirlərə görə, bütün bu peptidlər bir-biri ilə bükülür və bir-birinə qarışır. Bu yolla metal atomları, lipid qrupları və karbohidratlar ola bilən mürəkkəb konformasiya qlobulları əldə edilir. Belə zülallara misal olaraq: DNT polimeraza, tütün virusunun zülal qabığı, hemoglobin və s.

Tədqiq etdiyimiz bütün peptid strukturları xromatoqrafiya, sentrifuqa, elektron və optik mikroskopiya və yüksək kompüter texnologiyalarından istifadənin müasir imkanlarına əsaslanan laboratoriyada öz identifikasiya üsullarına malikdir.
İcra olunan funksiyalar
Zülalların quruluşu və funksiyaları bir-biri ilə sıx əlaqəlidir. Yəni hər bir peptid özünəməxsus, özünəməxsus və spesifik rol oynayır. Bir canlı hüceyrədə eyni anda bir neçə əhəmiyyətli əməliyyatı yerinə yetirə bilənlər də var. Bununla belə, canlı orqanizmlərdə zülal molekullarının əsas funksiyalarını ümumiləşdirilmiş formada ifadə etmək mümkündür:
- Hərəkətin təmin edilməsi. Təkhüceyrəli orqanizmlər, orqanoidlər və ya bəzi hüceyrə növləri hərəkət, büzülmə və hərəkət qabiliyyətinə malikdir. Bu, onların motor aparatlarının strukturunu təşkil edən zülallar tərəfindən təmin edilir: kirpiklər, bayraqlar və sitoplazmatik membran. Hərəkət edə bilməyən hüceyrələrdən danışırıqsa, zülallar onların daralmasına kömək edə bilər (əzələ miyozini).
- Qidalanma və ya ehtiyat funksiyası. Bu, itkin qida maddələrini daha da artırmaq üçün bitkilərin yumurtalarında, embrionlarında və toxumlarında protein molekullarının toplanmasıdır. Parçalandıqda peptidlər canlı orqanizmlərin normal inkişafı üçün zəruri olan amin turşuları və bioloji aktiv maddələr əmələ gətirir.
- Enerji funksiyası. Karbohidratlarla yanaşı, zülallar da orqanizmə güc verə bilir. 1 q peptidin parçalanması ilə həyati proseslərə sərf olunan adenozin trifosfor turşusu (ATP) şəklində 17,6 kJ faydalı enerji ayrılır.
- Siqnalizasiya davam edən prosesləri diqqətlə izləməkdən və siqnalların hüceyrələrdən toxumalara, onlardan orqanlara, sonuncudan sistemlərə və s. ötürülməsindən ibarətdir. Tipik bir nümunə qanda qlükoza miqdarını ciddi şəkildə təyin edən insulindir.
- Reseptor funksiyası. O, membranın bir tərəfində peptidin konformasiyasını dəyişdirərək, digər ucunu isə yenidən quruluşa cəlb etməklə həyata keçirilir. Eyni zamanda siqnal və lazımi məlumatlar ötürülür. Çox vaxt belə zülallar hüceyrələrin sitoplazmik membranlarına yerləşdirilir və ondan keçən bütün maddələrə ciddi nəzarət edir. Onlar həmçinin ətraf mühitdəki kimyəvi və fiziki dəyişikliklər haqqında məlumat verirlər.
- Peptidlərin nəql funksiyası. Kanal zülalları və daşıyıcı zülallar tərəfindən həyata keçirilir. Onların rolu göz qabağındadır - lazımi molekulları yüksək konsentrasiyalı hissələrdən aşağı konsentrasiyalı yerlərə daşımaq. Tipik bir nümunə, oksigen və karbon qazının orqan və toxumalar vasitəsilə hemoglobin zülalı ilə daşınmasıdır. Onlar həmçinin aşağı molekulyar çəkiyə malik birləşmələrin hüceyrə membranı vasitəsilə daxili hissəyə çatdırılmasını həyata keçirirlər.
- Struktur funksiyası. Zülalın yerinə yetirdiyi ən mühüm funksiyalardan biridir. Bütün hüceyrələrin və onların orqanoidlərinin quruluşu peptidlər tərəfindən təmin edilir. Onlar, bir çərçivə kimi, forma və quruluşu təyin edirlər. Bundan əlavə, onu dəstəkləyirlər və lazım olduqda dəyişdirirlər. Buna görə də böyümə və inkişaf üçün bütün canlı orqanizmlər qida rasionunda zülallara ehtiyac duyurlar. Belə peptidlərə elastin, tubulin, kollagen, aktin, keratin və başqaları daxildir.
- Katalitik funksiya. Fermentlər tərəfindən həyata keçirilir. Çoxsaylı və müxtəlifdirlər, bədəndəki bütün kimyəvi və biokimyəvi reaksiyaları sürətləndirirlər. Onların iştirakı olmadan mədədə adi bir alma cəmi iki gün ərzində həzm oluna bilər, çox güman ki, prosesdə çürüyür. Katalaza, peroksidaza və digər fermentlərin təsiri altında bu proses iki saat ərzində baş verir. Ümumiyyətlə, zülalların bu rolu sayəsində anabolizm və katabolizm həyata keçirilir, yəni plastik və

Qoruyucu rol
Zülalların bədəni qorumaq üçün nəzərdə tutulduğu bir neçə növ təhlükə var.
Birincisi, travmatik reagentlər, qazlar, molekullar, müxtəlif təsir spektrli maddələr. Peptidlər onlarla kimyəvi qarşılıqlı əlaqədə ola bilir, onları zərərsiz bir formaya çevirir və ya sadəcə zərərsizləşdirir.
İkincisi, yaraların fiziki təhlükəsi - əgər fibrinogen zülalı zədə yerində vaxtında fibrinə çevrilməzsə, qan laxtalanmayacaq, yəni tıxanma baş verməyəcək. Sonra, əksinə, laxtanı həll edə və damarın açıqlığını bərpa edə bilən peptid plazminə ehtiyacınız olacaq.
Üçüncüsü, toxunulmazlığa təhlükə. İmmun müdafiəni təşkil edən zülalların quruluşu və əhəmiyyəti son dərəcə vacibdir. Antikorlar, immunoqlobulinlər, interferonlar - bütün bunlar insanın limfa və immun sisteminin mühüm və əhəmiyyətli elementləridir. Hər hansı bir yad hissəcik, zərərli molekul, hüceyrənin ölü hissəsi və ya bütöv bir quruluş peptid birləşməsi tərəfindən dərhal araşdırılmalıdır. Buna görə bir insan müstəqil olaraq, dərmanların köməyi olmadan, hər gün özünü infeksiyalardan və sadə viruslardan qoruya bilər.
Fiziki xassələri
Hüceyrə zülalının quruluşu çox spesifikdir və yerinə yetirilən funksiyadan asılıdır. Lakin bütün peptidlərin fiziki xassələri oxşardır və aşağıdakı xüsusiyyətlərə qədər qaynayır.
- Molekulun çəkisi 1.000.000 Daltona qədərdir.
- Kolloid sistemlər sulu məhlulda əmələ gəlir. Orada quruluş ətraf mühitin turşuluğundan asılı olaraq dəyişə bilən bir yük alır.
- Sərt şəraitə (şüalanma, turşu və ya qələvi, temperatur və s.) məruz qaldıqda, onlar digər konformasiya səviyyələrinə, yəni denatürasiyaya keçə bilirlər. Bu proses 90% hallarda geri dönməzdir. Bununla belə, əks sürüşmə də var - renaturasiya.
Bunlar peptidlərin fiziki xüsusiyyətlərinin əsas xüsusiyyətləridir.