Jedná se o vysokomolekulární organické sloučeniny, biopolymery, sestavené z 20 typů L-a-aminokyselinových zbytků spojených v určité sekvenci do dlouhých řetězců. Molekulová hmotnost proteinů se pohybuje od 5 tisíc do 1 milionu. Pojmenování „bílé“ bylo poprvé dáno látce ptačích vajec, která se po zahřátí srazí na bílou nerozpustnou hmotu. Termín byl později rozšířen na další látky s podobnými vlastnostmi izolované ze zvířat a rostlin.
Rýže. 1. Nejsložitější biopolymery jsou proteiny. Jejich makromolekuly se skládají z monomerů, což jsou aminokyseliny. Každá aminokyselina má dvě funkční skupiny: karboxylovou skupinu a aminoskupinu. Veškerá rozmanitost proteinů je vytvořena jako výsledek různých kombinací 20 aminokyselin.
Bílkoviny převažují nad všemi ostatními sloučeninami přítomnými v živých organismech, obvykle tvoří více než polovinu jejich suché hmotnosti. Předpokládá se, že v přírodě existuje několik miliard jednotlivých proteinů (např. pouze v bakterii E. coli je přítomno více než 3 tisíce různých proteinů).
Proteiny hrají klíčovou roli v životních procesech každého organismu. Mezi proteiny patří enzymy, za jejichž účasti v buňce probíhají všechny chemické přeměny (metabolismus); řídí činnost genů; s jejich účastí se realizuje působení hormonů, provádí se transmembránový transport včetně generování nervových impulsů. Jsou nedílnou součástí imunitního systému (imunoglobuliny) a koagulačního systému, tvoří základ kosti a pojivové tkáně, podílejí se na přeměně a využití energie.
Historie výzkumu bílkovin
První pokusy o izolaci proteinů byly provedeny již v 18. století. Začátkem 19. století se objevily první práce o chemickém studiu proteinů. Francouzští vědci Joseph Louis Gay-Lussac a Louis Jacques Thénard se pokusili stanovit elementární složení proteinů z různých zdrojů, což znamenalo počátek systematických analytických studií, díky nimž se dospělo k závěru, že všechny proteiny jsou podobné v souboru prvků obsažených v jejich složení. V roce 1836 navrhl holandský chemik G. J. Mulder první teorii struktury bílkovinných látek, podle níž mají všechny bílkoviny určitý hypotetický radikál (C 40 H 62 N 10 O 12), spojený v různém poměru s atomy síry a fosforu. Tento radikál nazval „protein“ (z řeckého proteinu - první, hlavní). Mulderova teorie přispěla ke zvýšení zájmu o studium proteinů a zlepšení metod proteinové chemie. Byly vyvinuty techniky pro izolaci proteinů extrakcí roztoky neutrálních solí a proteiny byly poprvé získány v krystalické formě (některé rostlinné proteiny). K analýze bílkovin začali používat jejich předběžné štěpení kyselinami a zásadami.
Zároveň se začala věnovat stále větší pozornost studiu funkce proteinů. Jens Jakob Berzelius jako první v roce 1835 navrhl, že hrají roli biokatalyzátorů. Brzy byly objeveny proteolytické enzymy - pepsin (T. Schwann, 1836) a trypsin (L. Corvisart, 1856), které přitáhly pozornost k fyziologii trávení a analýze produktů vznikajících při štěpení živin. Další studium struktury proteinů a práce na chemické syntéze peptidů vyústily ve vznik peptidové hypotézy, podle níž jsou všechny proteiny sestaveny z aminokyselin. Do konce 19. století byla studována většina aminokyselin, které tvoří bílkoviny.
Německý chemik Emil Hermann Fischer na počátku 20. století jako první použil ke studiu proteinů metody organické chemie a dokázal, že proteiny se skládají z β-aminokyselin navzájem spojených amidovou (peptidovou) vazbou. Později, díky použití fyzikálně-chemických metod analýzy, byla stanovena molekulová hmotnost mnoha proteinů, byl stanoven sférický tvar globulárních proteinů, byla provedena rentgenová difrakční analýza aminokyselin a peptidů a byly použity metody chromatografické analýzy. vyvinuté (viz chromatografie).
Byl izolován první proteinový hormon (Frederick Grant Banting, John James Rickard McLeod, 1922), byla prokázána přítomnost gamaglobulinů v protilátkách a popsána enzymatická funkce svalového proteinu myosin (Vladimir Aleksandrovich Engelhardt, M. N. Lyubimova, 1939) . Poprvé byly získány enzymy v krystalické formě – ureáza (J.B. Saliner, 1926), pepsin (J.H. Nortron, 1929), lysozym (E.P. Abraham, Robert Robinson, 1937).

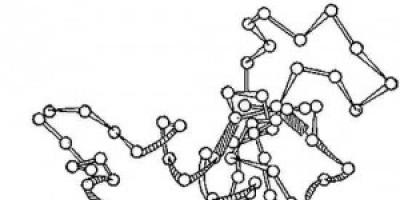
Rýže. 2. Schéma trojrozměrné struktury enzymu lysozymu. Kruhy - aminokyseliny; vlákna - peptidové vazby; stínované obdélníky jsou disulfidové vazby. Jsou viditelné spirálovité a prodloužené úseky polypeptidového řetězce.
V 50. letech 20. století byla prokázána tříúrovňová organizace proteinových molekul – přítomnost primární, sekundární a terciární struktury; vytvořil automatický analyzátor aminokyselin (Stanford Moore, William Howard Stein, 1950). V 60. letech byly činěny pokusy o chemickou syntézu proteinů (inzulín, ribonukleáza). Metody rentgenové difrakční analýzy byly významně vylepšeny; byl vytvořen přístroj - sekvenátor (P. Edman, G. Begg, 1967), který umožnil určit sekvenci aminokyselin v polypeptidovém řetězci. Důsledkem toho bylo vytvoření struktury několika stovek proteinů z různých zdrojů. Patří mezi ně proteolytické enzymy (pepsin, trypsin, chymotrypsin, subtilisin, karboxypeptidázy), myoglobiny, hemoglobiny, cytochromy, lysozymy, imunoglobuliny, histony, neurotoxiny, virové obalové proteiny, protein-peptidové hormony. V důsledku toho se objevily předpoklady pro řešení naléhavých problémů v enzymologii, imunologii, endokrinologii a dalších oblastech biologické chemie.
Na konci 20. století došlo k výraznému pokroku ve studiu úlohy proteinů v matricové syntéze biopolymerů, pochopení mechanismů jejich působení v různých životních procesech organismů a navázání souvislostí mezi jejich strukturou a funkcí. Velký význam mělo zdokonalení výzkumných metod a vznik nových metod separace proteinů a peptidů.
Vývoj efektivní metody pro analýzu sekvence nukleotidů v nukleových kyselinách umožnil výrazně zjednodušit a urychlit stanovení aminokyselinové sekvence v proteinech. To se ukázalo jako možné, protože pořadí aminokyselin v proteinu je určeno sekvencí nukleotidů v genu kódujícím tento protein (fragment). V důsledku toho, když známe uspořádání nukleotidů v tomto genu a genetický kód, lze přesně předpovědět, v jakém pořadí jsou aminokyseliny umístěny v polypeptidovém řetězci proteinu. Spolu s pokroky ve strukturní analýze proteinů bylo dosaženo významných výsledků ve studiu jejich prostorové organizace, mechanismů tvorby a působení supramolekulárních komplexů, včetně ribozomů a dalších buněčných organel, chromatinu, virů atd.
Struktura bílkovin
Téměř všechny proteiny jsou vytvořeny z 20 α-aminokyselin patřících do L-série a jsou stejné v téměř všech organismech. Aminokyseliny v proteinech jsou navzájem spojeny peptidovou vazbou -CO-NH-, která je tvořena karboxylovou a -aminoskupinou sousedních aminokyselinových zbytků: dvě aminokyseliny tvoří dipeptid, ve kterém je koncový karboxyl (-COOH) a aminoskupina (H2N-) zůstávají volné, ke kterým mohou být přidány nové aminokyseliny za vzniku polypeptidového řetězce.
Úsek řetězce, na kterém se nachází koncová H2N-skupina, se nazývá N-koncový a protilehlá část se nazývá C-konec. Obrovská rozmanitost proteinů je dána sekvencí uspořádání a počtem aminokyselinových zbytků, které obsahují. I když neexistuje jasné rozlišení, krátké řetězce se obvykle nazývají peptidy nebo oligopeptidy (z oligo...) a polypeptidy (proteiny) jsou obvykle chápány jako řetězce skládající se z 50 nebo více. Nejběžnější proteiny jsou ty, které obsahují 100-400 aminokyselinových zbytků, ale existují i takové, jejichž molekuly jsou tvořeny 1000 a více zbytky. Proteiny se mohou skládat z několika polypeptidových řetězců. V takových proteinech se každý polypeptidový řetězec nazývá podjednotka.
Prostorová struktura proteinů

Rýže. 3. Protein ve všech organismech se skládá z 20 typů aminokyselin. Každý protein se vyznačuje určitým sortimentem a kvantitativním poměrem aminokyselin. V molekulách proteinů jsou aminokyseliny vzájemně spojeny peptidovými vazbami (- CO - NH -) v lineárním sledu, což tvoří tzv. primární strukturu proteinu. Horní řádek - volné aminokyseliny s postranními skupinami R1, R2, R3; sečteno a podtrženo – aminokyseliny jsou spojeny peptidovými vazbami.
Polypeptidový řetězec je schopen spontánně tvořit a udržovat speciální prostorovou strukturu. Podle tvaru molekul bílkovin se bílkoviny dělí na fibrilární a globulární. V globulárních proteinech je jeden nebo více polypeptidových řetězců složeno do kompaktní kulovité struktury nebo globule. Typicky jsou tyto proteiny vysoce rozpustné ve vodě. Patří sem téměř všechny enzymy, krevní transportní proteiny a mnoho zásobních proteinů. Fibrilární proteiny jsou vláknité molekuly držené pohromadě příčnými vazbami a tvoří dlouhá vlákna nebo vrstvené struktury. Mají vysokou mechanickou pevnost, jsou nerozpustné ve vodě a plní především konstrukční a ochranné funkce. Typickými představiteli takových proteinů jsou vlasové a vlněné keratiny, hedvábný fibroin a kolagen šlach.
Pořadí kovalentně spojených aminokyselin v polypeptidovém řetězci se nazývá aminokyselinová sekvence nebo primární struktura proteinů. Primární struktura každého proteinu, kódovaná odpovídajícím genem, je konstantní a nese všechny informace nezbytné pro tvorbu struktur vyšší úrovně. Potenciální počet proteinů, které lze vytvořit z 20 aminokyselin, je prakticky neomezený.
V důsledku interakce postranních skupin aminokyselinových zbytků získávají jednotlivé relativně malé úseky polypeptidového řetězce tu či onu konformaci (typ skládání), známou jako sekundární struktura proteinů. Jeho nejcharakterističtějšími prvky jsou periodicky se opakující α-šroubovice a β-struktura. Sekundární konstrukce je velmi stabilní. Vzhledem k tomu, že je do značné míry určena aminokyselinovou sekvencí odpovídající proteinové oblasti, je možné ji s určitou mírou pravděpodobnosti předpovědět. Termín „?-helix“ zavedl americký biochemik, fyzik a chemik Linus Carl Pauling, který popsal uspořádání polypeptidového řetězce v proteinu?-keratinu ve formě pravotočivé šroubovice (?-helix can přirovnat k telefonnímu kabelu). Na každý obrat takové šroubovice v proteinu připadá 3,6 aminokyselinových zbytků. To znamená, že skupina -C=O jedné peptidové vazby tvoří vodíkovou vazbu se skupinou -NH jiné peptidové vazby, čtyři aminokyselinové zbytky vzdálené od první. V průměru každá α-helikální oblast obsahuje až 15 aminokyselin, což odpovídá 3-4 závitům šroubovice. Ale v každém jednotlivém proteinu se délka šroubovice může od této hodnoty značně lišit. V příčném řezu má α-šroubovice tvar disku, ze kterého směřují ven postranní řetězce aminokyselin.
Struktura, nebo? -složená vrstva, může být tvořena několika úseky polypeptidového řetězce. Tyto úseky jsou nataženy a položeny paralelně k sobě navzájem, vzájemně spojeny vodíkovými můstky, které se vyskytují mezi peptidovými vazbami. Mohou být orientovány ve stejných nebo opačných směrech (směr pohybu podél polypeptidového řetězce je obvykle považován za směr od N-konce k C-konci). V prvním případě se složená vrstva nazývá paralelní, ve druhém - antiparalelní. Ten se vytvoří, když se peptidový řetězec prudce otočí zpět a vytvoří ohyb (a-ohyb). Jsou postranní řetězce aminokyselin orientovány kolmo k rovině? -vrstva.
Relativní obsah? -spirálové sekce a? -struktury se mohou mezi různými proteiny značně lišit. Existují proteiny s převahou α-helixů (asi 75 % aminokyselin v myoglobinu a hemoglobinu) a hlavním typem skládání řetězce v mnoha fibrilárních proteinech (včetně hedvábného fibroinu, β-keratinu) je α-helix. -struktura. Oblasti polypeptidového řetězce, které nelze klasifikovat do žádné z výše popsaných konformací, se nazývají spojovací smyčky. Jejich struktura je dána především interakcemi mezi postranními řetězci aminokyselin a v molekule jakékoli bílkoviny přesně zapadá.
Terciální struktura se nazývá prostorová struktura globulárních proteinů. Ale často se tento koncept týká způsobu skládání polypeptidového řetězce v prostoru, charakteristickém pro každý konkrétní protein. Terciární struktura je tvořena polypeptidovým řetězcem proteinu spontánně, zjevně, podél určité koagulační cesty (cest) s předběžnou tvorbou prvků sekundární struktury. Pokud je stabilita sekundární struktury způsobena vodíkovými vazbami, pak je terciární struktura fixována různorodým systémem nekovalentních interakcí: vodíkovými, iontovými, intermolekulárními interakcemi a také hydrofobními kontakty mezi postranními řetězci nepolárních aminoskupin. zbytky kyselin.
U některých proteinů je terciární struktura dále stabilizována tvorbou disulfidových vazeb (vazby -S-S-) mezi cysteinovými zbytky. Uvnitř proteinové globule jsou zpravidla do jádra sestaveny postranní řetězce hydrofobních aminokyselin (jejich přenos uvnitř proteinové globule je termodynamicky výhodný), na periferii jsou hydrofilní zbytky a některé hydrofobní. Proteinová globule je obklopena několika stovkami molekul hydratační vody, která je nezbytná pro stabilitu molekuly proteinu a často se podílí na jejím fungování. Terciární struktura je pohyblivá, její jednotlivé úseky se mohou posouvat, což vede ke konformačním přechodům, které hrají významnou roli v interakci proteinu s jinými molekulami.
Terciární struktura je základem funkčních vlastností proteinu. Určuje tvorbu ansámblů funkčních skupin v proteinu - aktivních center a vazebných zón, dává jim potřebnou geometrii, umožňuje vytvoření vnitřního prostředí, které je předpokladem pro vznik mnoha reakcí a zajišťuje interakci s jinými proteiny. .
Terciární struktura proteinů jasně odpovídá jejich primární struktuře; pravděpodobně existuje dosud nerozluštěný stereochemický kód, který určuje povahu skládání proteinů. Jeden a tentýž způsob prostorového uspořádání však obvykle neodpovídá jedné primární struktuře, ale celé rodině struktur, ve kterých se může shodovat pouze malý zlomek (do 20-30 %) aminokyselinových zbytků, ale v určitých míst v řetězci je zachována podobnost aminokyselinových zbytků. Výsledkem je tvorba velkých rodin proteinů vyznačujících se podobnou terciární a víceméně podobnou primární strukturou a zpravidla společnou funkcí. Jsou to například bílkoviny organismů různých druhů, které mají stejnou funkci a jsou si evolučně příbuzné: myoglobiny a hemoglobiny, trypsin, chymotrypsin, elastáza a další živočišné proteinázy.

Rýže. 4. Výsledkem kombinace několika makromolekul bílkovin s terciární strukturou je kvartérní struktura bílkovin formována do komplexního komplexu. Příkladem takových komplexních proteinů je hemoglobin sestávající ze čtyř makromolekul.
Často, zvláště u velkých proteinů, dochází ke sbalení polypeptidového řetězce tím, že se jednotlivými úseky řetězce vytvoří více či méně autonomní prvky prostorové struktury - domény, které mohou mít funkční autonomii a jsou odpovědné za tu či onu biologickou aktivitu. protein. N-terminální domény krevních koagulačních proteinů tedy zajišťují jejich připojení k buněčné membráně.
Existuje mnoho proteinů, jejichž molekuly jsou souborem globulí (podjednotek), které drží pohromadě hydrofobní interakce, vodíkové nebo iontové vazby. Takové komplexy se nazývají oligomerní, multimerní nebo podjednotkové proteiny. Uspořádání podjednotek ve funkčně aktivním proteinovém komplexu se nazývá kvartérní struktura proteinu. Některé proteiny jsou schopny tvořit struktury vyšších řádů, například multienzymové komplexy, rozšířené struktury (povlakové proteiny bakteriofágů), supramolekulární komplexy, které fungují jako jeden celek (například ribozomy nebo složky mitochondriálního dýchacího řetězce).
Kvartérní struktura umožňuje tvorbu molekul s neobvyklými geometriemi. Feritin, tvořený 24 podjednotkami, má tedy vnitřní dutinu, díky které na sebe protein dokáže navázat až 3000 iontů železa. Navíc kvartérní struktura umožňuje, aby v jedné molekule bylo vykonáváno několik různých funkcí. Tryptofan syntetáza kombinuje enzymy odpovědné za několik po sobě jdoucích fází syntézy aminokyseliny tryptofanu.
Metody studia struktury proteinů
Primární struktura proteinů určuje všechny ostatní úrovně organizace molekuly proteinu. Proto je při studiu biologické funkce různých proteinů důležitá znalost této struktury. První protein, pro který byla stanovena sekvence aminokyselin, byl hormon slinivky břišní, inzulín. Tuto práci, která trvala 11 let, provedl anglický biochemik Frederick Sanger (1954). Určil umístění 51 aminokyselin v molekule hormonu a ukázal, že se skládá ze 2 řetězců spojených disulfidovými vazbami. Později byla většina práce na stanovení primární struktury proteinů automatizována.
S rozvojem metod genetického inženýrství bylo možné tento proces dále urychlit stanovením primární struktury proteinů v souladu s výsledky analýzy nukleotidové sekvence v genech kódujících tyto proteiny. Sekundární a terciární struktura proteinů je studována pomocí poměrně složitých fyzikálních metod, jako je například cirkulární dichroismus nebo rentgenová difrakční analýza proteinových krystalů. Terciární strukturu poprvé stanovil anglický biochemik John Cowdery Kendrew (1957) pro svalový protein myoglobin.

Rýže. 5. Model molekuly myoglobinu (prostorová konfigurace molekuly)
Denaturace bílkovin
Relativně slabé vazby zodpovědné za stabilizaci sekundárních, terciárních a kvartérních struktur proteinu jsou snadno zničeny, což je doprovázeno ztrátou jeho biologické aktivity. K destrukci původní (nativní) proteinové struktury, zvané denaturace, dochází za přítomnosti kyselin a zásad, zahříváním, změnami iontové síly a dalšími vlivy. Denaturované proteiny jsou zpravidla špatně nebo vůbec nerozpustné ve vodě. Při krátkodobém účinku a rychlé eliminaci denaturačních faktorů je možná renaturace bílkovin s úplným nebo částečným obnovením původní struktury a biologických vlastností.
Klasifikace bílkovin
Složitost struktury proteinových molekul a extrémní rozmanitost funkcí, které vykonávají, ztěžují vytvoření jejich jednotné a jasné klasifikace, ačkoli pokusy o to byly činěny opakovaně od konce 19. století. Na základě chemického složení se proteiny dělí na jednoduché a složité (někdy nazývané proteidy). Molekuly prvního se skládají pouze z aminokyselin. Kromě samotného polypeptidového řetězce obsahují komplexní proteiny neproteinové složky reprezentované sacharidy (glykoproteiny), lipidy (lipoproteiny), nukleovými kyselinami (nukleoproteiny), kovovými ionty (metaloproteiny), fosfátovou skupinou (fosfoproteiny), pigmenty (chromoproteiny), atd. .
V závislosti na funkcích, které vykonávají, se rozlišuje několik tříd proteinů. Nejrozmanitější a nejspecializovanější třídu tvoří proteiny s katalytickou funkcí - enzymy, které mají schopnost urychlovat chemické reakce probíhající v živých organismech. V této funkci se proteiny účastní všech procesů syntézy a rozkladu různých sloučenin během metabolismu, biosyntézy proteinů a nukleových kyselin, regulace vývoje a diferenciace buněk. Transportní proteiny mají schopnost selektivně vázat mastné kyseliny, hormony a další organické i anorganické sloučeniny a ionty a následně je proudem transportovat na požadované místo (např. hemoglobin se podílí na přenosu kyslíku z plic do všech buněk tělo). Transportní proteiny také provádějí aktivní transport iontů, lipidů, cukrů a aminokyselin přes biologické membrány.
Strukturní proteiny plní podpůrnou nebo ochrannou funkci; podílejí se na tvorbě buněčné kostry. Mezi nejčastější patří kolagen pojivové tkáně, keratin, nehty a peří, elastin cévních buněk a mnoho dalších. V kombinaci s lipidy jsou strukturálním základem buněčných a intracelulárních membrán.
Řada proteinů plní ochrannou funkci. Například imunoglobuliny (protilátky) obratlovců, mající schopnost vázat cizorodé patogenní mikroorganismy a látky, neutralizovat jejich patogenní účinky na organismus a zabraňovat proliferaci buněk. Fibrinogen a trombin se účastní procesu srážení krve. Mnoho bílkovinných látek vylučovaných bakteriemi, stejně jako složky některých bezobratlých, je klasifikováno jako toxiny.
Některé proteiny (regulační) se podílejí na regulaci fyziologické činnosti organismu jako celku, jednotlivých orgánů, buněk nebo procesů. Řídí transkripci genů a syntézu proteinů; mezi ně patří peptid-proteinové hormony vylučované endokrinními žlázami. Zásobní proteiny semen poskytují živiny pro počáteční fáze vývoje embrya. Patří sem také kasein, vaječný bílek albumin (ovalbumin) a mnoho dalších. Svalové buňky díky bílkovinám získávají schopnost se stahovat a v konečném důsledku zajistit pohyb tělu. Příklady takových kontraktilních proteinů jsou aktin a myosin kosterního svalstva, stejně jako tubulin, což jsou složky řasinek a bičíků jednobuněčných organismů; Zajišťují také divergenci chromozomů při dělení buněk.
Receptorové proteiny jsou cílem hormonů a dalších biologicky aktivních sloučenin. S jejich pomocí buňka vnímá informace o stavu vnějšího prostředí. Hrají důležitou roli při přenosu nervového vzruchu a při orientovaném pohybu buněk (chemotaxe). K přeměně a využití energie vstupující do těla, stejně jako energie, dochází i za účasti bílkovin bioenergetického systému (například zrakového pigmentu rodopsinu, cytochromů dýchacího řetězce). Existuje také mnoho proteinů s jinými, někdy spíše neobvyklými funkcemi (například plazma některých antarktických ryb obsahuje proteiny, které mají nemrznoucí vlastnosti).
Biosyntéza bílkovin
Veškeré informace o struktuře konkrétního proteinu jsou „uloženy“ v odpovídajících genech ve formě sekvence nukleotidů a jsou implementovány do procesu syntézy templátu. Nejprve je informace přenesena (přečtena) z molekuly DNA do messenger RNA (mRNA) pomocí enzymu DNA-dependentní RNA polymerázy a poté v ribozomu na mRNA, jako na matrici v souladu s genetickým kódem, za účasti transportních RNA doručujících aminokyseliny, dochází k tvorbě polypeptidového řetězce.
Syntetizované polypeptidové řetězce vystupující z ribozomu, spontánně se skládající, přebírají konformační charakteristiku proteinu a mohou být podrobeny posttranslační modifikaci. Postranní řetězce jednotlivých aminokyselin mohou podléhat modifikacím (hydroxylace, fosforylace atd.). Proto se v kolagenu nachází např. hydroxyprolin a hydroxylysin (viz). Modifikace může být také doprovázena rupturou polypeptidových vazeb. Tímto způsobem například dochází k tvorbě aktivní molekuly inzulínu, skládající se ze dvou řetězců spojených disulfidovými vazbami.

Rýže. 6. Obecné schéma biosyntézy proteinů.
Význam bílkovin ve výživě
Bílkoviny jsou nejdůležitější složkou potravy zvířat a lidí. Výživová hodnota bílkovin je dána jejich obsahem esenciálních aminokyselin, které si tělo samo nevytváří. V tomto ohledu jsou rostlinné bílkoviny méně hodnotné než bílkoviny živočišné: jsou chudší na lysin, methionin a tryptofan a hůře se tráví v gastrointestinálním traktu. Nedostatek esenciálních aminokyselin v potravě vede k těžkým poruchám metabolismu dusíku.
Bílkoviny se štěpí na volné aminokyseliny, které se po vstřebání ve střevě dostávají a jsou distribuovány do všech buněk. Některé z nich se rozkládají na jednoduché sloučeniny s uvolněním energie, používané pro různé potřeby buňkou, a některé směřují k syntéze nových proteinů charakteristických pro daný organismus. (R. A. Matveeva, Encyklopedie Cyril a Metoděj)
Výčet bílkovin
- amyloid - amyloid;
- aniontový - aniontový;
- antivirus - antivirový;
- autoimunitní - autoimunitní;
- autologous - autologický;
- bakteriální - bakteriální;
- protein Bence Jones;
- virem indukovaný - virem indukovaný;
- virový - virus;
- virový nestrukturální - virus nestrukturální;
- virová strukturální - virová strukturální;
- virově specifický - virově specifický;
- vysoká molekulová hmotnost - vysoká molekulová hmotnost;
- heme-obsahující — hem;
- heterologní - cizí;
- hybrid - hybrid;
- glykosylovaný - glykovaný;
- kulovitý - kulovitý;
- denaturovaný - denaturovaný;
- obsahující železo - železo;
- žloutek - žloutek;
- živočišná bílkovina - živočišná bílkovina;
- ochranný - obranný;
- imunitní - imunitní;
- imunogenní - imunologicky relevantní;
- vazba vápníku;
- kyselý - kyselý;
- corpuscular - korpuskulární;
- membrána - membrána;
- myelom - myelom;
- mikrosomální - mikrosomální;
- mléčná bílkovina - mléčná bílkovina;
- monoklonální - monoklonální imunoglobulin;
- svalová bílkovina - svalová bílkovina;
- nativní - domácí;
- nonhistone - nonhistone;
- vadný - částečný;
- nerozpustný - nerozpustný;
- nestravitelný - nerozpustný;
- neenzymatický - neenzymový;
- nízká molekulová hmotnost - nízká molekulová hmotnost;
- nový protein - nový protein;
- obecný - celý;
- onkogenní - onkoprotein;
- protein hlavní fáze - aniontový;
- protein akutní fáze (zánět) - protein akutní fáze;
- jídlo - jídlo;
- protein krevní plazmy - protein plazmy;
- placentární - placenta;
- uncoupling - rozpojení;
- protein regeneračního nervu;
- regulační - regulační;
- rekombinace - rekombinantní;
- receptor - receptor;
- ribozomální - ribozomální;
- vazba - vazba;
- sekreční protein - sekreční protein;
- C-reaktivní - C-reaktivní;
- syrovátkový protein - syrovátkový protein, laktoprotein;
- tkáň - tkáň;
- jedovatý - jedovatý;
- chimerický - chimérický;
- celý - celý;
- cytosolický - cytosolický;
- alkalický protein - aniontový protein;
- exogenní - exogenní;
- endogenní - endogenní protein.
Přečtěte si více o proteinech v literatuře:
- Volkenshtein M.V., Molecules and, M., 1965, kap. 3-5;
- Gaurowitz F., Chemie a funkce proteinů, trans. z angličtiny, Moskva, 1965;
- Sissakyan N. M. a Gladilin K. L., Biochemické aspekty syntézy proteinů, v knize: Pokroky v biologické chemii, díl 7, M., 1965, str. 3;
- Stepanov V. M. Molekulární biologie. Struktura a funkce bílkovin. M., 1996;
- Shamin A. N., Development of protein chemistry, M., 1966;
- Proteiny a peptidy. M., 1995-2000. T. 1-3;
- Biosyntéza proteinů a nukleových kyselin, ed. A. S. Spirina, M., 1965;
- Úvod do molekulární biologie, přel. z angličtiny, M., 1967
- Molekuly a buňky. [So. čl.], přel. z angličtiny, M., 1966, str. 7-27, 94-106;
- Základy biochemie: Překlad z angličtiny M., 1981. T. 1;
- Problém s bílkovinami. M., 1995. T. 1-5;
- Proteiny. New York, 1975-79. 3 vyd. V. 1-4.
Najděte něco jiného zajímavého:
Veverky- vysokomolekulární organické sloučeniny sestávající ze zbytků α-aminokyselin.
V složení bílkovin zahrnuje uhlík, vodík, dusík, kyslík, síru. Některé proteiny tvoří komplexy s jinými molekulami obsahujícími fosfor, železo, zinek a měď.
Bílkoviny mají velkou molekulovou hmotnost: vaječný albumin - 36 000, hemoglobin - 152 000, myosin - 500 000. Pro srovnání: molekulová hmotnost alkoholu je 46, kyselina octová - 60, benzen - 78.
Aminokyselinové složení bílkovin
Veverky- neperiodické polymery, jejichž monomery jsou a-aminokyseliny. Typicky se 20 typů α-aminokyselin nazývá proteinové monomery, ačkoli více než 170 z nich se nachází v buňkách a tkáních.
V závislosti na tom, zda mohou být aminokyseliny syntetizovány v těle lidí a jiných zvířat, se rozlišují: neesenciální aminokyseliny- lze syntetizovat; esenciální aminokyseliny- nelze syntetizovat. Esenciální aminokyseliny musí být tělu dodávány prostřednictvím potravy. Rostliny syntetizují všechny typy aminokyselin.
V závislosti na složení aminokyselin, bílkoviny jsou: kompletní- obsahují celou sadu aminokyselin; vadný- v jejich složení chybí některé aminokyseliny. Pokud se proteiny skládají pouze z aminokyselin, jsou tzv jednoduchý. Pokud bílkoviny obsahují kromě aminokyselin i neaminokyselinovou složku (prostetickou skupinu), jsou tzv komplex. Protetickou skupinu mohou představovat kovy (metaloproteiny), sacharidy (glykoproteiny), lipidy (lipoproteiny), nukleové kyseliny (nukleoproteiny).
Všechno obsahují aminokyseliny: 1) karboxylová skupina (-COOH), 2) aminoskupina (-NH2), 3) radikál nebo R-skupina (zbytek molekuly). Struktura radikálu je různá pro různé typy aminokyselin. V závislosti na počtu aminoskupin a karboxylových skupin obsažených ve složení aminokyselin se rozlišují: neutrální aminokyseliny mající jednu karboxylovou skupinu a jednu aminoskupinu; bazické aminokyseliny mající více než jednu aminoskupinu; kyselé aminokyseliny mající více než jednu karboxylovou skupinu.
Aminokyseliny jsou amfoterní sloučeniny, protože v roztoku mohou působit jako kyseliny i zásady. Ve vodných roztocích existují aminokyseliny v různých iontových formách.
Peptidová vazba
Peptidy- organické látky sestávající z aminokyselinových zbytků spojených peptidovými vazbami.
K tvorbě peptidů dochází v důsledku kondenzační reakce aminokyselin. Když aminoskupina jedné aminokyseliny interaguje s karboxylovou skupinou jiné, vznikne mezi nimi kovalentní vazba dusík-uhlík, tzv. peptid. V závislosti na počtu aminokyselinových zbytků zahrnutých v peptidu existují dipeptidy, tripeptidy, tetrapeptidy atd. Tvorba peptidové vazby se může mnohokrát opakovat. To vede k formaci polypeptidy. Na jednom konci peptidu je volná aminoskupina (nazývaná N-konec) a na druhém je volná karboxylová skupina (nazývaná C-konec).

Prostorová organizace molekul bílkovin
Plnění určitých specifických funkcí proteiny závisí na prostorové konfiguraci jejich molekul, kromě toho je pro buňku energeticky nevýhodné udržovat proteiny v nesbalené formě, ve formě řetězce, proto dochází k skládání polypeptidových řetězců a získávání určitá trojrozměrná struktura nebo konformace. K dispozici jsou 4 úrovně prostorová organizace proteinů.
Primární proteinová struktura- sekvence uspořádání aminokyselinových zbytků v polypeptidovém řetězci, který tvoří molekulu proteinu. Vazba mezi aminokyselinami je peptidová vazba.

Pokud se molekula proteinu skládá pouze z 10 aminokyselinových zbytků, pak počet teoreticky možných variant molekul proteinu, které se liší v pořadí střídání aminokyselin, je 10 20. S 20 aminokyselinami z nich můžete vytvořit ještě rozmanitější kombinace. V lidském těle bylo nalezeno asi deset tisíc různých bílkovin, které se liší jak jedna od druhé, tak i od bílkovin jiných organismů.
Je to primární struktura molekuly proteinu, která určuje vlastnosti molekul proteinu a její prostorovou konfiguraci. Nahrazení pouze jedné aminokyseliny jinou v polypeptidovém řetězci vede ke změně vlastností a funkcí proteinu. Například nahrazení šesté aminokyseliny glutamové v β-podjednotce hemoglobinu valinem vede k tomu, že molekula hemoglobinu jako celek nemůže plnit svou hlavní funkci – transport kyslíku; V takových případech se u člověka rozvine onemocnění zvané srpkovitá anémie.
Sekundární struktura- uspořádané skládání polypeptidového řetězce do spirály (vypadá jako prodloužená pružina). Závity šroubovice jsou zesíleny vodíkovými vazbami, které vznikají mezi karboxylovými skupinami a aminoskupinami. Téměř všechny skupiny CO a NH se podílejí na tvorbě vodíkových vazeb. Jsou slabší než peptidové, ale mnohokrát opakované, dodávají této konfiguraci stabilitu a tuhost. Na úrovni sekundární struktury jsou proteiny: fibroin (hedvábí, pavučina), keratin (vlasy, nehty), kolagen (šlachy).



Terciární struktura- sbalení polypeptidových řetězců do globulí, vyplývající z tvorby chemických vazeb (vodíkové, iontové, disulfidové) a ustavení hydrofobních interakcí mezi radikály aminokyselinových zbytků. Hlavní roli při tvorbě terciární struktury hrají hydrofilně-hydrofobní interakce. Ve vodných roztocích mají hydrofobní radikály tendenci se schovávat před vodou, seskupovat se uvnitř globule, zatímco hydrofilní radikály v důsledku hydratace (interakce s vodními dipóly) mají tendenci se objevovat na povrchu molekuly. U některých proteinů je terciární struktura stabilizována disulfidovými kovalentními vazbami vytvořenými mezi atomy síry dvou cysteinových zbytků. Na úrovni terciární struktury jsou enzymy, protilátky a některé hormony.

Kvartérní struktura charakteristické pro komplexní proteiny, jejichž molekuly jsou tvořeny dvěma nebo více globulemi. Podjednotky jsou v molekule drženy iontovými, hydrofobními a elektrostatickými interakcemi. Někdy při tvorbě kvartérní struktury dochází mezi podjednotkami k disulfidickým můstkům. Nejvíce studovaným proteinem s kvartérní strukturou je hemoglobin. Je tvořena dvěma α-podjednotkami (141 aminokyselinových zbytků) a dvěma β-podjednotkami (146 aminokyselinových zbytků). S každou podjednotkou je spojena molekula hemu obsahující železo.
Pokud se z nějakého důvodu prostorová konformace proteinů odchyluje od normálu, protein nemůže plnit své funkce. Například příčinou „nemoci šílených krav“ (spongiformní encefalopatie) je abnormální konformace prionů, povrchových proteinů nervových buněk.
Vlastnosti bílkovin
Určuje to složení aminokyselin a struktura molekuly proteinu vlastnosti. Proteiny kombinují základní a kyselé vlastnosti, určované aminokyselinovými radikály: čím kyselejší aminokyseliny jsou v proteinu, tím jsou jeho kyselé vlastnosti výraznější. Zjišťuje se schopnost darovat a přidat H + pufrovací vlastnosti proteinů; Jedním z nejsilnějších pufrů je hemoglobin v červených krvinkách, který udržuje pH krve na konstantní úrovni. Existují rozpustné bílkoviny (fibrinogen) a nerozpustné bílkoviny, které plní mechanické funkce (fibroin, keratin, kolagen). Existují proteiny, které jsou chemicky aktivní (enzymy), existují chemicky neaktivní proteiny, které jsou odolné vůči různým podmínkám prostředí a ty, které jsou extrémně nestabilní.
Vnější faktory (teplo, ultrafialové záření, těžké kovy a jejich soli, změny pH, záření, dehydratace)
může způsobit narušení strukturní organizace molekuly proteinu. Proces ztráty trojrozměrné konformace vlastní dané molekule proteinu se nazývá denaturace. Příčinou denaturace je porušení vazeb, které stabilizují určitou proteinovou strukturu. Zpočátku se přetrhnou ty nejslabší vazby, a jak se podmínky zpřísní, přetrhnou se i ty silnější. Proto se nejprve ztrácejí kvartérní, poté terciární a sekundární struktury. Změna prostorové konfigurace vede ke změně vlastností proteinu a v důsledku toho znemožňuje proteinu plnit jeho přirozené biologické funkce. Pokud není denaturace doprovázena destrukcí primární struktury, pak může být reverzibilní v tomto případě dochází k samoobnovení konformační charakteristiky proteinu. Například membránové receptorové proteiny podléhají takové denaturaci. Proces obnovy proteinové struktury po denaturaci se nazývá renaturace. Pokud je obnovení prostorové konfigurace proteinu nemožné, pak se nazývá denaturace nevratné.
Funkce proteinů
| Funkce | Příklady a vysvětlení |
|---|---|
| Konstrukce | Proteiny se podílejí na tvorbě buněčných a extracelulárních struktur: jsou součástí buněčných membrán (lipoproteiny, glykoproteiny), vlasů (keratin), šlach (kolagen) atd. |
| Doprava | Krevní bílkovina hemoglobin váže kyslík a transportuje ho z plic do všech tkání a orgánů a z nich přenáší oxid uhličitý do plic; Složení buněčných membrán zahrnuje speciální proteiny, které zajišťují aktivní a přísně selektivní přenos určitých látek a iontů z buňky do vnějšího prostředí a zpět. |
| Regulační | Proteinové hormony se podílejí na regulaci metabolických procesů. Například hormon inzulín reguluje hladinu glukózy v krvi, podporuje syntézu glykogenu a zvyšuje tvorbu tuků ze sacharidů. |
| Ochranný | V reakci na průnik cizích proteinů nebo mikroorganismů (antigenů) do těla se tvoří speciální proteiny – protilátky, které je dokážou vázat a neutralizovat. Fibrin, tvořený z fibrinogenu, pomáhá zastavit krvácení. |
| Motor | Kontraktilní proteiny aktin a myosin zajišťují svalovou kontrakci u mnohobuněčných živočichů. |
| Signál | Do povrchové membrány buňky jsou zabudovány proteinové molekuly, které jsou schopny měnit svou terciární strukturu v reakci na faktory prostředí, a tak přijímat signály z vnějšího prostředí a předávat buňce příkazy. |
| Úložný prostor | V těle zvířat se bílkoviny zpravidla neukládají, s výjimkou vaječného albuminu a mléčného kaseinu. Ale díky bílkovinám se některé látky mohou v těle ukládat, například při odbourávání hemoglobinu se železo z těla neodstraňuje, ale ukládá a tvoří komplex s bílkovinou feritin. |
| Energie | Když se 1 g bílkovin rozloží na konečné produkty, uvolní se 17,6 kJ. Nejprve se bílkoviny rozkládají na aminokyseliny a poté na konečné produkty - vodu, oxid uhličitý a amoniak. Bílkoviny se však jako zdroj energie využívají až při vyčerpání jiných zdrojů (sacharidů a tuků). |
| Katalytické | Jedna z nejdůležitějších funkcí bílkovin. Poskytují proteiny - enzymy, které urychlují biochemické reakce probíhající v buňkách. Například ribulóza bifosfát karboxyláza katalyzuje fixaci CO 2 během fotosyntézy. |
Enzymy
Enzymy nebo enzymy, jsou speciální třídou proteinů, které jsou biologickými katalyzátory. Díky enzymům probíhají biochemické reakce obrovskou rychlostí. Rychlost enzymatických reakcí je desetitisíckrát (a někdy i milionkrát) vyšší než rychlost reakcí probíhajících za účasti anorganických katalyzátorů. Látka, na kterou enzym působí, se nazývá Podklad.
Enzymy jsou globulární proteiny, strukturální vlastnosti enzymy lze rozdělit do dvou skupin: jednoduché a složité. Jednoduché enzymy jsou jednoduché bílkoviny, tzn. sestávají pouze z aminokyselin. Komplexní enzymy jsou komplexní proteiny, tzn. Kromě bílkovinné části obsahují skupinu nebílkovinné povahy - kofaktor. Některé enzymy používají vitaminy jako kofaktory. Molekula enzymu obsahuje speciální část zvanou aktivní centrum. Aktivní centrum- malá část enzymu (od tří do dvanácti aminokyselinových zbytků), kde dochází k vazbě substrátu nebo substrátů za vzniku komplexu enzym-substrát. Po dokončení reakce se komplex enzym-substrát rozloží na enzym a reakční produkt (produkty). Některé enzymy mají (kromě aktivních) alosterická centra- oblasti, ke kterým jsou připojeny regulátory rychlosti enzymů ( alosterické enzymy).

Reakce enzymatické katalýzy se vyznačují: 1) vysokou účinností, 2) přísnou selektivitou a směrem působení, 3) substrátovou specifitou, 4) jemnou a přesnou regulací. Substrátová a reakční specifičnost reakcí enzymatické katalýzy je vysvětlena hypotézami E. Fischera (1890) a D. Koshlanda (1959).
E. Fisher (hypotéza klíčového zámku) navrhl, že prostorové konfigurace aktivního centra enzymu a substrátu si musí přesně odpovídat. Substrát je přirovnáván ke „klíči“, enzym k „zámku“.
D. Koshland (hypotéza ruka-rukavice) navrhl, že prostorová korespondence mezi strukturou substrátu a aktivním centrem enzymu vzniká až v okamžiku jejich vzájemné interakce. Tato hypotéza se také nazývá hypotéza indukované korespondence.
Rychlost enzymatických reakcí závisí na: 1) teplotě, 2) koncentraci enzymu, 3) koncentraci substrátu, 4) pH. Je třeba zdůraznit, že jelikož enzymy jsou proteiny, jejich aktivita je nejvyšší za fyziologicky normálních podmínek.
Většina enzymů může pracovat pouze při teplotách mezi 0 a 40 °C. V těchto mezích se rychlost reakce zvyšuje přibližně 2krát s každým zvýšením teploty o 10 °C. Při teplotách nad 40 °C dochází k denaturaci bílkoviny a snižuje se aktivita enzymů. Při teplotách blízkých bodu mrazu jsou enzymy inaktivovány.
S rostoucím množstvím substrátu se zvyšuje rychlost enzymatické reakce, dokud se počet molekul substrátu nerovná počtu molekul enzymu. S dalším zvýšením množství substrátu se rychlost nezvýší, protože aktivní centra enzymu jsou nasycena. Zvýšení koncentrace enzymu vede ke zvýšené katalytické aktivitě, protože větší počet molekul substrátu projde transformací za jednotku času.

Pro každý enzym existuje optimální hodnota pH, při které vykazuje maximální aktivitu (pepsin - 2,0, slinná amyláza - 6,8, pankreatická lipáza - 9,0). Při vyšších nebo nižších hodnotách pH se aktivita enzymů snižuje. Při náhlých změnách pH enzym denaturuje.
Rychlost alosterických enzymů je regulována látkami, které se vážou na alosterická centra. Pokud tyto látky urychlí reakci, jsou tzv aktivátory pokud zpomalí - inhibitory.
Klasifikace enzymů
Podle typu chemických přeměn, které katalyzují, se enzymy dělí do 6 tříd:
- oxireduktázy(přenos atomů vodíku, kyslíku nebo elektronů z jedné látky na druhou - dehydrogenáza),
- transferázy(přenos methylové, acylové, fosfátové nebo aminoskupiny z jedné látky na druhou – transaminázu),
- hydrolázy(hydrolytické reakce, při kterých ze substrátu vznikají dva produkty - amyláza, lipáza),
- lyázy(nehydrolytická adice k substrátu nebo odtržení skupiny atomů z něj, v takovém případě lze přerušit vazby C-C, C-N, C-O, C-S - dekarboxyláza),
- izomerázy(intramolekulární přeskupení - izomeráza),
- ligázy(spojení dvou molekul v důsledku tvorby vazeb C-C, C-N, C-O, C-S - syntetáza).
Třídy se dále dělí na podtřídy a podtřídy. V současné mezinárodní klasifikaci má každý enzym specifický kód, který se skládá ze čtyř čísel oddělených tečkami. První číslo je třída, druhé je podtřída, třetí je podtřída, čtvrté je pořadové číslo enzymu v této podtřídě, například kód arginázy je 3.5.3.1.
Jít do přednášky č. 2"Struktura a funkce sacharidů a lipidů"
Jít do přednášky č. 4„Struktura a funkce ATP nukleových kyselin“
V první polovině 19. stol. řada chemiků, mezi nimi především J. von Liebig, postupně dospěla k závěru, že proteiny představují zvláštní třídu dusíkatých sloučenin. Název „proteiny“ (z řečtiny.
protos první) navrhl v roce 1840 holandský chemik G. Mulder. FYZIKÁLNÍ VLASTNOSTI Proteiny jsou bílé v pevném stavu, ale bezbarvé v roztoku, pokud nenesou nějaký druh chromoforové (barevné) skupiny, jako je hemoglobin. Rozpustnost ve vodě se mezi různými proteiny velmi liší. Mění se také v závislosti na pH a koncentraci solí v roztoku, takže je možné zvolit podmínky, za kterých se bude jeden protein selektivně vysrážet v přítomnosti jiných proteinů. Tato metoda „vysolování“ se široce používá k izolaci a čištění proteinů. Purifikovaný protein se často vysráží z roztoku jako krystaly.Ve srovnání s jinými sloučeninami je molekulová hmotnost proteinů velmi velká, pohybuje se od několika tisíc do mnoha milionů daltonů. Proto během ultracentrifugace dochází k sedimentaci proteinů, a to různými rychlostmi. Vzhledem k přítomnosti kladně a záporně nabitých skupin v molekulách bílkovin se tyto pohybují různou rychlostí a v elektrickém poli. To je základem elektroforézy, metody používané k izolaci jednotlivých proteinů z komplexních směsí. Proteiny se také čistí chromatografií.
CHEMICKÉ VLASTNOSTI Struktura. Proteiny jsou polymery, tzn. molekuly vytvořené jako řetězce z opakujících se monomerních jednotek nebo podjednotek, jejichž roli hrají A -aminokyseliny. Obecný vzorec aminokyselin kde R atom vodíku nebo nějaká organická skupina.Molekula proteinu (polypeptidový řetězec) se může skládat pouze z relativně malého počtu aminokyselin nebo několika tisíc monomerních jednotek. Kombinace aminokyselin v řetězci je možná, protože každá z nich má dvě různé chemické skupiny: aminoskupinu se základními vlastnostmi,
NH 2 a kyselá karboxylová skupina, COOH. Obě tyto skupiny jsou přidruženy A - atom uhlíku. Karboxylová skupina jedné aminokyseliny může tvořit amidovou (peptidovou) vazbu s aminoskupinou jiné aminokyseliny: Poté, co byly dvě aminokyseliny spojeny tímto způsobem, lze řetězec prodloužit přidáním třetí k druhé aminokyselině a tak dále. Jak je vidět z výše uvedené rovnice, když se vytvoří peptidová vazba, uvolní se molekula vody. V přítomnosti kyselin, alkálií nebo proteolytických enzymů probíhá reakce opačným směrem: polypeptidový řetězec se za přidání vody rozštěpí na aminokyseliny. Tato reakce se nazývá hydrolýza. K hydrolýze dochází spontánně a ke spojení aminokyselin do polypeptidového řetězce je zapotřebí energie.
Poté, co byly dvě aminokyseliny spojeny tímto způsobem, lze řetězec prodloužit přidáním třetí k druhé aminokyselině a tak dále. Jak je vidět z výše uvedené rovnice, když se vytvoří peptidová vazba, uvolní se molekula vody. V přítomnosti kyselin, alkálií nebo proteolytických enzymů probíhá reakce opačným směrem: polypeptidový řetězec se za přidání vody rozštěpí na aminokyseliny. Tato reakce se nazývá hydrolýza. K hydrolýze dochází spontánně a ke spojení aminokyselin do polypeptidového řetězce je zapotřebí energie. Karboxylová skupina a amidová skupina (nebo podobná imidová skupina v případě aminokyseliny prolin) jsou přítomny ve všech aminokyselinách, ale rozdíly mezi aminokyselinami jsou určeny povahou skupiny neboli „postranního řetězce“. což je uvedeno výše písmenem
R . Roli postranního řetězce může hrát jeden atom vodíku, jako v aminokyselině glycinu, nebo nějaká objemná skupina, jako je histidin a tryptofan. Některé postranní řetězce jsou chemicky inertní, zatímco jiné jsou výrazně reaktivní.Lze syntetizovat mnoho tisíc různých aminokyselin a v přírodě se vyskytuje mnoho různých aminokyselin, ale pro syntézu bílkovin se používá pouze 20 typů aminokyselin: alanin, arginin, asparagin, kyselina asparagová, valin, histidin, glycin, glutamin, glutamová kyselina, isoleucin, leucin, lysin, methionin, prolin, serin, tyrosin, threonin, tryptofan, fenylalanin a cystein (v proteinech může být cystein přítomen jako dimer
cystin). Pravda, některé proteiny obsahují kromě pravidelně se vyskytujících dvaceti ještě další aminokyseliny, ale ty vznikají modifikací jedné z dvaceti uvedených po jejím zařazení do proteinu.Optická aktivita. Všechny aminokyseliny, s výjimkou glycinu, mají A K atomu uhlíku jsou připojeny čtyři různé skupiny. Z hlediska geometrie mohou být čtyři různé skupiny připojeny dvěma způsoby a podle toho existují dvě možné konfigurace nebo dva izomery, které spolu souvisí jako objekt ke svému zrcadlovému obrazu, tzn. jako levá ruka doprava. Jedna konfigurace se nazývá levá nebo levá ( L ), a druhý pravý nebo pravotočivý ( D ), protože dva takové izomery se liší ve směru rotace roviny polarizovaného světla. Nachází se pouze v bílkovinách L -aminokyseliny (výjimkou je glycin; může být zastoupen pouze v jedné formě, protože dvě z jeho čtyř skupin jsou stejné) a všechny jsou opticky aktivní (protože existuje pouze jeden izomer). D -aminokyseliny jsou v přírodě vzácné; nacházejí se v některých antibiotikách a buněčné stěně bakterií.Sekvence aminokyselin. Aminokyseliny v polypeptidovém řetězci nejsou uspořádány náhodně, ale v určitém pevném pořadí a právě toto pořadí určuje funkce a vlastnosti proteinu. Změnou pořadí 20 druhů aminokyselin můžete vytvořit obrovské množství různých proteinů, stejně jako můžete vytvořit mnoho různých textů z písmen abecedy.V minulosti trvalo určení aminokyselinové sekvence proteinu často několik let. Přímé stanovení je stále poměrně pracný úkol, i když byla vytvořena zařízení, která umožňují jeho automatické provádění. Obvykle je jednodušší určit nukleotidovou sekvenci odpovídajícího genu a odvodit z ní aminokyselinovou sekvenci proteinu. K dnešnímu dni již byly stanoveny aminokyselinové sekvence mnoha stovek proteinů. Funkce dešifrovaných proteinů jsou obvykle známé, což pomáhá představit si možné funkce podobných proteinů vytvořených například u maligních novotvarů.
Komplexní proteiny. Proteiny skládající se pouze z aminokyselin se nazývají jednoduché. Často je však k polypeptidovému řetězci připojen atom kovu nebo nějaká chemická sloučenina, která není aminokyselinou. Takové proteiny se nazývají komplexní. Příkladem je hemoglobin: obsahuje porfyrin železa, který určuje jeho červenou barvu a umožňuje mu fungovat jako přenašeč kyslíku.Názvy nejsložitějších proteinů naznačují povahu připojených skupin: glykoproteiny obsahují cukry, lipoproteiny obsahují tuky. Pokud katalytická aktivita enzymu závisí na připojené skupině, pak se nazývá protetická skupina. Vitamín často hraje roli protetické skupiny nebo je součástí jedné. Například vitamín A navázaný na jeden z proteinů v sítnici určuje jeho citlivost na světlo.
Terciární struktura. Důležitá není ani tak sekvence aminokyselin samotného proteinu (primární struktura), ale způsob, jakým je rozložen v prostoru. Po celé délce polypeptidového řetězce tvoří vodíkové ionty pravidelné vodíkové vazby, které mu dávají tvar šroubovice nebo vrstvy (sekundární struktura). Z kombinace takových šroubovic a vrstev vzniká kompaktní forma dalšího řádu: terciární struktura proteinu. Kolem vazeb držících monomerní jednotky řetězce jsou možné rotace pod malými úhly. Z čistě geometrického hlediska je tedy počet možných konfigurací pro jakýkoli polypeptidový řetězec nekonečně velký. Ve skutečnosti každý protein normálně existuje pouze v jedné konfiguraci, určené jeho aminokyselinovou sekvencí. Tato struktura není tuhá, je jakoby « dýchá“ kolísá kolem určité průměrné konfigurace. Obvod je složen do konfigurace, ve které je volná energie (schopnost produkovat práci) minimální, stejně jako se uvolněná pružina stlačuje pouze do stavu odpovídajícího minimu volné energie. Často je jedna část řetězce pevně spojena s druhou disulfidem ( SS) vazby mezi dvěma cysteinovými zbytky. To je částečně důvod, proč cystein hraje zvláště důležitou roli mezi aminokyselinami.Složitost struktury proteinů je tak velká, že zatím není možné vypočítat terciární strukturu proteinu, i když je známa jeho aminokyselinová sekvence. Ale pokud je možné získat krystaly proteinu, pak lze jeho terciární strukturu určit pomocí rentgenové difrakce.
Ve strukturálních, kontraktilních a některých jiných proteinech jsou řetězce prodloužené a několik lehce složených řetězců ležících poblíž tvoří fibrily; fibrily se zase skládají do větších útvarů vláken. Většina proteinů v roztoku má však kulovitý tvar: řetězce jsou stočeny do globule, jako příze v klubíčku. Volná energie s touto konfigurací je minimální, protože hydrofobní („vodu odpuzující“) aminokyseliny jsou ukryty uvnitř globule a hydrofilní („vodu přitahující“) aminokyseliny jsou na jejím povrchu.
Mnoho proteinů jsou komplexy několika polypeptidových řetězců. Tato struktura se nazývá kvartérní struktura proteinu. Molekula hemoglobinu se například skládá ze čtyř podjednotek, z nichž každá je globulární protein.
Strukturní proteiny díky své lineární konfiguraci tvoří vlákna, která mají velmi vysokou pevnost v tahu, zatímco globulární konfigurace umožňuje proteinům vstupovat do specifických interakcí s jinými sloučeninami. Na povrchu globule se při správném rozložení řetězců objevují dutiny určitého tvaru, ve kterých jsou umístěny reaktivní chemické skupiny. Je-li daný protein enzym, pak se do takové dutiny dostane další, obvykle menší, molekula nějaké látky, stejně jako klíč do zámku; v tomto případě se vlivem chemických skupin umístěných v dutině mění konfigurace elektronového oblaku molekuly a to ji nutí k určité reakci. Tímto způsobem enzym katalyzuje reakci. Molekuly protilátek mají také dutiny, ve kterých se vážou různé cizorodé látky, a tím se stávají neškodnými. Model „zámek a klíč“, který vysvětluje interakci proteinů s jinými sloučeninami, nám umožňuje pochopit specifičnost enzymů a protilátek, tzn. jejich schopnost reagovat pouze s určitými sloučeninami.
Proteiny v různých typech organismů. Podobnou konfiguraci mají také proteiny, které plní stejnou funkci u různých druhů rostlin a živočichů, a proto nesou stejné jméno. Ty se však poněkud liší ve své aminokyselinové sekvenci. Jak se druhy liší od společného předka, jsou některé aminokyseliny na určitých pozicích nahrazeny mutacemi jinými. Škodlivé mutace, které způsobují dědičná onemocnění, jsou eliminovány přirozeným výběrem, ale prospěšné nebo alespoň neutrální mohou přetrvávat. Čím blíže jsou dva biologické druhy k sobě, tím menší rozdíly se nacházejí v jejich proteinech.Některé proteiny se mění poměrně rychle, jiné jsou velmi konzervativní. Mezi poslední jmenované patří například cytochrom S respirační enzym vyskytující se ve většině živých organismů. U lidí a šimpanzů jsou jeho aminokyselinové sekvence totožné a v cytochromu S V pšenici se lišilo pouze 38 % aminokyselin. I při srovnání lidí a bakterií podobnost cytochromů S(rozdíly zde postihují 65 % aminokyselin) je stále vidět, ačkoli společný předek bakterií a lidí žil na Zemi asi před dvěma miliardami let. V dnešní době se ke konstrukci fylogenetického (rodinného) stromu, odrážejícího evoluční vztahy mezi různými organismy, často používá srovnání aminokyselinových sekvencí.
Denaturace. Syntetizovaná molekula proteinu, sbalení, získává svou charakteristickou konfiguraci. Tato konfigurace však může být zničena zahříváním, změnou pH, vystavením organickým rozpouštědlům a dokonce i jednoduchým protřepáváním roztoku, dokud se na jeho povrchu neobjeví bubliny. Takto upravený protein se nazývá denaturovaný; ztrácí svou biologickou aktivitu a obvykle se stává nerozpustným. Známými příklady denaturovaných bílkovin jsou vařená vejce nebo šlehačka. Malé bílkoviny obsahující jen asi sto aminokyselin jsou schopné renaturace, tzn. znovu získat původní konfiguraci. Ale většina proteinů se jednoduše změní na masu zamotaných polypeptidových řetězců a neobnoví svou předchozí konfiguraci.Jednou z hlavních obtíží při izolaci aktivních proteinů je jejich extrémní citlivost na denaturaci. Tato vlastnost proteinů nachází užitečné uplatnění při konzervaci potravin: vysoká teplota nevratně denaturuje enzymy mikroorganismů a mikroorganismy odumírají.
PROTEOSYNTÉZA Pro syntézu bílkovin musí mít živý organismus systém enzymů schopných spojit jednu aminokyselinu s druhou. K určení, které aminokyseliny by měly být kombinovány, je také zapotřebí zdroj informací. Vzhledem k tomu, že v těle existují tisíce druhů bílkovin a každý z nich se skládá v průměru z několika stovek aminokyselin, musí být požadované informace skutečně obrovské. Je uložen (podobně jako záznam na magnetické pásce) v molekulách nukleových kyselin, které tvoří geny. Cm . též DĚDIČNÍ; NUKLEOVÉ KYSELINY.Aktivace enzymů. Polypeptidový řetězec syntetizovaný z aminokyselin není vždy protein ve své konečné podobě. Mnoho enzymů je syntetizováno nejprve jako neaktivní prekurzory a stávají se aktivními až poté, co jiný enzym odstraní několik aminokyselin na jednom konci řetězce. Některé z trávicích enzymů, jako je trypsin, jsou syntetizovány v této neaktivní formě; tyto enzymy jsou aktivovány v trávicím traktu v důsledku odstranění koncového fragmentu řetězce. Hormon inzulín, jehož molekula se v aktivní formě skládá ze dvou krátkých řetězců, je syntetizována ve formě jednoho řetězce, tzv. proinzulin. Střední část tohoto řetězce je poté odstraněna a zbývající fragmenty se spojí a vytvoří aktivní molekulu hormonu. Komplexní proteiny se tvoří až po připojení specifické chemické skupiny k proteinu a toto připojení často vyžaduje také enzym.Metabolický oběh. Po krmení zvířete aminokyselinami značenými radioaktivními izotopy uhlíku, dusíku nebo vodíku se značka rychle začlení do jeho proteinů. Pokud značené aminokyseliny přestanou vstupovat do těla, množství značeného proteinu se začne snižovat. Tyto experimenty ukazují, že výsledné proteiny se v těle neudrží až do konce života. Všechny, až na výjimky, jsou v dynamickém stavu, neustále se rozkládají na aminokyseliny a pak jsou znovu syntetizovány.Některé proteiny se při odumírání buněk rozkládají a jsou zničeny. To se děje neustále, například u červených krvinek a epiteliálních buněk lemujících vnitřní povrch střeva. Kromě toho dochází k rozkladu a resyntéze proteinů také v živých buňkách. Kupodivu se o rozkladu bílkovin ví méně než o jejich syntéze. Je však jasné, že na rozkladu se podílejí proteolytické enzymy podobné těm, které v trávicím traktu štěpí bílkoviny na aminokyseliny.
Poločas rozpadu různých proteinů se pohybuje od několika hodin po mnoho měsíců. Jedinou výjimkou je molekula kolagenu. Jakmile se vytvoří, zůstávají stabilní a nejsou obnovovány ani nahrazovány. Postupem času se však mění některé jejich vlastnosti, zejména elasticita, a protože se neobnovují, dochází k určitým změnám souvisejícím s věkem, jako je například výskyt vrásek na pokožce.
Syntetické proteiny. Chemici se již dlouho naučili polymerovat aminokyseliny, ale aminokyseliny se spojují neuspořádaným způsobem, takže produkty takové polymerace se jen málo podobají těm přírodním. Je pravda, že je možné kombinovat aminokyseliny v daném pořadí, což umožňuje získat některé biologicky aktivní proteiny, zejména inzulín. Proces je poměrně komplikovaný a tímto způsobem je možné získat pouze ty bílkoviny, jejichž molekuly obsahují asi sto aminokyselin. Místo toho je výhodné syntetizovat nebo izolovat nukleotidovou sekvenci genu odpovídající požadované aminokyselinové sekvenci a poté zavést tento gen do bakterie, která bude replikací produkovat velká množství požadovaného produktu. Tato metoda má však i své nevýhody. Cm . také GENETICKÉ INŽENÝRSTVÍ. PROTEINY A VÝŽIVA Když se bílkoviny v těle rozloží na aminokyseliny, mohou být tyto aminokyseliny znovu použity k syntéze bílkovin. Přitom samotné aminokyseliny podléhají rozkladu, takže nejsou zcela znovu využity. Je také jasné, že během růstu, těhotenství a hojení ran musí syntéza bílkovin převýšit rozklad. Tělo neustále ztrácí některé bílkoviny; Jsou to bílkoviny vlasů, nehtů a povrchové vrstvy kůže. Proto, aby mohl syntetizovat bílkoviny, musí každý organismus přijímat aminokyseliny z potravy. Zelené rostliny se syntetizují z CO 2 , voda a čpavek nebo dusičnany jsou všech 20 aminokyselin nalezených v bílkovinách. Mnoho bakterií je také schopno syntetizovat aminokyseliny v přítomnosti cukru (nebo nějakého ekvivalentu) a fixovaného dusíku, ale cukr je nakonec dodáván zelenými rostlinami. Zvířata mají omezenou schopnost syntetizovat aminokyseliny; aminokyseliny získávají konzumací zelených rostlin nebo jiných živočichů. V trávicím traktu se vstřebané bílkoviny štěpí na aminokyseliny, ty se vstřebávají a z nich se staví bílkoviny charakteristické pro daný organismus. Žádný z absorbovaných proteinů není zabudován do tělesných struktur jako takových. Jedinou výjimkou je, že u mnoha savců mohou některé mateřské protilátky procházet neporušené přes placentu do krevního oběhu plodu a prostřednictvím mateřského mléka (zejména u přežvýkavců) mohou být přeneseny na novorozence ihned po narození.Potřeba bílkovin. Je jasné, že pro udržení života musí tělo přijímat určité množství bílkovin z potravy. Rozsah této potřeby však závisí na řadě faktorů. Tělo potřebuje potravu jednak jako zdroj energie (kalorií) a jednak jako materiál pro stavbu svých struktur. Potřeba energie je na prvním místě. To znamená, že když je ve stravě málo sacharidů a tuků, dietní bílkoviny se nepoužívají pro syntézu vlastních bílkovin, ale jako zdroj kalorií. Během dlouhodobého půstu jsou dokonce vaše vlastní bílkoviny využívány k uspokojení energetických potřeb. Pokud je ve stravě dostatek sacharidů, pak lze snížit spotřebu bílkovin.Rovnováha dusíku. V průměru cca. 16 % z celkové hmotnosti bílkovin tvoří dusík. Při štěpení aminokyselin obsažených v bílkovinách se dusík, který obsahují, vylučuje z těla močí a (v menší míře) stolicí ve formě různých dusíkatých sloučenin. Pro posouzení kvality bílkovinné výživy je tedy vhodné použít indikátor jako je dusíková bilance, tzn. rozdíl (v gramech) mezi množstvím dusíku vstupujícího do těla a množstvím dusíku vyloučeného za den. Při normální výživě u dospělého jsou tato množství stejná. V rostoucím organismu je množství vyloučeného dusíku menší než množství přijatého, tzn. bilance je kladná. Pokud je ve stravě nedostatek bílkovin, je bilance negativní. Pokud je ve stravě dostatek kalorií, ale nejsou v ní žádné bílkoviny, tělo bílkovinami šetří. Současně se zpomaluje metabolismus bílkovin a opakované využití aminokyselin při syntéze bílkovin probíhá s nejvyšší možnou účinností. Ztráty jsou však nevyhnutelné a dusíkaté sloučeniny se stále vylučují močí a částečně stolicí. Množství dusíku vyloučeného z těla za den během proteinového půstu může sloužit jako měřítko denního nedostatku proteinů. Je přirozené předpokládat, že zavedením množství bílkovin odpovídající tomuto nedostatku do stravy lze obnovit dusíkovou bilanci. Nicméně není. Po přijetí tohoto množství bílkovin začne tělo využívat aminokyseliny méně efektivně, takže k obnovení dusíkové rovnováhy je potřeba nějaký další protein.Pokud množství bílkovin ve stravě překročí to, co je nezbytné pro udržení dusíkové bilance, zdá se, že k žádné škodě nedošlo. Přebytečné aminokyseliny se jednoduše používají jako zdroj energie. Zvláště nápadným příkladem je, že Eskymáci konzumují málo sacharidů a asi desetinásobek množství bílkovin potřebného k udržení dusíkové rovnováhy. Ve většině případů však použití bílkovin jako zdroje energie není výhodné, protože dané množství sacharidů může vyprodukovat mnohem více kalorií než stejné množství bílkovin. V chudých zemích lidé získávají kalorie ze sacharidů a konzumují minimální množství bílkovin.
Pokud tělo přijímá potřebný počet kalorií ve formě nebílkovinných produktů, pak minimální množství bílkovin pro zajištění udržení dusíkové bilance je cca. 30 g denně. Asi tolik bílkovin obsahují čtyři krajíce chleba nebo 0,5 litru mléka. O něco větší číslo je obvykle považováno za optimální; Doporučuje se 50 až 70 g.
Esenciální aminokyseliny. Dosud byl protein považován za celek. Mezitím, aby došlo k syntéze bílkovin, musí být v těle přítomny všechny potřebné aminokyseliny. Samotné tělo zvířete je schopno syntetizovat některé aminokyseliny. Nahraditelnými se nazývají proto, že nemusí být nutně přítomny ve stravě, důležité je pouze to, aby byl celkový přísun bílkovin jako zdroje dusíku dostatečný; pak, pokud je nedostatek neesenciálních aminokyselin, tělo je může syntetizovat na úkor těch, které jsou přítomny v nadbytku. Zbývající „esenciální“ aminokyseliny se nedají syntetizovat a musí být tělu dodány potravou. Pro člověka jsou nezbytné valin, leucin, isoleucin, threonin, methionin, fenylalanin, tryptofan, histidin, lysin a arginin. (Ačkoli se arginin může syntetizovat v těle, je klasifikován jako esenciální aminokyselina, protože u novorozenců a rostoucích dětí není produkován v dostatečném množství. Na druhou stranu se některé z těchto aminokyselin z potravy mohou stát pro dospělého nepotřebnými osoba.)Tento seznam esenciálních aminokyselin je přibližně stejný u jiných obratlovců a dokonce i hmyzu. Nutriční hodnota bílkovin se obvykle určuje jejich krmením rostoucím potkanům a sledováním přírůstku hmotnosti zvířat.
Nutriční hodnota bílkovin. Nutriční hodnota proteinu je určena esenciální aminokyselinou, která je nejvíce deficitní. Ukažme si to na příkladu. Bílkoviny v našem těle obsahují v průměru cca. 2 % tryptofanu (hmotnostní). Řekněme, že dieta obsahuje 10 g bílkovin obsahujících 1 % tryptofanu a že je v ní dostatek dalších esenciálních aminokyselin. V našem případě je 10 g této neúplné bílkoviny v podstatě ekvivalentní 5 g kompletní bílkoviny; zbývajících 5 g může sloužit pouze jako zdroj energie. Všimněte si, že vzhledem k tomu, že aminokyseliny se v těle prakticky neukládají, a aby došlo k syntéze bílkovin, musí být všechny aminokyseliny přítomny současně, lze účinek příjmu esenciálních aminokyselin zjistit pouze tehdy, pokud jsou všechny současně vstoupit do těla. Průměrné složení většiny živočišných bílkovin se blíží průměrnému složení bílkovin v lidském těle, takže je nepravděpodobné, že bychom čelili nedostatku aminokyselin, pokud je naše strava bohatá na potraviny, jako je maso, vejce, mléko a sýry. Existují však proteiny, jako je želatina (produkt denaturace kolagenu), které obsahují velmi málo esenciálních aminokyselin. Rostlinné bílkoviny, i když jsou v tomto smyslu lepší než želatina, jsou také chudé na esenciální aminokyseliny; Mají obzvláště nízký obsah lysinu a tryptofanu. Přesto nelze čistě vegetariánskou stravu vůbec považovat za škodlivou, pokud se v ní nekonzumuje o něco větší množství rostlinných bílkovin, dostatečné pro zásobení organismu esenciálními aminokyselinami. Rostliny obsahují nejvíce bílkovin ve svých semenech, zejména v semenech pšenice a různých luštěnin. Mladé výhonky, jako je chřest, jsou také bohaté na bílkoviny.Syntetické bílkoviny ve stravě. Přidáním malého množství syntetických esenciálních aminokyselin nebo proteinů bohatých na aminokyseliny k neplnohodnotným proteinům, jako jsou kukuřičné proteiny, lze výrazně zvýšit nutriční hodnotu kukuřičných proteinů, tzn. čímž se zvyšuje množství konzumovaných bílkovin. Další možností je pěstování bakterií nebo kvasinek na ropných uhlovodících s přídavkem dusičnanů nebo čpavku jako zdroje dusíku. Takto získaný mikrobiální protein může sloužit jako krmivo pro drůbež nebo hospodářská zvířata nebo může být přímo konzumován lidmi. Třetí, široce používaná metoda využívá fyziologii přežvýkavců. U přežvýkavců dochází v počáteční části žaludku k tzv. V bachoru žijí speciální formy bakterií a prvoků, které přeměňují neúplné rostlinné bílkoviny na úplnější mikrobiální bílkoviny a ty se zase po trávení a vstřebání mění na bílkoviny živočišné. Močovina, levná syntetická sloučenina obsahující dusík, se může přidávat do krmiva pro hospodářská zvířata. Mikroorganismy žijící v bachoru využívají močovinový dusík k přeměně sacharidů (kterých je v krmivu mnohem více) na bílkoviny. Asi třetina veškerého dusíku v krmivu pro hospodářská zvířata může pocházet ve formě močoviny, což v podstatě do určité míry znamená chemickou syntézu bílkovin. V USA hraje tato metoda důležitou roli jako jeden ze způsobů získávání bílkovin.LITERATURA Murray R., Grenner D., Mayes P., Rodwell W. Lidská biochemie, sv. 12. M., 1993Alberts B, Bray D, Lewis J a kol. Molekulární buněčná biologie, sv. 13. M., 1994
Vstupenka 2. 1. Esenciální nutriční faktory lipidové povahy. Některé lipidy nejsou v lidském těle syntetizovány, a jsou proto nezbytnými nutričními faktory. Patří sem mastné kyseliny se dvěma nebo více dvojnými vazbami (polyen) - esenciální mastné kyseliny. Některé z těchto kyselin jsou substráty pro syntézu lokálních hormonů – eikosanoidů (téma 8.10).
Vitamíny rozpustné v tucích vykonávat různé funkce: vitamín A podílí se na procesu vidění, stejně jako na růstu a diferenciaci buněk; byla prokázána jeho schopnost inhibovat růst určitých typů nádorů; vitamín K podílí se na srážení krve; Vitamín D podílí se na regulaci metabolismu vápníku; vitamín E- antioxidant, inhibuje tvorbu volných radikálů a působí tak proti poškození buněk v důsledku peroxidace lipidů.
Dokument
2.Struktura a úrovně strukturní organizace proteinů
Existují čtyři úrovně strukturní organizace proteinů: primární, sekundární, terciární a kvartérní. Každá úroveň má své vlastní charakteristiky.
Primární proteinová struktura
Primární strukturou proteinů je lineární polypeptidový řetězec aminokyselin spojených peptidovými vazbami. Primární struktura je nejjednodušší úrovní strukturní organizace molekuly proteinu. Vysoká stabilita je dána kovalentními peptidovými vazbami mezi α-aminoskupinou jedné aminokyseliny a α-karboxylovou skupinou jiné aminokyseliny. [ukázat].
Pokud se iminoskupina prolinu nebo hydroxyprolinu účastní tvorby peptidové vazby, pak má jinou formu [ukázat].
Když se v buňkách vytvoří peptidové vazby, nejprve se aktivuje karboxylová skupina jedné aminokyseliny a poté se spojí s aminoskupinou jiné. Laboratorní syntéza polypeptidů se provádí přibližně stejným způsobem.
Peptidová vazba je opakující se fragment polypeptidového řetězce. Má řadu vlastností, které ovlivňují nejen tvar primární struktury, ale také vyšší úrovně organizace polypeptidového řetězce:

koplanarita - všechny atomy zahrnuté v peptidové skupině jsou ve stejné rovině;
schopnost existovat ve dvou rezonančních formách (keto nebo enol forma);
trans polohu substituentů vzhledem k vazbě C-N;
schopnost tvořit vodíkové vazby a každá z peptidových skupin může tvořit dvě vodíkové vazby s jinými skupinami, včetně peptidových.
Výjimkou jsou peptidové skupiny zahrnující aminoskupinu prolinu nebo hydroxyprolinu. Jsou schopny vytvořit pouze jednu vodíkovou vazbu (viz výše). To ovlivňuje tvorbu sekundární struktury proteinu. Polypeptidový řetězec v oblasti, kde se nachází prolin nebo hydroxyprolin, se snadno ohýbá, protože není jako obvykle držen druhou vodíkovou vazbou.
Názvosloví peptidů a polypeptidů. Název peptidů se skládá z názvů jejich aminokyselin. Dvě aminokyseliny tvoří dipeptid, tři tvoří tripeptid, čtyři tvoří tetrapeptid atd. Každý peptidový nebo polypeptidový řetězec jakékoli délky má N-koncovou aminokyselinu obsahující volnou aminoskupinu a C-koncovou aminokyselinu obsahující volný karboxyl skupina. Při pojmenovávání polypeptidů jsou všechny aminokyseliny uvedeny postupně, počínaje N-koncovou, přičemž v jejich jménech, s výjimkou C-koncového, se nahradí přípona -in za -yl (protože aminokyseliny v peptidech již nemají karboxylová skupina, ale karbonylová). Například název uvedený na Obr. 1 tripeptid - leuk bahno fenylalanu bahno threon v.
Vlastnosti primární struktury proteinu. V páteři polypeptidového řetězce se rigidní struktury (ploché peptidové skupiny) střídají s relativně mobilními oblastmi (-CHR), které jsou schopné rotace kolem vazeb. Takové strukturní rysy polypeptidového řetězce ovlivňují jeho prostorové uspořádání.
Sekundární struktura proteinu
Sekundární struktura je způsob skládání polypeptidového řetězce do uspořádané struktury v důsledku tvorby vodíkových vazeb mezi peptidovými skupinami stejného řetězce nebo sousedních polypeptidových řetězců. Sekundární struktury se podle konfigurace dělí na šroubovité (α-helix) a vrstvené složené (β-struktura a křížová β-forma).


a-Helix. Jedná se o typ sekundární proteinové struktury, která vypadá jako pravidelná šroubovice, vytvořená díky interpeptidovým vodíkovým můstkům v rámci jednoho polypeptidového řetězce. Model struktury α-helixu (obr. 2), který zohledňuje všechny vlastnosti peptidové vazby, navrhli Pauling a Corey. Hlavní vlastnosti α-helixu:
helikální konfigurace polypeptidového řetězce mající helikální symetrii;
vytvoření vodíkových vazeb mezi peptidovými skupinami každého prvního a čtvrtého aminokyselinového zbytku;
pravidelnost spirálových závitů;
ekvivalence všech aminokyselinových zbytků v a-helixu, bez ohledu na strukturu jejich postranních radikálů;
postranní radikály aminokyselin se na tvorbě α-helixu nepodílejí.
Navenek vypadá α-helix jako mírně natažená spirála elektrického sporáku. Pravidelnost vodíkových vazeb mezi první a čtvrtou peptidovou skupinou určuje pravidelnost obratů polypeptidového řetězce. Výška jedné otáčky neboli stoupání α-šroubovice je 0,54 nm; zahrnuje 3,6 aminokyselinových zbytků, tj. každý aminokyselinový zbytek se pohybuje podél osy (výška jednoho aminokyselinového zbytku) o 0,15 nm (0,54:3,6 = 0,15 nm), což nám umožňuje mluvit o ekvivalenci všech aminokyselinových zbytků v α-šroubovici. Perioda pravidelnosti α-šroubovice je 5 závitů nebo 18 aminokyselinových zbytků; délka jedné periody je 2,7 nm. Rýže. 3. Pauling-Coreyův a-helixový model
β-Struktura. Jedná se o typ sekundární struktury, která má mírně zakřivenou konfiguraci polypeptidového řetězce a je tvořena interpeptidovými vodíkovými vazbami v rámci jednotlivých úseků jednoho polypeptidového řetězce nebo sousedních polypeptidových řetězců. Nazývá se také vrstvená struktura. Existují různé β-struktury. Omezené vrstvené oblasti tvořené jedním polypeptidovým řetězcem proteinu se nazývají cross-β forma (krátká β struktura). Mezi peptidovými skupinami smyček polypeptidového řetězce se tvoří vodíkové vazby ve formě cross-β. Další typ - kompletní β-struktura - je charakteristický pro celý polypeptidový řetězec, který má protáhlý tvar a je držen interpeptidovými vodíkovými vazbami mezi sousedními paralelními polypeptidovými řetězci (obr. 3). Tato struktura připomíná měchy akordeonu. Navíc jsou možné varianty β-struktur: mohou být tvořeny paralelními řetězci (N-terminální konce polypeptidových řetězců jsou nasměrovány stejným směrem) a antiparalelními (N-terminální konce jsou směrovány různými směry). Postranní radikály jedné vrstvy jsou umístěny mezi postranní radikály další vrstvy.
V proteinech jsou možné přechody z α-struktur na β-struktury a zpět díky přeskupení vodíkových vazeb. Namísto pravidelných interpeptidových vodíkových vazeb podél řetězce (díky kterým je polypeptidový řetězec stočen do spirály) se odvíjí šroubovicové úseky a uzavírají se vodíkové vazby mezi prodlouženými fragmenty polypeptidových řetězců. Tento přechod se nachází v keratinu, proteinu vlasů. Při mytí vlasů alkalickými detergenty se šroubovitá struktura β-keratinu snadno ničí a mění se na α-keratin (kudrnaté vlasy se narovnávají).
Destrukce pravidelných sekundárních struktur proteinů (α-helixy a β-struktury) analogicky s táním krystalu se nazývá „tavení“ polypeptidů. V tomto případě jsou vodíkové vazby přerušeny a polypeptidové řetězce mají formu náhodné spleti. V důsledku toho je stabilita sekundárních struktur určena interpeptidovými vodíkovými vazbami. Jiné typy vazeb se na tom téměř nepodílejí, s výjimkou disulfidových vazeb podél polypeptidového řetězce v místech cysteinových zbytků. Krátké peptidy jsou uzavřeny do cyklů díky disulfidovým vazbám. Mnoho proteinů obsahuje jak α-helikální oblasti, tak β-struktury. Neexistují téměř žádné přírodní proteiny skládající se ze 100% α-helixu (výjimkou je paramyosin, svalový protein, který je z 96-100% α-helix), zatímco syntetické polypeptidy mají 100% helix.
Jiné proteiny mají různý stupeň svinutí. Vysoká frekvence α-helikálních struktur je pozorována u paramyosinu, myoglobinu a hemoglobinu. Naproti tomu u trypsinu, ribonukleázy, je významná část polypeptidového řetězce složena do vrstvených β-struktur. Proteiny podpůrných tkání: keratin (protein vlasů, vlny), kolagen (protein šlach, kůže), fibroin (protein přírodního hedvábí) mají β-konfiguraci polypeptidových řetězců. Různé stupně helicity polypeptidových řetězců proteinů naznačují, že zjevně existují síly, které částečně narušují helicitu nebo „rozbijí“ pravidelné skládání polypeptidového řetězce. Důvodem je kompaktnější skládání proteinového polypeptidového řetězce v určitém objemu, tj. do terciární struktury.
Terciární struktura proteinu
Terciární struktura proteinu je způsob, jakým je polypeptidový řetězec uspořádán v prostoru. Podle tvaru terciární struktury se proteiny dělí především na globulární a fibrilární. Globulární proteiny mají nejčastěji elipsoidní tvar a fibrilární (vláknité) proteiny mají protáhlý tvar (tvar tyčinky nebo vřetena).
Konfigurace terciární struktury proteinů však zatím nedává důvod se domnívat, že fibrilární proteiny mají pouze β-strukturu a globulární proteiny mají α-helikální strukturu. Existují fibrilární proteiny, které mají spirálovitou, spíše než vrstvenou, složenou sekundární strukturu. Například α-keratin a paramyosin (protein obturátorového svalu měkkýšů), tropomyosiny (proteiny kosterních svalů) patří k fibrilárním proteinům (mají tyčinkový tvar) a jejich sekundární strukturou je α-helix; naproti tomu globulární proteiny mohou obsahovat velké množství β-struktur.
Spiralizace lineárního polypeptidového řetězce snižuje jeho velikost přibližně 4krát; a zabalením do terciární struktury je desetkrát kompaktnější než původní řetězec.
Vazby, které stabilizují terciární strukturu proteinu. Vazby mezi postranními radikály aminokyselin hrají roli při stabilizaci terciární struktury. Tato spojení lze rozdělit na:
silný (kovalentní) [ukázat].
slabý (polární a van der Waals) [ukázat].
Četné vazby mezi postranními radikály aminokyselin určují prostorovou konfiguraci molekuly proteinu.
Vlastnosti organizace terciární struktury bílkovin. Konformace terciární struktury polypeptidového řetězce je dána vlastnostmi postranních radikálů v něm obsažených aminokyselin (které nemají znatelný vliv na tvorbu primárních a sekundárních struktur) a mikroprostředí, tj. životní prostředí. Když je polypeptidový řetězec proteinu složen, má tendenci nabývat energeticky příznivé formy, vyznačující se minimem volné energie. Nepolární R-skupiny, „vyhýbající se“ vodě, tedy tvoří jakoby vnitřní část terciární struktury proteinu, kde se nachází hlavní část hydrofobních zbytků polypeptidového řetězce. Ve středu proteinové globule nejsou téměř žádné molekuly vody. Polární (hydrofilní) R skupiny aminokyseliny se nacházejí mimo toto hydrofobní jádro a jsou obklopeny molekulami vody. Polypeptidový řetězec je složitě ohnut v trojrozměrném prostoru. Když se ohne, sekundární šroubovitá konformace je narušena. Řetězec se „láme“ na slabých místech, kde se nachází prolin nebo hydroxyprolin, protože tyto aminokyseliny jsou v řetězci pohyblivější a tvoří pouze jednu vodíkovou vazbu s jinými peptidovými skupinami. Dalším místem ohybu je glycin, který má malou skupinu R (vodík). Proto R-skupiny jiných aminokyselin, když jsou naskládány, mají tendenci zabírat volný prostor v místě glycinu. Řada aminokyselin - alanin, leucin, glutamát, histidin - přispívá k zachování stabilních šroubovicových struktur v proteinu a jako methionin, valin, isoleucin, kyselina asparagová podporují tvorbu β-struktur. V molekule proteinu s terciární konfigurací jsou oblasti ve formě α-helixů (helikální), β-struktur (vrstevnaté) a náhodného klubka. Pouze správné prostorové uspořádání proteinu jej činí aktivním; jeho porušení vede ke změnám vlastností bílkovin a ztrátě biologické aktivity.
Kvartérní proteinová struktura
Proteiny skládající se z jednoho polypeptidového řetězce mají pouze terciární strukturu. Patří mezi ně myoglobin – protein svalové tkáně podílející se na vazbě kyslíku, řada enzymů (lysozym, pepsin, trypsin aj.). Některé proteiny jsou však vytvořeny z několika polypeptidových řetězců, z nichž každý má terciární strukturu. Pro takové proteiny byl zaveden koncept kvartérní struktury, což je organizace několika polypeptidových řetězců s terciární strukturou do jediné funkční molekuly proteinu. Takový protein s kvartérní strukturou se nazývá oligomer a jeho polypeptidové řetězce s terciární strukturou se nazývají protomery nebo podjednotky (obr. 4).

Na kvartérní úrovni organizace si proteiny zachovávají základní konfiguraci terciární struktury (globulární nebo fibrilární). Například hemoglobin je protein s kvartérní strukturou a skládá se ze čtyř podjednotek. Každá z podjednotek je globulární protein a obecně hemoglobin má také globulární konfiguraci. Vlasové a vlněné proteiny - keratiny, příbuzné terciární strukturou fibrilárním proteinům, mají fibrilární konformaci a kvartérní strukturu.
Stabilizace kvartérní struktury proteinu. Všechny proteiny, které mají kvartérní strukturu, jsou izolovány ve formě jednotlivých makromolekul, které se nerozpadají na podjednotky. Kontakty mezi povrchy podjednotek jsou možné pouze díky polárním skupinám aminokyselinových zbytků, protože při tvorbě terciární struktury každého z polypeptidových řetězců se postranní radikály nepolárních aminokyselin (které tvoří většinu všechny proteinogenní aminokyseliny) jsou skryty uvnitř podjednotky. Mezi jejich polárními skupinami vznikají četné iontové (sůl), vodíkové a v některých případech i disulfidické vazby, které pevně drží podjednotky ve formě organizovaného komplexu. Použití látek, které ruší vodíkové vazby nebo látek, které redukují disulfidové můstky, způsobuje desagregaci protomerů a destrukci kvartérní struktury proteinu. V tabulce 1 shrnuje údaje o vazbách, které stabilizují různé úrovně organizace molekuly proteinu [ukázat].
Vlastnosti strukturní organizace některých fibrilárních proteinů
Strukturní organizace fibrilárních proteinů má ve srovnání s globulárními proteiny řadu znaků. Tyto vlastnosti lze vidět na příkladu keratinu, fibroinu a kolagenu. Keratiny existují v α- a β-konformacích. α-Keratiny a fibroin mají vrstveně složenou sekundární strukturu, avšak u keratinu jsou řetězce paralelní au fibroinu jsou antiparalelní (viz obr. 3); Keratin navíc obsahuje meziřetězcové disulfidové vazby, zatímco fibroin je nemá. Rozbití disulfidových vazeb vede k oddělení polypeptidových řetězců v keratinech. Naopak vytvoření maximálního počtu disulfidických vazeb v keratinech působením oxidačních činidel vytváří silnou prostorovou strukturu. Obecně platí, že u fibrilárních proteinů, na rozdíl od globulárních proteinů, je někdy obtížné striktně rozlišovat mezi různými úrovněmi organizace. Pokud připustíme (jako u globulárního proteinu), že terciární struktura by měla být tvořena položením jednoho polypeptidového řetězce v prostoru a kvartérní struktura několika řetězci, pak ve fibrilárních proteinech je více polypeptidových řetězců zapojeno již při tvorbě sekundární struktury. . Typickým příkladem fibrilárního proteinu je kolagen, který je jedním z nejhojnějších proteinů v lidském těle (asi 1/3 hmotnosti všech proteinů). Nachází se v tkáních, které mají vysokou pevnost a nízkou roztažitelnost (kosti, šlachy, kůže, zuby atd.). V kolagenu tvoří třetinu aminokyselinových zbytků glycin a asi čtvrtinu nebo o něco více prolin nebo hydroxyprolin.

Izolovaný polypeptidový řetězec kolagenu (primární struktura) vypadá jako přerušovaná čára. Obsahuje asi 1000 aminokyselin a má molekulovou hmotnost asi 10 5 (obr. 5, a, b). Polypeptidový řetězec je sestaven z opakujícího se tria aminokyselin (tripletu) následujícího složení: gly-A-B, kde A a B jsou libovolné aminokyseliny jiné než glycin (nejčastěji prolin a hydroxyprolin). Kolagenové polypeptidové řetězce (neboli α-řetězce) při tvorbě sekundárních a terciárních struktur (obr. 5, c a d) nemohou produkovat typické α-helixy se šroubovicovou symetrií. Prolin, hydroxyprolin a glycin (antihelikální aminokyseliny) s tím interferují. Proto tři α-řetězce tvoří jakoby zakroucené spirály, jako tři nitě ovíjející se kolem válce. Tři šroubovicové α řetězce tvoří opakující se kolagenovou strukturu zvanou tropokolagen (obr. 5d). Tropokolagen je ve své organizaci terciární strukturou kolagenu. Ploché prstence prolinu a hydroxyprolinu, které se pravidelně střídají podél řetězce, mu dodávají tuhost, stejně jako meziřetězcové vazby mezi a-řetězci tropokolagenu (proto je kolagen odolný vůči natahování). Tropokolagen je v podstatě podjednotka kolagenových fibril. Ukládání podjednotek tropokolagenu do kvartérní struktury kolagenu probíhá stupňovitě (obr. 5e).
Ke stabilizaci kolagenových struktur dochází díky meziřetězcovým vodíkovým, iontovým a van der Waalsovým vazbám a malému počtu kovalentních vazeb.
α-řetězce kolagenu mají různé chemické struktury. Existují různé typy řetězců α 1 (I, II, III, IV) a řetězců α 2. Podle toho, které α 1 - a α 2 - řetězce se podílejí na tvorbě třívláknové šroubovice tropokolagenu, se rozlišují čtyři typy kolagenu:
první typ - dva α 1 (I) a jeden α 2 řetězec;
druhý typ - tři α 1 (II) řetězce;
třetí typ - tři α 1 (III) řetězce;
čtvrtý typ - tři α 1 (IV) řetězce.
Nejběžnější kolagen je prvního typu: nachází se v kostní tkáni, kůži, šlachách; kolagen typu 2 se nachází v tkáni chrupavky atd. Jeden typ tkáně může obsahovat různé typy kolagenu.
Uspořádaná agregace kolagenových struktur, jejich tuhost a inertnost zajišťují vysokou pevnost kolagenových vláken. Kolagenní proteiny obsahují i sacharidové složky, tedy jde o protein-sacharidové komplexy.
Kolagen je extracelulární protein, který je tvořen buňkami pojivové tkáně nacházejícími se ve všech orgánech. Proto při poškození kolagenu (nebo narušení jeho tvorby) dochází k mnohočetnému porušení podpůrných funkcí pojivové tkáně orgánů.
Alfa polypeptidový řetězec končí kombinací aminokyselin valin-leucin a beta polypeptidový řetězec končí kombinací valin-histidin-leucin. Alfa a beta polypeptidové řetězce v molekule hemoglobinu nejsou uspořádány lineárně, to je primární struktura. V důsledku existence intramolekulárních sil jsou polypeptidové řetězce stočeny do podoby spirály alfa-helix (sekundární struktura) typické pro proteiny. Samotná šroubovice alfa-helix se prostorově ohýbá pro každý alfa a beta polypeptidový řetězec a vytváří plexy vejčitého tvaru (terciární struktura). Jednotlivé části alfa-helixových helixů polypeptidových řetězců jsou označeny latinskými písmeny od A do H. Všechny čtyři terciární zakřivené alfa a beta polypeptidové řetězce jsou umístěny prostorově v určitém vztahu - kvartérní struktuře. Jsou spojeny nikoli skutečnými chemickými vazbami, ale mezimolekulárními silami.
Ukázalo se, že člověk má tři hlavní typy normálního hemoglobinu: embryonální - U, fetální - F a dospělý hemoglobin - A. HbU (pojmenovaný podle počátečního písmene slova děloha) se vyskytuje v embryu mezi 7. a 12. týdnem života, pak mizí a objevuje se fetální hemoglobin, který je po třetím měsíci hlavním hemoglobinem plodu. Následně se postupně objevuje běžný dospělý hemoglobin, nazývaný HbA, podle počátečního písmene anglického slova „adult“. Množství fetálního hemoglobinu postupně klesá, takže v okamžiku narození je 80 % hemoglobinu HbA a pouze 20 % HbF. Po narození se fetální hemoglobin dále snižuje a do 2–3 let života je to pouze 1–2 %. Stejné množství fetálního hemoglobinu je u dospělého. Množství HbF přesahující 2 % je považováno za patologické pro dospělého a pro děti starší 3 let.
Kromě normálních typů hemoglobinu je v současnosti známo přes 50 patologických variant. Nejprve byly pojmenovány latinskými písmeny. Písmeno B v označení typů hemoglobinu chybí, protože původně označovalo HbS.
Hemoglobin (Hb)- chromoprotein přítomný v červených krvinkách a podílející se na transportu kyslíku do tkání. Hemoglobin u dospělých se nazývá hemoglobin A (Hb A). Jeho molekulová hmotnost je asi 65 000 Da. Molekula Hb A má kvartérní strukturu a zahrnuje čtyři podjednotky - polypeptidové řetězce (označené α1, α2, β1 a β2, z nichž každá je spojena s hemem.
Pamatujte, že hemoglobin je alosterický protein, jehož molekuly se mohou reverzibilně měnit z jedné konformace do druhé. To mění afinitu proteinu k ligandům. Konformace s nejmenší afinitou k ligandu se nazývá napjatá nebo T-konformace. Konformace s největší afinitou k ligandu se nazývá uvolněná nebo R-konformace.
R- a T-konformace molekuly hemoglobinu jsou ve stavu dynamické rovnováhy:
Různé faktory prostředí mohou posunout tuto rovnováhu jedním nebo druhým směrem. Allosterické regulátory ovlivňující afinitu Hb k O2 jsou: 1) kyslík; 2) koncentrace H+ (střední pH); 3) oxid uhličitý (CO2); 4) 2,3-difosfoglycerát (DPG). Připojení molekuly kyslíku k jedné z podjednotek hemoglobinu podporuje přechod napjaté konformace do uvolněné a zvyšuje afinitu ke kyslíku ostatních podjednotek stejné molekuly hemoglobinu. Tento jev se nazývá kooperativní efekt. Komplexní charakter vazby hemoglobinu na kyslík odráží křivka saturace hemoglobinu O2, která má tvar S (obrázek 3.1).

Obrázek 3.1. Křivky saturace myoglobinu (1) a hemoglobinu (2) kyslíkem.
Molekulární formy hemoglobin se od sebe liší strukturou polypeptidových řetězců. Příkladem takového množství hemoglobinu, který existuje za fyziologických podmínek, je fetální hemoglobin (HbF), přítomný v krvi během embryonálního stádia lidského vývoje. Na rozdíl od HbA obsahuje jeho molekula 2 α- a 2 γ-řetězce (to znamená, že β-řetězce jsou nahrazeny γ-řetězci). Takový hemoglobin má vyšší afinitu ke kyslíku. Právě to umožňuje embryu přijímat kyslík z krve matky přes placentu. Brzy po narození je HbF v krvi dítěte nahrazen HbA.
Příkladem abnormálního nebo patologického hemoglobinu je již zmíněný (viz 2.4.) hemoglobin S, vyskytující se u pacientů se srpkovitou anémií. Jak již víte, liší se od hemoglobinu A nahrazením glutamátu valinem v β-řetězcích. Tato substituce aminokyselin způsobuje snížení rozpustnosti HbS ve vodě a snížení jeho afinity k O2.
Jak víte, bílkoviny jsou základem pro vznik života na naší planetě. Ale byla to kapička koacervátu skládající se z molekul peptidů, která se stala základem pro vznik živých tvorů. To je nepochybné, protože analýza vnitřního složení jakéhokoli zástupce biomasy ukazuje, že tyto látky jsou přítomny ve všem: rostlinách, zvířatech, mikroorganismech, houbách, virech. Navíc jsou velmi rozmanité a makromolekulární povahy.
Tyto struktury mají čtyři názvy, všechny jsou synonyma:
- proteiny;
- proteiny;
- polypeptidy;
- peptidy.
Molekuly bílkovin
Jejich počet je skutečně nespočet. V tomto případě lze všechny proteinové molekuly rozdělit do dvou velkých skupin:
- jednoduché - skládají se pouze z aminokyselinových sekvencí spojených peptidovými vazbami;
- komplex - struktura a struktura proteinu jsou charakterizovány dalšími protolytickými (prostetickými) skupinami, nazývanými také kofaktory.
Složité molekuly mají zároveň svou vlastní klasifikaci.
Gradace komplexních peptidů
- Glykoproteiny jsou blízce příbuzné sloučeniny bílkovin a sacharidů. Protetické skupiny mukopolysacharidů jsou vetkány do struktury molekuly.
- Lipoproteiny jsou komplexní sloučeninou bílkovin a lipidů.
- Metaloproteiny - kovové ionty (železo, mangan, měď a další) působí jako protetická skupina.
- Nukleoproteiny jsou spojením mezi proteinem a nukleovými kyselinami (DNA, RNA).
- Fosfoproteiny - konformace proteinu a zbytku kyseliny ortofosforečné.
- Chromoproteiny jsou velmi podobné metaloproteinům, avšak prvkem, který je součástí protetické skupiny, je celý barevný komplex (červená - hemoglobin, zelená - chlorofyl atd.).
V každé uvažované skupině se struktura a vlastnosti proteinů liší. Funkce, které vykonávají, se také liší v závislosti na typu molekuly.

Chemická struktura proteinů
Z tohoto pohledu jsou proteiny dlouhým masivním řetězcem aminokyselinových zbytků spojených navzájem specifickými vazbami nazývanými peptidové vazby. Větve nazývané radikály se rozkládají z postranních struktur kyselin. Tuto molekulární strukturu objevil E. Fischer na počátku 21. století.
Později byly proteiny, struktura a funkce proteinů studovány podrobněji. Bylo jasné, že existuje pouze 20 aminokyselin, které tvoří strukturu peptidu, ale mohou být kombinovány různými způsoby. Proto rozmanitost polypeptidových struktur. Kromě toho jsou proteiny v procesu života a při plnění svých funkcí schopny podstoupit řadu chemických přeměn. V důsledku toho změní strukturu a objeví se zcela nový typ připojení.
K přerušení peptidové vazby, tedy k narušení proteinu a struktury řetězců, je potřeba zvolit velmi přísné podmínky (vysoké teploty, kyseliny nebo zásady, katalyzátor). To je způsobeno vysokou pevností v molekule, konkrétně ve skupině peptidů.

Detekce proteinové struktury v laboratoři se provádí pomocí biuretové reakce - expozice čerstvě vysráženému polypeptidu (II). Komplex peptidové skupiny a iontu mědi dává jasně fialovou barvu.
Existují čtyři hlavní strukturní organizace, z nichž každá má své vlastní strukturální rysy proteinů.
Úrovně organizace: primární struktura
Jak je uvedeno výše, peptid je sekvence aminokyselinových zbytků s nebo bez inkluzí, koenzymů. Primární je tedy struktura molekuly, která je přírodní, přírodní, skutečně aminokyseliny spojené peptidovými vazbami a nic víc. Tedy polypeptid s lineární strukturou. Kromě toho strukturální rysy proteinů tohoto typu spočívají v tom, že taková kombinace kyselin je rozhodující pro plnění funkcí molekuly proteinu. Díky přítomnosti těchto znaků je možné peptid nejen identifikovat, ale také předpovědět vlastnosti a roli zcela nového, dosud neobjeveného. Příklady peptidů s přirozenou primární strukturou jsou inzulín, pepsin, chymotrypsin a další.

Sekundární konformace
Struktura a vlastnosti proteinů v této kategorii se poněkud liší. Taková struktura může být původně vytvořena přírodou nebo když je primární struktura vystavena silné hydrolýze, teplotě nebo jiným podmínkám.
Tato konformace má tři odrůdy:
- Hladké, pravidelné, stereopravidelné obraty, postavené z aminokyselinových zbytků, které se stáčejí kolem hlavní osy spojení. Pohromadě je drží pouze ty, které vznikají mezi kyslíkem jedné peptidové skupiny a vodíkem druhé. Navíc je struktura považována za správnou díky skutečnosti, že otáčky se rovnoměrně opakují každé 4 články. Taková struktura může být levotočivá nebo pravotočivá. Ale ve většině známých proteinů převládá pravotočivý izomer. Takové konformace se obvykle nazývají alfa struktury.
- Složení a struktura proteinů dalšího typu se liší od předchozího v tom, že vodíkové vazby se nevytvářejí mezi zbytky sousedícími s jednou stranou molekuly, ale mezi výrazně vzdálenými a v poměrně velké vzdálenosti. Z tohoto důvodu má celá struktura podobu několika zvlněných, hadovitých polypeptidových řetězců. Existuje jedna vlastnost, kterou musí protein vykazovat. Struktura aminokyselin na větvích by měla být co nejkratší, jako je například glycin nebo alanin. Tento typ sekundární konformace se nazývá beta listy pro jejich schopnost slepit se a vytvořit společnou strukturu.
- Biologie označuje třetí typ proteinové struktury jako komplexní, heterogenně rozptýlené, neuspořádané fragmenty, které nemají stereoregularitu a jsou schopny měnit strukturu vlivem vnějších podmínek.
Nebyly identifikovány žádné příklady proteinů, které mají přirozeně sekundární strukturu.

Terciární vzdělávání
Jedná se o poměrně složitou konformaci nazývanou „globule“. Co je to za protein? Jeho struktura je založena na sekundární struktuře, přidávají se však nové typy interakcí mezi atomy skupin a celá molekula se jakoby složí, čímž se soustředí na skutečnost, že hydrofilní skupiny směřují do globule a hydrofobní ty směrem ven.
To vysvětluje náboj molekuly proteinu v koloidních roztocích vody. Jaké typy interakcí jsou zde přítomny?
- Vodíkové vazby – zůstávají nezměněny mezi stejnými částmi jako v sekundární struktuře.
- interakce – nastávají, když je polypeptid rozpuštěn ve vodě.
- Iontové přitažlivosti se tvoří mezi různě nabitými skupinami aminokyselinových zbytků (radikálů).
- Kovalentní interakce - mohou se tvořit mezi specifickými kyselými místy - cysteinovými molekulami, nebo spíše jejich ocasy.
Složení a strukturu proteinů s terciární strukturou lze tedy popsat jako polypeptidové řetězce složené do globulí, které si zachovávají a stabilizují svou konformaci díky různým typům chemických interakcí. Příklady takových peptidů: fosfoglycerát kenáza, tRNA, alfa-keratin, hedvábný fibroin a další.
Kvartérní struktura
Jedná se o jednu z nejsložitějších globulí, které tvoří proteiny. Struktura a funkce proteinů tohoto typu jsou velmi mnohostranné a specifické.
Jaká je tato konformace? Jedná se o několik (v některých případech desítky) velkých a malých polypeptidových řetězců, které se tvoří nezávisle na sobě. Ale pak, v důsledku stejných interakcí, které jsme uvažovali pro terciární strukturu, se všechny tyto peptidy stáčejí a vzájemně proplétají. Tímto způsobem se získají komplexní konformační globule, které mohou obsahovat atomy kovů, lipidové skupiny a sacharidy. Příklady takových proteinů: DNA polymeráza, proteinový obal tabákového viru, hemoglobin a další.

Všechny námi zkoumané peptidové struktury mají své vlastní metody laboratorní identifikace založené na moderních možnostech použití chromatografie, centrifugace, elektronové a optické mikroskopie a špičkových počítačových technologií.
Provedené funkce
Struktura a funkce proteinů spolu úzce korelují. To znamená, že každý peptid hraje specifickou roli, jedinečnou a specifickou. Existují také takové, které jsou schopny provádět několik významných operací najednou v jedné živé buňce. Je však možné vyjádřit v zobecněné formě hlavní funkce molekul bílkovin v živých organismech:
- Poskytování pohybu. Jednobuněčné organismy nebo organely nebo některé typy buněk jsou schopné pohybu, kontrakce a pohybu. To zajišťují proteiny, které tvoří strukturu jejich motorického aparátu: řasinky, bičíky a cytoplazmatickou membránu. Pokud mluvíme o buňkách neschopných pohybu, pak k jejich kontrakci mohou přispívat bílkoviny (svalový myosin).
- Nutriční nebo rezervní funkce. Jde o hromadění molekul bílkovin ve vejcích, embryích a semenech rostlin za účelem dalšího doplňování chybějících živin. Při rozkladu peptidy produkují aminokyseliny a biologicky aktivní látky, které jsou nezbytné pro normální vývoj živých organismů.
- Energetická funkce. Kromě sacharidů mohou tělu dodat sílu i bílkoviny. Rozpadem 1 g peptidu se uvolní 17,6 kJ užitečné energie ve formě kyseliny adenosintrifosforečné (ATP), která se vynakládá na životně důležité procesy.
- Signalizace spočívá v pečlivém sledování probíhajících procesů a přenášení signálů z buněk do tkání, z nich do orgánů, z těchto do systémů a tak dále. Typickým příkladem je inzulín, který striktně fixuje množství glukózy v krvi.
- Funkce receptoru. Provádí se změnou konformace peptidu na jedné straně membrány a zapojením druhého konce do restrukturalizace. Současně se přenáší signál a potřebné informace. Nejčastěji jsou takové proteiny zabudovány do cytoplazmatických membrán buněk a vykonávají přísnou kontrolu nad všemi látkami, které přes ně procházejí. Poskytují také informace o chemických a fyzikálních změnách v prostředí.
- Transportní funkce peptidů. Je prováděna kanálovými proteiny a transportními proteiny. Jejich role je zřejmá - transport potřebných molekul do míst s nízkou koncentrací z částí s vysokou koncentrací. Typickým příkladem je transport kyslíku a oxidu uhličitého přes orgány a tkáně proteinem hemoglobinem. Provádějí také dodávku sloučenin s nízkou molekulovou hmotností přes buněčnou membránu do nitra.
- Strukturální funkce. Jedna z nejdůležitějších funkcí, kterou plní protein. Strukturu všech buněk a jejich organel zajišťují peptidy. Jako rám nastavují tvar a strukturu. Navíc ji podporují a v případě potřeby upravují. Proto všechny živé organismy potřebují pro svůj růst a vývoj bílkoviny ve své stravě. Mezi takové peptidy patří elastin, tubulin, kolagen, aktin, keratin a další.
- Katalytická funkce. Provádějí ho enzymy. Četné a rozmanité urychlují všechny chemické a biochemické reakce v těle. Bez jejich účasti by obyčejné jablko v žaludku mohlo být stráveno za pouhé dva dny, s největší pravděpodobností při tom hnijící. Pod vlivem katalázy, peroxidázy a dalších enzymů k tomuto procesu dochází za dvě hodiny. Obecně platí, že právě díky této roli proteinů probíhá anabolismus a katabolismus, tedy plasty a

Ochranná role
Existuje několik typů hrozeb, před kterými jsou proteiny určeny k ochraně těla.
Za prvé, traumatická činidla, plyny, molekuly, látky různého spektra účinku. Peptidy jsou schopny s nimi chemicky interagovat, převádět je do neškodné formy nebo je jednoduše neutralizovat.
Za druhé fyzické ohrožení ranami – pokud se protein fibrinogen v místě poranění včas nepřemění na fibrin, krev se nesrazí, tedy nedojde k zablokování. Pak budete naopak potřebovat peptidový plazmin, který dokáže sraženinu rozpustit a obnovit průchodnost cévy.
Za třetí, ohrožení imunity. Struktura a význam proteinů, které tvoří imunitní obranu, jsou nesmírně důležité. Protilátky, imunoglobuliny, interferony – to vše jsou důležité a významné prvky lidského lymfatického a imunitního systému. Jakákoli cizí částice, škodlivá molekula, odumřelá část buňky nebo celá struktura je předmětem okamžitého zkoumání peptidovou sloučeninou. To je důvod, proč se člověk může nezávisle, bez pomoci léků, denně chránit před infekcemi a jednoduchými viry.
Fyzikální vlastnosti
Struktura buněčného proteinu je velmi specifická a závisí na vykonávané funkci. Ale fyzikální vlastnosti všech peptidů jsou podobné a scvrkají se na následující charakteristiky.
- Hmotnost molekuly je až 1 000 000 Daltonů.
- Koloidní systémy se tvoří ve vodném roztoku. Tam struktura získává náboj, který se může měnit v závislosti na kyselosti prostředí.
- Při vystavení drsným podmínkám (ozařování, kyselina nebo alkálie, teplota atd.) jsou schopny přejít na jiné úrovně konformace, to znamená denaturovat. Tento proces je v 90 % případů nevratný. Existuje však i zpětný posun – renaturace.
To jsou hlavní vlastnosti fyzikálních vlastností peptidů.