Dessa är högmolekylära organiska föreningar, biopolymerer, byggda av 20 typer av L-p-aminosyrarester kopplade i en viss sekvens till långa kedjor. Molekylvikten hos proteiner varierar från 5 tusen till 1 miljon. Namnet "vita" gavs först till ämnet av fågelägg, som koagulerar när det värms upp till en vit olöslig massa. Termen utvidgades senare till andra ämnen med liknande egenskaper isolerade från djur och växter.
Ris. 1. De mest komplexa biopolymererna är proteiner. Deras makromolekyler består av monomerer, som är aminosyror. Varje aminosyra har två funktionella grupper: en karboxylgrupp och en aminogrupp. All mångfald av proteiner skapas som ett resultat av olika kombinationer av 20 aminosyror.
Proteiner dominerar över alla andra föreningar som finns i levande organismer och står vanligtvis för mer än hälften av deras torrvikt. Det antas att det finns flera miljarder individuella proteiner i naturen (till exempel finns mer än 3 tusen olika proteiner bara i E. coli-bakterien).
Proteiner spelar en nyckelroll i alla organismers livsprocesser. Proteiner inkluderar enzymer, med vars deltagande alla kemiska omvandlingar sker i cellen (metabolism); de kontrollerar geners verkan; med deras deltagande realiseras verkan av hormoner, transmembrantransport utförs, inklusive generering av nervimpulser. De är en integrerad del av immunsystemet (immunoglobuliner) och koagulationssystemet, utgör grunden för ben och bindväv och är involverade i omvandlingen och utnyttjandet av energi.
Proteinforskningens historia
De första försöken att isolera proteiner gjordes redan på 1700-talet. I början av 1800-talet dök de första verken på den kemiska studien av proteiner upp. De franska forskarna Joseph Louis Gay-Lussac och Louis Jacques Thénard försökte fastställa den elementära sammansättningen av proteiner från olika källor, vilket markerade början på systematiska analytiska studier, tack vare vilka man drog slutsatsen att alla proteiner är lika i uppsättningen av element som ingår i deras sammansättning. År 1836 föreslog den holländska kemisten G. J. Mulder den första teorin om strukturen av proteinämnen, enligt vilken alla proteiner har en viss hypotetisk radikal (C 40 H 62 N 10 O 12), associerad i olika proportioner med svavel- och fosforatomer. Han kallade denna radikala "protein" (från det grekiska proteinet - först, huvud). Mulders teori bidrog till att öka intresset för studier av proteiner och förbättra metoderna för proteinkemi. Tekniker för att isolera proteiner genom extraktion med lösningar av neutrala salter utvecklades och proteiner erhölls i kristallin form för första gången (vissa växtproteiner). För att analysera proteiner började de använda sin preliminära matsmältning med syror och alkalier.
Samtidigt började man ägna allt större uppmärksamhet åt studiet av proteinfunktion. Jens Jakob Berzelius var den första som 1835 föreslog att de skulle spela rollen som biokatalysatorer. Snart upptäcktes proteolytiska enzymer - pepsin (T. Schwann, 1836) och trypsin (L. Corvisart, 1856), vilket uppmärksammade matsmältningens fysiologi och analysen av produkter som bildas under nedbrytningen av näringsämnen. Ytterligare studier av proteinstruktur och arbete med kemisk syntes av peptider resulterade i uppkomsten av peptidhypotesen, enligt vilken alla proteiner är uppbyggda av aminosyror. I slutet av 1800-talet studerades de flesta av aminosyrorna som utgör proteiner.
I början av 1900-talet var den tyske kemisten Emil Hermann Fischer den förste som använde den organiska kemins metoder för att studera proteiner och bevisade att proteiner består av β-aminosyror kopplade till varandra genom en amid (peptid) bindning. Senare, tack vare användningen av fysikalisk-kemiska analysmetoder, bestämdes molekylmassan för många proteiner, den sfäriska formen av globulära proteiner fastställdes, röntgendiffraktionsanalys av aminosyror och peptider utfördes och metoder för kromatografisk analys utfördes utvecklats (se kromatografi).
Det första proteinhormonet isolerades (Frederick Grant Banting, John James Rickard McLeod, 1922), närvaron av gammaglobuliner i antikroppar bevisades och den enzymatiska funktionen av muskelproteinet myosin beskrevs (Vladimir Aleksandrovich Engelhardt, M. N. Lyubimova, 1939) . För första gången erhölls enzymer i kristallin form - ureas (J.B. Saliner, 1926), pepsin (J.H. Nortron, 1929), lysozym (E.P. Abraham, Robert Robinson, 1937).

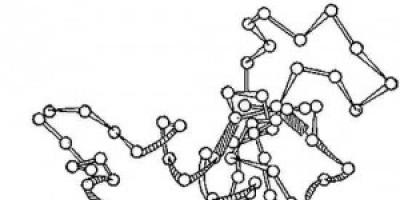
Ris. 2. Schema för den tredimensionella strukturen av enzymet lysozym. Cirklar - aminosyror; strängar - peptidbindningar; skuggade rektanglar är disulfidbindningar. Spiraliserade och långsträckta sektioner av polypeptidkedjan är synliga.
På 1950-talet bevisades den trenivåiga organisationen av proteinmolekyler - närvaron av en primär, sekundär och tertiär struktur; skapade en automatisk aminosyraanalysator (Stanford Moore, William Howard Stein, 1950). På 60-talet gjordes försök att kemiskt syntetisera proteiner (insulin, ribonukleas). Analysmetoder för röntgendiffraktion har förbättrats avsevärt; en anordning skapades - en sekvenserare (P. Edman, G. Begg, 1967), som gjorde det möjligt att bestämma sekvensen av aminosyror i en polypeptidkedja. Konsekvensen av detta var etableringen av strukturen för flera hundra proteiner från en mängd olika källor. Bland dem finns proteolytiska enzymer (pepsin, trypsin, kymotrypsin, subtilisin, karboxipeptidaser), myoglobiner, hemoglobiner, cytokromer, lysozymer, immunglobuliner, histoner, neurotoxiner, virala höljeproteiner, protein-peptidhormoner. Som ett resultat uppstod förutsättningar för att lösa pressande problem inom enzymologi, immunologi, endokrinologi och andra områden inom biologisk kemi.
I slutet av 1900-talet gjordes betydande framsteg när det gäller att studera proteiners roll i matrissyntesen av biopolymerer, förstå mekanismerna för deras verkan i olika livsprocesser hos organismer och fastställa sambandet mellan deras struktur och funktion. Förbättringen av forskningsmetoder och framväxten av nya metoder för att separera proteiner och peptider var av stor betydelse.
Utvecklingen av en effektiv metod för att analysera sekvensen av nukleotider i nukleinsyror har gjort det möjligt att avsevärt förenkla och påskynda bestämningen av aminosyrasekvensen i proteiner. Detta visade sig vara möjligt eftersom ordningen på aminosyror i ett protein bestäms av sekvensen av nukleotider i genen som kodar för detta protein (fragment). Följaktligen kan man, genom att känna till arrangemanget av nukleotider i denna gen och den genetiska koden, exakt förutsäga i vilken ordning aminosyrorna finns i polypeptidkedjan i ett protein. Tillsammans med framsteg inom strukturanalys av proteiner har betydande resultat uppnåtts i studiet av deras rumsliga organisation, mekanismer för bildning och verkan av supramolekylära komplex, inklusive ribosomer och andra cellulära organeller, kromatin, virus, etc.
Proteinstruktur
Nästan alla proteiner är uppbyggda av 20 α-aminosyror som tillhör L-serien, och är likadana i nästan alla organismer. Aminosyror i proteiner är anslutna till varandra genom en peptidbindning -CO-NH-, som bildas av karboxyl- och -aminogruppen av angränsande aminosyrarester: två aminosyror bildar en dipeptid där den terminala karboxylen (-COOH) och aminogruppen (H2N-) förblir fri, till vilken nya aminosyror kan tillsättas för att bilda en polypeptidkedja.
Den sektion av kedjan på vilken terminalen H 2 N-gruppen är belägen kallas N-terminal, och den motsatta delen kallas C-terminal. Den enorma variationen av proteiner bestäms av ordningsföljden och antalet aminosyrarester de innehåller. Även om det inte finns någon tydlig skillnad brukar korta kedjor kallas peptider eller oligopeptider (från oligo...), och polypeptider (proteiner) förstås vanligtvis som kedjor som består av 50 eller fler. De vanligaste proteinerna är de som innehåller 100-400 aminosyrarester, men det finns också de vars molekyler bildas av 1000 eller fler rester. Proteiner kan bestå av flera polypeptidkedjor. I sådana proteiner kallas varje polypeptidkedja en subenhet.
Spatial struktur av proteiner

Ris. 3. Protein i alla organismer består av 20 typer av aminosyror. Varje protein kännetecknas av ett visst sortiment och kvantitativt förhållande av aminosyror. I proteinmolekyler är aminosyror kopplade till varandra genom peptidbindningar (- CO - NH -) i en linjär sekvens, som utgör proteinets så kallade primära struktur. Topplinje - fria aminosyror med sidogrupperna R1, R2, R3; slutsatsen - aminosyror är förbundna med peptidbindningar.
Polypeptidkedjan är kapabel att spontant bilda och bibehålla en speciell rumslig struktur. Baserat på formen på proteinmolekyler delas proteiner in i fibrillära och globulära. I globulära proteiner viks en eller flera polypeptidkedjor till en kompakt sfärisk struktur, eller globul. Typiskt är dessa proteiner mycket lösliga i vatten. Dessa inkluderar nästan alla enzymer, blodtransportproteiner och många lagringsproteiner. Fibrillära proteiner är trådliknande molekyler som hålls samman av tvärbindningar och bildar långa fibrer eller skiktade strukturer. De har hög mekanisk hållfasthet, är olösliga i vatten och utför huvudsakligen strukturella och skyddande funktioner. Typiska representanter för sådana proteiner är hår- och ullkeratiner, silkesfibroin och senkollagen.
Ordningen av kovalent kopplade aminosyror i en polypeptidkedja kallas aminosyrasekvensen, eller den primära strukturen hos proteiner. Den primära strukturen för varje protein, kodad av motsvarande gen, är konstant och bär all information som behövs för bildandet av strukturer på högre nivå. Det potentiella antalet proteiner som kan bildas från 20 aminosyror är praktiskt taget obegränsat.
Som ett resultat av växelverkan mellan sidogrupper av aminosyrarester antar individuella relativt små sektioner av polypeptidkedjan en eller annan konformation (typ av veckning), känd som den sekundära strukturen av proteiner. Dess mest karakteristiska element är den periodiskt upprepade α-helixen och β-strukturen. Den sekundära strukturen är mycket stabil. Eftersom det till stor del bestäms av aminosyrasekvensen för motsvarande proteinregion, blir det möjligt att förutsäga det med en viss grad av sannolikhet. Termen "?-helix" introducerades av den amerikanske biokemisten, fysikern och kemisten Linus Carl Pauling, som beskrev arrangemanget av polypeptidkedjan i proteinet?-keratin i form av en högerhänt helix (?-helixen kan jämföras med en telefonsladd). För varje varv av en sådan helix i ett protein finns det 3,6 aminosyrarester. Detta betyder att -C=O-gruppen i en peptidbindning bildar en vätebindning med -NH-gruppen i en annan peptidbindning, fyra aminosyrarester på avstånd från den första. I genomsnitt innehåller varje α-helixregion upp till 15 aminosyror, vilket motsvarar 3-4 varv av helixen. Men i varje enskilt protein kan längden på helixen skilja sig mycket från detta värde. I tvärsnitt har α-helixen formen av en skiva, från vilken aminosyrornas sidokedjor pekar utåt.
Struktur, eller? -vikt skikt, kan bildas av flera sektioner av polypeptidkedjan. Dessa sektioner sträcks ut och läggs parallellt med varandra, förbundna med varandra genom vätebindningar som uppstår mellan peptidbindningar. De kan vara orienterade i samma eller motsatta riktningar (rörelseriktningen längs polypeptidkedjan anses vanligtvis vara från N-terminalen till C-terminalen). I det första fallet kallas det vikta lagret parallellt, i det andra - antiparallellt. Den senare bildas när peptidkedjan gör en skarp sväng tillbaka och bildar en böj (?-böj). Är aminosyrasidokedjorna orienterade vinkelrätt mot planet? -lager.
Relativt innehåll? -spiralsektioner och? -strukturer kan variera kraftigt mellan olika proteiner. Det finns proteiner med en dominans av α-helixar (ca 75 % av aminosyrorna i myoglobin och hemoglobin), och den huvudsakliga typen av kedjeveckning i många fibrillära proteiner (inklusive silkesfibroin, β-keratin) är α-helix. -strukturera. Regioner av polypeptidkedjan som inte kan klassificeras i någon av de ovan beskrivna konformationerna kallas förbindande loopar. Deras struktur bestäms huvudsakligen av interaktionerna mellan sidokedjorna av aminosyror, och i molekylen av vilket protein som helst passar den på ett strikt definierat sätt.
Den tertiära strukturen kallas rumslig struktur av globulära proteiner. Men ofta hänvisar detta koncept till metoden att vika polypeptidkedjan i rymden, karakteristisk för varje specifikt protein. Den tertiära strukturen bildas av polypeptidkedjan av ett protein spontant, uppenbarligen, längs en viss koagulationsväg(ar) med den preliminära bildningen av sekundära strukturelement. Om stabiliteten hos den sekundära strukturen beror på vätebindningar, så fixeras den tertiära strukturen av ett mångsidigt system av icke-kovalenta interaktioner: väte, joniska, intermolekylära interaktioner, såväl som hydrofoba kontakter mellan sidokedjorna av opolär amino syrarester.
I vissa proteiner stabiliseras den tertiära strukturen ytterligare genom bildandet av disulfidbindningar (-S-S-bindningar) mellan cysteinrester. Som regel finns det inuti proteinkulan sidokedjor av hydrofoba aminosyror samlade i kärnan (deras överföring inuti proteinkulan är termodynamiskt gynnsam), och i periferin finns hydrofila rester och några hydrofoba sådana. Proteinkulan är omgiven av flera hundra molekyler av hydratiseringsvatten, vilket är nödvändigt för proteinmolekylens stabilitet och ofta är involverat i dess funktion. Den tertiära strukturen är mobil, dess individuella sektioner kan skifta, vilket leder till konformationsövergångar som spelar en betydande roll i interaktionen mellan proteinet och andra molekyler.
Tertiär struktur är grunden för de funktionella egenskaperna hos ett protein. Det bestämmer bildandet av ensembler av funktionella grupper i proteinet - aktiva centra och bindningszoner, ger dem den nödvändiga geometrin, tillåter skapandet av en inre miljö, vilket är en förutsättning för förekomsten av många reaktioner, och säkerställer interaktion med andra proteiner .
Den tertiära strukturen hos proteiner motsvarar tydligt dess primära struktur; det finns förmodligen en ännu okrypterad stereokemisk kod som bestämmer typen av proteinveckning. En och samma metod för rumslig arrangemang motsvarar dock vanligtvis inte en enda primär struktur, utan en hel familj av strukturer där endast en liten del (upp till 20-30%) av aminosyrarester kan sammanfalla, men i vissa platser i kedjan är likheten mellan aminosyrarester bevarad. Resultatet är bildandet av stora familjer av proteiner som kännetecknas av liknande tertiär och mer eller mindre liknande primärstruktur och, som regel, gemensam funktion. Dessa är till exempel proteiner från organismer av olika arter som har samma funktion och är evolutionärt besläktade: myoglobiner och hemoglobiner, trypsin, kymotrypsin, elastas och andra animaliska proteinaser.

Ris. 4. Som ett resultat av kombinationen av flera proteinmakromolekyler med en tertiär struktur bildas en kvartär proteinstruktur till ett komplext komplex. Ett exempel på sådana komplexa proteiner är hemoglobin, som består av fyra makromolekyler.
Ofta, särskilt i stora proteiner, sker veckningen av en polypeptidkedja genom att enskilda delar av kedjan bildar mer eller mindre autonoma element av rumslig struktur - domäner som kan ha funktionell autonomi, som är ansvariga för en eller annan biologisk aktivitet hos protein. Således säkerställer de N-terminala domänerna av blodkoagulationsproteiner deras vidhäftning till cellmembranet.
Det finns många proteiner vars molekyler är en ensemble av kulor (subenheter) som hålls samman av hydrofoba interaktioner, väte- eller jonbindningar. Sådana komplex kallas oligomera, multimera eller subenhetsproteiner. Arrangemanget av subenheter i ett funktionellt aktivt proteinkomplex kallas proteinets kvartära struktur. Vissa proteiner kan bilda strukturer av högre ordning, till exempel multienzymkomplex, utökade strukturer (bakteriofaghöljeproteiner), supramolekylära komplex som fungerar som en enda helhet (till exempel ribosomer eller komponenter i den mitokondriella andningskedjan).
Den kvartära strukturen tillåter skapandet av molekyler med ovanliga geometrier. Således har ferritin, bildat av 24 subenheter, en inre hålighet, tack vare vilken proteinet lyckas binda upp till 3000 järnjoner. Dessutom tillåter den kvartära strukturen att flera olika funktioner kan utföras i en molekyl. Tryptofansyntetas kombinerar enzymer som är ansvariga för flera på varandra följande stadier av syntesen av aminosyran tryptofan.
Metoder för att studera proteinstruktur
Den primära strukturen hos proteiner bestämmer alla andra nivåer av organisering av proteinmolekylen. När man studerar olika proteiners biologiska funktion är därför kunskap om denna struktur viktig. Det första proteinet för vilket aminosyrasekvensen fastställdes var pankreashormonet insulin. Detta arbete, som tog 11 år, utfördes av den engelske biokemisten Frederick Sanger (1954). Han bestämde platsen för 51 aminosyror i hormonmolekylen och visade att den består av 2 kedjor förbundna med disulfidbindningar. Senare automatiserades det mesta av arbetet med att fastställa proteinernas primära struktur.
Med utvecklingen av genteknikmetoder blev det möjligt att ytterligare accelerera denna process genom att bestämma den primära strukturen hos proteiner i enlighet med resultaten av analysen av nukleotidsekvensen i generna som kodar för dessa proteiner. Den sekundära och tertiära strukturen hos proteiner studeras med hjälp av ganska komplexa fysikaliska metoder, till exempel cirkulär dikroism eller röntgendiffraktionsanalys av proteinkristaller. Den tertiära strukturen etablerades först av den engelske biokemisten John Cowdery Kendrew (1957) för muskelproteinet myoglobin.

Ris. 5. Modell av myoglobinmolekylen (spatial konfiguration av molekylen)
Denaturering av proteiner
Relativt svaga bindningar som är ansvariga för att stabilisera proteinets sekundära, tertiära och kvartära strukturer förstörs lätt, vilket åtföljs av en förlust av dess biologiska aktivitet. Förstörelsen av den ursprungliga (naturliga) proteinstrukturen, kallad denaturering, sker i närvaro av syror och baser, med uppvärmning, förändringar i jonstyrka och andra influenser. Som regel är denaturerade proteiner dåligt eller inte alls lösliga i vatten. Med en korttidseffekt och snabb eliminering av denaturerande faktorer är proteinrenaturering möjlig med fullständig eller partiell återställande av den ursprungliga strukturen och biologiska egenskaperna.
Proteinklassificering
Komplexiteten i strukturen hos proteinmolekyler och den extrema variationen av funktioner de utför gör det svårt att skapa en enhetlig och tydlig klassificering av dem, även om försök att göra detta har gjorts upprepade gånger sedan slutet av 1800-talet. Baserat på deras kemiska sammansättning delas proteiner in i enkla och komplexa (ibland kallade proteider). Molekylerna i den förra består endast av aminosyror. Förutom själva polypeptidkedjan innehåller komplexa proteiner icke-proteinkomponenter representerade av kolhydrater (glykoproteiner), lipider (lipoproteiner), nukleinsyror (nukleoproteiner), metalljoner (metalloproteiner), fosfatgrupp (fosfoproteiner), pigment (kromoproteiner), etc. .
Beroende på vilka funktioner de utför särskiljs flera klasser av proteiner. Den mest mångsidiga och mest specialiserade klassen består av proteiner med en katalytisk funktion - enzymer som har förmågan att påskynda kemiska reaktioner som förekommer i levande organismer. I denna egenskap deltar proteiner i alla processer för syntes och nedbrytning av olika föreningar under metabolism, i biosyntesen av proteiner och nukleinsyror, reglering av cellutveckling och differentiering. Transportproteiner har förmågan att selektivt binda fettsyror, hormoner och andra organiska och oorganiska föreningar och joner och sedan transportera dem med ström till önskad plats (till exempel är hemoglobin involverat i överföringen av syre från lungorna till alla celler i kroppen). Transportproteiner utför också aktiv transport av joner, lipider, sockerarter och aminosyror över biologiska membran.
Strukturella proteiner utför en stödjande eller skyddande funktion; de deltar i bildandet av cellskelettet. De vanligaste bland dem är kollagen från bindväv, keratin, naglar och fjädrar, elastin från kärlceller och många andra. I kombination med lipider är de den strukturella basen för cellulära och intracellulära membran.
Ett antal proteiner har en skyddande funktion. Till exempel immunglobuliner (antikroppar) från ryggradsdjur, som har förmågan att binda främmande patogena mikroorganismer och ämnen, neutraliserar deras patogena effekter på kroppen och förhindrar cellproliferation. Fibrinogen och trombin är involverade i blodkoaguleringsprocessen. Många proteinämnen som utsöndras av bakterier, liksom komponenter från vissa ryggradslösa djur, klassificeras som toxiner.
Vissa proteiner (regulatoriska) är involverade i regleringen av den fysiologiska aktiviteten i kroppen som helhet, enskilda organ, celler eller processer. De kontrollerar gentranskription och proteinsyntes; dessa inkluderar peptid-proteinhormoner som utsöndras av endokrina körtlar. Frölagringsproteiner tillhandahåller näringsämnen för de inledande stadierna av embryonutveckling. Dessa inkluderar även kasein, äggvitealbumin (ovalbumin) och många andra. Tack vare proteiner får muskelceller förmågan att dra ihop sig och i slutändan ge rörelse åt kroppen. Exempel på sådana kontraktila proteiner är skelettmuskelaktin och myosin, såväl som tubulin, som är komponenter i flimmerhåren och flagellerna hos encelliga organismer; De säkerställer också divergensen av kromosomer under celldelning.
Receptorproteiner är målet för hormoner och andra biologiskt aktiva föreningar. Med deras hjälp uppfattar cellen information om tillståndet i den yttre miljön. De spelar en viktig roll i överföringen av nervös excitation och i orienterad cellrörelse (kemotaxi). Omvandlingen och utnyttjandet av energi som kommer in i kroppen, såväl som energi, sker också med deltagande av proteiner i bioenergisystemet (till exempel det visuella pigmentet rhodopsin, cytokromer i andningskedjan). Det finns också många proteiner med andra, ibland ganska ovanliga funktioner (till exempel innehåller plasma från vissa antarktiska fiskar proteiner som har frostskyddande egenskaper).
Proteinbiosyntes
All information om strukturen hos ett visst protein "lagras" i motsvarande gener i form av en sekvens av nukleotider och implementeras i processen med mallsyntes. Först överförs (läses) information från DNA-molekylen till budbärar-RNA (mRNA) med hjälp av enzymet DNA-beroende RNA-polymeras, och sedan i ribosomen på mRNA, som på en matris i enlighet med den genetiska koden, med deltagande av transport-RNA som levererar aminosyror, sker bildningen polypeptidkedja.
De syntetiserade polypeptidkedjorna som kommer ut från ribosomen, spontant viker sig, antar proteinets konformationsegenskaper och kan bli föremål för posttranslationell modifiering. Sidokedjorna av individuella aminosyror kan genomgå modifieringar (hydroxylering, fosforylering, etc.). Det är därför till exempel hydroxyprolin och hydroxylysin finns i kollagen (se). Modifieringen kan också åtföljas av brott av polypeptidbindningar. På så sätt sker till exempel bildningen av en aktiv insulinmolekyl, bestående av två kedjor sammankopplade med disulfidbindningar.

Ris. 6. Allmänt schema för proteinbiosyntes.
Vikten av proteiner i näring
Proteiner är de viktigaste komponenterna i djur- och människors mat. Proteiners näringsvärde bestäms av deras innehåll av essentiella aminosyror, som inte produceras i kroppen själv. I detta avseende är växtproteiner mindre värdefulla än animaliska proteiner: de är fattigare på lysin, metionin och tryptofan och är svårare att smälta i mag-tarmkanalen. Bristen på essentiella aminosyror i maten leder till allvarliga störningar i kvävemetabolismen.
Proteiner bryts ner till fria aminosyror, som efter absorption i tarmen kommer in och distribueras till alla celler. Vissa av dem bryts ner till enkla föreningar med frigörande av energi, som används för olika behov av cellen, och några går till syntes av nya proteiner som är karakteristiska för en given organism. (R. A. Matveeva, Encyclopedia Cyril and Methodius)
Uppräkning av proteiner
- amyloid - amyloid;
- anjonisk - anjonisk;
- antivirus - antiviral;
- autoimmun - autoimmun;
- autolog - autologisk;
- bakteriell - bakteriell;
- Bence Jones protein;
- virusinducerad - virusinducerad;
- viral - virus;
- viral icke-strukturell - virus icke-strukturell;
- viral strukturell - virus strukturell;
- virusspecifik - virusspecifik;
- hög molekylvikt - hög molekylvikt;
- hem-innehållande - heme;
- heterolog - främmande;
- hybrid - hybrid;
- glykosylerad - glykosylerad;
- globulär - globulär;
- denaturerad - denaturerad;
- järnhaltig - järn;
- äggula - äggula;
- animaliskt protein - animaliskt protein;
- skyddande - defensiv;
- immun - immun;
- immunogen - immunologiskt relevant;
- kalciumbindning;
- sur - sur;
- corpuscular - corpuscular;
- membran - membran;
- myelom - myelom;
- mikrosomal - mikrosomal;
- mjölkprotein - mjölkprotein;
- monoklonalt - monoklonalt immunglobulin;
- muskelprotein - muskelprotein;
- infödd - infödd;
- icke-histon - icke-histon;
- defekt - partiell;
- olöslig - olöslig;
- svårsmält - olöslig;
- icke-enzymatisk - icke-enzym;
- låg molekylvikt - låg molekylvikt;
- nytt protein - nytt protein;
- allmänt - helhet;
- onkogen - onkoprotein;
- huvudfasprotein - anjoniskt;
- protein av akut fas (inflammation) - protein av akut fas;
- mat - mat;
- blodplasmaprotein - plasmaprotein;
- placenta - placenta;
- frånkoppling - frånkoppling;
- protein av regenererande nerv;
- reglerande - reglerande;
- rekombination - rekombinant;
- receptor - receptor;
- ribosomal - ribosomal;
- bindande - bindande;
- sekretoriskt protein - sekretoriskt protein;
- C-reaktiv - C-reaktiv;
- vassleprotein - vassleprotein, laktoprotein;
- vävnad - vävnad;
- giftig - giftig;
- chimär - chimär;
- hel - hel;
- cytosolisk - cytosolisk;
- alkaliskt protein - anjoniskt protein;
- exogen - exogen;
- endogent - endogent protein.
Läs mer om proteiner i litteraturen:
- Volkenshtein M.V., Molecules and, M., 1965, kap. 3-5;
- Gaurowitz F., Kemi och funktioner hos proteiner, trans. från engelska, Moskva, 1965;
- Sissakyan N. M. och Gladilin K. L., Biochemical aspects of proteinsynthesis, i boken: Advances in biological chemistry, vol. 7, M., 1965, sid. 3;
- Stepanov V. M. Molekylärbiologi. Proteiners struktur och funktion. M., 1996;
- Shamin A. N., Development of protein chemistry, M., 1966;
- Proteiner och peptider. M., 1995-2000. T. 1-3;
- Biosyntes av protein och nukleinsyror, red. A.S. Spirina, M., 1965;
- Introduktion till molekylärbiologi, övers. från engelska, M., 1967
- Molekyler och celler. [lör. Art.], övers. från English, M., 1966, sid. 7 - 27, 94 - 106;
- Fundamentals of biochemistry: Översättning från engelska M., 1981. T. 1;
- Proteinproblemet. M., 1995. T. 1-5;
- Proteinerna. New York, 1975-79. 3 uppl. V. 1-4.
Hitta något annat intressant:
Ekorrar- organiska föreningar med hög molekylvikt bestående av α-aminosyrarester.
I proteinsammansättning inkluderar kol, väte, kväve, syre, svavel. Vissa proteiner bildar komplex med andra molekyler som innehåller fosfor, järn, zink och koppar.
Proteiner har en stor molekylvikt: äggalbumin - 36 000, hemoglobin - 152 000, myosin - 500 000. Som jämförelse: alkoholens molekylvikt är 46, ättiksyra - 60, bensen - 78.
Aminosyrasammansättning av proteiner
Ekorrar- icke-periodiska polymerer, vars monomerer är a-aminosyror. Typiskt kallas 20 typer av α-aminosyror för proteinmonomerer, även om över 170 av dem finns i celler och vävnader.
Beroende på om aminosyror kan syntetiseras i kroppen hos människor och andra djur, särskiljs de: icke-essentiella aminosyror- kan syntetiseras; essentiella aminosyror- kan inte syntetiseras. Essentiella aminosyror måste tillföras kroppen genom maten. Växter syntetiserar alla typer av aminosyror.
Beroende på aminosyrasammansättningen, proteiner är: kompletta- innehåller hela uppsättningen aminosyror; defekt- Vissa aminosyror saknas i sammansättningen. Om proteiner endast består av aminosyror kallas de enkel. Om proteiner förutom aminosyror innehåller en icke-aminosyrakomponent (protesgrupp) kallas de komplex. Protesgruppen kan representeras av metaller (metalloproteiner), kolhydrater (glykoproteiner), lipider (lipoproteiner), nukleinsyror (nukleoproteiner).
Allt aminosyror innehåller: 1) karboxylgrupp (-COOH), 2) aminogrupp (-NH 2), 3) radikal eller R-grupp (resten av molekylen). Radikalens struktur är olika för olika typer av aminosyror. Beroende på antalet aminogrupper och karboxylgrupper som ingår i sammansättningen av aminosyror, särskiljs de: neutrala aminosyror med en karboxylgrupp och en aminogrupp; basiska aminosyror som har mer än en aminogrupp; sura aminosyror som har mer än en karboxylgrupp.
Aminosyror är amfotera föreningar, eftersom de i lösning kan fungera som både syror och baser. I vattenlösningar finns aminosyror i olika jonformer.
Peptidbindning
Peptider- organiska ämnen som består av aminosyrarester sammankopplade med peptidbindningar.
Bildandet av peptider sker som ett resultat av kondensationsreaktionen av aminosyror. När aminogruppen i en aminosyra interagerar med karboxylgruppen i en annan, uppstår en kovalent kväve-kolbindning mellan dem, som kallas peptid. Beroende på antalet aminosyrarester som ingår i peptiden finns det dipeptider, tripeptider, tetrapeptider etc. Bildandet av en peptidbindning kan upprepas många gånger. Detta leder till bildningen polypeptider. I ena änden av peptiden finns en fri aminogrupp (kallad N-terminal), och i den andra finns en fri karboxylgrupp (kallad C-terminal).

Rumslig organisation av proteinmolekyler
Utförandet av vissa specifika funktioner av proteiner beror på den rumsliga konfigurationen av deras molekyler; dessutom är det energetiskt ogynnsamt för cellen att hålla proteiner i en ovikt form, i form av en kedja, därför genomgår polypeptidkedjor vikning och förvärvar en viss tredimensionell struktur eller konformation. Det finns 4 nivåer rumslig organisation av proteiner.
Primär proteinstruktur- sekvensen av arrangemang av aminosyrarester i polypeptidkedjan som utgör proteinmolekylen. Bindningen mellan aminosyror är en peptidbindning.

Om en proteinmolekyl består av endast 10 aminosyrarester, är antalet teoretiskt möjliga varianter av proteinmolekyler som skiljer sig åt i ordningsföljden för alternering av aminosyror 10 20. Med 20 aminosyror kan du göra ännu fler olika kombinationer av dem. Ungefär tio tusen olika proteiner har hittats i människokroppen, som skiljer sig både från varandra och från andra organismers proteiner.
Det är proteinmolekylens primära struktur som bestämmer egenskaperna hos proteinmolekylerna och dess rumsliga konfiguration. Att ersätta bara en aminosyra med en annan i en polypeptidkedja leder till en förändring av proteinets egenskaper och funktioner. Till exempel, att ersätta den sjätte glutaminaminosyran med valin i β-subenheten av hemoglobin leder till det faktum att hemoglobinmolekylen som helhet inte kan utföra sin huvudfunktion - syretransport; I sådana fall utvecklar personen en sjukdom som kallas sicklecellanemi.
Sekundär struktur- ordnad veckning av polypeptidkedjan till en spiral (ser ut som en förlängd fjäder). Helixens varv förstärks av vätebindningar som uppstår mellan karboxylgrupper och aminogrupper. Nästan alla CO- och NH-grupper deltar i bildandet av vätebindningar. De är svagare än peptider, men, upprepade många gånger, ger denna konfiguration stabilitet och styvhet. På nivån av sekundär struktur finns det proteiner: fibroin (silke, spindelnät), keratin (hår, naglar), kollagen (senor).



Tertiär struktur- packning av polypeptidkedjor till kulor, till följd av bildandet av kemiska bindningar (väte, jon, disulfid) och upprättandet av hydrofoba interaktioner mellan radikalerna i aminosyrarester. Huvudrollen i bildandet av den tertiära strukturen spelas av hydrofila-hydrofoba interaktioner. I vattenlösningar tenderar hydrofoba radikaler att gömma sig från vatten och grupperas inuti kulan, medan hydrofila radikaler, som ett resultat av hydratisering (interaktion med vattendipoler), tenderar att uppträda på ytan av molekylen. I vissa proteiner stabiliseras den tertiära strukturen av kovalenta disulfidbindningar som bildas mellan svavelatomerna i två cysteinrester. På tertiär strukturnivå finns enzymer, antikroppar och vissa hormoner.

Kvartär struktur kännetecknande för komplexa proteiner vars molekyler bildas av två eller flera kulor. Subenheterna hålls i molekylen genom joniska, hydrofoba och elektrostatiska interaktioner. Ibland, under bildandet av en kvartär struktur, uppstår disulfidbindningar mellan subenheter. Det mest studerade proteinet med en kvartär struktur är hemoglobin. Den bildas av två a-subenheter (141 aminosyrarester) och två β-subenheter (146 aminosyrarester). Förknippad med varje subenhet är en hemmolekyl innehållande järn.
Om den rumsliga konformationen av proteiner av någon anledning avviker från det normala, kan proteinet inte utföra sina funktioner. Till exempel är orsaken till "galna ko-sjukan" (spongiform encefalopati) den onormala konformationen av prioner, ytproteinerna hos nervceller.
Egenskaper hos proteiner
Proteinmolekylens aminosyrasammansättning och struktur bestämmer det egenskaper. Proteiner kombinerar grundläggande och sura egenskaper, bestämda av aminosyraradikaler: ju surare aminosyror i ett protein, desto mer uttalade dess sura egenskaper. Förmågan att donera och lägga till H+ bestäms buffrande egenskaper hos proteiner; En av de mest kraftfulla buffertarna är hemoglobin i röda blodkroppar, som håller blodets pH på en konstant nivå. Det finns lösliga proteiner (fibrinogen), och det finns olösliga proteiner som utför mekaniska funktioner (fibroin, keratin, kollagen). Det finns proteiner som är kemiskt aktiva (enzymer), det finns kemiskt inaktiva proteiner som är resistenta mot olika miljöförhållanden och de som är extremt instabila.
Externa faktorer (värme, ultraviolett strålning, tungmetaller och deras salter, pH-förändringar, strålning, uttorkning)
kan orsaka störningar av proteinmolekylens strukturella organisation. Processen med förlust av den tredimensionella konformationen som är inneboende i en given proteinmolekyl kallas denaturering. Orsaken till denaturering är brytningen av bindningar som stabiliserar en viss proteinstruktur. Inledningsvis bryts de svagaste banden, och när villkoren blir strängare bryts även starkare. Därför går först de kvartära, sedan de tertiära och sekundära strukturerna förlorade. En förändring i rumslig konfiguration leder till en förändring av proteinets egenskaper och gör det som ett resultat omöjligt för proteinet att utföra sina inneboende biologiska funktioner. Om denaturering inte åtföljs av förstörelse av den primära strukturen, så kan det vara det reversibel i detta fall sker självåterhämtning av konformationen som är karakteristisk för proteinet. Till exempel genomgår membranreceptorproteiner sådan denaturering. Processen att återställa proteinstrukturen efter denaturering kallas renaturering. Om återställande av den rumsliga konfigurationen av proteinet är omöjligt, kallas denaturering irreversibel.
Funktioner av proteiner
| Fungera | Exempel och förklaringar |
|---|---|
| Konstruktion | Proteiner är involverade i bildandet av cellulära och extracellulära strukturer: de är en del av cellmembran (lipoproteiner, glykoproteiner), hår (keratin), senor (kollagen), etc. |
| Transport | Blodproteinet hemoglobin fäster syre och transporterar det från lungorna till alla vävnader och organ, och från dem överför koldioxid till lungorna; Sammansättningen av cellmembran inkluderar speciella proteiner som säkerställer aktiv och strikt selektiv överföring av vissa ämnen och joner från cellen till den yttre miljön och tillbaka. |
| Reglerande | Proteinhormoner deltar i regleringen av metaboliska processer. Till exempel reglerar hormonet insulin blodsockernivåerna, främjar glykogensyntesen och ökar bildningen av fetter från kolhydrater. |
| Skyddande | Som svar på att främmande proteiner eller mikroorganismer (antigener) tränger in i kroppen, bildas speciella proteiner - antikroppar som kan binda och neutralisera dem. Fibrin, bildat av fibrinogen, hjälper till att stoppa blödning. |
| Motor | De kontraktila proteinerna aktin och myosin ger muskelkontraktion hos flercelliga djur. |
| Signal | Inbyggda i cellens ytmembran finns proteinmolekyler som kan ändra sin tertiära struktur som svar på miljöfaktorer och på så sätt ta emot signaler från den yttre miljön och sända kommandon till cellen. |
| Lagring | I djurkroppen lagras proteiner som regel inte, med undantag för äggalbumin och mjölkkasein. Men tack vare proteiner kan vissa ämnen lagras i kroppen; till exempel under nedbrytningen av hemoglobin avlägsnas inte järn från kroppen utan lagras och bildar ett komplex med proteinet ferritin. |
| Energi | När 1 g protein bryts ner till slutprodukter frigörs 17,6 kJ. Först bryts proteiner ner till aminosyror och sedan till slutprodukterna - vatten, koldioxid och ammoniak. Proteiner används dock som energikälla endast när andra källor (kolhydrater och fetter) är förbrukade. |
| Katalytisk | En av de viktigaste funktionerna hos proteiner. Tillhandahålls av proteiner - enzymer som påskyndar biokemiska reaktioner som sker i celler. Till exempel katalyserar ribulosbifosfatkarboxylas fixeringen av CO 2 under fotosyntes. |
Enzymer
Enzymer, eller enzymer, är en speciell klass av proteiner som är biologiska katalysatorer. Tack vare enzymer sker biokemiska reaktioner med enorm hastighet. Hastigheten för enzymatiska reaktioner är tiotusentals gånger (och ibland miljoner) högre än hastigheten för reaktioner som sker med deltagande av oorganiska katalysatorer. Ämnet som enzymet verkar på kallas substrat.
Enzymer är klotformiga proteiner, strukturella egenskaper enzymer kan delas in i två grupper: enkla och komplexa. Enkla enzymerär enkla proteiner, dvs. består endast av aminosyror. Komplexa enzymerär komplexa proteiner, dvs. Förutom proteindelen innehåller de en grupp av icke-proteinnatur - kofaktor. Vissa enzymer använder vitaminer som kofaktorer. Enzymmolekylen innehåller en speciell del som kallas det aktiva centret. Aktivt centrum- en liten del av enzymet (från tre till tolv aminosyrarester), där bindningen av substratet eller substraten sker för att bilda ett enzym-substratkomplex. När reaktionen är fullbordad bryts enzym-substratkomplexet ner till enzymet och reaktionsprodukten/-erna. Vissa enzymer har (förutom aktiva) allosteriska centra- områden till vilka enzymhastighetsregulatorer är fästa ( allosteriska enzymer).

Reaktioner av enzymatisk katalys kännetecknas av: 1) hög effektivitet, 2) strikt selektivitet och verkningsriktning, 3) substratspecificitet, 4) fin och exakt reglering. Substrat- och reaktionsspecificiteten för enzymatiska katalysreaktioner förklaras av hypoteserna av E. Fischer (1890) och D. Koshland (1959).
E. Fisher (nyckellåshypotes) föreslog att de rumsliga konfigurationerna av det aktiva stället för enzymet och substratet måste motsvara exakt varandra. Substratet jämförs med "nyckeln", enzymet med "låset".
D. Koshland (handskehypotes) föreslog att den rumsliga överensstämmelsen mellan strukturen av substratet och det aktiva centrumet av enzymet skapas endast i ögonblicket av deras interaktion med varandra. Denna hypotes kallas också inducerad överensstämmelsehypotes.
Hastigheten för enzymatiska reaktioner beror på: 1) temperatur, 2) enzymkoncentration, 3) substratkoncentration, 4) pH. Det bör betonas att eftersom enzymer är proteiner är deras aktivitet högst under fysiologiskt normala förhållanden.
De flesta enzymer kan bara arbeta vid temperaturer mellan 0 och 40°C. Inom dessa gränser ökar reaktionshastigheten ungefär 2 gånger för varje 10 °C ökning av temperaturen. Vid temperaturer över 40 °C denatureras proteinet och enzymaktiviteten minskar. Vid temperaturer nära fryspunkten inaktiveras enzymer.
När mängden substrat ökar, ökar hastigheten för den enzymatiska reaktionen tills antalet substratmolekyler är lika med antalet enzymmolekyler. Med en ytterligare ökning av mängden substrat kommer hastigheten inte att öka, eftersom enzymets aktiva centra är mättade. En ökning av enzymkoncentrationen leder till ökad katalytisk aktivitet, eftersom ett större antal substratmolekyler genomgår transformationer per tidsenhet.

För varje enzym finns det ett optimalt pH-värde vid vilket det uppvisar maximal aktivitet (pepsin - 2,0, salivamylas - 6,8, bukspottkörtellipas - 9,0). Vid högre eller lägre pH-värden minskar enzymaktiviteten. Vid plötsliga förändringar i pH denatureras enzymet.
Hastigheten hos allosteriska enzymer regleras av ämnen som fäster vid allosteriska centra. Om dessa ämnen påskyndar en reaktion kallas de aktivatorer, om de saktar ner - inhibitorer.
Klassificering av enzymer
Beroende på vilken typ av kemiska omvandlingar de katalyserar delas enzymer in i 6 klasser:
- oxireduktaser(överföring av väte, syre eller elektronatomer från ett ämne till ett annat - dehydrogenas),
- transferaser(överföring av metyl-, acyl-, fosfat- eller aminogrupp från en substans till en annan - transaminas),
- hydrolaser(hydrolysreaktioner där två produkter bildas från substratet - amylas, lipas),
- lyaser(icke-hydrolytisk tillägg till substratet eller lossning av en grupp atomer från det, i vilket fall C-C, C-N, C-O, C-S-bindningar kan brytas - dekarboxylas),
- isomeraser(intramolekylär omarrangering - isomeras),
- ligaser(kopplingen av två molekyler som ett resultat av bildandet av C-C, C-N, C-O, C-S bindningar - syntetas).
Klasser är i sin tur indelade i underklasser och underunderklasser. I den nuvarande internationella klassificeringen har varje enzym en specifik kod, bestående av fyra siffror åtskilda med punkter. Det första numret är klassen, det andra är underklassen, det tredje är underunderklassen, det fjärde är serienumret för enzymet i denna underklass, till exempel är arginaskoden 3.5.3.1.
Gå till föreläsningar nr 2"Struktur och funktioner av kolhydrater och lipider"
Gå till föreläsningar nr 4"Struktur och funktioner hos ATP-nukleinsyror"
Under första hälften av 1800-talet. många kemister, och bland dem i första hand J. von Liebig, kom så småningom till slutsatsen att proteiner representerar en speciell klass av kvävehaltiga föreningar. Namnet "proteiner" (från grekiska.
protos första) föreslogs 1840 av den holländska kemisten G. Mulder. FYSIKALISKA EGENSKAPER Proteiner är vita i fast tillstånd, men färglösa i lösning, såvida de inte bär någon form av kromofor (färgad) grupp, såsom hemoglobin. Lösligheten i vatten varierar mycket mellan olika proteiner. Det ändras också beroende på pH och koncentrationen av salter i lösningen, så det är möjligt att välja förhållanden under vilka ett protein selektivt kommer att fällas ut i närvaro av andra proteiner. Denna "utsaltning"-metod används i stor utsträckning för att isolera och rena proteiner. Det renade proteinet faller ofta ut ur lösningen som kristaller.Jämfört med andra föreningar är proteiners molekylvikt mycket stor, från flera tusen till många miljoner dalton. Därför sedimenteras proteiner under ultracentrifugering och i olika hastigheter. På grund av närvaron av positivt och negativt laddade grupper i proteinmolekyler rör sig de med olika hastigheter och i ett elektriskt fält. Detta är grunden för elektrofores, en metod som används för att isolera enskilda proteiner från komplexa blandningar. Proteiner renas också genom kromatografi.
KEMISKA EGENSKAPER Strukturera. Proteiner är polymerer, dvs. molekyler byggda som kedjor från upprepande monomerenheter, eller subenheter, vars roll de spelar a -aminosyror. Allmän formel för aminosyror där R en väteatom eller någon organisk grupp.En proteinmolekyl (polypeptidkedja) kan bestå av endast ett relativt litet antal aminosyror eller flera tusen monomerenheter. Kombinationen av aminosyror i en kedja är möjlig eftersom var och en av dem har två olika kemiska grupper: en aminogrupp med grundläggande egenskaper,
NH 2 och en sur karboxylgrupp, COOH. Båda dessa grupper är anslutna till a -kolatom. Karboxylgruppen i en aminosyra kan bilda en amid (peptid) bindning med aminogruppen i en annan aminosyra: Efter att två aminosyror har kopplats ihop på detta sätt kan kedjan förlängas genom att lägga till en tredje till den andra aminosyran, och så vidare. Som kan ses från ovanstående ekvation, när en peptidbindning bildas, frigörs en vattenmolekyl. I närvaro av syror, alkalier eller proteolytiska enzymer fortsätter reaktionen i motsatt riktning: polypeptidkedjan delas upp i aminosyror med tillsats av vatten. Denna reaktion kallas hydrolys. Hydrolys sker spontant och energi krävs för att koppla aminosyror till en polypeptidkedja.
Efter att två aminosyror har kopplats ihop på detta sätt kan kedjan förlängas genom att lägga till en tredje till den andra aminosyran, och så vidare. Som kan ses från ovanstående ekvation, när en peptidbindning bildas, frigörs en vattenmolekyl. I närvaro av syror, alkalier eller proteolytiska enzymer fortsätter reaktionen i motsatt riktning: polypeptidkedjan delas upp i aminosyror med tillsats av vatten. Denna reaktion kallas hydrolys. Hydrolys sker spontant och energi krävs för att koppla aminosyror till en polypeptidkedja. En karboxylgrupp och en amidgrupp (eller en liknande imidgrupp i fallet med aminosyran prolin) finns i alla aminosyror, men skillnaderna mellan aminosyror bestäms av gruppens eller "sidokedjans" natur. vilket anges ovan med bokstaven
R . Rollen av sidokedjan kan spelas av en väteatom, som i aminosyran glycin, eller av någon skrymmande grupp, som i histidin och tryptofan. Vissa sidokedjor är kemiskt inerta, medan andra är markant reaktiva.Många tusen olika aminosyror kan syntetiseras, och många olika aminosyror förekommer i naturen, men endast 20 typer av aminosyror används för proteinsyntes: alanin, arginin, asparagin, asparaginsyra, valin, histidin, glycin, glutamin, glutamin. syra, isoleucin, leucin, lysin, metionin, prolin, serin, tyrosin, treonin, tryptofan, fenylalanin och cystein (i proteiner kan cystein förekomma som en dimer
cystin). Visserligen innehåller vissa proteiner andra aminosyror utöver de regelbundet förekommande tjugo, men de bildas som ett resultat av modifiering av en av de tjugo listade efter att den har inkluderats i proteinet.Optisk aktivitet. Alla aminosyror, med undantag för glycin, har a -kolatomen har fyra olika grupper bundna till sig. Ur geometrisk synvinkel kan fyra olika grupper fästas på två sätt, och följaktligen finns det två möjliga konfigurationer, eller två isomerer, relaterade till varandra som ett objekt är till sin spegelbild, dvs. som vänster hand till höger. En konfiguration kallas vänster, eller vänsterhänt ( L ), och den andra höger, eller högervridande ( D ), eftersom två sådana isomerer skiljer sig åt i rotationsriktningen för planet för polariserat ljus. Finns bara i proteiner L -aminosyror (undantaget är glycin; det kan endast representeras i en form, eftersom två av dess fyra grupper är lika), och alla är optiskt aktiva (eftersom det bara finns en isomer). D -aminosyror är sällsynta i naturen; de finns i vissa antibiotika och i bakteriers cellvägg.Aminosyrasekvens. Aminosyror i en polypeptidkedja är inte ordnade slumpmässigt, utan i en viss bestämd ordning, och det är denna ordning som avgör proteinets funktioner och egenskaper. Genom att variera ordningen på de 20 typerna av aminosyror kan du skapa ett enormt antal olika proteiner, precis som du kan skapa många olika texter från bokstäverna i alfabetet.Tidigare tog det ofta flera år att fastställa aminosyrasekvensen för ett protein. Direkt beslutsamhet är fortfarande en ganska arbetskrävande uppgift, även om enheter har skapats som gör att det kan utföras automatiskt. Det är vanligtvis lättare att bestämma nukleotidsekvensen för motsvarande gen och härleda proteinets aminosyrasekvens från den. Hittills har aminosyrasekvenserna för många hundra proteiner redan bestämts. Funktionerna hos de dechiffrerade proteinerna är vanligtvis kända, och detta hjälper till att föreställa sig de möjliga funktionerna hos liknande proteiner som bildas, till exempel i maligna neoplasmer.
Komplexa proteiner. Proteiner som endast består av aminosyror kallas enkla. Ofta är dock en metallatom eller någon kemisk förening som inte är en aminosyra fäst till polypeptidkedjan. Sådana proteiner kallas komplexa. Ett exempel är hemoglobin: det innehåller järnporfyrin, som bestämmer dess röda färg och låter det fungera som en syrebärare.Namnen på de flesta komplexa proteiner indikerar arten av de bifogade grupperna: glykoproteiner innehåller sockerarter, lipoproteiner innehåller fetter. Om den katalytiska aktiviteten hos ett enzym beror på den anslutna gruppen, kallas det en protesgrupp. Ofta spelar ett vitamin rollen som en protesgrupp eller är en del av en. Vitamin A, till exempel, fäst till ett av proteinerna i näthinnan, bestämmer dess känslighet för ljus.
Tertiär struktur. Det viktiga är inte så mycket aminosyrasekvensen för själva proteinet (den primära strukturen), utan hur det är upplagt i rymden. Längs hela längden av polypeptidkedjan bildar vätejoner regelbundna vätebindningar, vilket ger den formen av en helix eller ett lager (sekundär struktur). Ur kombinationen av sådana spiraler och lager uppstår en kompakt form av nästa ordning: proteinets tertiära struktur. Runt bindningarna som håller monomerenheterna i kedjan är rotationer i små vinklar möjliga. Ur en rent geometrisk synvinkel är därför antalet möjliga konfigurationer för varje polypeptidkedja oändligt stort. I verkligheten existerar varje protein normalt i endast en konfiguration, bestäms av dess aminosyrasekvens. Denna struktur är inte stel, det är som om « andas” fluktuerar kring en viss genomsnittlig konfiguration. Kretsen viks till en konfiguration där fri energi (förmågan att producera arbete) är minimal, precis som en frigjord fjäder komprimeras endast till ett tillstånd som motsvarar den minsta fria energin. Ofta är en del av kedjan styvt kopplad till en annan av disulfid ( SS) bindningar mellan två cysteinrester. Det är delvis därför cystein spelar en särskilt viktig roll bland aminosyror.Komplexiteten i proteiners struktur är så stor att det ännu inte är möjligt att beräkna den tertiära strukturen för ett protein, även om dess aminosyrasekvens är känd. Men om det är möjligt att erhålla proteinkristaller, kan dess tertiära struktur bestämmas genom röntgendiffraktion.
I strukturella, kontraktila och vissa andra proteiner är kedjorna långsträckta och flera lätt vikta kedjor som ligger nära bildar fibriller; fibrillerna i sin tur viker sig till större formationer av fibrer. Men de flesta proteiner i lösning har en klotform: kedjorna är lindade i en kula, som garn i en boll. Fri energi med denna konfiguration är minimal, eftersom hydrofoba ("vattenavstötande") aminosyror är gömda inuti kulan och hydrofila ("vattenattraherande") aminosyror finns på dess yta.
Många proteiner är komplex av flera polypeptidkedjor. Denna struktur kallas proteinets kvartära struktur. Hemoglobinmolekylen, till exempel, består av fyra subenheter, som var och en är ett klotformigt protein.
Strukturella proteiner, på grund av sin linjära konfiguration, bildar fibrer som har en mycket hög draghållfasthet, medan den globulära konfigurationen gör att proteinerna kan ingå i specifika interaktioner med andra föreningar. På ytan av kulan, när kedjorna är korrekt utlagda, uppstår håligheter av en viss form där reaktiva kemiska grupper finns. Om ett givet protein är ett enzym, kommer en annan, vanligtvis mindre, molekyl av något ämne in i en sådan hålighet, precis som en nyckel går in i ett lås; i det här fallet förändras konfigurationen av molekylens elektronmoln under påverkan av de kemiska grupperna som finns i kaviteten, och detta tvingar den att reagera på ett visst sätt. På detta sätt katalyserar enzymet reaktionen. Antikroppsmolekyler har också håligheter i vilka olika främmande ämnen binds och därigenom oskadliggöras. "Lås och nyckel"-modellen, som förklarar interaktionen mellan proteiner och andra föreningar, gör att vi kan förstå specificiteten hos enzymer och antikroppar, d.v.s. deras förmåga att endast reagera med vissa föreningar.
Proteiner i olika typer av organismer. Proteiner som utför samma funktion hos olika arter av växter och djur och därför bär samma namn har också en liknande konfiguration. De skiljer sig dock något åt i sin aminosyrasekvens. När arter avviker från en gemensam förfader ersätts vissa aminosyror på vissa positioner av mutationer av andra. Skadliga mutationer som orsakar ärftliga sjukdomar elimineras genom naturligt urval, men fördelaktiga eller åtminstone neutrala sådana kan bestå. Ju närmare två biologiska arter är varandra, desto mindre skillnader finns i deras proteiner.Vissa proteiner förändras relativt snabbt, andra är mycket konserverade. Det senare inkluderar till exempel cytokrom Med ett respiratoriskt enzym som finns i de flesta levande organismer. Hos människor och schimpanser är dess aminosyrasekvenser identiska, och i cytokrom Med I vete var endast 38 % av aminosyrorna olika. Även om man jämför människor och bakterier, likheten mellan cytokromer Med(skillnaderna påverkar 65% av aminosyrorna här) kan fortfarande ses, även om den gemensamma förfadern till bakterier och människor levde på jorden för cirka två miljarder år sedan. Nuförtiden används ofta jämförelse av aminosyrasekvenser för att konstruera ett fylogenetiskt (släktträd) som återspeglar de evolutionära förhållandena mellan olika organismer.
Denaturering. Den syntetiserade proteinmolekylen, vikning, får sin karakteristiska konfiguration. Denna konfiguration kan emellertid förstöras genom upphettning, genom att ändra pH, genom exponering för organiska lösningsmedel, och till och med genom att helt enkelt skaka lösningen tills det uppstår bubblor på dess yta. Ett protein som modifierats på detta sätt kallas denaturerat; den förlorar sin biologiska aktivitet och blir vanligtvis olöslig. Välkända exempel på denaturerat protein är kokta ägg eller vispgrädde. Små proteiner som bara innehåller cirka hundra aminosyror är kapabla till renaturering, d.v.s. återskaffa den ursprungliga konfigurationen. Men de flesta proteiner förvandlas helt enkelt till en massa trassliga polypeptidkedjor och återställer inte sin tidigare konfiguration.En av de största svårigheterna med att isolera aktiva proteiner är deras extrema känslighet för denaturering. Denna egenskap hos proteiner finner användbar tillämpning vid konservering av livsmedel: hög temperatur denaturerar irreversibelt mikroorganismernas enzymer och mikroorganismerna dör.
PROTEINSYNTES För att syntetisera protein måste en levande organism ha ett system av enzymer som kan sammanfoga en aminosyra till en annan. En informationskälla behövs också för att avgöra vilka aminosyror som ska kombineras. Eftersom det finns tusentals typer av proteiner i kroppen och var och en av dem i genomsnitt består av flera hundra aminosyror, måste informationen som krävs verkligen vara enorm. Det lagras (liknande hur en inspelning lagras på ett magnetband) i de nukleinsyramolekyler som utgör gener. Centimeter . även ÄRFTLIG; NUKLEINSYROR.Enzymaktivering. En polypeptidkedja syntetiserad från aminosyror är inte alltid ett protein i sin slutliga form. Många enzymer syntetiseras först som inaktiva prekursorer och blir aktiva först efter att ett annat enzym tar bort flera aminosyror i ena änden av kedjan. Några av matsmältningsenzymerna, såsom trypsin, syntetiseras i denna inaktiva form; dessa enzymer aktiveras i matsmältningskanalen som ett resultat av avlägsnandet av det terminala fragmentet av kedjan. Hormonet insulin, vars molekyl i sin aktiva form består av två korta kedjor, syntetiseras i form av en kedja, den sk. proinsulin. Den mellersta delen av denna kedja avlägsnas sedan, och de återstående fragmenten binder samman för att bilda den aktiva hormonmolekylen. Komplexa proteiner bildas först efter att en specifik kemisk grupp fästs till proteinet, och denna bindning kräver ofta också ett enzym.Metabolisk cirkulation. Efter att ha matat ett djur med aminosyror märkta med radioaktiva isotoper av kol, kväve eller väte, införlivas märkningen snabbt i dess proteiner. Om märkta aminosyror slutar komma in i kroppen börjar mängden märkning i proteiner att minska. Dessa experiment visar att de resulterande proteinerna inte hålls kvar i kroppen förrän i slutet av livet. Alla, med få undantag, är i ett dynamiskt tillstånd, bryts ständigt ner till aminosyror och syntetiseras sedan igen.Vissa proteiner bryts ner när celler dör och förstörs. Detta händer hela tiden, till exempel med röda blodkroppar och epitelceller som kantar den inre ytan av tarmen. Dessutom sker nedbrytning och återsyntes av proteiner också i levande celler. Märkligt nog vet man mindre om nedbrytningen av proteiner än om deras syntes. Det är dock tydligt att nedbrytningen involverar proteolytiska enzymer liknande de som bryter ner proteiner till aminosyror i matsmältningskanalen.
Halveringstiden för olika proteiner varierar från flera timmar till många månader. Det enda undantaget är kollagenmolekylen. När de väl bildats förblir de stabila och förnyas inte eller byts ut. Med tiden förändras dock en del av deras egenskaper, i synnerhet elasticiteten, och eftersom de inte förnyas resulterar detta i vissa åldersrelaterade förändringar, såsom uppkomsten av rynkor på huden.
Syntetiska proteiner. Kemister har länge lärt sig att polymerisera aminosyror, men aminosyrorna kombineras på ett oordnat sätt, så att produkterna från en sådan polymerisation har liten likhet med naturliga. Det är sant att det är möjligt att kombinera aminosyror i en given ordning, vilket gör det möjligt att erhålla vissa biologiskt aktiva proteiner, särskilt insulin. Processen är ganska komplicerad, och på detta sätt är det möjligt att bara få de proteiner vars molekyler innehåller cirka hundra aminosyror. Det är att föredra istället att syntetisera eller isolera nukleotidsekvensen för en gen som motsvarar den önskade aminosyrasekvensen, och sedan introducera denna gen i en bakterie, som kommer att producera stora mängder av den önskade produkten genom replikation. Denna metod har emellertid också sina nackdelar. Centimeter . även GENETEKNIK. PROTEIN OCH NÄRING När proteiner i kroppen bryts ner till aminosyror kan dessa aminosyror användas igen för att syntetisera proteiner. Samtidigt är själva aminosyrorna föremål för nedbrytning, så de återanvänds inte helt. Det är också tydligt att under tillväxt, graviditet och sårläkning måste proteinsyntesen överstiga nedbrytningen. Kroppen förlorar kontinuerligt vissa proteiner; Dessa är proteinerna i hår, naglar och ytskiktet av huden. Därför, för att syntetisera proteiner, måste varje organism få aminosyror från maten. Gröna växter syntetiseras från CO 2 , vatten och ammoniak eller nitrater är alla 20 aminosyror som finns i proteiner. Många bakterier kan också syntetisera aminosyror i närvaro av socker (eller något motsvarande) och fixerat kväve, men socker tillförs i slutändan gröna växter. Djur har en begränsad förmåga att syntetisera aminosyror; de får aminosyror genom att äta gröna växter eller andra djur. I matsmältningskanalen bryts absorberade proteiner ner till aminosyror, de senare absorberas, och från dem byggs proteiner som är karakteristiska för en given organism. Inget av det absorberade proteinet är inkorporerat i kroppsstrukturer som sådant. Det enda undantaget är att hos många däggdjur kan vissa moderns antikroppar passera intakta genom moderkakan in i fostrets blodomlopp, och genom modersmjölken (särskilt hos idisslare) kan de överföras till det nyfödda barnet direkt efter födseln.Proteinbehov. Det är klart att för att upprätthålla livet måste kroppen få en viss mängd protein från maten. Omfattningen av detta behov beror dock på ett antal faktorer. Kroppen behöver mat både som energikälla (kalorier) och som material för att bygga upp sina strukturer. Behovet av energi kommer först. Detta innebär att när det finns lite kolhydrater och fetter i kosten, används dietproteiner inte för syntesen av sina egna proteiner, utan som en källa till kalorier. Under långvarig fasta används även dina egna proteiner för att tillfredsställa energibehovet. Om det finns tillräckligt med kolhydrater i kosten kan proteinkonsumtionen minskas.Kvävebalans. I genomsnitt ca. 16% av den totala massan av protein är kväve. När aminosyrorna som finns i proteiner bryts ned utsöndras kvävet de innehåller från kroppen i urinen och (i mindre utsträckning) i avföring i form av olika kvävehaltiga föreningar. Det är därför bekvämt att använda en indikator som kvävebalans för att bedöma kvaliteten på proteinnäring, d.v.s. skillnaden (i gram) mellan mängden kväve som kommer in i kroppen och mängden kväve som utsöndras per dag. Med normal näring hos en vuxen är dessa mängder lika. I en växande organism är mängden kväve som utsöndras mindre än den mottagna mängden, d.v.s. balansen är positiv. Om det är brist på protein i kosten är balansen negativ. Om det finns tillräckligt med kalorier i kosten, men det inte finns några proteiner i den, sparar kroppen proteiner. Samtidigt saktar proteinmetabolismen ner, och det upprepade utnyttjandet av aminosyror i proteinsyntesen sker med högsta möjliga effektivitet. Men förluster är oundvikliga och kvävehaltiga föreningar utsöndras fortfarande i urinen och delvis i avföringen. Mängden kväve som utsöndras från kroppen per dag under proteinfasta kan fungera som ett mått på daglig proteinbrist. Det är naturligt att anta att genom att införa en mängd protein som motsvarar denna brist i kosten kan kvävebalansen återställas. Det är det dock inte. Efter att ha fått denna mängd protein börjar kroppen att använda aminosyror mindre effektivt, så det krävs lite extra protein för att återställa kvävebalansen.Om mängden protein i kosten överstiger vad som är nödvändigt för att upprätthålla kvävebalansen, verkar det inte vara någon skada. Överskott av aminosyror används helt enkelt som en energikälla. Som ett särskilt slående exempel konsumerar eskimåerna få kolhydrater och ungefär tio gånger den mängd protein som krävs för att upprätthålla kvävebalansen. I de flesta fall är det dock inte fördelaktigt att använda protein som energikälla eftersom en viss mängd kolhydrater kan producera många fler kalorier än samma mängd protein. I fattiga länder får människor sina kalorier från kolhydrater och konsumerar minimala mängder protein.
Om kroppen får det nödvändiga antalet kalorier i form av icke-proteinprodukter, är den minsta mängden protein för att säkerställa upprätthållandet av kvävebalansen ca. 30 g per dag. Ungefär så mycket protein finns i fyra skivor bröd eller 0,5 liter mjölk. Ett lite större antal brukar anses vara optimalt; 50 till 70 g rekommenderas.
Essentiella aminosyror. Fram till nu har protein betraktats som en helhet. Under tiden måste alla nödvändiga aminosyror finnas i kroppen för att proteinsyntes ska kunna ske. Djurets kropp kan själv syntetisera några av aminosyrorna. De kallas utbytbara eftersom de inte nödvändigtvis behöver finnas i kosten, det är bara viktigt att den totala tillgången på protein som kvävekälla är tillräcklig; sedan, om det är brist på icke-essentiella aminosyror, kan kroppen syntetisera dem på bekostnad av de som finns i överskott. De återstående, "essentiella" aminosyrorna kan inte syntetiseras och måste tillföras kroppen genom mat. Viktiga för människor är valin, leucin, isoleucin, treonin, metionin, fenylalanin, tryptofan, histidin, lysin och arginin. (Även om arginin kan syntetiseras i kroppen, klassificeras det som en essentiell aminosyra eftersom det inte produceras i tillräckliga mängder hos nyfödda och växande barn. Å andra sidan kan vissa av dessa aminosyror från mat bli onödiga för en vuxen person.)Denna lista över essentiella aminosyror är ungefär densamma hos andra ryggradsdjur och till och med insekter. Proteiners näringsvärde bestäms vanligtvis genom att mata dem till växande råttor och övervaka djurens viktökning.
Näringsvärde av proteiner. Ett proteins näringsvärde bestäms av den essentiella aminosyra som är mest bristfällig. Låt oss illustrera detta med ett exempel. Proteinerna i vår kropp innehåller i genomsnitt ca. 2% tryptofan (i vikt). Låt oss säga att kosten innehåller 10 g protein som innehåller 1% tryptofan, och att det finns tillräckligt med andra essentiella aminosyror i den. I vårt fall är 10 g av detta ofullständiga protein väsentligen ekvivalent med 5 g komplett protein; de återstående 5 g kan bara fungera som en energikälla. Observera att eftersom aminosyror praktiskt taget inte lagras i kroppen, och för att proteinsyntes ska ske måste alla aminosyror vara närvarande samtidigt, kan effekten av intaget av essentiella aminosyror bara upptäckas om alla gå in i kroppen samtidigt. Den genomsnittliga sammansättningen av de flesta animaliska proteiner är nära den genomsnittliga sammansättningen av proteiner i människokroppen, så vi kommer sannolikt inte att möta aminosyrabrist om vår kost är rik på livsmedel som kött, ägg, mjölk och ost. Det finns dock proteiner, såsom gelatin (en produkt av kollagendenaturering), som innehåller mycket få essentiella aminosyror. Växtproteiner, även om de är bättre än gelatin i denna mening, är också fattiga på essentiella aminosyror; De är särskilt låga i lysin och tryptofan. Ändå kan en rent vegetarisk kost inte alls anses vara skadlig, om den inte förbrukar en något större mängd växtproteiner, tillräckligt för att förse kroppen med essentiella aminosyror. Växter innehåller mest protein i sina frön, särskilt i frön av vete och olika baljväxter. Unga skott, som sparris, är också rika på protein.Syntetiska proteiner i kosten. Genom att tillsätta små mängder syntetiska essentiella aminosyror eller aminosyrarika proteiner till ofullständiga proteiner, såsom majsproteiner, kan näringsvärdet av de senare ökas avsevärt, d.v.s. vilket ökar mängden protein som konsumeras. En annan möjlighet är att odla bakterier eller jäst på petroleumkolväten med tillsats av nitrater eller ammoniak som kvävekälla. Det mikrobiella proteinet som erhålls på detta sätt kan fungera som foder för fjäderfä eller boskap, eller kan direkt konsumeras av människor. Den tredje, mycket använda metoden använder idisslares fysiologi. Hos idisslare, i den inledande delen av magen, den sk. Vom är bebodd av speciella former av bakterier och protozoer som omvandlar ofullständiga växtproteiner till mer kompletta mikrobiella proteiner, och dessa i sin tur, efter matsmältning och absorption, omvandlas till animaliska proteiner. Urea, en billig syntetisk kvävehaltig förening, kan tillsättas till djurfoder. Mikroorganismer som lever i vommen använder ureakväve för att omvandla kolhydrater (som det finns mycket mer av i fodret) till protein. Ungefär en tredjedel av allt kväve i djurfoder kan komma i form av urea, vilket i huvudsak betyder, till viss del, kemisk syntes av protein. I USA spelar denna metod en viktig roll som ett av sätten att få fram protein.LITTERATUR Murray R., Grenner D., Mayes P., Rodwell W. Människans biokemi vol. 12. M., 1993Alberts B, Bray D, Lewis J, et al. Molekylär cellbiologi vol. 13. M., 1994
Biljett 2. 1. Väsentliga näringsfaktorer av lipid natur. Vissa lipider syntetiseras inte i människokroppen och är därför viktiga näringsfaktorer. Dessa inkluderar fettsyror med två eller flera dubbelbindningar (polyen) - essentiella fettsyror. Vissa av dessa syror är substrat för syntesen av lokala hormoner - eikosanoider (ämne 8.10).
Fettlösliga vitaminer utföra olika funktioner: vitamin A deltar i synprocessen, såväl som celltillväxt och differentiering; dess förmåga att hämma tillväxten av vissa typer av tumörer har bevisats; vitamin K deltar i blodkoagulering; vitamin D deltar i regleringen av kalciummetabolismen; vitamin E- antioxidant, hämmar bildandet av fria radikaler och motverkar därmed cellskador till följd av lipidperoxidation.
Dokumentera
2. Struktur och nivåer av strukturell organisation av proteiner
Det finns fyra nivåer av strukturell organisation av proteiner: primär, sekundär, tertiär och kvartär. Varje nivå har sina egna egenskaper.
Primär proteinstruktur
Den primära strukturen hos proteiner är en linjär polypeptidkedja av aminosyror sammankopplade med peptidbindningar. Primär struktur är den enklaste nivån av strukturell organisation av en proteinmolekyl. Hög stabilitet ges till den genom kovalenta peptidbindningar mellan α-aminogruppen i en aminosyra och α-karboxylgruppen i en annan aminosyra. [show].
Om iminogruppen av prolin eller hydroxiprolin är involverad i bildandet av en peptidbindning, har den en annan form [show].
När peptidbindningar bildas i celler aktiveras först karboxylgruppen i en aminosyra, och sedan kombineras den med aminogruppen i en annan. Laboratoriesyntes av polypeptider utförs på ungefär samma sätt.
En peptidbindning är ett repeterande fragment av en polypeptidkedja. Den har ett antal funktioner som påverkar inte bara formen på den primära strukturen, utan också de högre nivåerna av organisation av polypeptidkedjan:

samplanaritet - alla atomer som ingår i peptidgruppen är i samma plan;
förmågan att existera i två resonansformer (keto- eller enolform);
trans-position av substituenterna i förhållande till C-N-bindningen;
förmågan att bilda vätebindningar, och var och en av peptidgrupperna kan bilda två vätebindningar med andra grupper, inklusive peptidgrupper.
Undantaget är peptidgrupper som involverar aminogruppen av prolin eller hydroxiprolin. De kan bara bilda en vätebindning (se ovan). Detta påverkar bildandet av proteinets sekundära struktur. Polypeptidkedjan i området där prolin eller hydroxiprolin finns böjs lätt, eftersom den inte hålls som vanligt av en andra vätebindning.
Nomenklatur för peptider och polypeptider. Namnet på peptider består av namnen på deras ingående aminosyror. Två aminosyror bildar en dipeptid, tre bildar en tripeptid, fyra bildar en tetrapeptid, etc. Varje peptid eller polypeptidkedja av valfri längd har en N-terminal aminosyra som innehåller en fri aminogrupp och en C-terminal aminosyra som innehåller en fri karboxyl. grupp. Vid namngivning av polypeptider listas alla aminosyror sekventiellt, börjar med den N-terminala, och ersätter i deras namn, förutom den C-terminala, suffixet -in med -yl (eftersom aminosyrorna i peptider inte längre har en karboxylgrupp, men en karbonylgrupp). Till exempel, namnet som visas i fig. 1 tripeptid - leuc slam fenylalan slam threon i.
Funktioner hos proteinets primära struktur. I ryggraden i polypeptidkedjan alternerar stela strukturer (platta peptidgrupper) med relativt mobila regioner (-CHR), som kan rotera runt bindningar. Sådana strukturella egenskaper hos polypeptidkedjan påverkar dess rumsliga arrangemang.
Protein sekundär struktur
Sekundär struktur är ett sätt att vika en polypeptidkedja till en ordnad struktur på grund av bildandet av vätebindningar mellan peptidgrupper i samma kedja eller intilliggande polypeptidkedjor. Enligt deras konfiguration är sekundära strukturer uppdelade i spiralformade (α-helix) och skikt-veckade (β-struktur och kors-β-form).


a-helix. Detta är en typ av sekundär proteinstruktur som ser ut som en vanlig helix, bildad på grund av interpeptidvätebindningar inom en polypeptidkedja. Modellen för strukturen av a-helixen (fig. 2), som tar hänsyn till alla egenskaper hos peptidbindningen, föreslogs av Pauling och Corey. Huvuddragen hos α-helixen:
spiralformad konfiguration av polypeptidkedjan med spiralformad symmetri;
bildandet av vätebindningar mellan peptidgrupperna i varje första och fjärde aminosyrarest;
regelbundenhet i spiralvarv;
ekvivalensen av alla aminosyrarester i a-helixen, oavsett strukturen på deras sidoradikaler;
sidoradikaler av aminosyror deltar inte i bildandet av α-helixen.
Externt ser α-helixen ut som en något utdragen spiral av en elektrisk spis. Regelbundenheten hos vätebindningar mellan den första och fjärde peptidgruppen bestämmer regelbundenheten hos polypeptidkedjans varv. Höjden på ett varv, eller stigningen för a-helixen, är 0,54 nm; den inkluderar 3,6 aminosyrarester, dvs varje aminosyrarest rör sig längs axeln (höjden av en aminosyrarest) med 0,15 nm (0,54:3,6 = 0,15 nm), vilket gör att vi kan tala om ekvivalens av alla aminosyrarester i α-helixen. Regelbundenhetsperioden för en α-helix är 5 varv eller 18 aminosyrarester; längden på en period är 2,7 nm. Ris. 3. Pauling-Corey a-helix modell
β-struktur. Detta är en typ av sekundär struktur som har en lätt krökt konfiguration av polypeptidkedjan och som bildas av interpeptidvätebindningar inom individuella sektioner av en polypeptidkedja eller intilliggande polypeptidkedjor. Det kallas också en lagerveckstruktur. Det finns varianter av β-strukturer. De begränsade skiktade regionerna som bildas av en polypeptidkedja av ett protein kallas kors-β-form (kort β-struktur). Vätebindningar i kors-β-formen bildas mellan peptidgrupperna i polypeptidkedjans loopar. En annan typ - den fullständiga β-strukturen - är karakteristisk för hela polypeptidkedjan, som har en långsträckt form och hålls av interpeptidvätebindningar mellan intilliggande parallella polypeptidkedjor (fig. 3). Denna struktur liknar bälgen på ett dragspel. Dessutom är varianter av β-strukturer möjliga: de kan bildas av parallella kedjor (de N-terminala ändarna av polypeptidkedjorna är riktade i samma riktning) och antiparallella (de N-terminala ändarna är riktade i olika riktningar). Sidoradikalerna i ett skikt placeras mellan sidoradikalerna i ett annat skikt.
I proteiner är övergångar från α-strukturer till β-strukturer och tillbaka möjliga på grund av omarrangemang av vätebindningar. Istället för regelbundna interpeptidvätebindningar längs kedjan (tack vare polypeptidkedjan vrids till en spiral), lindas de spiralformade sektionerna upp och vätebindningar sluter sig mellan de långsträckta fragmenten av polypeptidkedjorna. Denna övergång finns i keratin, hårets protein. När man tvättar hår med alkaliska tvättmedel förstörs den spiralformade strukturen av β-keratin lätt och det förvandlas till α-keratin (lockigt hår rätar ut).
Förstörelsen av vanliga sekundära strukturer av proteiner (α-helixer och β-strukturer), analogt med smältningen av en kristall, kallas "smältning" av polypeptider. I det här fallet bryts vätebindningar och polypeptidkedjorna tar formen av en slumpmässig härva. Följaktligen bestäms stabiliteten hos sekundära strukturer av interpeptidvätebindningar. Andra typer av bindningar tar nästan ingen del i detta, med undantag för disulfidbindningar längs polypeptidkedjan på platserna för cysteinrester. Korta peptider sluts i cykler på grund av disulfidbindningar. Många proteiner innehåller både a-spiralformade regioner och β-strukturer. Det finns nästan inga naturliga proteiner som består av 100 % α-helix (undantaget är paramyosin, ett muskelprotein som är 96-100 % α-helix), medan syntetiska polypeptider har 100 % helix.
Andra proteiner har olika grader av lindning. En hög frekvens av α-helixstrukturer observeras i paramyosin, myoglobin och hemoglobin. I motsats härtill, i trypsin, ett ribonukleas, viks en betydande del av polypeptidkedjan till skiktade β-strukturer. Proteiner från stödjande vävnader: keratin (protein från hår, ull), kollagen (protein från senor, hud), fibroin (protein av naturligt siden) har en β-konfiguration av polypeptidkedjor. De olika graderna av helicitet hos polypeptidkedjorna av proteiner indikerar att det uppenbarligen finns krafter som delvis stör heliciteten eller "bryter" den regelbundna veckningen av polypeptidkedjan. Anledningen till detta är en mer kompakt veckning av proteinpolypeptidkedjan i en viss volym, dvs till en tertiär struktur.
Protein tertiär struktur
Den tertiära strukturen av ett protein är hur polypeptidkedjan är ordnad i rymden. Baserat på formen på deras tertiära struktur delas proteiner huvudsakligen in i globulära och fibrillära. Globulära proteiner har oftast en ellipsoid form, och fibrillära (trådliknande) proteiner har en långsträckt form (stav- eller spindelform).
Konfigurationen av den tertiära strukturen hos proteiner ger dock ännu inte anledning att tro att fibrillära proteiner endast har en β-struktur, och globulära proteiner har en α-helixstruktur. Det finns fibrillära proteiner som har en spiralformad, snarare än skiktad, veckad sekundär struktur. Till exempel hör α-keratin och paramyosin (protein från obturatormuskeln hos blötdjur), tropomyosiner (proteiner i skelettmuskler) till fibrillära proteiner (har en stavform), och deras sekundära struktur är α-helix; däremot kan globulära proteiner innehålla ett stort antal β-strukturer.
Spiralisering av en linjär polypeptidkedja minskar dess storlek med ungefär 4 gånger; och packning i den tertiära strukturen gör den tiotals gånger mer kompakt än den ursprungliga kedjan.
Bindningar som stabiliserar den tertiära strukturen hos ett protein. Bindningar mellan sidoradikaler av aminosyror spelar en roll för att stabilisera den tertiära strukturen. Dessa anslutningar kan delas in i:
stark (kovalent) [show].
svag (polär och van der Waals) [show].
Många bindningar mellan aminosyrornas sidoradikaler bestämmer den rumsliga konfigurationen av proteinmolekylen.
Funktioner i organisationen av protein tertiär struktur. Konformationen av den tertiära strukturen av polypeptidkedjan bestäms av egenskaperna hos sidoradikalerna i aminosyrorna som ingår i den (som inte har en märkbar effekt på bildandet av primära och sekundära strukturer) och mikromiljön, dvs. miljö. När den är veckad tenderar polypeptidkedjan i ett protein att anta en energimässigt gynnsam form, kännetecknad av ett minimum av fri energi. Därför bildar opolära R-grupper, som "undviker" vatten, så att säga den inre delen av proteinets tertiära struktur, där huvuddelen av de hydrofoba resterna av polypeptidkedjan finns. Det finns nästan inga vattenmolekyler i mitten av proteinkulan. De polära (hydrofila) R-grupperna i aminosyran är belägna utanför denna hydrofoba kärna och är omgivna av vattenmolekyler. Polypeptidkedjan är intrikat böjd i tredimensionellt utrymme. När den böjs störs den sekundära spiralformade konformationen. Kedjan "bryts" vid svaga punkter där prolin eller hydroxiprolin finns, eftersom dessa aminosyror är mer rörliga i kedjan och bildar endast en vätebindning med andra peptidgrupper. Ett annat böjställe är glycin, som har en liten R-grupp (väte). Därför tenderar R-grupperna av andra aminosyror, när de är staplade, att uppta det fria utrymmet vid platsen för glycin. Ett antal aminosyror - alanin, leucin, glutamat, histidin - bidrar till bevarandet av stabila spiralformade strukturer i protein, och såsom metionin, valin, isoleucin, asparaginsyra gynnar bildandet av β-strukturer. I en proteinmolekyl med tertiär konfiguration finns regioner i form av α-helixar (spiralformade), β-strukturer (skiktade) och en slumpmässig spole. Endast det korrekta rumsliga arrangemanget av proteinet gör det aktivt; dess kränkning leder till förändringar i proteinegenskaper och förlust av biologisk aktivitet.
Kvartär proteinstruktur
Proteiner som består av en polypeptidkedja har endast tertiär struktur. Dessa inkluderar myoglobin - ett muskelvävnadsprotein som är involverat i bindningen av syre, ett antal enzymer (lysozym, pepsin, trypsin, etc.). Vissa proteiner är dock uppbyggda av flera polypeptidkedjor, som var och en har en tertiär struktur. För sådana proteiner har begreppet kvartär struktur introducerats, vilket är organiseringen av flera polypeptidkedjor med en tertiär struktur till en enda funktionell proteinmolekyl. Ett sådant protein med en kvartär struktur kallas en oligomer, och dess polypeptidkedjor med en tertiär struktur kallas protomerer eller subenheter (Fig. 4).

På den kvartära organisationsnivån behåller proteiner den grundläggande konfigurationen av den tertiära strukturen (globulär eller fibrillär). Hemoglobin är till exempel ett protein med en kvartär struktur och består av fyra subenheter. Var och en av subenheterna är ett globulärt protein och i allmänhet har hemoglobin också en globulär konfiguration. Hår- och ullproteiner - keratiner, besläktade i tertiär struktur till fibrillära proteiner, har en fibrillär konformation och en kvartär struktur.
Stabilisering av proteins kvartära struktur. Alla proteiner som har en kvartär struktur isoleras i form av enskilda makromolekyler som inte bryts ner till subenheter. Kontakter mellan ytorna på subenheter är möjliga endast på grund av de polära grupperna av aminosyrarester, eftersom under bildandet av den tertiära strukturen av var och en av polypeptidkedjorna, sidoradikaler av opolära aminosyror (som utgör majoriteten av alla proteinogena aminosyror) är gömda inuti subenheten. Många joniska (salt), väte och i vissa fall disulfidbindningar bildas mellan deras polära grupper, som stadigt håller underenheterna i form av ett organiserat komplex. Användningen av ämnen som bryter vätebindningar eller ämnen som reducerar disulfidbryggor orsakar sönderdelning av protomerer och förstörelse av proteinets kvartära struktur. I tabell 1 sammanfattar data om de bindningar som stabiliserar olika nivåer av organisering av proteinmolekylen [show].
Funktioner i den strukturella organisationen av vissa fibrillära proteiner
Den strukturella organisationen av fibrillära proteiner har ett antal egenskaper jämfört med globulära proteiner. Dessa egenskaper kan ses i exemplet med keratin, fibroin och kollagen. Keratiner finns i α- och β-konformationer. α-Keratiner och fibroin har en skiktad veckad sekundär struktur, men i keratin är kedjorna parallella och i fibroin är de antiparallella (se fig. 3); Dessutom innehåller keratin disulfidbindningar mellan kedjorna, medan fibroin inte har dem. Brytning av disulfidbindningar leder till separation av polypeptidkedjor i keratiner. Tvärtom skapar bildningen av det maximala antalet disulfidbindningar i keratiner genom exponering för oxidationsmedel en stark rumslig struktur. I allmänhet är det i fibrillära proteiner, till skillnad från globulära proteiner, ibland svårt att strikt skilja mellan olika organisationsnivåer. Om vi accepterar (som för ett globulärt protein) att den tertiära strukturen ska bildas genom att lägga en polypeptidkedja i rymden, och den kvartära strukturen av flera kedjor, så är flera polypeptidkedjor involverade i fibrillära proteiner redan under bildandet av den sekundära strukturen . Ett typiskt exempel på ett fibrillärt protein är kollagen, som är ett av de mest förekommande proteinerna i människokroppen (cirka 1/3 av massan av alla proteiner). Det finns i vävnader som har hög styrka och låg töjbarhet (ben, senor, hud, tänder, etc.). I kollagen är en tredjedel av aminosyraresterna glycin, och ungefär en fjärdedel eller något mer är prolin eller hydroxiprolin.

Den isolerade polypeptidkedjan av kollagen (primär struktur) ser ut som en bruten linje. Den innehåller cirka 1000 aminosyror och har en molekylvikt av cirka 105 (Fig. 5, a, b). Polypeptidkedjan är uppbyggd av en återkommande trio av aminosyror (triplett) med följande sammansättning: gly-A-B, där A och B är alla andra aminosyror än glycin (oftast prolin och hydroxiprolin). Kollagenpolypeptidkedjor (eller a-kedjor) under bildningen av sekundära och tertiära strukturer (fig. 5, c och d) kan inte producera typiska a-helixar med spiralformad symmetri. Prolin, hydroxiprolin och glycin (antiheliska aminosyror) stör detta. Därför bildar tre α-kedjor, så att säga, tvinnade spiraler, som tre trådar som lindas runt en cylinder. Tre spiralformade α-kedjor bildar en upprepad kollagenstruktur som kallas tropokollagen (Fig. 5d). Tropocollagen i dess organisation är den tertiära strukturen av kollagen. De platta ringarna av prolin och hydroxiprolin som regelbundet alternerar längs kedjan ger den stelhet, liksom bindningarna mellan kedjorna mellan α-kedjorna av tropokollagen (vilket är anledningen till att kollagen är resistent mot stretching). Tropokollagen är i huvudsak en underenhet av kollagenfibriller. Inläggningen av tropokollagensubenheter i den kvartära strukturen av kollagen sker på ett stegvis sätt (fig. 5e).
Stabilisering av kollagenstrukturer sker på grund av väte-, jon- och van der Waals-bindningar mellan kedjorna och ett litet antal kovalenta bindningar.
α-kedjorna av kollagen har olika kemiska strukturer. Det finns olika typer av α 1-kedjor (I, II, III, IV) och α 2-kedjor. Beroende på vilka α 1 - och α 2 -kedjor som är involverade i bildandet av den tresträngade helixen av tropokollagen, särskiljs fyra typer av kollagen:
den första typen - två ai (I) och en a2-kedja;
den andra typen - tre ai(II)-kedjor;
tredje typen - tre ai(III)-kedjor;
fjärde typen - tre α 1 (IV) kedjor.
Det vanligaste kollagenet är den första typen: det finns i benvävnad, hud, senor; kollagen typ 2 finns i broskvävnad etc. En typ av vävnad kan innehålla olika typer av kollagen.
Den ordnade aggregationen av kollagenstrukturer, deras styvhet och tröghet säkerställer kollagenfibrernas höga styrka. Kollagenproteiner innehåller också kolhydratkomponenter, det vill säga de är protein-kolhydratkomplex.
Kollagen är ett extracellulärt protein som bildas av bindvävsceller som finns i alla organ. Därför, med skada på kollagen (eller störning av dess bildning), uppstår flera kränkningar av stödfunktionerna hos organens bindväv.
Alfa-polypeptidkedjan slutar med aminosyrakombinationen valin-leucin, och beta-polypeptidkedjan slutar med kombinationen valin-histidin-leucin. Alfa- och betapolypeptidkedjorna i hemoglobinmolekylen är inte arrangerade linjärt, detta är den primära strukturen. På grund av förekomsten av intramolekylära krafter vrids polypeptidkedjor i form av en alfa-helix helix (sekundär struktur) typisk för proteiner. Själva alfa-helix-helixen böjer sig rumsligt för varje alfa- och betapolypeptidkedja och bildar plexusar med en äggformad form (tertiär struktur). Enskilda delar av polypeptidkedjornas alfa-helixspiraler är markerade med latinska bokstäver från A till H. Alla fyra tertiärt krökta alfa- och betapolypeptidkedjorna är belägna rumsligt i ett visst förhållande - en kvartär struktur. De är inte förbundna med verkliga kemiska bindningar, utan av intermolekylära krafter.
Det visade sig att människor har tre huvudtyper av normalt hemoglobin: embryonalt - U, foster - F och vuxenhemoglobin - A. HbU (uppkallad efter den första bokstaven i ordet livmoder) förekommer i embryot mellan 7 och 12 veckor av livet, sedan försvinner det och uppträder fosterhemoglobin, som efter den tredje månaden är fostrets huvudsakliga hemoglobin. Efter detta uppstår gradvis vanligt vuxenhemoglobin, kallat HbA, efter den första bokstaven i det engelska ordet "adult". Mängden fosterhemoglobin minskar gradvis, så att vid födseln är 80% av hemoglobinet HbA och endast 20% är HbF. Efter födseln fortsätter fostrets hemoglobin att minska och efter 2–3 år av livet är det bara 1–2 %. Samma mängd fosterhemoglobin finns hos en vuxen. En mängd HbF som överstiger 2 % anses vara patologisk för en vuxen och för barn över 3 år.
Förutom normala typer av hemoglobin är över 50 patologiska varianter för närvarande kända. De namngavs först med latinska bokstäver. Bokstaven B saknas i beteckningen av hemoglobintyper, eftersom den ursprungligen betecknade HbS.
Hemoglobin (Hb)- ett kromoprotein som finns i röda blodkroppar och som är involverat i transporten av syre till vävnader. Hemoglobin hos vuxna kallas hemoglobin A (Hb A). Dess molekylvikt är cirka 65 000 Da. Hb A-molekylen har en kvartär struktur och inkluderar fyra subenheter - polypeptidkedjor (betecknade α1, α2, β1 och β2, som var och en är associerad med hem.
Kom ihåg att hemoglobin är ett allosteriskt protein; dess molekyler kan reversibelt ändras från en konformation till en annan. Detta ändrar proteinets affinitet för ligander. Konformationen med minst affinitet för liganden kallas spänningen eller T-konformationen. Konformationen med störst affinitet för liganden kallas den avslappnade eller R-konformationen.
Hemoglobinmolekylens R- och T-konformationer är i ett tillstånd av dynamisk jämvikt:
Olika miljöfaktorer kan förskjuta denna balans i en eller annan riktning. Allosteriska regulatorer som påverkar affiniteten av Hb för O2 är: 1) syre; 2) H+-koncentration (medium pH); 3) koldioxid (CO2); 4) 2,3-difosfoglycerat (DPG). Fästningen av en syremolekyl till en av hemoglobinsubenheterna främjar övergången av en spänd konformation till en avslappnad och ökar affiniteten för syre hos andra subenheter av samma hemoglobinmolekyl. Detta fenomen kallas den kooperativa effekten. Den komplexa karaktären av bindningen av hemoglobin till syre reflekteras av hemoglobin O2-mättnadskurvan, som har en S-form (Figur 3.1).

Figur 3.1. Kurvor av myoglobin (1) och hemoglobin (2) syremättnad.
Molekylära former hemoglobin skiljer sig från varandra i strukturen av polypeptidkedjorna. Ett exempel på en sådan variation av hemoglobin som existerar under fysiologiska förhållanden är fosterhemoglobin (HbF), närvarande i blodet under det embryonala skedet av mänsklig utveckling. Till skillnad från HbA innehåller dess molekyl 2 α- och 2 y-kedjor (det vill säga β-kedjor är ersatta av γ-kedjor). Sådant hemoglobin har en högre affinitet för syre. Det är detta som gör att embryot kan ta emot syre från moderns blod genom moderkakan. Strax efter födseln ersätts HbF i barnets blod med HbA.
Ett exempel på onormalt eller patologiskt hemoglobin är det redan nämnda (se 2.4.) hemoglobin S, som finns hos patienter med sicklecellanemi. Som du redan vet skiljer det sig från hemoglobin A genom att ersätta glutamat med valin i β-kedjorna. Denna aminosyrasubstitution orsakar en minskning av lösligheten av HbS i vatten och en minskning av dess affinitet för O2.
Som ni vet är proteiner grunden för livets ursprung på vår planet. Men det var koacervatdroppen, bestående av peptidmolekyler, som blev grunden för levande varelsers ursprung. Detta är utom tvivel, eftersom analys av den interna sammansättningen av alla representanter för biomassa visar att dessa ämnen finns i allt: växter, djur, mikroorganismer, svampar, virus. Dessutom är de mycket olika och makromolekylära till sin natur.
Dessa strukturer har fyra namn, alla är synonymer:
- proteiner;
- proteiner;
- polypeptider;
- peptider.
Proteinmolekyler
Deras antal är verkligen oräkneligt. I det här fallet kan alla proteinmolekyler delas in i två stora grupper:
- enkel - består endast av aminosyrasekvenser förbundna med peptidbindningar;
- komplex - proteinets struktur och struktur kännetecknas av ytterligare protolytiska (protetiska) grupper, även kallade kofaktorer.
Samtidigt har komplexa molekyler också sin egen klassificering.
Gradering av komplexa peptider
- Glykoproteiner är närbesläktade föreningar av protein och kolhydrater. Protetiska grupper av mukopolysackarider vävs in i molekylens struktur.
- Lipoproteiner är en komplex förening av protein och lipid.
- Metalloproteiner - metalljoner (järn, mangan, koppar och andra) fungerar som en protesgrupp.
- Nukleoproteiner är kopplingen mellan protein och nukleinsyror (DNA, RNA).
- Fosfoproteiner - konformation av ett protein och en ortofosforsyrarest.
- Kromoproteiner är mycket lika metalloproteiner, men elementet som är en del av protesgruppen är ett helfärgat komplex (rött - hemoglobin, grönt - klorofyll, och så vidare).
I varje betraktad grupp är strukturen och egenskaperna hos proteiner olika. De funktioner de utför varierar också beroende på typen av molekyl.

Kemisk struktur av proteiner
Ur denna synvinkel är proteiner en lång, massiv kedja av aminosyrarester kopplade till varandra genom specifika bindningar som kallas peptidbindningar. Grenar som kallas radikaler sträcker sig från sidostrukturerna av syror. Denna molekylära struktur upptäcktes av E. Fischer i början av 2000-talet.
Senare studerades proteiner, proteiners struktur och funktioner mer i detalj. Det blev tydligt att det bara finns 20 aminosyror som bildar peptidens struktur, men de kan kombineras på en mängd olika sätt. Därav mångfalden av polypeptidstrukturer. Dessutom, i livets process och när de utför sina funktioner, kan proteiner genomgå ett antal kemiska omvandlingar. Som ett resultat ändrar de strukturen, och en helt ny typ av anslutning dyker upp.
För att bryta peptidbindningen, det vill säga att störa proteinet och kedjornas struktur, måste du välja mycket stränga villkor (höga temperaturer, syror eller alkalier, en katalysator). Detta beror på den höga styrkan i molekylen, nämligen i peptidgruppen.

Detektering av proteinstruktur i laboratoriet utförs med hjälp av biuretreaktionen - exponering för nyutfälld polypeptid (II). Komplexet av peptidgruppen och kopparjonen ger en ljus lila färg.
Det finns fyra huvudsakliga strukturella organisationer, som var och en har sina egna strukturella egenskaper hos proteiner.
Organisationsnivåer: primär struktur
Som nämnts ovan är en peptid en sekvens av aminosyrarester med eller utan inneslutningar, koenzymer. Så det primära är strukturen hos en molekyl som är naturliga, naturliga, verkligen aminosyror sammankopplade med peptidbindningar, och inget mer. Det vill säga en polypeptid med linjär struktur. Dessutom är de strukturella egenskaperna hos proteiner av denna typ att en sådan kombination av syror är avgörande för att utföra proteinmolekylens funktioner. Tack vare närvaron av dessa funktioner är det möjligt att inte bara identifiera en peptid, utan också att förutsäga egenskaperna och rollen för en helt ny, ännu inte upptäckt. Exempel på peptider med en naturlig primär struktur är insulin, pepsin, kymotrypsin och andra.

Sekundär konformation
Strukturen och egenskaperna hos proteiner i denna kategori varierar något. En sådan struktur kan bildas initialt av naturen eller när den primära utsätts för svår hydrolys, temperatur eller andra förhållanden.
Denna konformation har tre varianter:
- Jämna, regelbundna, stereoregelbundna svängar, byggda av aminosyrarester, som vrider sig runt anslutningens huvudaxel. De hålls samman endast av de som uppstår mellan syret i en peptidgrupp och vätet i en annan. Dessutom anses strukturen vara korrekt på grund av det faktum att svängarna upprepas jämnt var fjärde länk. En sådan struktur kan vara antingen vänsterhänt eller högerhänt. Men i de flesta kända proteiner dominerar den högervridande isomeren. Sådana konformationer brukar kallas alfastrukturer.
- Sammansättningen och strukturen av proteiner av nästa typ skiljer sig från den föregående genom att vätebindningar bildas inte mellan rester som gränsar till ena sidan av molekylen, utan mellan betydligt avlägsna sådana och på ett ganska stort avstånd. Av denna anledning tar hela strukturen formen av flera vågiga, ormliknande polypeptidkedjor. Det finns en egenskap som ett protein måste uppvisa. Strukturen av aminosyror på grenarna bör vara så kort som möjligt, som glycin eller alanin, till exempel. Denna typ av sekundär konformation kallas beta-ark för deras förmåga att hålla ihop för att bilda en gemensam struktur.
- Biologi hänvisar till den tredje typen av proteinstruktur som komplexa, heterogent spridda, oordnade fragment som inte har stereoregularitet och som kan ändra struktur under påverkan av yttre förhållanden.
Inga exempel på proteiner som naturligt har sekundär struktur har identifierats.

Högskoleutbildning
Detta är en ganska komplex konformation som kallas "klot". Vad är detta för protein? Dess struktur är baserad på den sekundära strukturen, men nya typer av interaktioner mellan atomerna i grupperna läggs till, och hela molekylen tycks vika sig, vilket fokuserar på det faktum att de hydrofila grupperna är riktade in i kulan, och de hydrofoba sådana utåt.
Detta förklarar laddningen av proteinmolekylen i kolloidala lösningar av vatten. Vilka typer av interaktioner finns här?
- Vätebindningar - förblir oförändrade mellan samma delar som i sekundärstrukturen.
- interaktioner - uppstår när polypeptiden löses i vatten.
- Joniska attraktioner bildas mellan olika laddade grupper av aminosyrarester (radikaler).
- Kovalenta interaktioner - kan bildas mellan specifika sura platser - cysteinmolekyler, eller snarare deras svansar.
Således kan sammansättningen och strukturen av proteiner med en tertiär struktur beskrivas som polypeptidkedjor vikta till kulor som bibehåller och stabiliserar sin konformation på grund av olika typer av kemiska interaktioner. Exempel på sådana peptider: fosfoglyceratkenas, tRNA, alfa-keratin, silkesfibroin och andra.
Kvartär struktur
Detta är en av de mest komplexa kulorna som proteiner bildar. Strukturen och funktionerna hos proteiner av denna typ är mycket mångfacetterade och specifika.
Vad är denna konformation? Dessa är flera (i vissa fall dussintals) stora och små polypeptidkedjor som bildas oberoende av varandra. Men sedan, på grund av samma interaktioner som vi övervägde för den tertiära strukturen, vrider och flätar alla dessa peptider ihop sig med varandra. På detta sätt erhålls komplexa konformationskulor, som kan innehålla metallatomer, lipidgrupper och kolhydrater. Exempel på sådana proteiner: DNA-polymeras, tobaksvirusets proteinskal, hemoglobin och andra.

Alla peptidstrukturer vi undersökte har sina egna metoder för identifiering i laboratoriet, baserade på moderna möjligheter att använda kromatografi, centrifugering, elektron- och optisk mikroskopi och hög datorteknik.
Utförda funktioner
Strukturen och funktionerna hos proteiner är nära korrelerade med varandra. Det vill säga att varje peptid spelar en specifik roll, unik och specifik. Det finns också de som kan utföra flera betydande operationer samtidigt i en levande cell. Det är dock möjligt att uttrycka i en generaliserad form huvudfunktionerna hos proteinmolekyler i levande organismer:
- Ger rörelse. Encelliga organismer, eller organeller, eller vissa typer av celler är kapabla till rörelse, sammandragning och rörelse. Detta säkerställs av proteiner som utgör strukturen av deras motoriska apparat: flimmerhår, flageller och cytoplasmatiskt membran. Om vi talar om celler som inte kan röra sig, kan proteiner bidra till deras sammandragning (muskelmyosin).
- Närings- eller reservfunktion. Det är ackumuleringen av proteinmolekyler i ägg, embryon och frön från växter för att ytterligare fylla på saknade näringsämnen. När de bryts ned producerar peptider aminosyror och biologiskt aktiva ämnen som är nödvändiga för den normala utvecklingen av levande organismer.
- Energifunktion. Förutom kolhydrater kan proteiner också ge styrka till kroppen. Nedbrytningen av 1 g peptid frisätter 17,6 kJ användbar energi i form av adenosintrifosforsyra (ATP), som spenderas på vitala processer.
- Signalering består av att noggrant övervaka pågående processer och sända signaler från celler till vävnader, från dem till organ, från de senare till system osv. Ett typiskt exempel är insulin, som strikt fixerar mängden glukos i blodet.
- Receptorfunktion. Det utförs genom att ändra konformationen av peptiden på ena sidan av membranet och involvera den andra änden i omstruktureringen. Samtidigt sänds signalen och nödvändig information. Oftast är sådana proteiner inbäddade i cellernas cytoplasmatiska membran och utövar strikt kontroll över alla ämnen som passerar genom det. De ger också information om kemiska och fysiska förändringar i miljön.
- Peptiders transportfunktion. Det utförs av kanalproteiner och transportproteiner. Deras roll är uppenbar - att transportera nödvändiga molekyler till platser med låg koncentration från delar med hög koncentration. Ett typiskt exempel är transporten av syre och koldioxid genom organ och vävnader med proteinet hemoglobin. De utför också leverans av föreningar med låg molekylvikt genom cellmembranet in i det inre.
- Strukturell funktion. En av de viktigaste funktionerna som utförs av protein. Strukturen av alla celler och deras organeller säkerställs av peptider. De, som en ram, sätter formen och strukturen. Dessutom stödjer de det och modifierar det vid behov. Därför, för tillväxt och utveckling, kräver alla levande organismer proteiner i sin kost. Sådana peptider inkluderar elastin, tubulin, kollagen, aktin, keratin och andra.
- Katalytisk funktion. Det utförs av enzymer. De är många och varierande och accelererar alla kemiska och biokemiska reaktioner i kroppen. Utan deras medverkan kunde ett vanligt äpple i magen smältas på bara två dagar, och troligen ruttna under processen. Under påverkan av katalas, peroxidas och andra enzymer sker denna process på två timmar. I allmänhet är det tack vare denna roll av proteiner som anabolism och katabolism utförs, det vill säga plast och

Skyddande roll
Det finns flera typer av hot från vilka proteiner är utformade för att skydda kroppen.
För det första traumatiska reagenser, gaser, molekyler, ämnen med olika verkningsspektrum. Peptider kan interagera kemiskt med dem, omvandla dem till en ofarlig form eller helt enkelt neutralisera dem.
För det andra, det fysiska hotet från sår - om proteinet fibrinogen inte omvandlas till fibrin på platsen för skadan i tid, kommer blodet inte att koagulera, vilket innebär att blockering inte kommer att inträffa. Då behöver du tvärtom peptiden plasmin, som kan lösa upp koageln och återställa kärlets öppenhet.
För det tredje, ett hot mot immuniteten. Strukturen och betydelsen av proteiner som bildar immunförsvar är extremt viktiga. Antikroppar, immunglobuliner, interferoner - alla dessa är viktiga och betydelsefulla delar av det mänskliga lymf- och immunsystemet. Varje främmande partikel, skadlig molekyl, död del av en cell eller en hel struktur är föremål för omedelbar undersökning av peptidföreningen. Det är därför en person självständigt, utan hjälp av mediciner, kan skydda sig dagligen från infektioner och enkla virus.
Fysikaliska egenskaper
Strukturen hos ett cellprotein är mycket specifik och beror på vilken funktion som utförs. Men de fysikaliska egenskaperna hos alla peptider är lika och kokar ner till följande egenskaper.
- Molekylens vikt är upp till 1 000 000 Dalton.
- Kolloidala system bildas i en vattenlösning. Där får strukturen en laddning som kan variera beroende på surheten i miljön.
- När de utsätts för svåra förhållanden (bestrålning, syra eller alkali, temperatur, etc.) kan de flytta till andra nivåer av konformationer, det vill säga denaturera. Denna process är irreversibel i 90% av fallen. Men det finns också en omvänd förskjutning - renaturering.
Dessa är huvudegenskaperna hos peptidernas fysiska egenskaper.