São compostos orgânicos de alto peso molecular, biopolímeros, construídos a partir de 20 tipos de resíduos de L-?-aminoácidos conectados em uma determinada sequência em longas cadeias. O peso molecular das proteínas varia de 5 mil a 1 milhão. O nome “brancos” foi dado pela primeira vez à substância dos ovos de aves, que coagula quando aquecido em uma massa branca insolúvel. O termo foi posteriormente estendido a outras substâncias com propriedades semelhantes isoladas de animais e plantas.
Arroz. 1. Os biopolímeros mais complexos são as proteínas. Suas macromoléculas consistem em monômeros, que são aminoácidos. Cada aminoácido possui dois grupos funcionais: um grupo carboxila e um grupo amino. Toda a diversidade de proteínas é criada a partir de diferentes combinações de 20 aminoácidos.
As proteínas predominam sobre todos os outros compostos presentes nos organismos vivos, geralmente representando mais da metade do seu peso seco. Supõe-se que existam vários bilhões de proteínas individuais na natureza (por exemplo, mais de 3 mil proteínas diferentes estão presentes apenas na bactéria E. coli).
As proteínas desempenham um papel fundamental nos processos vitais de qualquer organismo. As proteínas incluem enzimas, com a participação das quais ocorrem todas as transformações químicas na célula (metabolismo); controlam a ação dos genes; com a participação deles, realiza-se a ação dos hormônios, realiza-se o transporte transmembrana, incluindo a geração de impulsos nervosos. Eles são parte integrante do sistema imunológico (imunoglobulinas) e do sistema de coagulação, formam a base do osso e do tecido conjuntivo e estão envolvidos na transformação e utilização de energia.
História da pesquisa de proteínas
As primeiras tentativas de isolar proteínas foram feitas no século XVIII. No início do século XIX surgiram os primeiros trabalhos sobre o estudo químico das proteínas. Os cientistas franceses Joseph Louis Gay-Lussac e Louis Jacques Thénard tentaram estabelecer a composição elementar das proteínas de diferentes fontes, o que marcou o início de estudos analíticos sistemáticos, graças aos quais se concluiu que todas as proteínas são semelhantes no conjunto de elementos incluídos em sua composição. Em 1836, o químico holandês G. J. Mulder propôs a primeira teoria da estrutura das substâncias proteicas, segundo a qual todas as proteínas possuem um certo radical hipotético (C 40 H 62 N 10 O 12), associado em várias proporções a átomos de enxofre e fósforo. Ele chamou esse radical de “proteína” (do grego proteína – primeiro, principal). A teoria de Mulder contribuiu para aumentar o interesse no estudo de proteínas e melhorar os métodos de química de proteínas. Foram desenvolvidas técnicas de isolamento de proteínas por extração com soluções de sais neutros, e pela primeira vez foram obtidas proteínas na forma cristalina (algumas proteínas vegetais). Para analisar proteínas, passaram a utilizar sua digestão preliminar com ácidos e álcalis.
Ao mesmo tempo, cada vez mais atenção começou a ser dada ao estudo da função das proteínas. Jens Jakob Berzelius foi o primeiro a sugerir em 1835 que eles desempenhavam o papel de biocatalisadores. Logo foram descobertas enzimas proteolíticas - pepsina (T. Schwann, 1836) e tripsina (L. Corvisart, 1856), que chamaram a atenção para a fisiologia da digestão e para a análise dos produtos formados durante a quebra dos nutrientes. Estudos posteriores da estrutura das proteínas e trabalhos na síntese química de peptídeos resultaram no surgimento da hipótese peptídica, segundo a qual todas as proteínas são construídas a partir de aminoácidos. No final do século XIX, a maioria dos aminoácidos que constituem as proteínas foram estudados.
No início do século 20, o químico alemão Emil Hermann Fischer foi o primeiro a utilizar os métodos da química orgânica para estudar proteínas e provou que as proteínas consistem em β-aminoácidos ligados entre si por uma ligação amida (peptídeo). Posteriormente, graças ao uso de métodos físico-químicos de análise, foi determinada a massa molecular de muitas proteínas, estabelecida a forma esférica das proteínas globulares, realizada análise de difração de raios X de aminoácidos e peptídeos e métodos de análise cromatográfica foram desenvolvido (ver cromatografia).
O primeiro hormônio protéico foi isolado (Frederick Grant Banting, John James Rickard McLeod, 1922), a presença de gamaglobulinas em anticorpos foi comprovada e a função enzimática da proteína muscular miosina foi descrita (Vladimir Aleksandrovich Engelhardt, M. N. Lyubimova, 1939) . Pela primeira vez, enzimas foram obtidas na forma cristalina - urease (J.B. Saliner, 1926), pepsina (J.H. Nortron, 1929), lisozima (E.P. Abraham, Robert Robinson, 1937).

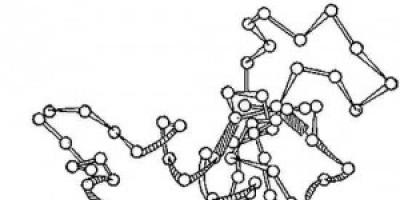
Arroz. 2. Esquema da estrutura tridimensional da enzima lisozima. Círculos - aminoácidos; fios - ligações peptídicas; retângulos sombreados são ligações dissulfeto. Seções espiralizadas e alongadas da cadeia polipeptídica são visíveis.
Na década de 1950, foi comprovada a organização em três níveis das moléculas de proteínas - a presença de uma estrutura primária, secundária e terciária; criou um analisador automático de aminoácidos (Stanford Moore, William Howard Stein, 1950). Na década de 60, foram feitas tentativas de sintetizar quimicamente proteínas (insulina, ribonuclease). Os métodos de análise de difração de raios X foram significativamente melhorados; foi criado um dispositivo - um sequenciador (P. Edman, G. Begg, 1967), que possibilitou determinar a sequência de aminoácidos de uma cadeia polipeptídica. A consequência disso foi o estabelecimento da estrutura de várias centenas de proteínas provenientes de diversas fontes. Entre eles estão enzimas proteolíticas (pepsina, tripsina, quimotripsina, subtilisina, carboxipeptidases), mioglobinas, hemoglobinas, citocromos, lisozimas, imunoglobulinas, histonas, neurotoxinas, proteínas do envelope viral, hormônios proteína-peptídeos. Como resultado, surgiram pré-requisitos para resolver problemas urgentes em enzimologia, imunologia, endocrinologia e outras áreas da química biológica.
No final do século XX, registaram-se progressos significativos no estudo do papel das proteínas na síntese da matriz dos biopolímeros, na compreensão dos mecanismos da sua ação nos diversos processos vitais dos organismos e no estabelecimento da ligação entre a sua estrutura e função. O aprimoramento dos métodos de pesquisa e o surgimento de novos métodos de separação de proteínas e peptídeos foram de grande importância.
O desenvolvimento de um método eficaz para analisar a sequência de nucleotídeos em ácidos nucleicos permitiu simplificar e acelerar significativamente a determinação da sequência de aminoácidos em proteínas. Isto acabou por ser possível porque a ordem dos aminoácidos numa proteína é determinada pela sequência de nucleótidos no gene que codifica esta proteína (fragmento). Conseqüentemente, conhecendo o arranjo dos nucleotídeos neste gene e o código genético, pode-se prever com precisão em que ordem os aminoácidos estão localizados na cadeia polipeptídica de uma proteína. Junto com os avanços na análise estrutural de proteínas, resultados significativos foram alcançados no estudo de sua organização espacial, mecanismos de formação e ação de complexos supramoleculares, incluindo ribossomos e outras organelas celulares, cromatina, vírus, etc.
Estrutura proteica
Quase todas as proteínas são constituídas por 20 α-aminoácidos pertencentes à série L e são iguais em quase todos os organismos. Os aminoácidos nas proteínas são conectados entre si por uma ligação peptídica -CO-NH-, que é formada pelos grupos carboxila e -amino de resíduos de aminoácidos vizinhos: dois aminoácidos formam um dipeptídeo no qual a carboxila terminal (-COOH) e o grupo amino (H 2 N-) permanecem livres, aos quais novos aminoácidos podem ser adicionados para formar uma cadeia polipeptídica.
A seção da cadeia na qual o grupo terminal H 2 N está localizado é chamada de N-terminal, e a parte oposta a ela é chamada de C-terminal. A enorme variedade de proteínas é determinada pela sequência de arranjo e pelo número de resíduos de aminoácidos que elas contêm. Embora não haja uma distinção clara, as cadeias curtas são geralmente chamadas de peptídeos ou oligopeptídeos (de oligo...), e os polipeptídeos (proteínas) são geralmente entendidos como cadeias compostas por 50 ou mais. As proteínas mais comuns são aquelas que contêm 100-400 resíduos de aminoácidos, mas também existem aquelas cujas moléculas são formadas por 1000 ou mais resíduos. As proteínas podem consistir em várias cadeias polipeptídicas. Nessas proteínas, cada cadeia polipeptídica é chamada de subunidade.
Estrutura espacial das proteínas

Arroz. 3. A proteína em todos os organismos consiste em 20 tipos de aminoácidos. Cada proteína é caracterizada por uma certa variedade e proporção quantitativa de aminoácidos. Nas moléculas de proteínas, os aminoácidos estão ligados entre si por ligações peptídicas (-CO - NH -) em uma sequência linear, constituindo a chamada estrutura primária da proteína. Linha superior - aminoácidos livres com grupos laterais R1, R2, R3; resultado final - os aminoácidos são conectados por ligações peptídicas.
A cadeia polipeptídica é capaz de formar e manter espontaneamente uma estrutura espacial especial. Com base na forma das moléculas de proteína, as proteínas são divididas em fibrilares e globulares. Nas proteínas globulares, uma ou mais cadeias polipeptídicas são dobradas em uma estrutura esférica compacta, ou glóbulo. Normalmente, essas proteínas são altamente solúveis em água. Estes incluem quase todas as enzimas, proteínas de transporte sanguíneo e muitas proteínas de armazenamento. As proteínas fibrilares são moléculas semelhantes a fios mantidas juntas por ligações cruzadas e formam fibras longas ou estruturas em camadas. Possuem alta resistência mecânica, são insolúveis em água e desempenham principalmente funções estruturais e protetoras. Representantes típicos de tais proteínas são as queratinas do cabelo e da lã, a fibroína da seda e o colágeno dos tendões.
A ordem dos aminoácidos ligados covalentemente em uma cadeia polipeptídica é chamada de sequência de aminoácidos ou estrutura primária das proteínas. A estrutura primária de cada proteína, codificada pelo gene correspondente, é constante e carrega todas as informações necessárias para a formação de estruturas de nível superior. O número potencial de proteínas que podem ser formadas a partir de 20 aminoácidos é praticamente ilimitado.
Como resultado da interação de grupos laterais de resíduos de aminoácidos, seções individuais relativamente pequenas da cadeia polipeptídica assumem uma ou outra conformação (tipo de dobramento), conhecida como estrutura secundária das proteínas. Seus elementos mais característicos são a hélice α e a estrutura β que se repetem periodicamente. A estrutura secundária é muito estável. Uma vez que é largamente determinado pela sequência de aminoácidos da região proteica correspondente, torna-se possível prevê-lo com um certo grau de probabilidade. O termo “?-hélice” foi introduzido pelo bioquímico, físico e químico americano Linus Carl Pauling, que descreveu o arranjo da cadeia polipeptídica na proteína ?-queratina na forma de uma hélice destra (a ?-hélice pode ser comparado a um fio telefônico). Para cada volta dessa hélice em uma proteína existem 3,6 resíduos de aminoácidos. Isso significa que o grupo -C = O de uma ligação peptídica forma uma ligação de hidrogênio com o grupo -NH de outra ligação peptídica, distante quatro resíduos de aminoácidos da primeira. Em média, cada região α-hélice inclui até 15 aminoácidos, o que corresponde a 3-4 voltas da hélice. Mas em cada proteína individual, o comprimento da hélice pode diferir muito deste valor. Em seção transversal, a hélice α tem o formato de um disco, a partir do qual as cadeias laterais dos aminoácidos apontam para fora.
Estrutura, ou? -camada dobrada, pode ser formada por várias seções da cadeia polipeptídica. Essas seções são esticadas e colocadas paralelamente umas às outras, conectadas entre si por ligações de hidrogênio que ocorrem entre ligações peptídicas. Eles podem ser orientados na mesma direção ou em direções opostas (a direção do movimento ao longo da cadeia polipeptídica é geralmente considerada como sendo do terminal N para o terminal C). No primeiro caso, a camada dobrada é chamada de paralela, no segundo - antiparalela. Este último é formado quando a cadeia peptídica faz uma curva acentuada para trás, formando uma curva (?-curva). As cadeias laterais dos aminoácidos estão orientadas perpendicularmente ao plano? -camada.
Conteúdo relativo? -seções espirais e? -estruturas podem variar amplamente entre diferentes proteínas. Existem proteínas com predominância de α-hélices (cerca de 75% dos aminoácidos na mioglobina e na hemoglobina), e o principal tipo de dobramento de cadeia em muitas proteínas fibrilares (incluindo fibroína da seda, β-queratina) é a α-hélice. -estrutura. As regiões da cadeia polipeptídica que não podem ser classificadas em nenhuma das conformações descritas acima são chamadas de alças de conexão. Sua estrutura é determinada principalmente pelas interações entre as cadeias laterais dos aminoácidos, e na molécula de qualquer proteína ela se enquadra de forma estritamente definida.
A estrutura terciária é chamada estrutura espacial das proteínas globulares. Mas muitas vezes esse conceito se refere ao método de dobramento da cadeia polipeptídica no espaço, característico de cada proteína específica. A estrutura terciária é formada pela cadeia polipeptídica de uma proteína espontaneamente, aparentemente, ao longo de uma(s) certa(s) via(s) de coagulação com a formação preliminar de elementos da estrutura secundária. Se a estabilidade da estrutura secundária é devida a ligações de hidrogênio, então a estrutura terciária é fixada por um sistema diversificado de interações não covalentes: hidrogênio, interações iônicas, intermoleculares, bem como contatos hidrofóbicos entre as cadeias laterais de aminoácidos não polares resíduos ácidos.
Em algumas proteínas, a estrutura terciária é ainda estabilizada pela formação de ligações dissulfeto (ligações -S-S-) entre os resíduos de cisteína. Via de regra, dentro do glóbulo protéico existem cadeias laterais de aminoácidos hidrofóbicos reunidos no núcleo (sua transferência dentro do glóbulo protéico é termodinamicamente favorável), e na periferia existem resíduos hidrofílicos e alguns hidrofóbicos. O glóbulo proteico é rodeado por várias centenas de moléculas de água de hidratação, que é necessária para a estabilidade da molécula proteica e está frequentemente envolvida no seu funcionamento. A estrutura terciária é móvel, suas seções individuais podem mudar, o que leva a transições conformacionais que desempenham um papel significativo na interação da proteína com outras moléculas.
A estrutura terciária é a base das propriedades funcionais de uma proteína. Determina a formação de conjuntos de grupos funcionais na proteína - centros ativos e zonas de ligação, confere-lhes a geometria necessária, permite a criação de um ambiente interno, que é um pré-requisito para a ocorrência de muitas reações, e garante a interação com outras proteínas .
A estrutura terciária das proteínas corresponde claramente à sua estrutura primária; provavelmente existe um código estereoquímico ainda não decifrado que determina a natureza do enovelamento das proteínas. No entanto, o mesmo método de arranjo espacial geralmente corresponde não a uma única estrutura primária, mas a toda uma família de estruturas nas quais apenas uma pequena fração (até 20-30%) de resíduos de aminoácidos pode coincidir, mas em certos lugares na cadeia a semelhança dos resíduos de aminoácidos é preservada. O resultado é a formação de grandes famílias de proteínas caracterizadas por estruturas terciárias semelhantes e primárias mais ou menos semelhantes e, via de regra, função comum. São, por exemplo, proteínas de organismos de diferentes espécies que possuem a mesma função e estão evolutivamente relacionadas: mioglobinas e hemoglobinas, tripsina, quimotripsina, elastase e outras proteinases animais.

Arroz. 4. Como resultado da combinação de várias macromoléculas proteicas com estrutura terciária, uma estrutura proteica quaternária é formada em um complexo complexo. Um exemplo dessas proteínas complexas é a hemoglobina, que consiste em quatro macromoléculas.
Muitas vezes, especialmente em proteínas grandes, o dobramento de uma cadeia polipeptídica ocorre através da formação, por seções individuais da cadeia, de elementos mais ou menos autônomos de estrutura espacial - domínios que podem ter autonomia funcional, sendo responsáveis por uma ou outra atividade biológica do proteína. Assim, os domínios N-terminais das proteínas da coagulação sanguínea garantem a sua ligação à membrana celular.
Existem muitas proteínas cujas moléculas são um conjunto de glóbulos (subunidades) mantidos juntos por interações hidrofóbicas, hidrogênio ou ligações iônicas. Tais complexos são chamados de proteínas oligoméricas, multiméricas ou de subunidades. O arranjo das subunidades em um complexo proteico funcionalmente ativo é chamado de estrutura quaternária da proteína. Algumas proteínas são capazes de formar estruturas de ordens superiores, por exemplo, complexos multienzimáticos, estruturas estendidas (proteínas de revestimento de bacteriófagos), complexos supramoleculares que funcionam como um todo (por exemplo, ribossomos ou componentes da cadeia respiratória mitocondrial).
A estrutura quaternária permite a criação de moléculas com geometrias incomuns. Assim, a ferritina, formada por 24 subunidades, possui uma cavidade interna, graças à qual a proteína consegue se ligar até 3.000 íons de ferro. Além disso, a estrutura quaternária permite que diversas funções diferentes sejam desempenhadas em uma molécula. A triptofano sintetase combina enzimas responsáveis por vários estágios sucessivos da síntese do aminoácido triptofano.
Métodos para estudar a estrutura das proteínas
A estrutura primária das proteínas determina todos os outros níveis de organização da molécula proteica. Portanto, ao estudar a função biológica de diversas proteínas, o conhecimento dessa estrutura é importante. A primeira proteína para a qual a sequência de aminoácidos foi estabelecida foi o hormônio pancreático, a insulina. Este trabalho, que durou 11 anos, foi realizado pelo bioquímico inglês Frederick Sanger (1954). Ele determinou a localização de 51 aminoácidos na molécula do hormônio e mostrou que ela consiste em 2 cadeias conectadas por ligações dissulfeto. Mais tarde, a maior parte do trabalho de estabelecimento da estrutura primária das proteínas foi automatizada.
Com o desenvolvimento dos métodos de engenharia genética, tornou-se possível acelerar ainda mais esse processo, determinando a estrutura primária das proteínas de acordo com os resultados da análise da sequência de nucleotídeos nos genes que codificam essas proteínas. A estrutura secundária e terciária das proteínas é estudada usando métodos físicos bastante complexos, por exemplo, dicroísmo circular ou análise de difração de raios X de cristais de proteínas. A estrutura terciária foi estabelecida pela primeira vez pelo bioquímico inglês John Cowdery Kendrew (1957) para a proteína muscular mioglobina.

Arroz. 5. Modelo da molécula de mioglobina (configuração espacial da molécula)
Desnaturação de proteínas
Ligações relativamente fracas responsáveis pela estabilização das estruturas secundárias, terciárias e quaternárias da proteína são facilmente destruídas, o que é acompanhado pela perda da sua atividade biológica. A destruição da estrutura original (nativa) da proteína, chamada desnaturação, ocorre na presença de ácidos e bases, com aquecimento, alterações na força iônica e outras influências. Como regra, as proteínas desnaturadas são pouco ou nada solúveis em água. Com efeito de curto prazo e rápida eliminação dos fatores desnaturantes, a renaturação das proteínas é possível com restauração total ou parcial da estrutura original e das propriedades biológicas.
Classificação de proteínas
A complexidade da estrutura das moléculas de proteínas e a extrema variedade de funções que desempenham tornam difícil criar uma classificação unificada e clara das mesmas, embora tentativas nesse sentido tenham sido feitas repetidamente desde o final do século XIX. Com base na sua composição química, as proteínas são divididas em simples e complexas (às vezes chamadas de proteínas). As moléculas do primeiro consistem apenas em aminoácidos. Além da própria cadeia polipeptídica, as proteínas complexas contêm componentes não proteicos representados por carboidratos (glicoproteínas), lipídios (lipoproteínas), ácidos nucléicos (nucleoproteínas), íons metálicos (metaloproteínas), grupo fosfato (fosfoproteínas), pigmentos (cromoproteínas), etc.
Dependendo das funções que desempenham, distinguem-se várias classes de proteínas. A classe mais diversa e especializada consiste em proteínas com função catalítica - enzimas que têm a capacidade de acelerar reações químicas que ocorrem nos organismos vivos. Nesta capacidade, as proteínas participam em todos os processos de síntese e degradação de vários compostos durante o metabolismo, na biossíntese de proteínas e ácidos nucleicos, na regulação do desenvolvimento e diferenciação celular. As proteínas de transporte têm a capacidade de se ligar seletivamente a ácidos graxos, hormônios e outros compostos e íons orgânicos e inorgânicos e, em seguida, transportá-los com corrente para o local desejado (por exemplo, a hemoglobina está envolvida na transferência de oxigênio dos pulmões para todas as células de o corpo). As proteínas de transporte também realizam o transporte ativo de íons, lipídios, açúcares e aminoácidos através das membranas biológicas.
As proteínas estruturais desempenham uma função de suporte ou proteção; eles participam da formação do esqueleto celular. Os mais comuns entre eles são o colágeno do tecido conjuntivo, queratina, unhas e penas, elastina das células vasculares e muitos outros. Em combinação com lipídios, constituem a base estrutural das membranas celulares e intracelulares.
Várias proteínas desempenham uma função protetora. Por exemplo, imunoglobulinas (anticorpos) de vertebrados, que têm a capacidade de se ligar a microrganismos e substâncias patogénicas estranhas, neutralizam os seus efeitos patogénicos no corpo e previnem a proliferação celular. O fibrinogênio e a trombina estão envolvidos no processo de coagulação do sangue. Muitas substâncias proteicas secretadas por bactérias, bem como componentes de alguns invertebrados, são classificadas como toxinas.
Algumas proteínas (reguladoras) estão envolvidas na regulação da atividade fisiológica do corpo como um todo, órgãos, células ou processos individuais. Eles controlam a transcrição genética e a síntese de proteínas; estes incluem hormônios peptídicos-proteicos secretados pelas glândulas endócrinas. As proteínas de armazenamento de sementes fornecem nutrientes para os estágios iniciais do desenvolvimento embrionário. Estes também incluem caseína, albumina de clara de ovo (ovalbumina) e muitos outros. Graças às proteínas, as células musculares adquirem a capacidade de se contrair e, em última análise, proporcionar movimento ao corpo. Exemplos de tais proteínas contráteis são a actina e a miosina do músculo esquelético, bem como a tubulina, que são componentes dos cílios e flagelos de organismos unicelulares; Eles também garantem a divergência dos cromossomos durante a divisão celular.
As proteínas receptoras são alvo de hormônios e outros compostos biologicamente ativos. Com a ajuda deles, a célula percebe informações sobre o estado do ambiente externo. Desempenham um papel importante na transmissão da excitação nervosa e no movimento celular orientado (quimiotaxia). A transformação e aproveitamento da energia que entra no corpo, assim como da energia, também ocorre com a participação de proteínas do sistema bioenergético (por exemplo, o pigmento visual rodopsina, citocromos da cadeia respiratória). Existem também muitas proteínas com outras funções, às vezes bastante incomuns (por exemplo, o plasma de alguns peixes da Antártida contém proteínas com propriedades anticongelantes).
Biossíntese de proteínas
Todas as informações sobre a estrutura de uma determinada proteína são “armazenadas” nos genes correspondentes na forma de uma sequência de nucleotídeos e implementadas no processo de síntese do modelo. Primeiro, a informação é transferida (lida) da molécula de DNA para o RNA mensageiro (mRNA) usando a enzima RNA polimerase dependente de DNA, e depois no ribossomo no mRNA, como em uma matriz de acordo com o código genético, com a participação de RNAs de transporte que entregam aminoácidos, ocorre a formação de uma cadeia polipeptídica.
As cadeias polipeptídicas sintetizadas que emergem do ribossomo, dobrando-se espontaneamente, assumem a conformação característica da proteína e podem sofrer modificações pós-tradução. As cadeias laterais de aminoácidos individuais podem sofrer modificações (hidroxilação, fosforilação, etc.). É por isso que, por exemplo, a hidroxiprolina e a hidroxilisina são encontradas no colágeno (ver). A modificação também pode ser acompanhada pela ruptura de ligações polipeptídicas. Dessa forma, ocorre, por exemplo, a formação de uma molécula ativa de insulina, constituída por duas cadeias ligadas por ligações dissulfeto.

Arroz. 6. Esquema geral da biossíntese de proteínas.
A importância das proteínas na nutrição
As proteínas são os componentes mais importantes da alimentação animal e humana. O valor nutricional das proteínas é determinado pelo seu conteúdo de aminoácidos essenciais, que não são produzidos no próprio corpo. A este respeito, as proteínas vegetais são menos valiosas que as proteínas animais: são mais pobres em lisina, metionina e triptofano e são mais difíceis de digerir no trato gastrointestinal. A falta de aminoácidos essenciais nos alimentos leva a graves distúrbios do metabolismo do nitrogênio.
As proteínas são decompostas em aminoácidos livres, que, após absorção no intestino, entram e são distribuídos por todas as células. Alguns deles se decompõem em compostos simples com liberação de energia, utilizada para diversas necessidades da célula, e alguns vão para a síntese de novas proteínas características de um determinado organismo. (R. A. Matveeva, Enciclopédia Cirilo e Metódio)
Enumeração de proteínas
- amilóide - amilóide;
- aniônico - aniônico;
- antivírus - antiviral;
- autoimune - autoimune;
- autólogo - autólogo;
- bacteriano - bacteriano;
- proteína Bence Jones;
- induzido por vírus - induzido por vírus;
- viral - vírus;
- viral não estrutural - vírus não estrutural;
- estrutural viral - estrutural do vírus;
- específico de vírus - específico de vírus;
- alto peso molecular - alto peso molecular;
- contendo heme - heme;
- heterólogo - estrangeiro;
- híbrido - híbrido;
- glicosilado - glicado;
- globular - globular;
- desnaturado - desnaturado;
- contendo ferro - ferro;
- gema - gema;
- proteína animal - proteína animal;
- protetor - defensivo;
- imune - imune;
- imunogênico - imunologicamente relevante;
- ligação ao cálcio;
- azedo - ácido;
- corpuscular - corpuscular;
- membrana - membrana;
- mieloma - mieloma;
- microssomal - microssomal;
- proteína do leite - proteína do leite;
- monoclonal - imunoglobulina monoclonal;
- proteína muscular - proteína muscular;
- nativo - nativo;
- não-histona - não-histona;
- defeituoso - parcial;
- insolúvel - insolúvel;
- indigestível - insolúvel;
- não enzimático - não enzimático;
- baixo peso molecular - baixo peso molecular;
- nova proteína - nova proteína;
- geral - todo;
- oncogênico - oncoproteína;
- proteína de fase principal - aniônica;
- proteína de fase aguda (inflamação) - proteína de fase aguda;
- comida comida;
- proteína plasmática sanguínea - proteína plasmática;
- placentário - placenta;
- desacoplamento - desacoplamento;
- proteína de regeneração nervosa;
- regulatório - regulatório;
- recombinação - recombinante;
- receptor - receptor;
- ribossômico - ribossômico;
- vinculativo - vinculativo;
- proteína secretora - proteína secretora;
- C-reativo - C-reativo;
- proteína de soro de leite - proteína de soro de leite, lactoproteína;
- tecido - tecido;
- tóxico - tóxico;
- quimérico - quimérico;
- todo - todo;
- citosólico - citosólico;
- proteína alcalina - proteína aniônica;
- exógeno - exógeno;
- endógeno - proteína endógena.
Leia mais sobre proteínas na literatura:
- Volkenshtein M.V., Moléculas e, M., 1965, cap. 3 - 5;
- Gaurowitz F., Química e funções das proteínas, trad. do inglês, Moscou, 1965;
- Sissakyan N. M. e Gladilin K. L., Aspectos bioquímicos da síntese de proteínas, no livro: Avanços na química biológica, vol. 7, M., 1965, p. 3;
- Stepanov V. M. Biologia molecular. Estrutura e função das proteínas. M., 1996;
- Shamin A. N., Desenvolvimento de química de proteínas, M., 1966;
- Proteínas e peptídeos. M., 1995-2000. T. 1-3;
- Biossíntese de proteínas e ácidos nucléicos, ed. AS Spirina, M., 1965;
- Introdução à biologia molecular, trad. do inglês, M., 1967
- Moléculas e células. [Sentado. Art.], trad. do inglês, M., 1966, p. 7 - 27, 94 - 106;
- Fundamentos de bioquímica: Tradução do inglês M., 1981. T. 1;
- O problema das proteínas. M., 1995. T. 1-5;
- As proteínas. Nova York, 1975-79. 3ª edição. V. 1-4.
Encontre outra coisa interessante:
Esquilos- compostos orgânicos de alto peso molecular constituídos por resíduos de α-aminoácidos.
EM composição proteica inclui carbono, hidrogênio, nitrogênio, oxigênio, enxofre. Algumas proteínas formam complexos com outras moléculas contendo fósforo, ferro, zinco e cobre.
As proteínas têm um grande peso molecular: albumina do ovo - 36.000, hemoglobina - 152.000, miosina - 500.000. Para comparação: o peso molecular do álcool é 46, ácido acético - 60, benzeno - 78.
Composição de aminoácidos de proteínas
Esquilos- polímeros não periódicos, cujos monômeros são α-aminoácidos. Normalmente, 20 tipos de α-aminoácidos são chamados de monômeros proteicos, embora mais de 170 deles sejam encontrados em células e tecidos.
Dependendo se os aminoácidos podem ser sintetizados no corpo humano e de outros animais, eles são diferenciados: aminoácidos não essenciais- pode ser sintetizado; Aminoácidos essenciais- não pode ser sintetizado. Os aminoácidos essenciais devem ser fornecidos ao corpo através dos alimentos. As plantas sintetizam todos os tipos de aminoácidos.
Dependendo da composição de aminoácidos, proteínas são: completas- contém todo o conjunto de aminoácidos; defeituoso- faltam alguns aminoácidos em sua composição. Se as proteínas consistem apenas em aminoácidos, elas são chamadas simples. Se as proteínas contêm, além dos aminoácidos, um componente não aminoácido (grupo protético), elas são chamadas complexo. O grupo protético pode ser representado por metais (metaloproteínas), carboidratos (glicoproteínas), lipídios (lipoproteínas), ácidos nucléicos (nucleoproteínas).
Todos aminoácidos contêm: 1) grupo carboxila (-COOH), 2) grupo amino (-NH 2), 3) radical ou grupo R (o resto da molécula). A estrutura do radical é diferente para diferentes tipos de aminoácidos. Dependendo do número de grupos amino e grupos carboxila incluídos na composição dos aminoácidos, eles são diferenciados: aminoácidos neutros tendo um grupo carboxila e um grupo amino; aminoácidos básicos tendo mais de um grupo amino; aminoácidos ácidos tendo mais de um grupo carboxila.
Os aminoácidos são compostos anfotéricos, pois em solução podem atuar tanto como ácidos quanto como bases. Em soluções aquosas, os aminoácidos existem em diferentes formas iônicas.
Ligação peptídica
Peptídeos- substâncias orgânicas constituídas por resíduos de aminoácidos ligados por ligações peptídicas.
A formação de peptídeos ocorre como resultado da reação de condensação de aminoácidos. Quando o grupo amino de um aminoácido interage com o grupo carboxila de outro, ocorre uma ligação covalente nitrogênio-carbono entre eles, que é chamada peptídeo. Dependendo do número de resíduos de aminoácidos incluídos no peptídeo, existem dipeptídeos, tripéptidos, tetrapeptídeos etc. A formação de uma ligação peptídica pode ser repetida muitas vezes. Isto leva à formação polipeptídeos. Em uma extremidade do peptídeo existe um grupo amino livre (chamado de terminal N) e na outra extremidade há um grupo carboxila livre (chamado de terminal C).

Organização espacial de moléculas de proteínas
O desempenho de determinadas funções específicas pelas proteínas depende da configuração espacial de suas moléculas; além disso, é energeticamente desfavorável para a célula manter as proteínas de forma desdobrada, em forma de cadeia, portanto as cadeias polipeptídicas sofrem enovelamento, adquirindo uma certa estrutura tridimensional ou conformação. Existem 4 níveis organização espacial de proteínas.
Estrutura primária da proteína- a sequência de disposição dos resíduos de aminoácidos na cadeia polipeptídica que constitui a molécula de proteína. A ligação entre aminoácidos é uma ligação peptídica.

Se uma molécula de proteína consiste em apenas 10 resíduos de aminoácidos, então o número de variantes teoricamente possíveis de moléculas de proteína que diferem na ordem de alternância de aminoácidos é 10 20. Tendo 20 aminoácidos, você pode fazer combinações ainda mais diversas com eles. Cerca de dez mil proteínas diferentes foram encontradas no corpo humano, que diferem entre si e das proteínas de outros organismos.
É a estrutura primária da molécula de proteína que determina as propriedades das moléculas de proteína e sua configuração espacial. A substituição de apenas um aminoácido por outro em uma cadeia polipeptídica leva a uma alteração nas propriedades e funções da proteína. Por exemplo, a substituição do sexto aminoácido glutâmico da subunidade β da hemoglobina por valina leva ao fato de que a molécula de hemoglobina como um todo não consegue cumprir sua função principal - transporte de oxigênio; Nesses casos, a pessoa desenvolve uma doença chamada anemia falciforme.
Estrutura secundária- dobramento ordenado da cadeia polipeptídica em uma espiral (parece uma mola estendida). As voltas da hélice são reforçadas por ligações de hidrogênio que surgem entre grupos carboxila e grupos amino. Quase todos os grupos CO e NH participam da formação de ligações de hidrogênio. Eles são mais fracos que os peptídicos, mas, repetidos muitas vezes, conferem estabilidade e rigidez a essa configuração. Ao nível da estrutura secundária, encontram-se as proteínas: fibroína (seda, teia de aranha), queratina (cabelos, unhas), colagénio (tendões).



Estrutura terciária- empacotamento de cadeias polipeptídicas em glóbulos, resultante da formação de ligações químicas (hidrogênio, iônica, dissulfeto) e do estabelecimento de interações hidrofóbicas entre os radicais dos resíduos de aminoácidos. O papel principal na formação da estrutura terciária é desempenhado pelas interações hidrofílicas-hidrofóbicas. Em soluções aquosas, os radicais hidrofóbicos tendem a se esconder da água, agrupando-se dentro do glóbulo, enquanto os radicais hidrofílicos, como resultado da hidratação (interação com dipolos de água), tendem a aparecer na superfície da molécula. Em algumas proteínas, a estrutura terciária é estabilizada por ligações covalentes dissulfeto formadas entre os átomos de enxofre de dois resíduos de cisteína. No nível da estrutura terciária existem enzimas, anticorpos e alguns hormônios.

Estrutura quaternária característica de proteínas complexas cujas moléculas são formadas por dois ou mais glóbulos. As subunidades são mantidas na molécula por interações iônicas, hidrofóbicas e eletrostáticas. Às vezes, durante a formação de uma estrutura quaternária, ocorrem ligações dissulfeto entre as subunidades. A proteína com estrutura quaternária mais estudada é hemoglobina. É formado por duas subunidades α (141 resíduos de aminoácidos) e duas subunidades β (146 resíduos de aminoácidos). Associada a cada subunidade está uma molécula heme contendo ferro.
Se por algum motivo a conformação espacial das proteínas se desviar do normal, a proteína não poderá desempenhar suas funções. Por exemplo, a causa da “doença da vaca louca” (encefalopatia espongiforme) é a conformação anormal dos príons, as proteínas de superfície das células nervosas.
Propriedades das proteínas
A composição de aminoácidos e a estrutura da molécula de proteína determinam isso propriedades. As proteínas combinam propriedades básicas e ácidas, determinadas pelos radicais de aminoácidos: quanto mais aminoácidos ácidos houver em uma proteína, mais pronunciadas serão suas propriedades ácidas. A capacidade de doar e adicionar H + é determinada propriedades tampão de proteínas; Um dos tampões mais poderosos é a hemoglobina nos glóbulos vermelhos, que mantém o pH do sangue num nível constante. Existem proteínas solúveis (fibrinogênio) e existem proteínas insolúveis que desempenham funções mecânicas (fibroína, queratina, colágeno). Existem proteínas que são quimicamente ativas (enzimas), existem proteínas quimicamente inativas que são resistentes a diversas condições ambientais e aquelas que são extremamente instáveis.
Fatores externos (calor, radiação ultravioleta, metais pesados e seus sais, alterações de pH, radiação, desidratação)
pode causar perturbação da organização estrutural da molécula de proteína. O processo de perda da conformação tridimensional inerente a uma determinada molécula de proteína é denominado desnaturação. A causa da desnaturação é a quebra de ligações que estabilizam uma determinada estrutura proteica. Inicialmente, os laços mais fracos são rompidos e, à medida que as condições se tornam mais rigorosas, os laços ainda mais fortes são rompidos. Portanto, primeiro se perdem as estruturas quaternárias, depois as terciárias e secundárias. Uma mudança na configuração espacial leva a uma mudança nas propriedades da proteína e, como resultado, torna impossível que a proteína desempenhe as suas funções biológicas inerentes. Se a desnaturação não for acompanhada pela destruição da estrutura primária, então pode ser reversível, neste caso ocorre a autorrecuperação da conformação característica da proteína. Por exemplo, as proteínas receptoras de membrana sofrem tal desnaturação. O processo de restauração da estrutura da proteína após a desnaturação é denominado renaturação. Se a restauração da configuração espacial da proteína for impossível, então a desnaturação é chamada irreversível.
Funções das proteínas
| Função | Exemplos e explicações |
|---|---|
| Construção | As proteínas estão envolvidas na formação de estruturas celulares e extracelulares: fazem parte das membranas celulares (lipoproteínas, glicoproteínas), cabelos (queratina), tendões (colágeno), etc. |
| Transporte | A proteína hemoglobina do sangue liga oxigênio e o transporta dos pulmões para todos os tecidos e órgãos, e deles transfere dióxido de carbono para os pulmões; A composição das membranas celulares inclui proteínas especiais que garantem a transferência ativa e estritamente seletiva de certas substâncias e íons da célula para o ambiente externo e vice-versa. |
| Regulatório | Os hormônios proteicos participam da regulação dos processos metabólicos. Por exemplo, o hormônio insulina regula os níveis de glicose no sangue, promove a síntese de glicogênio e aumenta a formação de gorduras a partir de carboidratos. |
| Protetor | Em resposta à penetração de proteínas ou microrganismos estranhos (antígenos) no corpo, são formadas proteínas especiais - anticorpos que podem ligá-los e neutralizá-los. A fibrina, formada a partir do fibrinogênio, ajuda a estancar o sangramento. |
| Motor | As proteínas contráteis actina e miosina proporcionam contração muscular em animais multicelulares. |
| Sinal | Construídas na membrana superficial da célula estão moléculas de proteína que são capazes de alterar sua estrutura terciária em resposta a fatores ambientais, recebendo assim sinais do ambiente externo e transmitindo comandos para a célula. |
| Armazenar | No corpo dos animais, as proteínas, via de regra, não são armazenadas, com exceção da albumina do ovo e da caseína do leite. Mas graças às proteínas, algumas substâncias podem ser armazenadas no corpo, por exemplo, durante a quebra da hemoglobina, o ferro não é retirado do corpo, mas é armazenado, formando um complexo com a proteína ferritina. |
| Energia | Quando 1 g de proteína se decompõe em produtos finais, 17,6 kJ são liberados. Primeiro, as proteínas se decompõem em aminoácidos e depois nos produtos finais - água, dióxido de carbono e amônia. No entanto, as proteínas são utilizadas como fonte de energia apenas quando outras fontes (carboidratos e gorduras) se esgotam. |
| Catalítico | Uma das funções mais importantes das proteínas. Fornecido por proteínas - enzimas que aceleram as reações bioquímicas que ocorrem nas células. Por exemplo, a ribulose bifosfato carboxilase catalisa a fixação de CO 2 durante a fotossíntese. |
Enzimas
Enzimas, ou enzimas, são uma classe especial de proteínas que são catalisadores biológicos. Graças às enzimas, as reações bioquímicas ocorrem a uma velocidade tremenda. A velocidade das reações enzimáticas é dezenas de milhares de vezes (e às vezes milhões) maior que a velocidade das reações que ocorrem com a participação de catalisadores inorgânicos. A substância sobre a qual a enzima atua é chamada substrato.
As enzimas são proteínas globulares, características estruturais as enzimas podem ser divididas em dois grupos: simples e complexas. Enzimas simples são proteínas simples, ou seja, consistem apenas em aminoácidos. Enzimas complexas são proteínas complexas, ou seja, Além da parte proteica, contêm um grupo de natureza não proteica - cofator. Algumas enzimas usam vitaminas como cofatores. A molécula da enzima contém uma parte especial chamada centro ativo. Centro ativo- uma pequena seção da enzima (de três a doze resíduos de aminoácidos), onde ocorre a ligação do substrato ou substratos para formar um complexo enzima-substrato. Após a conclusão da reação, o complexo enzima-substrato se decompõe na enzima e no(s) produto(s) da reação. Algumas enzimas possuem (exceto as ativas) centros alostéricos- áreas às quais os reguladores de velocidade das enzimas estão ligados ( enzimas alostéricas).

As reações de catálise enzimática são caracterizadas por: 1) alta eficiência, 2) seletividade e direção de ação rigorosas, 3) especificidade do substrato, 4) regulação fina e precisa. A especificidade do substrato e da reação das reações de catálise enzimática são explicadas pelas hipóteses de E. Fischer (1890) e D. Koshland (1959).
E. Fisher (hipótese da fechadura) sugeriram que as configurações espaciais do centro ativo da enzima e do substrato devem corresponder exatamente entre si. O substrato é comparado à “chave”, a enzima à “fechadura”.
D. Koshland (hipótese da luva) sugeriram que a correspondência espacial entre a estrutura do substrato e o centro ativo da enzima é criada apenas no momento de sua interação entre si. Essa hipótese também é chamada hipótese de correspondência induzida.
A taxa de reações enzimáticas depende de: 1) temperatura, 2) concentração da enzima, 3) concentração do substrato, 4) pH. Deve-se enfatizar que, como as enzimas são proteínas, a sua atividade é mais elevada em condições fisiologicamente normais.
A maioria das enzimas só pode funcionar em temperaturas entre 0 e 40°C. Dentro destes limites, a taxa de reação aumenta aproximadamente 2 vezes a cada aumento de 10 °C na temperatura. Em temperaturas acima de 40 °C, a proteína sofre desnaturação e a atividade enzimática diminui. Em temperaturas próximas ao congelamento, as enzimas são inativadas.
À medida que a quantidade de substrato aumenta, a taxa da reação enzimática aumenta até que o número de moléculas de substrato seja igual ao número de moléculas de enzima. Com um aumento adicional na quantidade de substrato, a velocidade não aumentará, pois os centros ativos da enzima ficam saturados. Um aumento na concentração da enzima leva ao aumento da atividade catalítica, uma vez que um maior número de moléculas de substrato sofre transformações por unidade de tempo.

Para cada enzima existe um valor de pH ideal no qual ela exibe atividade máxima (pepsina - 2,0, amilase salivar - 6,8, lipase pancreática - 9,0). Em valores de pH mais altos ou mais baixos, a atividade enzimática diminui. Com mudanças repentinas no pH, a enzima desnatura.
A velocidade das enzimas alostéricas é regulada por substâncias que se ligam aos centros alostéricos. Se essas substâncias aceleram uma reação, elas são chamadas ativadores, se eles desacelerarem - inibidores.
Classificação de enzimas
De acordo com o tipo de transformações químicas que catalisam, as enzimas são divididas em 6 classes:
- oxiredutases(transferência de átomos de hidrogênio, oxigênio ou elétrons de uma substância para outra - desidrogenase),
- transferases(transferência de grupo metil, acil, fosfato ou amino de uma substância para outra - transaminase),
- hidrolases(reações de hidrólise nas quais dois produtos são formados a partir do substrato - amilase, lipase),
- liases(adição não hidrolítica ao substrato ou separação de um grupo de átomos dele, caso em que as ligações CC, C-N, C-O, C-S podem ser quebradas - descarboxilase),
- isomerases(rearranjo intramolecular - isomerase),
- ligases(a ligação de duas moléculas como resultado da formação de ligações C-C, C-N, C-O, C-S - sintetase).
As classes, por sua vez, são subdivididas em subclasses e subsubclasses. Na classificação internacional atual, cada enzima possui um código específico, composto por quatro números separados por pontos. O primeiro número é a classe, o segundo é a subclasse, o terceiro é a subsubclasse, o quarto é o número de série da enzima nesta subclasse, por exemplo, o código da arginase é 3.5.3.1.
Vá para palestras nº 2“Estrutura e funções dos carboidratos e lipídios”
Vá para palestras nº 4"Estrutura e funções dos ácidos nucléicos ATP"
Na primeira metade do século XIX. muitos químicos, e entre eles principalmente J. von Liebig, gradualmente chegaram à conclusão de que as proteínas representam uma classe especial de compostos nitrogenados. O nome "proteínas" (do grego.
protos primeiro) foi proposto em 1840 pelo químico holandês G. Mulder. PROPRIEDADES FÍSICAS As proteínas são brancas no estado sólido, mas incolores em solução, a menos que carreguem algum tipo de grupo cromóforo (colorido), como a hemoglobina. A solubilidade em água varia muito entre as diferentes proteínas. Também muda dependendo do pH e da concentração de sais na solução, por isso é possível selecionar condições sob as quais uma proteína precipitará seletivamente na presença de outras proteínas. Este método de “salga” é amplamente utilizado para isolar e purificar proteínas. A proteína purificada frequentemente precipita da solução na forma de cristais.Comparado a outros compostos, o peso molecular das proteínas é muito grande, variando de vários milhares a muitos milhões de daltons. Portanto, durante a ultracentrifugação, as proteínas são sedimentadas e em taxas diferentes. Devido à presença de grupos carregados positiva e negativamente nas moléculas de proteínas, elas se movem em velocidades diferentes e em um campo elétrico. Esta é a base da eletroforese, um método utilizado para isolar proteínas individuais de misturas complexas. As proteínas também são purificadas por cromatografia.
PROPRIEDADES QUIMICAS Estrutura. As proteínas são polímeros, ou seja, moléculas construídas como cadeias a partir de unidades monoméricas repetidas, ou subunidades, cujo papel desempenham a -aminoácidos. Fórmula geral de aminoácidos onde R um átomo de hidrogênio ou algum grupo orgânico.Uma molécula de proteína (cadeia polipeptídica) pode consistir apenas em um número relativamente pequeno de aminoácidos ou em vários milhares de unidades monoméricas. A combinação de aminoácidos em uma cadeia é possível porque cada um deles possui dois grupos químicos diferentes: um grupo amino com propriedades básicas,
NH2 , e um grupo carboxila ácido, COOH. Ambos os grupos são afiliados a a -átomo de carbono. O grupo carboxila de um aminoácido pode formar uma ligação amida (peptídeo) com o grupo amino de outro aminoácido: Após dois aminoácidos terem sido ligados desta forma, a cadeia pode ser estendida adicionando um terceiro ao segundo aminoácido, e assim por diante. Como pode ser visto na equação acima, quando uma ligação peptídica é formada, uma molécula de água é liberada. Na presença de ácidos, álcalis ou enzimas proteolíticas, a reação ocorre na direção oposta: a cadeia polipeptídica é dividida em aminoácidos com adição de água. Esta reação é chamada de hidrólise. A hidrólise ocorre espontaneamente e é necessária energia para conectar os aminoácidos em uma cadeia polipeptídica.
Após dois aminoácidos terem sido ligados desta forma, a cadeia pode ser estendida adicionando um terceiro ao segundo aminoácido, e assim por diante. Como pode ser visto na equação acima, quando uma ligação peptídica é formada, uma molécula de água é liberada. Na presença de ácidos, álcalis ou enzimas proteolíticas, a reação ocorre na direção oposta: a cadeia polipeptídica é dividida em aminoácidos com adição de água. Esta reação é chamada de hidrólise. A hidrólise ocorre espontaneamente e é necessária energia para conectar os aminoácidos em uma cadeia polipeptídica. Um grupo carboxila e um grupo amida (ou um grupo imida semelhante no caso do aminoácido prolina) estão presentes em todos os aminoácidos, mas as diferenças entre os aminoácidos são determinadas pela natureza do grupo, ou “cadeia lateral”. que é indicado acima pela letra
R . O papel da cadeia lateral pode ser desempenhado por um átomo de hidrogênio, como no aminoácido glicina, ou por algum grupo volumoso, como na histidina e no triptofano. Algumas cadeias laterais são quimicamente inertes, enquanto outras são marcadamente reativas.Muitos milhares de aminoácidos diferentes podem ser sintetizados, e muitos aminoácidos diferentes ocorrem na natureza, mas apenas 20 tipos de aminoácidos são usados para a síntese de proteínas: alanina, arginina, asparagina, ácido aspártico, valina, histidina, glicina, glutamina, ácido glutâmico. ácido, isoleucina, leucina, lisina, metionina, prolina, serina, tirosina, treonina, triptofano, fenilalanina e cisteína (nas proteínas, a cisteína pode estar presente como um dímero
cistina). É verdade que algumas proteínas contêm outros aminoácidos além dos vinte que ocorrem regularmente, mas são formados como resultado da modificação de um dos vinte listados depois de ter sido incluído na proteína.Atividade óptica. Todos os aminoácidos, com exceção da glicina, possuem a O átomo de carbono tem quatro grupos diferentes ligados a ele. Do ponto de vista da geometria, quatro grupos diferentes podem ser ligados de duas maneiras e, consequentemente, existem duas configurações possíveis, ou dois isômeros, relacionados entre si como um objeto está com sua imagem espelhada, ou seja, como a mão esquerda para a direita. Uma configuração é chamada de canhoto ou canhoto ( eu ), e o outro direito, ou dextrógiro ( D ), uma vez que dois desses isômeros diferem na direção de rotação do plano da luz polarizada. Encontrado apenas em proteínas eu -aminoácidos (a exceção é a glicina; ela pode ser representada em apenas uma forma, pois dois de seus quatro grupos são iguais), e todos são opticamente ativos (já que existe apenas um isômero). D -aminoácidos são raros na natureza; eles são encontrados em alguns antibióticos e na parede celular das bactérias.Sequência de aminoácidos. Os aminoácidos em uma cadeia polipeptídica não estão dispostos aleatoriamente, mas em uma certa ordem fixa, e é essa ordem que determina as funções e propriedades da proteína. Variando a ordem dos 20 tipos de aminoácidos, você pode criar um grande número de proteínas diferentes, assim como pode criar muitos textos diferentes a partir das letras do alfabeto.No passado, a determinação da sequência de aminoácidos de uma proteína demorava frequentemente vários anos. A determinação direta ainda é uma tarefa bastante trabalhosa, embora tenham sido criados dispositivos que permitem que ela seja realizada automaticamente. Geralmente é mais fácil determinar a sequência de nucleotídeos do gene correspondente e deduzir dela a sequência de aminoácidos da proteína. Até à data, as sequências de aminoácidos de muitas centenas de proteínas já foram determinadas. As funções das proteínas decifradas são geralmente conhecidas, o que ajuda a imaginar as possíveis funções de proteínas semelhantes formadas, por exemplo, em neoplasias malignas.
Proteínas complexas. As proteínas que consistem apenas em aminoácidos são chamadas de simples. Freqüentemente, porém, um átomo de metal ou algum composto químico que não seja um aminoácido está ligado à cadeia polipeptídica. Essas proteínas são chamadas de complexas. Um exemplo é a hemoglobina: contém ferroporfirina, que determina sua cor vermelha e permite que atue como carreador de oxigênio.Os nomes das proteínas mais complexas indicam a natureza dos grupos anexados: as glicoproteínas contêm açúcares, as lipoproteínas contêm gorduras. Se a atividade catalítica de uma enzima depende do grupo ligado, então ela é chamada de grupo protético. Freqüentemente, uma vitamina desempenha o papel de um grupo protético ou faz parte de um. A vitamina A, por exemplo, ligada a uma das proteínas da retina, determina sua sensibilidade à luz.
Estrutura terciária. O que é importante não é tanto a sequência de aminoácidos da proteína em si (a estrutura primária), mas a forma como ela está disposta no espaço. Ao longo de todo o comprimento da cadeia polipeptídica, os íons hidrogênio formam ligações regulares de hidrogênio, que lhe conferem a forma de uma hélice ou camada (estrutura secundária). Da combinação dessas hélices e camadas, emerge uma forma compacta da próxima ordem: a estrutura terciária da proteína. Em torno das ligações que prendem as unidades monoméricas da cadeia, são possíveis rotações em pequenos ângulos. Portanto, do ponto de vista puramente geométrico, o número de configurações possíveis para qualquer cadeia polipeptídica é infinitamente grande. Na realidade, cada proteína normalmente existe em apenas uma configuração, determinada pela sua sequência de aminoácidos. Esta estrutura não é rígida, é como se « respira” flutua em torno de uma certa configuração média. O circuito é dobrado em uma configuração na qual a energia livre (a capacidade de produzir trabalho) é mínima, assim como uma mola liberada é comprimida apenas até um estado correspondente à energia livre mínima. Freqüentemente, uma parte da cadeia está rigidamente ligada a outra por dissulfeto ( SS) ligações entre dois resíduos de cisteína. Em parte, é por isso que a cisteína desempenha um papel particularmente importante entre os aminoácidos.A complexidade da estrutura das proteínas é tão grande que ainda não é possível calcular a estrutura terciária de uma proteína, mesmo que sua sequência de aminoácidos seja conhecida. Mas se for possível obter cristais de proteína, então sua estrutura terciária pode ser determinada por difração de raios X.
Nas proteínas estruturais, contráteis e em algumas outras proteínas, as cadeias são alongadas e várias cadeias ligeiramente dobradas próximas formam fibrilas; as fibrilas, por sua vez, dobram-se em formações maiores de fibras. No entanto, a maioria das proteínas em solução tem uma forma globular: as cadeias são enroladas num glóbulo, como um fio numa bola. A energia livre com esta configuração é mínima, uma vez que os aminoácidos hidrofóbicos (“repelentes de água”) estão escondidos dentro do glóbulo e os aminoácidos hidrofílicos (“atraentes de água”) estão em sua superfície.
Muitas proteínas são complexos de várias cadeias polipeptídicas. Essa estrutura é chamada de estrutura quaternária da proteína. A molécula de hemoglobina, por exemplo, consiste em quatro subunidades, cada uma das quais é uma proteína globular.
As proteínas estruturais, devido à sua configuração linear, formam fibras que apresentam uma resistência à tração muito elevada, enquanto a configuração globular permite que as proteínas entrem em interações específicas com outros compostos. Na superfície do glóbulo, quando as cadeias estão corretamente dispostas, aparecem cavidades de determinado formato, nas quais se localizam grupos químicos reativos. Se uma determinada proteína é uma enzima, então outra molécula, geralmente menor, de alguma substância entra nessa cavidade, assim como uma chave entra em uma fechadura; neste caso, a configuração da nuvem eletrônica da molécula muda sob a influência dos grupos químicos localizados na cavidade, e isso a obriga a reagir de determinada forma. Desta forma, a enzima catalisa a reação. As moléculas de anticorpos também possuem cavidades nas quais várias substâncias estranhas se ligam e, portanto, são tornadas inofensivas. O modelo “fechadura e chave”, que explica a interação das proteínas com outros compostos, permite-nos compreender a especificidade das enzimas e dos anticorpos, ou seja, sua capacidade de reagir apenas com certos compostos.
Proteínas em diferentes tipos de organismos. Proteínas que desempenham a mesma função em diferentes espécies de plantas e animais e, portanto, levam o mesmo nome, também apresentam configuração semelhante. Eles, no entanto, diferem um pouco na sua sequência de aminoácidos. À medida que as espécies divergem de um ancestral comum, alguns aminoácidos em determinadas posições são substituídos por mutações em outros. Mutações prejudiciais que causam doenças hereditárias são eliminadas pela seleção natural, mas as benéficas ou pelo menos neutras podem persistir. Quanto mais próximas duas espécies biológicas estão uma da outra, menos diferenças são encontradas em suas proteínas.Algumas proteínas mudam com relativa rapidez, outras são muito conservadas. Este último inclui, por exemplo, citocromo Com uma enzima respiratória encontrada na maioria dos organismos vivos. Em humanos e chimpanzés, suas sequências de aminoácidos são idênticas, e no citocromo Com No trigo, apenas 38% dos aminoácidos eram diferentes. Mesmo comparando humanos e bactérias, a semelhança dos citocromos Com(as diferenças afetam 65% dos aminoácidos aqui) ainda podem ser vistos, embora o ancestral comum das bactérias e dos humanos tenha vivido na Terra há cerca de dois bilhões de anos. Hoje em dia, a comparação de sequências de aminoácidos é frequentemente usada para construir uma árvore filogenética (família), refletindo as relações evolutivas entre diferentes organismos.
Desnaturação. A molécula de proteína sintetizada, dobrando-se, adquire sua configuração característica. Esta configuração, no entanto, pode ser destruída pelo aquecimento, pela alteração do pH, pela exposição a solventes orgânicos e até mesmo pela simples agitação da solução até aparecerem bolhas na sua superfície. Uma proteína modificada desta forma é chamada de desnaturada; perde sua atividade biológica e geralmente torna-se insolúvel. Exemplos bem conhecidos de proteína desnaturada são ovos cozidos ou chantilly. Pequenas proteínas contendo apenas cerca de cem aminoácidos são capazes de renaturar, ou seja, readquirir a configuração original. Mas a maioria das proteínas simplesmente se transforma em uma massa de cadeias polipeptídicas emaranhadas e não restaura sua configuração anterior.Uma das principais dificuldades no isolamento de proteínas ativas é a sua extrema sensibilidade à desnaturação. Esta propriedade das proteínas encontra aplicação útil na preservação de alimentos: a alta temperatura desnatura irreversivelmente as enzimas dos microrganismos e os microrganismos morrem.
SÍNTESE PROTEÍCA Para sintetizar proteínas, um organismo vivo deve possuir um sistema de enzimas capaz de unir um aminoácido a outro. Também é necessária uma fonte de informação para determinar quais aminoácidos devem ser combinados. Como existem milhares de tipos de proteínas no corpo e cada uma delas consiste, em média, em várias centenas de aminoácidos, a informação necessária deve ser verdadeiramente enorme. Ele é armazenado (semelhante à forma como uma gravação é armazenada em uma fita magnética) nas moléculas de ácido nucléico que constituem os genes. Cm . também Hereditário; ÁCIDOS NUCLEICOS.Ativação enzimática. Uma cadeia polipeptídica sintetizada a partir de aminoácidos nem sempre é uma proteína em sua forma final. Muitas enzimas são sintetizadas primeiro como precursores inativos e tornam-se ativas somente depois que outra enzima remove vários aminoácidos em uma extremidade da cadeia. Algumas das enzimas digestivas, como a tripsina, são sintetizadas nesta forma inativa; essas enzimas são ativadas no trato digestivo como resultado da remoção do fragmento terminal da cadeia. O hormônio insulina, cuja molécula em sua forma ativa consiste em duas cadeias curtas, é sintetizado na forma de uma cadeia, a chamada. pró-insulina. A parte intermediária desta cadeia é então removida e os fragmentos restantes se unem para formar a molécula hormonal ativa. Proteínas complexas são formadas somente depois que um grupo químico específico é ligado à proteína, e essa ligação geralmente também requer uma enzima.Circulação metabólica. Depois de alimentar um animal com aminoácidos marcados com isótopos radioativos de carbono, nitrogênio ou hidrogênio, o rótulo é rapidamente incorporado às suas proteínas. Se os aminoácidos marcados pararem de entrar no corpo, a quantidade de aminoácidos marcados nas proteínas começa a diminuir. Estas experiências mostram que as proteínas resultantes não são retidas no corpo até o fim da vida. Todos eles, com poucas exceções, estão em estado dinâmico, decompondo-se constantemente em aminoácidos e sendo novamente sintetizados.Algumas proteínas se decompõem quando as células morrem e são destruídas. Isso acontece o tempo todo, por exemplo, com glóbulos vermelhos e células epiteliais que revestem a superfície interna do intestino. Além disso, a quebra e a ressíntese de proteínas também ocorrem nas células vivas. Curiosamente, sabe-se menos sobre a degradação das proteínas do que sobre a sua síntese. É claro, porém, que a degradação envolve enzimas proteolíticas semelhantes àquelas que decompõem as proteínas em aminoácidos no trato digestivo.
A meia-vida de diferentes proteínas varia de algumas horas a vários meses. A única exceção é a molécula de colágeno. Uma vez formados, permanecem estáveis e não são renovados ou substituídos. Com o tempo, porém, algumas das suas propriedades mudam, nomeadamente a elasticidade, e como não são renovadas, isso resulta em certas alterações relacionadas com a idade, como o aparecimento de rugas na pele.
Proteínas sintéticas. Os químicos aprenderam há muito tempo a polimerizar aminoácidos, mas os aminoácidos são combinados de maneira desordenada, de modo que os produtos dessa polimerização têm pouca semelhança com os naturais. É verdade que é possível combinar aminoácidos numa determinada ordem, o que permite obter algumas proteínas biologicamente ativas, nomeadamente a insulina. O processo é bastante complicado e desta forma só é possível obter aquelas proteínas cujas moléculas contêm cerca de cem aminoácidos. É preferível, em vez disso, sintetizar ou isolar a sequência de nucleótidos de um gene correspondente à sequência de aminoácidos desejada e depois introduzir este gene numa bactéria, que produzirá grandes quantidades do produto desejado por replicação. Este método, no entanto, também tem as suas desvantagens. Cm . também ENGENHARIA GENÉTICA. PROTEÍNA E NUTRIÇÃO Quando as proteínas do corpo são decompostas em aminoácidos, esses aminoácidos podem ser usados novamente para sintetizar proteínas. Ao mesmo tempo, os próprios aminoácidos estão sujeitos à degradação, por isso não são totalmente reutilizados. Também está claro que durante o crescimento, a gravidez e a cicatrização de feridas, a síntese protéica deve exceder a degradação. O corpo perde continuamente algumas proteínas; Estas são as proteínas do cabelo, das unhas e da camada superficial da pele. Portanto, para sintetizar proteínas, cada organismo deve receber aminoácidos dos alimentos. As plantas verdes sintetizam a partir de CO 2 , água e amônia ou nitratos são todos os 20 aminoácidos encontrados nas proteínas. Muitas bactérias também são capazes de sintetizar aminoácidos na presença de açúcar (ou algum equivalente) e nitrogênio fixo, mas o açúcar é, em última análise, fornecido pelas plantas verdes. Os animais têm uma capacidade limitada de sintetizar aminoácidos; eles obtêm aminoácidos comendo plantas verdes ou outros animais. No trato digestivo, as proteínas absorvidas são decompostas em aminoácidos, estes últimos são absorvidos e a partir deles são construídas proteínas características de um determinado organismo. Nenhuma das proteínas absorvidas é incorporada nas estruturas do corpo como tal. A única exceção é que, em muitos mamíferos, alguns anticorpos maternos podem passar intactos através da placenta para a corrente sanguínea fetal e, através do leite materno (especialmente em ruminantes), podem ser transferidos para o recém-nascido imediatamente após o nascimento.Necessidade de proteína. É claro que para manter a vida o corpo deve receber uma certa quantidade de proteínas dos alimentos. No entanto, a extensão desta necessidade depende de vários fatores. O corpo necessita de alimentos tanto como fonte de energia (calorias) quanto como material para a construção de suas estruturas. A necessidade de energia vem em primeiro lugar. Isso significa que quando há poucos carboidratos e gorduras na dieta, as proteínas da dieta são utilizadas não para a síntese de suas próprias proteínas, mas como fonte de calorias. Durante o jejum prolongado, até as suas próprias proteínas são utilizadas para satisfazer as necessidades energéticas. Se houver carboidratos suficientes na dieta, o consumo de proteínas poderá ser reduzido.Balanço de nitrogênio. Em média aprox. 16% da massa total de proteína é nitrogênio. Quando os aminoácidos contidos nas proteínas são decompostos, o nitrogênio que eles contêm é excretado do corpo na urina e (em menor grau) nas fezes na forma de vários compostos nitrogenados. É portanto conveniente utilizar um indicador como o balanço de azoto para avaliar a qualidade da nutrição proteica, ou seja, a diferença (em gramas) entre a quantidade de nitrogênio que entra no corpo e a quantidade de nitrogênio excretado por dia. Com a nutrição normal de um adulto, essas quantidades são iguais. Em um organismo em crescimento, a quantidade de nitrogênio excretada é menor que a quantidade recebida, ou seja, o saldo é positivo. Se houver falta de proteínas na dieta, o saldo é negativo. Se houver calorias suficientes na dieta, mas não houver proteínas nela, o corpo economiza proteínas. Ao mesmo tempo, o metabolismo das proteínas fica mais lento e a utilização repetida de aminoácidos na síntese protéica ocorre com a maior eficiência possível. No entanto, as perdas são inevitáveis e os compostos nitrogenados ainda são excretados na urina e parcialmente nas fezes. A quantidade de nitrogênio excretada do corpo por dia durante o jejum protéico pode servir como uma medida da deficiência diária de proteínas. É natural supor que ao introduzir na dieta uma quantidade de proteína equivalente a esta deficiência, o equilíbrio de nitrogênio possa ser restaurado. No entanto, não é. Depois de receber essa quantidade de proteína, o corpo começa a usar aminoácidos de forma menos eficiente, portanto, é necessária alguma proteína adicional para restaurar o equilíbrio de nitrogênio.Se a quantidade de proteína na dieta exceder o necessário para manter o equilíbrio de nitrogênio, então parece não haver nenhum dano. O excesso de aminoácidos é simplesmente usado como fonte de energia. Como exemplo particularmente notável, os esquimós consomem poucos hidratos de carbono e cerca de dez vezes a quantidade de proteína necessária para manter o equilíbrio de nitrogénio. Na maioria dos casos, porém, usar proteína como fonte de energia não é benéfico porque uma determinada quantidade de carboidrato pode produzir muito mais calorias do que a mesma quantidade de proteína. Nos países pobres, as pessoas obtêm as calorias dos hidratos de carbono e consomem quantidades mínimas de proteínas.
Se o corpo receber a quantidade necessária de calorias na forma de produtos não proteicos, a quantidade mínima de proteína para garantir a manutenção do equilíbrio de nitrogênio é de aprox. 30g por dia. Aproximadamente essa quantidade de proteína está contida em quatro fatias de pão ou 0,5 litro de leite. Um número ligeiramente maior é geralmente considerado ideal; Recomenda-se 50 a 70 g.
Aminoácidos essenciais. Até agora, a proteína era considerada como um todo. Entretanto, para que ocorra a síntese proteica, todos os aminoácidos necessários devem estar presentes no corpo. O próprio corpo do animal é capaz de sintetizar alguns dos aminoácidos. São chamados de substituíveis porque não precisam necessariamente estar presentes na dieta alimentar, só é importante que o fornecimento global de proteínas como fonte de nitrogênio seja suficiente; então, se houver escassez de aminoácidos não essenciais, o corpo poderá sintetizá-los às custas daqueles que estão presentes em excesso. Os restantes aminoácidos “essenciais” não podem ser sintetizados e devem ser fornecidos ao corpo através dos alimentos. Essenciais para os humanos são valina, leucina, isoleucina, treonina, metionina, fenilalanina, triptofano, histidina, lisina e arginina. (Embora a arginina possa ser sintetizada no corpo, ela é classificada como um aminoácido essencial porque não é produzida em quantidades suficientes em recém-nascidos e crianças em crescimento. Por outro lado, alguns desses aminoácidos dos alimentos podem se tornar desnecessários para um adulto pessoa.)Esta lista de aminoácidos essenciais é aproximadamente a mesma em outros vertebrados e até mesmo em insetos. O valor nutricional das proteínas é geralmente determinado pela alimentação de ratos em crescimento e pelo monitoramento do ganho de peso dos animais.
Valor nutricional das proteínas. O valor nutricional de uma proteína é determinado pelo aminoácido essencial mais deficiente. Vamos ilustrar isso com um exemplo. As proteínas do nosso corpo contêm em média aprox. 2% de triptofano (em peso). Digamos que a dieta inclua 10 g de proteína contendo 1% de triptofano e que contenha outros aminoácidos essenciais suficientes. No nosso caso, 10 g desta proteína incompleta equivalem essencialmente a 5 g de proteína completa; os 5 g restantes só podem servir como fonte de energia. Observe que como os aminoácidos praticamente não são armazenados no corpo, e para que ocorra a síntese protéica, todos os aminoácidos devem estar presentes ao mesmo tempo, o efeito da ingestão de aminoácidos essenciais só pode ser detectado se todos eles entrar no corpo ao mesmo tempo. A composição média da maioria das proteínas animais está próxima da composição média das proteínas do corpo humano, por isso é improvável que enfrentemos deficiência de aminoácidos se a nossa dieta for rica em alimentos como carne, ovos, leite e queijo. No entanto, existem proteínas, como a gelatina (produto da desnaturação do colágeno), que contêm poucos aminoácidos essenciais. As proteínas vegetais, embora sejam melhores que a gelatina nesse sentido, também são pobres em aminoácidos essenciais; Eles são especialmente pobres em lisina e triptofano. No entanto, uma dieta puramente vegetariana não pode ser considerada prejudicial, a menos que consuma uma quantidade um pouco maior de proteínas vegetais, suficientes para fornecer aminoácidos essenciais ao corpo. As plantas contêm mais proteínas em suas sementes, especialmente nas sementes de trigo e de várias leguminosas. Os rebentos jovens, como os espargos, também são ricos em proteínas.Proteínas sintéticas na dieta. Ao adicionar pequenas quantidades de aminoácidos essenciais sintéticos ou proteínas ricas em aminoácidos a proteínas incompletas, como proteínas de milho, o valor nutricional destas últimas pode ser significativamente aumentado, ou seja, aumentando assim a quantidade de proteína consumida. Outra possibilidade é cultivar bactérias ou leveduras em hidrocarbonetos de petróleo com adição de nitratos ou amônia como fonte de nitrogênio. A proteína microbiana assim obtida pode servir como ração para aves ou gado, ou pode ser consumida diretamente pelo homem. O terceiro método amplamente utilizado utiliza a fisiologia dos ruminantes. Nos ruminantes, na parte inicial do estômago, ocorre o chamado. O rúmen é habitado por formas especiais de bactérias e protozoários que convertem proteínas vegetais incompletas em proteínas microbianas mais completas, e estas, por sua vez, após digestão e absorção, transformam-se em proteínas animais. A uréia, um composto sintético barato que contém nitrogênio, pode ser adicionada à alimentação do gado. Os microrganismos que vivem no rúmen usam nitrogênio uréico para converter carboidratos (dos quais há muito mais na ração) em proteínas. Cerca de um terço de todo o nitrogênio na alimentação do gado pode vir na forma de uréia, o que significa essencialmente, até certo ponto, a síntese química de proteínas. Nos EUA, esse método desempenha um papel importante como uma das formas de obtenção de proteínas.LITERATURA Murray R., Grenner D., Mayes P., Rodwell W. Bioquímica humana, vol. 12. M., 1993Alberts B, Bray D, Lewis J, et al. Biologia celular molecular, vol. 13. M., 1994
Bilhete 2. 1. Fatores nutricionais essenciais de natureza lipídica. Alguns lipídios não são sintetizados no corpo humano e, portanto, são fatores nutricionais essenciais. Estes incluem ácidos graxos com duas ou mais ligações duplas (polieno) - ácidos graxos essenciais. Alguns desses ácidos são substratos para a síntese de hormônios locais - eicosanóides (tópico 8.10).
Vitaminas lipossolúveis executar diversas funções: vitamina A participa do processo de visão, bem como do crescimento e diferenciação celular; foi comprovada sua capacidade de inibir o crescimento de certos tipos de tumores; vitamina K participa da coagulação do sangue; vitamina D participa da regulação do metabolismo do cálcio; vitamina E- antioxidante, inibe a formação de radicais livres e assim neutraliza os danos celulares resultantes da peroxidação lipídica.
Documento
2.Estrutura e níveis de organização estrutural das proteínas
Existem quatro níveis de organização estrutural das proteínas: primário, secundário, terciário e quaternário. Cada nível tem suas próprias características.
Estrutura primária da proteína
A estrutura primária das proteínas é uma cadeia polipeptídica linear de aminoácidos conectados por ligações peptídicas. A estrutura primária é o nível mais simples de organização estrutural de uma molécula de proteína. Alta estabilidade é dada por ligações peptídicas covalentes entre o grupo α-amino de um aminoácido e o grupo α-carboxila de outro aminoácido. [mostrar].
Se o grupo imino da prolina ou hidroxiprolina estiver envolvido na formação de uma ligação peptídica, então ela terá uma forma diferente [mostrar].
Quando as ligações peptídicas se formam nas células, o grupo carboxila de um aminoácido é primeiro ativado e depois se combina com o grupo amino de outro. A síntese laboratorial de polipeptídeos é realizada aproximadamente da mesma maneira.
Uma ligação peptídica é um fragmento repetido de uma cadeia polipeptídica. Possui uma série de características que afetam não apenas a forma da estrutura primária, mas também os níveis mais elevados de organização da cadeia polipeptídica:

coplanaridade - todos os átomos incluídos no grupo peptídico estão no mesmo plano;
a capacidade de existir em duas formas de ressonância (forma ceto ou enol);
posição trans dos substituintes em relação à ligação C-N;
a capacidade de formar ligações de hidrogênio, e cada um dos grupos peptídicos pode formar duas ligações de hidrogênio com outros grupos, incluindo os peptídicos.
A exceção são os grupos peptídicos envolvendo o grupo amino da prolina ou hidroxiprolina. Eles só são capazes de formar uma ligação de hidrogênio (veja acima). Isto afeta a formação da estrutura secundária da proteína. A cadeia polipeptídica na área onde a prolina ou hidroxiprolina está localizada dobra-se facilmente, uma vez que não é mantida, como de costume, por uma segunda ligação de hidrogênio.
Nomenclatura de peptídeos e polipeptídeos. O nome dos peptídeos é composto pelos nomes dos aminoácidos constituintes. Dois aminoácidos formam um dipeptídeo, três formam um tripéptido, quatro formam um tetrapeptídeo, etc. Cada peptídeo ou cadeia polipeptídica de qualquer comprimento tem um aminoácido N-terminal contendo um grupo amino livre e um aminoácido C-terminal contendo uma carboxila livre. grupo. Ao nomear os polipeptídeos, todos os aminoácidos são listados sequencialmente, começando pelo N-terminal, substituindo em seus nomes, exceto o C-terminal, o sufixo -in por -il (já que os aminoácidos nos peptídeos não possuem mais um grupo carboxila, mas um grupo carbonila). Por exemplo, o nome mostrado na Fig. 1 tripéptido - leu lodo fenilalano lodo treon em.
Características da estrutura primária da proteína. Na espinha dorsal da cadeia polipeptídica, estruturas rígidas (grupos peptídicos planos) alternam com regiões relativamente móveis (-CHR), que são capazes de girar em torno de ligações. Tais características estruturais da cadeia polipeptídica afetam seu arranjo espacial.
Estrutura secundária da proteína
A estrutura secundária é uma forma de dobrar uma cadeia polipeptídica em uma estrutura ordenada devido à formação de ligações de hidrogênio entre grupos peptídicos da mesma cadeia ou cadeias polipeptídicas adjacentes. De acordo com sua configuração, as estruturas secundárias são divididas em helicoidais (hélice α) e dobradas em camadas (estrutura β e forma β cruzada).


α-hélice. Este é um tipo de estrutura proteica secundária que se parece com uma hélice regular, formada devido a ligações de hidrogênio interpeptídicas dentro de uma cadeia polipeptídica. O modelo da estrutura da hélice α (Fig. 2), que leva em consideração todas as propriedades da ligação peptídica, foi proposto por Pauling e Corey. Principais características da hélice α:
configuração helicoidal da cadeia polipeptídica possuindo simetria helicoidal;
a formação de ligações de hidrogénio entre os grupos peptídicos de cada primeiro e quarto resíduo de aminoácido;
regularidade das voltas espirais;
a equivalência de todos os resíduos de aminoácidos na hélice α, independentemente da estrutura de seus radicais laterais;
radicais laterais de aminoácidos não participam da formação da hélice α.
Externamente, a hélice α parece uma espiral ligeiramente esticada de um fogão elétrico. A regularidade das ligações de hidrogênio entre o primeiro e o quarto grupos peptídicos determina a regularidade das voltas da cadeia polipeptídica. A altura de uma volta, ou passo da hélice α, é 0,54 nm; inclui 3,6 resíduos de aminoácidos, ou seja, cada resíduo de aminoácido se move ao longo do eixo (altura de um resíduo de aminoácido) em 0,15 nm (0,54:3,6 = 0,15 nm), o que nos permite falar sobre a equivalência de todos os resíduos de aminoácidos na α-hélice. O período de regularidade de uma hélice α é de 5 voltas ou 18 resíduos de aminoácidos; a duração de um período é 2,7 nm. Arroz. 3. Modelo a-hélice de Pauling-Corey
Estrutura β. Este é um tipo de estrutura secundária que possui uma configuração ligeiramente curva da cadeia polipeptídica e é formada por ligações de hidrogênio interpeptídicas dentro de seções individuais de uma cadeia polipeptídica ou cadeias polipeptídicas adjacentes. Também é chamada de estrutura dobrada em camadas. Existem variedades de estruturas β. As regiões limitadas em camadas formadas por uma cadeia polipeptídica de uma proteína são chamadas de forma β cruzada (estrutura β curta). As ligações de hidrogênio na forma β cruzada são formadas entre os grupos peptídicos das alças da cadeia polipeptídica. Outro tipo - a estrutura β completa - é característica de toda a cadeia polipeptídica, que tem uma forma alongada e é mantida por ligações de hidrogênio interpeptídicas entre cadeias polipeptídicas paralelas adjacentes (Fig. 3). Esta estrutura lembra o fole de um acordeão. Além disso, variantes de estruturas β são possíveis: elas podem ser formadas por cadeias paralelas (as extremidades N-terminais das cadeias polipeptídicas são direcionadas na mesma direção) e antiparalelas (as extremidades N-terminais são direcionadas em direções diferentes). Os radicais laterais de uma camada são colocados entre os radicais laterais de outra camada.
Nas proteínas, as transições de estruturas α para estruturas β e vice-versa são possíveis devido ao rearranjo das ligações de hidrogênio. Em vez de ligações de hidrogênio interpeptídicas regulares ao longo da cadeia (graças às quais a cadeia polipeptídica é torcida em espiral), as seções helicoidais se desenrolam e as ligações de hidrogênio se fecham entre os fragmentos alongados das cadeias polipeptídicas. Essa transição é encontrada na queratina, a proteína do cabelo. Ao lavar os cabelos com detergentes alcalinos, a estrutura helicoidal da β-queratina é facilmente destruída e se transforma em α-queratina (os cabelos cacheados alisam).
A destruição de estruturas secundárias regulares de proteínas (hélices α e estruturas β), por analogia com a fusão de um cristal, é chamada de “fusão” de polipeptídeos. Nesse caso, as ligações de hidrogênio são quebradas e as cadeias polipeptídicas assumem a forma de um emaranhado aleatório. Consequentemente, a estabilidade das estruturas secundárias é determinada por ligações de hidrogénio interpeptídicas. Outros tipos de ligações quase não participam disso, com exceção das ligações dissulfeto ao longo da cadeia polipeptídica nos locais dos resíduos de cisteína. Peptídeos curtos são fechados em ciclos devido a ligações dissulfeto. Muitas proteínas contêm regiões α-helicoidais e estruturas β. Quase não existem proteínas naturais que consistem em 100% de hélice α (a exceção é a paramiosina, uma proteína muscular que é 96-100% de hélice α), enquanto os polipeptídeos sintéticos têm 100% de hélice.
Outras proteínas têm vários graus de enrolamento. Uma alta frequência de estruturas α-helicoidais é observada na paramiosina, mioglobina e hemoglobina. Em contraste, na tripsina, uma ribonuclease, uma parte significativa da cadeia polipeptídica é dobrada em estruturas β em camadas. Proteínas dos tecidos de suporte: queratina (proteína do cabelo, lã), colágeno (proteína dos tendões, pele), fibroína (proteína da seda natural) possuem configuração β de cadeias polipeptídicas. Os diferentes graus de helicidade das cadeias polipeptídicas das proteínas indicam que, obviamente, existem forças que perturbam parcialmente a helicidade ou “quebram” o dobramento regular da cadeia polipeptídica. A razão para isso é um dobramento mais compacto da cadeia polipeptídica da proteína em um determinado volume, ou seja, em uma estrutura terciária.
Estrutura terciária da proteína
A estrutura terciária de uma proteína é a forma como a cadeia polipeptídica está organizada no espaço. Com base na forma da sua estrutura terciária, as proteínas são divididas principalmente em globulares e fibrilares. As proteínas globulares geralmente têm uma forma elipsóide, e as proteínas fibrilares (semelhantes a um fio) têm uma forma alongada (forma de bastão ou fuso).
No entanto, a configuração da estrutura terciária das proteínas ainda não dá motivos para pensar que as proteínas fibrilares tenham apenas uma estrutura β, e as proteínas globulares tenham uma estrutura α-helicoidal. Existem proteínas fibrilares que possuem uma estrutura secundária dobrada helicoidal, em vez de em camadas. Por exemplo, α-queratina e paramiosina (proteína do músculo obturador dos moluscos), tropomiosinas (proteínas dos músculos esqueléticos) pertencem a proteínas fibrilares (têm formato de bastonete) e sua estrutura secundária é α-hélice; em contraste, as proteínas globulares podem conter um grande número de estruturas β.
A espiralização de uma cadeia polipeptídica linear reduz seu tamanho em aproximadamente 4 vezes; e o empacotamento na estrutura terciária a torna dezenas de vezes mais compacta que a cadeia original.
Ligações que estabilizam a estrutura terciária de uma proteína. As ligações entre os radicais laterais dos aminoácidos desempenham um papel na estabilização da estrutura terciária. Essas conexões podem ser divididas em:
forte (covalente) [mostrar].
fraco (polar e van der Waals) [mostrar].
Numerosas ligações entre os radicais laterais dos aminoácidos determinam a configuração espacial da molécula de proteína.
Características da organização da estrutura terciária da proteína. A conformação da estrutura terciária da cadeia polipeptídica é determinada pelas propriedades dos radicais laterais dos aminoácidos nela incluídos (que não têm efeito perceptível na formação de estruturas primárias e secundárias) e pelo microambiente, ou seja, o ambiente. Quando dobrada, a cadeia polipeptídica de uma proteína tende a assumir uma forma energeticamente favorável, caracterizada por um mínimo de energia livre. Portanto, os grupos R apolares, “evitando” a água, formam, por assim dizer, a parte interna da estrutura terciária da proteína, onde está localizada a parte principal dos resíduos hidrofóbicos da cadeia polipeptídica. Quase não há moléculas de água no centro do glóbulo de proteína. Os grupos R polares (hidrofílicos) do aminoácido estão localizados fora deste núcleo hidrofóbico e são rodeados por moléculas de água. A cadeia polipeptídica é intrinsecamente dobrada no espaço tridimensional. Quando dobra, a conformação helicoidal secundária é interrompida. A cadeia “quebra” em pontos fracos onde se localizam a prolina ou a hidroxiprolina, pois esses aminoácidos são mais móveis na cadeia, formando apenas uma ligação de hidrogênio com outros grupos peptídicos. Outro local de curvatura é a glicina, que possui um pequeno grupo R (hidrogênio). Portanto, os grupos R de outros aminoácidos, quando empilhados, tendem a ocupar o espaço livre na localização da glicina. Vários aminoácidos - alanina, leucina, glutamato, histidina - contribuem para a preservação de estruturas helicoidais estáveis nas proteínas, e como metionina, valina, isoleucina e ácido aspártico favorecem a formação de estruturas β. Em uma molécula de proteína com configuração terciária, existem regiões na forma de hélices α (helicoidais), estruturas β (em camadas) e uma bobina aleatória. Somente o arranjo espacial correto da proteína a torna ativa; sua violação leva a alterações nas propriedades das proteínas e perda de atividade biológica.
Estrutura quaternária da proteína
As proteínas que consistem em uma cadeia polipeptídica possuem apenas estrutura terciária. Estes incluem a mioglobina - uma proteína do tecido muscular envolvida na ligação do oxigênio, uma série de enzimas (lisozima, pepsina, tripsina, etc.). No entanto, algumas proteínas são construídas a partir de várias cadeias polipeptídicas, cada uma das quais com uma estrutura terciária. Para tais proteínas, foi introduzido o conceito de estrutura quaternária, que é a organização de várias cadeias polipeptídicas com estrutura terciária em uma única molécula de proteína funcional. Essa proteína com estrutura quaternária é chamada de oligômero, e suas cadeias polipeptídicas com estrutura terciária são chamadas de protômeros ou subunidades (Fig. 4).

No nível quaternário de organização, as proteínas mantêm a configuração básica da estrutura terciária (globular ou fibrilar). Por exemplo, a hemoglobina é uma proteína com estrutura quaternária e consiste em quatro subunidades. Cada uma das subunidades é uma proteína globular e, em geral, a hemoglobina também possui configuração globular. Proteínas do cabelo e da lã - queratinas, relacionadas na estrutura terciária às proteínas fibrilares, possuem conformação fibrilar e estrutura quaternária.
Estabilização da estrutura quaternária da proteína. Todas as proteínas que possuem estrutura quaternária são isoladas na forma de macromoléculas individuais que não se decompõem em subunidades. Os contatos entre as superfícies das subunidades só são possíveis devido aos grupos polares de resíduos de aminoácidos, pois durante a formação da estrutura terciária de cada uma das cadeias polipeptídicas, os radicais laterais dos aminoácidos apolares (que constituem a maioria dos todos os aminoácidos proteinogênicos) estão escondidos dentro da subunidade. Numerosas ligações iônicas (sal), de hidrogênio e, em alguns casos, dissulfeto são formadas entre seus grupos polares, que mantêm firmemente as subunidades na forma de um complexo organizado. A utilização de substâncias que quebram as ligações de hidrogênio ou substâncias que reduzem as pontes dissulfeto causa desagregação dos protômeros e destruição da estrutura quaternária da proteína. Na tabela 1 resume os dados sobre as ligações que estabilizam diferentes níveis de organização da molécula de proteína [mostrar].
Características da organização estrutural de algumas proteínas fibrilares
A organização estrutural das proteínas fibrilares possui várias características em comparação com as proteínas globulares. Essas características podem ser observadas no exemplo da queratina, fibroína e colágeno. As queratinas existem em conformações α e β. As α-queratinas e a fibroína têm uma estrutura secundária dobrada em camadas, porém, na queratina as cadeias são paralelas e na fibroína são antiparalelas (ver Fig. 3); Além disso, a queratina contém ligações dissulfeto entre cadeias, enquanto a fibroína não as possui. A quebra das ligações dissulfeto leva à separação das cadeias polipeptídicas nas queratinas. Pelo contrário, a formação do número máximo de ligações dissulfureto nas queratinas através da exposição a agentes oxidantes cria uma forte estrutura espacial. Em geral, nas proteínas fibrilares, ao contrário das proteínas globulares, às vezes é difícil distinguir estritamente entre os diferentes níveis de organização. Se aceitarmos (como para uma proteína globular) que a estrutura terciária deve ser formada pela colocação de uma cadeia polipeptídica no espaço, e a estrutura quaternária por várias cadeias, então nas proteínas fibrilares várias cadeias polipeptídicas estão envolvidas já durante a formação da estrutura secundária . Um exemplo típico de proteína fibrilar é o colágeno, que é uma das proteínas mais abundantes no corpo humano (cerca de 1/3 da massa de todas as proteínas). É encontrada em tecidos de alta resistência e baixa extensibilidade (ossos, tendões, pele, dentes, etc.). No colágeno, um terço dos resíduos de aminoácidos são glicina e cerca de um quarto ou um pouco mais são prolina ou hidroxiprolina.

A cadeia polipeptídica isolada de colágeno (estrutura primária) parece uma linha tracejada. Contém cerca de 1000 aminoácidos e tem um peso molecular de cerca de 10 5 (Fig. 5, a, b). A cadeia polipeptídica é construída a partir de um trio repetido de aminoácidos (tripleto) da seguinte composição: gli-A-B, onde A e B são quaisquer aminoácidos diferentes da glicina (mais frequentemente prolina e hidroxiprolina). Cadeias polipeptídicas de colágeno (ou cadeias α) durante a formação de estruturas secundárias e terciárias (Fig. 5, c e d) não podem produzir hélices α típicas com simetria helicoidal. Prolina, hidroxiprolina e glicina (aminoácidos anti-hélicos) interferem nisso. Portanto, três cadeias α formam, por assim dizer, espirais torcidas, como três fios enrolados em um cilindro. Três cadeias α helicoidais formam uma estrutura repetitiva de colágeno chamada tropocolágeno (Fig. 5d). O tropocolágeno em sua organização é a estrutura terciária do colágeno. Os anéis planos de prolina e hidroxiprolina alternando regularmente ao longo da cadeia conferem-lhe rigidez, assim como as ligações intercadeias entre as cadeias α do tropocolágeno (razão pela qual o colágeno é resistente ao estiramento). O tropocolágeno é essencialmente uma subunidade de fibrilas de colágeno. A colocação das subunidades do tropocolágeno na estrutura quaternária do colágeno ocorre de maneira gradual (Fig. 5e).
A estabilização das estruturas de colágeno ocorre devido às ligações intercadeias de hidrogênio, iônicas e de van der Waals e um pequeno número de ligações covalentes.
As cadeias α do colágeno possuem estruturas químicas diferentes. Existem diferentes tipos de cadeias α 1 (I, II, III, IV) e cadeias α 2. Dependendo de quais cadeias α 1 e α 2 estão envolvidas na formação da hélice tripla do tropocolágeno, quatro tipos de colágeno são distinguidos:
o primeiro tipo - duas cadeias α 1 (I) e uma cadeia α 2;
o segundo tipo - três cadeias α 1 (II);
terceiro tipo - três cadeias α 1 (III);
quarto tipo - três cadeias α 1 (IV).
O colágeno mais comum é o primeiro tipo: é encontrado no tecido ósseo, na pele, nos tendões; o colágeno tipo 2 é encontrado no tecido cartilaginoso, etc. Um tipo de tecido pode conter diferentes tipos de colágeno.
A agregação ordenada das estruturas de colágeno, sua rigidez e inércia garantem a alta resistência das fibras de colágeno. As proteínas de colágeno também contêm componentes de carboidratos, ou seja, são complexos proteína-carboidrato.
O colágeno é uma proteína extracelular formada por células do tecido conjuntivo encontradas em todos os órgãos. Portanto, com danos ao colágeno (ou violação de sua formação), ocorrem múltiplas violações das funções de suporte do tecido conjuntivo dos órgãos.
A cadeia polipeptídica alfa termina com a combinação de aminoácidos valina-leucina, e a cadeia polipeptídica beta termina com a combinação valina-histidina-leucina. As cadeias polipeptídicas alfa e beta na molécula de hemoglobina não estão dispostas linearmente; esta é a estrutura primária. Devido à existência de forças intramoleculares, as cadeias polipeptídicas são torcidas na forma de uma hélice alfa (estrutura secundária) típica das proteínas. A própria hélice alfa-hélice se curva espacialmente para cada cadeia polipeptídica alfa e beta, formando plexos de formato ovóide (estrutura terciária). Partes individuais das hélices alfa-hélices das cadeias polipeptídicas são marcadas com letras latinas de A a H. Todas as quatro cadeias polipeptídicas alfa e beta curvas terciárias estão localizadas espacialmente em uma certa relação - uma estrutura quaternária. Eles estão conectados não por ligações químicas reais, mas por forças intermoleculares.
Descobriu-se que os humanos têm três tipos principais de hemoglobina normal: embrionária - U, fetal - F e hemoglobina adulta - A. HbU (em homenagem à letra inicial da palavra útero) ocorre no embrião entre 7 e 12 semanas de vida, depois desaparece e aparece a hemoglobina fetal, que a partir do terceiro mês é a principal hemoglobina do feto. Em seguida, aparece gradualmente a hemoglobina adulta comum, chamada HbA, após a letra inicial da palavra inglesa “adulto”. A quantidade de hemoglobina fetal diminui gradativamente, de modo que, no momento do nascimento, 80% da hemoglobina é HbA e apenas 20% é HbF. Após o nascimento, a hemoglobina fetal continua a diminuir e aos 2–3 anos de vida é de apenas 1–2%. A mesma quantidade de hemoglobina fetal existe em um adulto. Uma quantidade de HbF superior a 2% é considerada patológica para um adulto e para crianças com mais de 3 anos de idade.
Além dos tipos normais de hemoglobina, são conhecidas atualmente mais de 50 variantes patológicas. Eles foram nomeados pela primeira vez com letras latinas. A letra B está ausente na designação dos tipos de hemoglobina, pois originalmente designava HbS.
Hemoglobina (Hb)- uma cromoproteína presente nos glóbulos vermelhos e envolvida no transporte de oxigénio para os tecidos. A hemoglobina em adultos é chamada hemoglobina A (Hb A). Seu peso molecular é de cerca de 65.000 Da. A molécula de Hb A tem uma estrutura quaternária e inclui quatro subunidades - cadeias polipeptídicas (designadas α1, α2, β1 e β2, cada uma das quais está associada ao heme.
Lembre-se de que a hemoglobina é uma proteína alostérica; suas moléculas podem mudar reversivelmente de uma conformação para outra. Isso altera a afinidade da proteína pelos ligantes. A conformação com menor afinidade pelo ligante é chamada de conformação tensa ou T. A conformação com maior afinidade pelo ligante é chamada de conformação relaxada ou R.
As conformações R e T da molécula de hemoglobina estão em estado de equilíbrio dinâmico:
Vários factores ambientais podem alterar este equilíbrio numa direcção ou noutra. Os reguladores alostéricos que afetam a afinidade da Hb pelo O2 são: 1) oxigênio; 2) Concentração de H+ (pH médio); 3) dióxido de carbono (CO2); 4) 2,3-difosfoglicerato (DPG). A ligação de uma molécula de oxigênio a uma das subunidades de hemoglobina promove a transição de uma conformação tensa para uma relaxada e aumenta a afinidade pelo oxigênio de outras subunidades da mesma molécula de hemoglobina. Este fenômeno é chamado de efeito cooperativo. A natureza complexa da ligação da hemoglobina ao oxigênio é refletida pela curva de saturação da hemoglobina O2, que tem formato de S (Figura 3.1).

Figura 3.1. Curvas de saturação de oxigênio da mioglobina (1) e da hemoglobina (2).
Formas moleculares hemoglobinas diferem entre si na estrutura das cadeias polipeptídicas. Um exemplo dessa variedade de hemoglobina que existe em condições fisiológicas é hemoglobina fetal (HbF), presente no sangue durante a fase embrionária do desenvolvimento humano. Ao contrário da HbA, sua molécula contém 2 cadeias α e 2 cadeias γ (ou seja, as cadeias β são substituídas por cadeias γ). Essa hemoglobina tem maior afinidade pelo oxigênio. É isso que permite ao embrião receber oxigênio do sangue da mãe através da placenta. Logo após o nascimento, a HbF no sangue do bebê é substituída por HbA.
Um exemplo de hemoglobina anormal ou patológica é a já mencionada (ver 2.4.) hemoglobina S, encontrada em pacientes com anemia falciforme. Como você já sabe, ela difere da hemoglobina A por substituir o glutamato por valina nas cadeias β. Esta substituição de aminoácidos provoca uma diminuição na solubilidade da HbS em água e uma diminuição na sua afinidade pelo O2.
Como você sabe, as proteínas são a base da origem da vida em nosso planeta. Mas foi a gota coacervada, composta por moléculas peptídicas, que se tornou a base para a origem dos seres vivos. Isto não tem dúvida, porque a análise da composição interna de qualquer representante da biomassa mostra que essas substâncias estão presentes em tudo: plantas, animais, microrganismos, fungos, vírus. Além disso, eles são muito diversos e de natureza macromolecular.
Essas estruturas possuem quatro nomes, todos sinônimos:
- proteínas;
- proteínas;
- polipeptídeos;
- peptídeos.
Moléculas de proteína
Seu número é verdadeiramente inumerável. Neste caso, todas as moléculas de proteína podem ser divididas em dois grandes grupos:
- simples - consistem apenas em sequências de aminoácidos conectadas por ligações peptídicas;
- complexo - a estrutura e a estrutura da proteína são caracterizadas por grupos protolíticos (protéticos) adicionais, também chamados de cofatores.
Ao mesmo tempo, moléculas complexas também possuem sua própria classificação.
Gradação de peptídeos complexos
- As glicoproteínas são compostos intimamente relacionados de proteínas e carboidratos. Grupos protéticos de mucopolissacarídeos estão entrelaçados na estrutura da molécula.
- As lipoproteínas são um composto complexo de proteínas e lipídios.
- Metaloproteínas - íons metálicos (ferro, manganês, cobre e outros) atuam como um grupo protético.
- As nucleoproteínas são a conexão entre proteínas e ácidos nucléicos (DNA, RNA).
- Fosfoproteínas - conformação de uma proteína e de um resíduo de ácido ortofosfórico.
- As cromoproteínas são muito semelhantes às metaloproteínas, porém, o elemento que faz parte do grupo protético é um complexo totalmente colorido (vermelho - hemoglobina, verde - clorofila e assim por diante).
Em cada grupo considerado, a estrutura e as propriedades das proteínas são diferentes. As funções que desempenham também variam dependendo do tipo de molécula.

Estrutura química das proteínas
Deste ponto de vista, as proteínas são uma longa e maciça cadeia de resíduos de aminoácidos ligados entre si por ligações específicas chamadas ligações peptídicas. Ramos chamados radicais estendem-se das estruturas laterais dos ácidos. Esta estrutura molecular foi descoberta por E. Fischer no início do século XXI.
Mais tarde, as proteínas, a estrutura e as funções das proteínas foram estudadas com mais detalhes. Ficou claro que existem apenas 20 aminoácidos que formam a estrutura do peptídeo, mas eles podem ser combinados de várias maneiras. Daí a variedade de estruturas polipeptídicas. Além disso, no processo de vida e no desempenho de suas funções, as proteínas são capazes de passar por uma série de transformações químicas. Como resultado, eles mudam a estrutura e surge um tipo de conexão completamente novo.
Para quebrar a ligação peptídica, ou seja, para romper a proteína e a estrutura das cadeias, é necessário selecionar condições muito rigorosas (altas temperaturas, ácidos ou álcalis, um catalisador). Isto se deve à alta resistência da molécula, nomeadamente no grupo peptídico.

A detecção da estrutura da proteína em laboratório é realizada por meio da reação do biureto - exposição ao polipeptídeo (II) recém-precipitado. O complexo do grupo peptídico e do íon cobre dá uma cor roxa brilhante.
Existem quatro organizações estruturais principais, cada uma com suas próprias características estruturais de proteínas.
Níveis de organização: estrutura primária
Como mencionado acima, um peptídeo é uma sequência de resíduos de aminoácidos com ou sem inclusões, coenzimas. Então, o primário é a estrutura de uma molécula que é natural, natural, verdadeiramente aminoácidos conectados por ligações peptídicas e nada mais. Ou seja, um polipeptídeo com estrutura linear. Além disso, as características estruturais das proteínas deste tipo são que tal combinação de ácidos é decisiva para o desempenho das funções da molécula proteica. Graças à presença dessas características, é possível não só identificar um peptídeo, mas também prever as propriedades e o papel de um peptídeo completamente novo, ainda não descoberto. Exemplos de peptídeos com estrutura primária natural são insulina, pepsina, quimotripsina e outros.

Conformação secundária
A estrutura e as propriedades das proteínas nesta categoria variam um pouco. Tal estrutura pode ser formada inicialmente pela natureza ou quando a primária é exposta a severa hidrólise, temperatura ou outras condições.
Esta conformação possui três variedades:
- Voltas suaves, regulares e estereoregulares, construídas a partir de resíduos de aminoácidos, que giram em torno do eixo principal da conexão. Eles são mantidos juntos apenas por aqueles que surgem entre o oxigênio de um grupo peptídico e o hidrogênio de outro. Além disso, a estrutura é considerada correta devido ao fato das voltas se repetirem uniformemente a cada 4 elos. Essa estrutura pode ser canhota ou destra. Mas na maioria das proteínas conhecidas predomina o isômero dextrógiro. Tais conformações são geralmente chamadas de estruturas alfa.
- A composição e estrutura das proteínas do próximo tipo diferem das anteriores porque as ligações de hidrogênio são formadas não entre resíduos adjacentes a um lado da molécula, mas entre resíduos significativamente distantes e a uma distância bastante grande. Por esse motivo, toda a estrutura assume a forma de várias cadeias polipeptídicas onduladas, semelhantes a cobras. Existe uma característica que uma proteína deve apresentar. A estrutura dos aminoácidos nas ramificações deve ser a mais curta possível, como glicina ou alanina, por exemplo. Este tipo de conformação secundária é chamada de folhas beta devido à sua capacidade de se unirem para formar uma estrutura comum.
- A biologia refere-se ao terceiro tipo de estrutura proteica como fragmentos complexos, heterogeneamente dispersos e desordenados que não possuem estereregularidade e são capazes de alterar a estrutura sob a influência de condições externas.
Nenhum exemplo de proteínas que possuem naturalmente estrutura secundária foi identificado.

Educação terciária
Esta é uma conformação bastante complexa chamada “glóbulo”. O que é essa proteína? Sua estrutura é baseada na estrutura secundária, porém, novos tipos de interações entre os átomos dos grupos são adicionados, e toda a molécula parece se dobrar, focando assim no fato de que os grupos hidrofílicos são direcionados para o glóbulo, e os hidrofóbicos aqueles para fora.
Isso explica a carga da molécula de proteína em soluções coloidais de água. Que tipos de interações estão presentes aqui?
- Ligações de hidrogênio - permanecem inalteradas entre as mesmas partes da estrutura secundária.
- interações - ocorrem quando o polipeptídeo é dissolvido em água.
- As atrações iônicas são formadas entre grupos de resíduos de aminoácidos com cargas diferentes (radicais).
- Interações covalentes - podem se formar entre sítios ácidos específicos - moléculas de cisteína, ou melhor, suas caudas.
Assim, a composição e estrutura das proteínas com estrutura terciária podem ser descritas como cadeias polipeptídicas dobradas em glóbulos que retêm e estabilizam sua conformação devido a vários tipos de interações químicas. Exemplos de tais peptídeos: fosfoglicerato kenase, tRNA, alfa-queratina, fibroína de seda e outros.
Estrutura quaternária
Este é um dos glóbulos mais complexos que as proteínas formam. A estrutura e funções das proteínas deste tipo são muito multifacetadas e específicas.
O que é essa conformação? Estas são várias (em alguns casos dezenas) cadeias polipeptídicas grandes e pequenas que são formadas independentemente umas das outras. Mas então, devido às mesmas interações que consideramos para a estrutura terciária, todos esses peptídeos se torcem e se entrelaçam. Dessa forma, são obtidos glóbulos conformacionais complexos, que podem conter átomos metálicos, grupos lipídicos e carboidratos. Exemplos de tais proteínas: DNA polimerase, o invólucro proteico do vírus do tabaco, hemoglobina e outros.

Todas as estruturas peptídicas que examinamos possuem métodos próprios de identificação em laboratório, baseados em modernas capacidades de uso de cromatografia, centrifugação, microscopia eletrônica e óptica e altas tecnologias computacionais.
Funções desempenhadas
A estrutura e as funções das proteínas estão intimamente correlacionadas entre si. Ou seja, cada peptídeo desempenha uma função específica, única e específica. Existem também aqueles que são capazes de realizar várias operações significativas em uma célula viva ao mesmo tempo. Porém, é possível expressar de forma generalizada as principais funções das moléculas de proteínas nos organismos vivos:
- Fornecendo movimento. Organismos unicelulares, ou organelas, ou alguns tipos de células são capazes de movimento, contração e movimento. Isso é garantido por proteínas que compõem a estrutura de seu aparelho motor: cílios, flagelos e membrana citoplasmática. Se falamos de células incapazes de se mover, então as proteínas podem contribuir para a sua contração (miosina muscular).
- Função nutricional ou de reserva. É o acúmulo de moléculas de proteína nos ovos, embriões e sementes das plantas para repor ainda mais os nutrientes perdidos. Quando decompostos, os peptídeos produzem aminoácidos e substâncias biologicamente ativas que são necessárias para o desenvolvimento normal dos organismos vivos.
- Função energética. Além dos carboidratos, as proteínas também podem dar força ao corpo. A quebra de 1 g de peptídeo libera 17,6 kJ de energia útil na forma de ácido adenosina trifosfórico (ATP), que é gasto em processos vitais.
- A sinalização consiste em monitorar cuidadosamente os processos em andamento e transmitir sinais das células para os tecidos, destes para os órgãos, destes para os sistemas e assim por diante. Um exemplo típico é a insulina, que fixa estritamente a quantidade de glicose no sangue.
- Função receptora. É realizada alterando a conformação do peptídeo de um lado da membrana e envolvendo a outra extremidade na reestruturação. Ao mesmo tempo, o sinal e as informações necessárias são transmitidos. Na maioria das vezes, essas proteínas estão incorporadas nas membranas citoplasmáticas das células e exercem controle estrito sobre todas as substâncias que passam por elas. Eles também fornecem informações sobre mudanças químicas e físicas no meio ambiente.
- Função de transporte de peptídeos. É realizado por proteínas de canal e proteínas transportadoras. Seu papel é óbvio - transportar moléculas necessárias para locais com baixa concentração a partir de partes com alta concentração. Um exemplo típico é o transporte de oxigênio e dióxido de carbono através de órgãos e tecidos pela proteína hemoglobina. Eles também realizam a entrega de compostos de baixo peso molecular através da membrana celular para o interior.
- Função estrutural. Uma das funções mais importantes desempenhadas pela proteína. A estrutura de todas as células e suas organelas é assegurada por peptídeos. Eles, como uma moldura, definem a forma e a estrutura. Além disso, eles o apoiam e modificam se necessário. Portanto, para o crescimento e desenvolvimento, todos os organismos vivos necessitam de proteínas na sua dieta. Tais peptídeos incluem elastina, tubulina, colágeno, actina, queratina e outros.
- Função catalítica. É realizado por enzimas. Numerosos e variados, aceleram todas as reações químicas e bioquímicas do corpo. Sem a participação deles, uma maçã comum no estômago poderia ser digerida em apenas dois dias, provavelmente apodrecendo no processo. Sob a influência da catalase, peroxidase e outras enzimas, esse processo ocorre em duas horas. Em geral, é graças a esse papel das proteínas que se realizam o anabolismo e o catabolismo, ou seja, plástico e

Papel protetor
Existem vários tipos de ameaças das quais as proteínas são projetadas para proteger o corpo.
Em primeiro lugar, reagentes traumáticos, gases, moléculas, substâncias de diversos espectros de ação. Os peptídeos são capazes de interagir quimicamente com eles, convertendo-os em uma forma inofensiva ou simplesmente neutralizando-os.
Em segundo lugar, a ameaça física das feridas - se a proteína fibrinogênio não for transformada em fibrina no local da lesão a tempo, o sangue não coagulará, o que significa que não ocorrerá bloqueio. Então, ao contrário, você precisará do peptídeo plasmina, que pode dissolver o coágulo e restaurar a patência do vaso.
Em terceiro lugar, uma ameaça à imunidade. A estrutura e o significado das proteínas que formam a defesa imunológica são extremamente importantes. Anticorpos, imunoglobulinas, interferons - todos estes são elementos importantes e significativos do sistema linfático e imunológico humano. Qualquer partícula estranha, molécula prejudicial, parte morta de uma célula ou uma estrutura inteira está sujeita a exame imediato pelo composto peptídico. É por isso que uma pessoa pode, de forma independente, sem a ajuda de medicamentos, proteger-se diariamente de infecções e vírus simples.
Propriedades físicas
A estrutura de uma proteína celular é muito específica e depende da função desempenhada. Mas as propriedades físicas de todos os peptídeos são semelhantes e resumem-se às seguintes características.
- O peso da molécula é de até 1.000.000 Daltons.
- Os sistemas coloidais são formados em solução aquosa. Aí a estrutura adquire uma carga que pode variar dependendo da acidez do ambiente.
- Quando expostos a condições adversas (irradiação, ácido ou álcali, temperatura, etc.) são capazes de passar para outros níveis de conformações, ou seja, desnaturar. Este processo é irreversível em 90% dos casos. No entanto, há também uma mudança reversa - a renaturação.
Estas são as principais propriedades das características físicas dos peptídeos.