هذه مركبات عضوية عالية الجزيئات، بوليمرات حيوية، مبنية من 20 نوعًا من بقايا الأحماض الأمينية L- متصلة بتسلسل معين في سلاسل طويلة. يتراوح الوزن الجزيئي للبروتينات من 5 آلاف إلى 1 مليون. أُطلق اسم "البياض" لأول مرة على مادة بيض الطيور، التي تتخثر عند تسخينها إلى كتلة بيضاء غير قابلة للذوبان. وقد امتد المصطلح لاحقًا ليشمل مواد أخرى ذات خصائص مماثلة معزولة عن الحيوانات والنباتات.
أرز. 1. البوليمرات الحيوية الأكثر تعقيدا هي البروتينات. تتكون جزيئاتها الكبيرة من المونومرات، وهي أحماض أمينية. يحتوي كل حمض أميني على مجموعتين وظيفيتين: مجموعة الكربوكسيل ومجموعة أمينية. يتم إنشاء كل تنوع البروتينات نتيجة لمجموعات مختلفة من 20 حمضًا أمينيًا.
تهيمن البروتينات على جميع المركبات الأخرى الموجودة في الكائنات الحية، وعادة ما تمثل أكثر من نصف وزنها الجاف. من المفترض أن هناك عدة مليارات من البروتينات الفردية في الطبيعة (على سبيل المثال، يوجد أكثر من 3 آلاف بروتين مختلف في بكتيريا الإشريكية القولونية وحدها).
تلعب البروتينات دورًا رئيسيًا في العمليات الحيوية لأي كائن حي. تشتمل البروتينات على إنزيمات تحدث بها جميع التحولات الكيميائية في الخلية (التمثيل الغذائي)؛ يتحكمون في عمل الجينات. بمشاركتهم، يتم تحقيق عمل الهرمونات، ويتم نقل الغشاء، بما في ذلك توليد النبضات العصبية. وهي جزء لا يتجزأ من الجهاز المناعي (الجلوبيولين المناعي) ونظام التخثر، وتشكل أساس العظام والنسيج الضام، وتشارك في تحويل الطاقة واستخدامها.
تاريخ أبحاث البروتين
جرت المحاولات الأولى لعزل البروتينات في القرن الثامن عشر. بحلول بداية القرن التاسع عشر، ظهرت الأعمال الأولى في الدراسة الكيميائية للبروتينات. حاول العالمان الفرنسيان جوزيف لويس جاي لوساك ولويس جاك ثينارد تحديد التركيب العنصري للبروتينات من مصادر مختلفة، مما يمثل بداية الدراسات التحليلية المنهجية، والتي بفضلها تم التوصل إلى أن جميع البروتينات متشابهة في مجموعة العناصر المدرجة في تكوينهم. في عام 1836، اقترح الكيميائي الهولندي جي جي مولدر النظرية الأولى لتركيب المواد البروتينية، والتي بموجبها تحتوي جميع البروتينات على جذري افتراضي معين (C 40 H 62 N 10 O 12)، يرتبط بنسب مختلفة مع ذرات الكبريت والفوسفور. أطلق على هذا اسم "البروتين" الجذري (من البروتين اليوناني - الأول، الرئيسي). ساهمت نظرية مولدر في زيادة الاهتمام بدراسة البروتينات وتحسين طرق كيمياء البروتين. تم تطوير تقنيات عزل البروتينات عن طريق الاستخلاص بمحاليل الأملاح المحايدة، وتم الحصول على البروتينات في شكل بلوري لأول مرة (بعض البروتينات النباتية). لتحليل البروتينات، بدأوا في استخدام الهضم الأولي للأحماض والقلويات.
في الوقت نفسه، بدأ الاهتمام المتزايد بدراسة وظيفة البروتين. كان ينس جاكوب بيرسيليوس أول من اقترح في عام 1835 أنها تلعب دور المحفزات الحيوية. وسرعان ما تم اكتشاف الإنزيمات المحللة للبروتين - البيبسين (T. Schwann، 1836) والتربسين (L. Corvisart، 1856)، والتي جذبت الانتباه إلى فسيولوجيا الهضم وتحليل المنتجات المتكونة أثناء تحلل العناصر الغذائية. أدت الدراسات الإضافية لبنية البروتين والعمل على التركيب الكيميائي للببتيدات إلى ظهور فرضية الببتيد، والتي بموجبها يتم بناء جميع البروتينات من الأحماض الأمينية. بحلول نهاية القرن التاسع عشر، تمت دراسة معظم الأحماض الأمينية التي تشكل البروتينات.
في بداية القرن العشرين، كان الكيميائي الألماني إميل هيرمان فيشر أول من استخدم طرق الكيمياء العضوية لدراسة البروتينات وأثبت أن البروتينات تتكون من أحماض أمينية بيتا مرتبطة ببعضها البعض بواسطة رابطة أميد (ببتيد). لاحقًا، وبفضل استخدام طرق التحليل الفيزيائية والكيميائية، تم تحديد الكتلة الجزيئية للعديد من البروتينات، وتم تحديد الشكل الكروي للبروتينات الكروية، وتم إجراء تحليل حيود الأشعة السينية للأحماض الأمينية والببتيدات، وتم تحديد طرق التحليل الكروماتوغرافي. المتقدمة (انظر اللوني).
تم عزل أول هرمون بروتيني (فريدريك جرانت بانتنج، جون جيمس ريكارد ماكلويد، 1922)، وتم إثبات وجود جلوبيولين جاما في الأجسام المضادة، وتم وصف الوظيفة الأنزيمية لبروتين العضلات الميوسين (فلاديمير ألكساندروفيتش إنجلهارت، إم إن ليوبيموفا، 1939). . لأول مرة، تم الحصول على الإنزيمات في شكل بلوري - اليورياز (J.B. Saliner، 1926)، البيبسين (J.H. Nortron، 1929)، الليزوزيم (E.P. أبراهام، روبرت روبنسون، 1937).

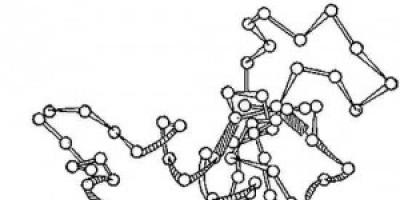
أرز. 2. مخطط التركيب ثلاثي الأبعاد لإنزيم الليزوزيم. الدوائر - الأحماض الأمينية. فروع - روابط الببتيد. المستطيلات المظللة هي روابط ثاني كبريتيد. تظهر المقاطع الحلزونية والمطولة من سلسلة البولي ببتيد.
في الخمسينيات من القرن الماضي، تم إثبات التنظيم ثلاثي المستويات لجزيئات البروتين - وجود بنية أولية وثانوية وثلاثية؛ أنشأ محللًا آليًا للأحماض الأمينية (ستانفورد مور، ويليام هوارد شتاين، 1950). في الستينيات، تم إجراء محاولات لتجميع البروتينات كيميائيا (الأنسولين، ريبونوكلياز). تم تحسين طرق تحليل حيود الأشعة السينية بشكل ملحوظ؛ تم إنشاء جهاز - جهاز تسلسل (P. Edman، G. Begg، 1967)، مما جعل من الممكن تحديد تسلسل الأحماض الأمينية في سلسلة بولي ببتيد. وكانت نتيجة ذلك إنشاء بنية عدة مئات من البروتينات من مجموعة متنوعة من المصادر. من بينها الإنزيمات المحللة للبروتين (الببسين، التربسين، الكيموتريبسين، سبتيليسين، كربوكسي ببتيداز)، الميوجلوبين، الهيموجلوبين، السيتوكروم، الليزوزيمات، الجلوبيولين المناعي، الهستونات، السموم العصبية، بروتينات الغلاف الفيروسي، هرمونات البروتين الببتيد. ونتيجة لذلك، ظهرت المتطلبات الأساسية لحل المشاكل الملحة في علم الإنزيمات والمناعة والغدد الصماء وغيرها من مجالات الكيمياء البيولوجية.
في نهاية القرن العشرين، تم إحراز تقدم كبير في دراسة دور البروتينات في تركيب مصفوفة البوليمرات الحيوية، وفهم آليات عملها في العمليات الحياتية المختلفة للكائنات الحية، وإقامة العلاقة بين بنيتها ووظيفتها. كان لتحسين طرق البحث وظهور طرق جديدة لفصل البروتينات والببتيدات أهمية كبيرة.
إن تطوير طريقة فعالة لتحليل تسلسل النيوكليوتيدات في الأحماض النووية جعل من الممكن تبسيط وتسريع تحديد تسلسل الأحماض الأمينية في البروتينات بشكل كبير. لقد تبين أن هذا ممكن لأن ترتيب الأحماض الأمينية في البروتين يتم تحديده من خلال تسلسل النيوكليوتيدات في الجين الذي يشفر هذا البروتين (الجزء). وبالتالي، بمعرفة ترتيب النيوكليوتيدات في هذا الجين والشفرة الوراثية، يمكن للمرء أن يتنبأ بدقة بترتيب وجود الأحماض الأمينية في سلسلة البولي ببتيد للبروتين. جنبا إلى جنب مع التقدم في التحليل الهيكلي للبروتينات، تم تحقيق نتائج مهمة في دراسة تنظيمها المكاني، وآليات تكوين وعمل المجمعات فوق الجزيئية، بما في ذلك الريبوسومات والعضيات الخلوية الأخرى، والكروماتين، والفيروسات، وما إلى ذلك.
هيكل البروتين
يتم بناء جميع البروتينات تقريبًا من 20 حمضًا أمينيًا ألفا تنتمي إلى السلسلة L، وهي متماثلة في جميع الكائنات الحية تقريبًا. ترتبط الأحماض الأمينية في البروتينات ببعضها البعض بواسطة رابطة الببتيد -CO-NH-، والتي تتكون من مجموعة الكربوكسيل والأمينية من بقايا الأحماض الأمينية المجاورة: يشكل حمضان أمينيان ثنائي الببتيد الذي يكون فيه الكربوكسيل الطرفي (-COOH) وتبقى المجموعة الأمينية (H 2 N-) حرة، ويمكن إضافة أحماض أمينية جديدة إليها لتكوين سلسلة متعددة الببتيد.
يُطلق على قسم السلسلة الذي تقع عليه المجموعة الطرفية H 2 N اسم N-terminal ، والجزء المقابل له يسمى C-terminal. يتم تحديد التنوع الكبير للبروتينات من خلال تسلسل الترتيب وعدد بقايا الأحماض الأمينية التي تحتوي عليها. على الرغم من عدم وجود تمييز واضح، إلا أن السلاسل القصيرة تسمى عادة الببتيدات أو قليلات الببتيد (من أوليغو...)، وعادة ما تفهم البوليببتيدات (البروتينات) على أنها سلاسل تتكون من 50 أو أكثر. البروتينات الأكثر شيوعًا هي تلك التي تحتوي على 100-400 بقايا حمض أميني، ولكن هناك أيضًا تلك التي تتكون جزيئاتها من 1000 بقايا أو أكثر. يمكن أن تتكون البروتينات من عدة سلاسل متعددة الببتيد. في مثل هذه البروتينات، تسمى كل سلسلة بولي ببتيد وحدة فرعية.
التركيب المكاني للبروتينات

أرز. 3. يتكون البروتين في جميع الكائنات الحية من 20 نوعا من الأحماض الأمينية. يتميز كل بروتين بتشكيلة معينة ونسبة كمية من الأحماض الأمينية. في جزيئات البروتين، ترتبط الأحماض الأمينية ببعضها البعض بواسطة روابط الببتيد (- CO - NH -) في تسلسل خطي، لتشكل ما يسمى بالبنية الأولية للبروتين. الخط العلوي - الأحماض الأمينية الحرة مع المجموعات الجانبية R1، R2، R3؛ خلاصة القول - ترتبط الأحماض الأمينية بواسطة روابط الببتيد.
سلسلة البولي ببتيد قادرة على تكوين وصيانة بنية مكانية خاصة تلقائيًا. بناءً على شكل جزيئات البروتين، تنقسم البروتينات إلى ليفية وكروية. في البروتينات الكروية، يتم طي واحدة أو أكثر من سلاسل البوليببتيد لتكوين بنية كروية مدمجة، أو كروية. عادةً ما تكون هذه البروتينات قابلة للذوبان بدرجة عالية في الماء. وتشمل هذه جميع الإنزيمات تقريبًا وبروتينات نقل الدم والعديد من بروتينات التخزين. البروتينات الليفية هي جزيئات تشبه الخيوط يتم ربطها معًا بواسطة روابط متقاطعة وتشكل أليافًا طويلة أو هياكل ذات طبقات. لديهم قوة ميكانيكية عالية، وغير قابلة للذوبان في الماء وتؤدي وظائف هيكلية ووقائية بشكل رئيسي. الممثلون النموذجيون لهذه البروتينات هم كيراتين الشعر والصوف، وألياف الحرير، وكولاجين الأوتار.
يُطلق على ترتيب الأحماض الأمينية المرتبطة تساهميًا في سلسلة البولي ببتيد اسم تسلسل الأحماض الأمينية، أو البنية الأساسية للبروتينات. البنية الأساسية لكل بروتين، والتي يتم تشفيرها بواسطة الجين المقابل، تكون ثابتة وتحمل جميع المعلومات اللازمة لتشكيل الهياكل ذات المستوى الأعلى. العدد المحتمل للبروتينات التي يمكن تكوينها من 20 حمضًا أمينيًا غير محدود عمليًا.
نتيجة لتفاعل المجموعات الجانبية من بقايا الأحماض الأمينية، فإن الأجزاء الفردية الصغيرة نسبيًا من سلسلة البولي ببتيد تأخذ شكلاً أو آخر (نوع الطي)، المعروف باسم البنية الثانوية للبروتينات. أكثر العناصر المميزة لها هي حلزون ألفا وهيكل بيتا المتكرر بشكل دوري. الهيكل الثانوي مستقر للغاية. نظرًا لأنه يتم تحديده إلى حد كبير من خلال تسلسل الأحماض الأمينية لمنطقة البروتين المقابلة، يصبح من الممكن التنبؤ به بدرجة معينة من الاحتمال. تم تقديم مصطلح "؟-الحلزون" من قبل عالم الكيمياء الحيوية والفيزيائي والكيميائي الأمريكي لينوس كارل بولينج، الذي وصف ترتيب سلسلة البولي ببتيد في البروتين؟-الكيراتين في شكل حلزون أيمن (يمكن للحلزون؟ يمكن مقارنتها بسلك الهاتف). لكل دورة من هذا الحلزون في البروتين هناك 3.6 بقايا من الأحماض الأمينية. وهذا يعني أن مجموعة -C=O من رابطة ببتيدية واحدة تشكل رابطة هيدروجينية مع مجموعة -NH من رابطة ببتيدية أخرى، وأربعة بقايا من الأحماض الأمينية بعيدة عن الأولى. في المتوسط، تحتوي كل منطقة حلزونية ألفا على ما يصل إلى 15 حمضًا أمينيًا، وهو ما يتوافق مع 3-4 دورات من الحلزون. ولكن في كل بروتين فردي، يمكن أن يختلف طول الحلزون بشكل كبير عن هذه القيمة. في المقطع العرضي، يكون الحلزون ألفا على شكل قرص، حيث تشير السلاسل الجانبية للأحماض الأمينية إلى الخارج.
هيكل أم؟ - طبقة مطوية، يمكن أن تتكون من عدة أقسام من سلسلة البولي ببتيد. يتم تمديد هذه المقاطع ووضعها بالتوازي مع بعضها البعض، وتتصل ببعضها البعض بواسطة روابط هيدروجينية تحدث بين الروابط الببتيدية. يمكن توجيهها في نفس الاتجاه أو في اتجاهين متعاكسين (عادة ما يعتبر اتجاه الحركة على طول سلسلة البولي ببتيد من الطرف N إلى الطرف C). في الحالة الأولى، تسمى الطبقة المطوية بالتوازي، في الثانية - غير الموازية. يتم تشكيل الأخير عندما تقوم سلسلة الببتيد بتحول حاد إلى الخلف، لتشكل انحناء (؟-انحناء). هل السلاسل الجانبية للأحماض الأمينية متعامدة مع المستوى؟ -طبقة.
المحتوى النسبي؟ -أقسام دوامة و؟ - يمكن أن تختلف الهياكل بشكل كبير بين البروتينات المختلفة. هناك بروتينات تهيمن عليها حلزونات ألفا (حوالي 75% من الأحماض الأمينية في الميوجلوبين والهيموجلوبين)، والنوع الرئيسي لسلسلة قابلة للطي في العديد من البروتينات الليفية (بما في ذلك ألياف الحرير، بيتا كيراتين) هو حلزون ألفا. -بناء. مناطق سلسلة البولي ببتيد التي لا يمكن تصنيفها في أي من المطابقات الموصوفة أعلاه تسمى حلقات الاتصال. يتم تحديد هيكلها بشكل أساسي من خلال التفاعلات بين السلاسل الجانبية للأحماض الأمينية، وفي جزيء أي بروتين يتناسب بطريقة محددة بدقة.
يسمى الهيكل الثالثالتركيب المكاني للبروتينات الكروية. ولكن غالبًا ما يشير هذا المفهوم إلى طريقة طي سلسلة البولي ببتيد في الفضاء، وهي خاصية مميزة لكل بروتين محدد. يتكون الهيكل الثالث من سلسلة بولي ببتيد من البروتين تلقائيًا، على ما يبدو، على طول مسار (مسارات) تخثر معينة مع التكوين الأولي لعناصر البنية الثانوية. إذا كان استقرار البنية الثانوية يرجع إلى الروابط الهيدروجينية، فإن البنية الثلاثية يتم تثبيتها من خلال نظام متنوع من التفاعلات غير التساهمية: التفاعلات الهيدروجينية والأيونية والجزيئية، بالإضافة إلى الاتصالات الكارهة للماء بين السلاسل الجانبية للأحماض الأمينية غير القطبية. بقايا الحمض.
في بعض البروتينات، يتم تثبيت البنية الثلاثية بشكل أكبر من خلال تكوين روابط ثاني كبريتيد (-S-S- Bonds) بين بقايا السيستين. كقاعدة عامة، توجد داخل كرية البروتين سلاسل جانبية من الأحماض الأمينية الكارهة للماء مجمعة في القلب (انتقالها داخل كرية البروتين مناسب من الناحية الديناميكية الحرارية)، وعلى المحيط توجد بقايا محبة للماء وبعض البقايا الكارهة للماء. كرة البروتين محاطة بعدة مئات من جزيئات الماء المائي، وهو أمر ضروري لاستقرار جزيء البروتين وغالباً ما يشارك في عمله. البنية الثلاثية متحركة، ويمكن لأقسامها الفردية أن تتغير، مما يؤدي إلى التحولات التوافقية التي تلعب دورًا مهمًا في تفاعل البروتين مع الجزيئات الأخرى.
البنية الثلاثية هي أساس الخصائص الوظيفية للبروتين. فهو يحدد تكوين مجموعات المجموعات الوظيفية في البروتين - المراكز النشطة ومناطق الارتباط، ويمنحها الشكل الهندسي اللازم، ويسمح بخلق بيئة داخلية، وهي شرط أساسي لحدوث العديد من التفاعلات، ويضمن التفاعل مع البروتينات الأخرى. .
يتوافق التركيب الثلاثي للبروتينات بشكل واضح مع بنيتها الأساسية؛ من المحتمل أن يكون هناك كود كيميائي مجسم غير مفكك بعد يحدد طبيعة طي البروتين. ومع ذلك، فإن نفس طريقة الترتيب المكاني لا تتوافق عادةً مع بنية أساسية واحدة، ولكن مع عائلة كاملة من الهياكل التي قد يتطابق فيها جزء صغير فقط (يصل إلى 20-30٪) من بقايا الأحماض الأمينية، ولكن في بعض الحالات. الأماكن في السلسلة يتم الحفاظ على تشابه بقايا الأحماض الأمينية. والنتيجة هي تكوين عائلات كبيرة من البروتينات التي تتميز ببنية أولية متشابهة ومتشابهة إلى حد ما، وكقاعدة عامة، وظيفة مشتركة. هذه، على سبيل المثال، بروتينات كائنات حية من أنواع مختلفة لها نفس الوظيفة وترتبط ارتباطًا تطوريًا: الميوجلوبين والهيموجلوبين والتربسين والكيموتربسين والإيلاستاز والبروتينات الحيوانية الأخرى.

أرز. 4. نتيجة لدمج العديد من جزيئات البروتين الكبيرة مع البنية الثلاثية، يتم تشكيل بنية البروتين الرباعية في مجمع معقد. مثال على هذه البروتينات المعقدة هو الهيموجلوبين، الذي يتكون من أربعة جزيئات كبيرة.
في كثير من الأحيان، خاصة في البروتينات الكبيرة، يحدث طي سلسلة البولي ببتيد من خلال تكوين أقسام فردية من السلسلة لعناصر أكثر أو أقل مستقلة من البنية المكانية - المجالات التي يمكن أن يكون لها استقلالية وظيفية، حيث تكون مسؤولة عن نشاط بيولوجي واحد أو آخر للبروتينات الكبيرة. بروتين. وبالتالي، تضمن المجالات الطرفية N لبروتينات تخثر الدم ارتباطها بغشاء الخلية.
هناك العديد من البروتينات التي تكون جزيئاتها عبارة عن مجموعة من الكريات (الوحدات الفرعية) المرتبطة ببعضها البعض عن طريق تفاعلات كارهة للماء أو روابط هيدروجينية أو أيونية. تسمى هذه المجمعات بروتينات قليلة القسيم أو متعددة القسيمات أو بروتينات الوحدة. يسمى ترتيب الوحدات الفرعية في مجمع البروتين النشط وظيفيًا بالبنية الرباعية للبروتين. بعض البروتينات قادرة على تكوين هياكل ذات رتب أعلى، على سبيل المثال، مجمعات الإنزيمات المتعددة، والهياكل الممتدة (بروتينات غلاف العاثية)، والمجمعات فوق الجزيئية التي تعمل ككل واحد (على سبيل المثال، الريبوسومات أو مكونات سلسلة الجهاز التنفسي للميتوكوندريا).
يسمح الهيكل الرباعي بإنشاء جزيئات ذات أشكال هندسية غير عادية. وبالتالي، فإن الفيريتين، الذي يتكون من 24 وحدة فرعية، لديه تجويف داخلي، بفضله يتمكن البروتين من ربط ما يصل إلى 3000 أيون حديد. بالإضافة إلى ذلك، يسمح التركيب الرباعي بأداء عدة وظائف مختلفة في جزيء واحد. يجمع إنزيم التربتوفان بين الإنزيمات المسؤولة عن عدة مراحل متتالية من تخليق الحمض الأميني التربتوفان.
طرق دراسة بنية البروتين
يحدد الهيكل الأساسي للبروتينات جميع المستويات الأخرى لتنظيم جزيء البروتين. لذلك، عند دراسة الوظيفة البيولوجية للبروتينات المختلفة، فإن معرفة هذا الهيكل أمر مهم. البروتين الأول الذي تم إنشاء تسلسل الأحماض الأمينية له هو هرمون البنكرياس، الأنسولين. وقد نفذ هذا العمل، الذي استغرق 11 عامًا، عالم الكيمياء الحيوية الإنجليزي فريدريك سانجر (1954). حدد موقع 51 حمضًا أمينيًا في جزيء الهرمون وأظهر أنه يتكون من سلسلتين متصلتين بروابط ثاني كبريتيد. وفي وقت لاحق، تمت أتمتة معظم العمل على إنشاء البنية الأولية للبروتينات.
ومع تطور أساليب الهندسة الوراثية، أصبح من الممكن تسريع هذه العملية بشكل أكبر من خلال تحديد البنية الأولية للبروتينات وفقًا لنتائج تحليل تسلسل النوكليوتيدات في الجينات التي تشفر هذه البروتينات. تتم دراسة البنية الثانوية والثالثية للبروتينات باستخدام طرق فيزيائية معقدة للغاية، على سبيل المثال، ثنائية اللون الدائرية أو تحليل حيود الأشعة السينية لبلورات البروتين. تم إنشاء البنية الثلاثية لأول مرة من قبل عالم الكيمياء الحيوية الإنجليزي جون كاودري كيندرو (1957) لبروتين العضلات الميوجلوبين.

أرز. 5. نموذج لجزيء الميوجلوبين (التكوين المكاني للجزيء)
تمسخ البروتينات
يتم بسهولة تدمير الروابط الضعيفة نسبيًا المسؤولة عن تثبيت الهياكل الثانوية والثالثية والرباعية للبروتين، الأمر الذي يصاحبه فقدان نشاطها البيولوجي. يحدث تدمير بنية البروتين الأصلي (الأصلي)، والذي يسمى تمسخ الطبيعة، في وجود الأحماض والقواعد، مع التسخين والتغيرات في القوة الأيونية والمؤثرات الأخرى. كقاعدة عامة، تكون البروتينات المشوهة ضعيفة الذوبان في الماء أو غير قابلة للذوبان على الإطلاق. مع تأثير قصير المدى والقضاء السريع على عوامل تغيير طبيعة البروتين، من الممكن إعادة تكوين البروتين من خلال الاستعادة الكاملة أو الجزئية للبنية الأصلية والخصائص البيولوجية.
تصنيف البروتين
إن تعقيد بنية جزيئات البروتين والتنوع الشديد في الوظائف التي تؤديها يجعل من الصعب إنشاء تصنيف موحد وواضح لها، على الرغم من محاولات القيام بذلك بشكل متكرر منذ نهاية القرن التاسع عشر. بناءً على تركيبها الكيميائي، تنقسم البروتينات إلى بسيطة ومعقدة (تسمى أحيانًا البروتينات). تتكون جزيئات الأولى من الأحماض الأمينية فقط. بالإضافة إلى سلسلة البولي ببتيد نفسها، تحتوي البروتينات المعقدة على مكونات غير بروتينية تتمثل في الكربوهيدرات (البروتينات السكرية)، والدهون (البروتينات الدهنية)، والأحماض النووية (البروتينات النووية)، والأيونات المعدنية (البروتينات المعدنية)، ومجموعة الفوسفات (البروتينات الفوسفاتية)، والأصباغ (البروتينات الملونة)، إلخ. .
اعتمادا على الوظائف التي تؤديها، يتم تمييز عدة فئات من البروتينات. تتكون الفئة الأكثر تنوعًا وتخصصًا من بروتينات ذات وظيفة تحفيزية - إنزيمات لديها القدرة على تسريع التفاعلات الكيميائية التي تحدث في الكائنات الحية. وبهذه الصفة، تشارك البروتينات في جميع عمليات التوليف وتفكيك المركبات المختلفة أثناء عملية التمثيل الغذائي، وفي التخليق الحيوي للبروتينات والأحماض النووية، وتنظيم تطور الخلايا وتمايزها. تتمتع بروتينات النقل بالقدرة على ربط الأحماض الدهنية والهرمونات وغيرها من المركبات والأيونات العضوية وغير العضوية بشكل انتقائي، ثم نقلها مع التيار إلى الموقع المطلوب (على سبيل المثال، يشارك الهيموجلوبين في نقل الأكسجين من الرئتين إلى جميع خلايا الجسم). الجسم). تقوم بروتينات النقل أيضًا بالنقل النشط للأيونات والدهون والسكريات والأحماض الأمينية عبر الأغشية البيولوجية.
تؤدي البروتينات الهيكلية وظيفة داعمة أو وقائية؛ يشاركون في تكوين الهيكل العظمي للخلية. وأكثرها شيوعًا هو كولاجين الأنسجة الضامة والكيراتين والأظافر والريش والإيلاستين لخلايا الأوعية الدموية وغيرها الكثير. بالاشتراك مع الدهون، فهي تشكل الأساس الهيكلي للأغشية الخلوية وداخل الخلايا.
يؤدي عدد من البروتينات وظيفة وقائية. على سبيل المثال، الغلوبولين المناعي (الأجسام المضادة) للفقاريات، التي لديها القدرة على ربط الكائنات الحية الدقيقة والمواد المسببة للأمراض الأجنبية، وتحييد آثارها المسببة للأمراض على الجسم ومنع تكاثر الخلايا. ويشارك الفيبرينوجين والثرومبين في عملية تخثر الدم. يتم تصنيف العديد من المواد البروتينية التي تفرزها البكتيريا، وكذلك مكونات بعض اللافقاريات، على أنها سموم.
تشارك بعض البروتينات (التنظيمية) في تنظيم النشاط الفسيولوجي للجسم ككل أو الأعضاء أو الخلايا أو العمليات الفردية. إنهم يتحكمون في نسخ الجينات وتخليق البروتين. وتشمل هذه هرمونات البروتين الببتيد التي تفرزها الغدد الصماء. توفر بروتينات تخزين البذور العناصر الغذائية للمراحل الأولى من تطور الجنين. وتشمل هذه أيضًا الكازين وألبومين بياض البيض (ألبومين البيض) وغيرها الكثير. بفضل البروتينات، تكتسب خلايا العضلات القدرة على الانقباض وتوفير الحركة للجسم في النهاية. ومن أمثلة هذه البروتينات المقلصة الأكتين العضلي الهيكلي والميوسين، وكذلك التوبولين، وهي مكونات الأهداب والسوط للكائنات وحيدة الخلية؛ كما أنها تضمن اختلاف الكروموسومات أثناء انقسام الخلايا.
بروتينات المستقبلات هي هدف الهرمونات وغيرها من المركبات النشطة بيولوجيا. وبمساعدتهم، تتصور الخلية معلومات حول حالة البيئة الخارجية. إنها تلعب دورًا مهمًا في نقل الإثارة العصبية وفي حركة الخلايا الموجهة (الانجذاب الكيميائي). يحدث تحويل واستخدام الطاقة التي تدخل الجسم، وكذلك الطاقة، أيضًا بمشاركة بروتينات نظام الطاقة الحيوية (على سبيل المثال، الصباغ البصري رودوبسين، السيتوكرومات في السلسلة التنفسية). هناك أيضًا العديد من البروتينات ذات وظائف أخرى غير عادية في بعض الأحيان (على سبيل المثال، تحتوي بلازما بعض أسماك القطب الجنوبي على بروتينات لها خصائص مضادة للتجمد).
التخليق الحيوي للبروتين
يتم "تخزين" جميع المعلومات المتعلقة ببنية بروتين معين في الجينات المقابلة في شكل تسلسل من النيوكليوتيدات ويتم تنفيذها في عملية تخليق القالب. أولاً، يتم نقل (قراءة) المعلومات من جزيء الحمض النووي إلى الحمض النووي الريبي المرسال (mRNA) باستخدام إنزيم بوليميراز الحمض النووي الريبي المعتمد على الحمض النووي، ثم في الريبوسوم الموجود على mRNA، كما هو الحال في المصفوفة وفقًا للشفرة الجينية، بمشاركة من نقل الحمض النووي الريبي (RNA) الذي ينقل الأحماض الأمينية، يحدث تكوين سلسلة متعددة الببتيد.
سلاسل البوليببتيد المُصنّعة الخارجة من الريبوسوم، القابلة للطي تلقائيًا، تأخذ خاصية التشكل الخاصة بالبروتين ويمكن أن تخضع لتعديل ما بعد الترجمة. يمكن أن تخضع السلاسل الجانبية للأحماض الأمينية الفردية لتعديلات (الهيدروكسيل، الفسفرة، وما إلى ذلك). ولهذا السبب، على سبيل المثال، يوجد الهيدروكسي برولين والهيدروكسي سيلين في الكولاجين (انظر). قد يكون التعديل أيضًا مصحوبًا بتمزق روابط البولي ببتيد. وبهذه الطريقة، على سبيل المثال، يتم تكوين جزيء الأنسولين النشط، الذي يتكون من سلسلتين متصلتين بواسطة روابط ثاني كبريتيد.

أرز. 6. المخطط العام للتخليق الحيوي للبروتين.
أهمية البروتينات في التغذية
البروتينات هي أهم مكونات الغذاء الحيواني والإنساني. يتم تحديد القيمة الغذائية للبروتينات من خلال محتواها من الأحماض الأمينية الأساسية، والتي لا يتم إنتاجها في الجسم نفسه. وفي هذا الصدد، تعتبر البروتينات النباتية أقل قيمة من البروتينات الحيوانية: فهي أكثر فقراً في الليسين والميثيونين والتربتوفان، كما أن هضمها أكثر صعوبة في الجهاز الهضمي. يؤدي نقص الأحماض الأمينية الأساسية في الغذاء إلى اضطرابات شديدة في استقلاب النيتروجين.
يتم تقسيم البروتينات إلى أحماض أمينية حرة، والتي، بعد امتصاصها في الأمعاء، تدخل وتوزع على جميع الخلايا. يتحلل بعضها إلى مركبات بسيطة مع إطلاق الطاقة التي تستخدمها الخلية لتلبية احتياجات مختلفة، والبعض الآخر يذهب إلى تخليق بروتينات جديدة مميزة لكائن معين. (R. A. Matveeva، موسوعة سيريل وميثوديوس)
تعداد البروتينات
- اميلويد - اميلويد.
- أنيوني - أنيوني.
- مكافحة الفيروسات - مضاد للفيروسات.
- المناعة الذاتية - المناعة الذاتية.
- ذاتي - ذاتي؛
- البكتيرية - البكتيرية.
- بروتين بنس جونز؛
- الناجم عن الفيروس - الناجم عن الفيروس؛
- فيروسي - فيروس؛
- فيروسي غير هيكلي - فيروس غير هيكلي؛
- الهيكلية الفيروسية - الهيكلية الفيروسية؛
- فيروس محدد - فيروس محدد؛
- ارتفاع الوزن الجزيئي - ارتفاع الوزن الجزيئي.
- تحتوي على الهيم - الهيم.
- غير متجانس - أجنبي؛
- هجين - هجين
- غليكوزيلاتي - غليكوزيلاتي.
- كروي - كروي.
- مشوهة - مشوهة.
- تحتوي على الحديد - الحديد؛
- صفار - صفار؛
- البروتين الحيواني - البروتين الحيواني؛
- وقائي - دفاعي
- مناعة - مناعة.
- مناعي - ذو صلة مناعيًا ؛
- ملزمة الكالسيوم.
- حامض - حامض.
- جسيمية - جسيمية.
- غشاء - غشاء
- المايلوما - المايلوما.
- ميكروسومال - ميكروسومال.
- بروتين الحليب - بروتين الحليب؛
- وحيدة النسيلة - الجلوبيولين المناعي وحيدة النسيلة.
- بروتين العضلات - بروتين العضلات.
- أصلي - أصلي؛
- غير هيستون - غير هيستون.
- معيبة - جزئية؛
- غير قابلة للذوبان - غير قابلة للذوبان؛
- غير قابل للهضم - غير قابل للذوبان.
- غير إنزيمي - غير إنزيمي.
- الوزن الجزيئي المنخفض - الوزن الجزيئي المنخفض.
- بروتين جديد - بروتين جديد؛
- عام - كامل؛
- جينات المنشأ - البروتين الورمي.
- بروتين المرحلة الرئيسية - أنيوني.
- بروتين المرحلة الحادة (الالتهاب) - بروتين المرحلة الحادة؛
- الغذاء الغذاء؛
- بروتين بلازما الدم - بروتين البلازما.
- المشيمة - المشيمة.
- فك الارتباط - فك الارتباط؛
- بروتين تجديد العصب.
- تنظيمي - تنظيمي
- إعادة التركيب - المؤتلف؛
- مستقبل - مستقبل.
- الريبوسوم - الريبوسوم.
- ملزمة - ملزمة؛
- بروتين إفرازي - بروتين إفرازي.
- سي التفاعلي - سي التفاعلي.
- بروتين مصل اللبن - بروتين مصل اللبن، بروتين اللبن.
- الأنسجة - الأنسجة.
- سامة - سامة.
- خيميري - خيميري؛
- كامل - كامل؛
- عصاري خلوي - عصاري خلوي.
- البروتين القلوي - البروتين الأنيوني.
- خارجي - خارجي.
- الذاتية - البروتين الداخلي.
اقرأ المزيد عن البروتينات في الأدب:
- Volkenshtein M.V.، الجزيئات و، M.، 1965، الفصل. 3 - 5؛
- جاوروويتز ف.، الكيمياء ووظائف البروتينات، العابرة. من الإنجليزية، موسكو، 1965؛
- سيساكيان ن.م. وجلاديلين ك.ل، الجوانب البيوكيميائية لتخليق البروتين، في كتاب: التقدم في الكيمياء البيولوجية، المجلد 7، م، 1965، ص. 3؛
- ستيبانوف في إم البيولوجيا الجزيئية. هيكل ووظيفة البروتينات. م.، 1996؛
- شامين أ.ن.، تطوير كيمياء البروتين، م.، 1966؛
- البروتينات والببتيدات. م، 1995-2000. ت 1-3؛
- التخليق الحيوي للبروتين والأحماض النووية، أد. أ.س. سبيرينا، م.، 1965؛
- مقدمة في البيولوجيا الجزيئية، عبر. من الإنجليزية، م، 1967
- الجزيئات والخلايا. [قعد. فن.]، عبر. من الإنجليزية، م، 1966، ص. 7 - 27، 94 - 106؛
- أساسيات الكيمياء الحيوية: ترجمة من الإنجليزية M.، 1981. T. 1؛
- مشكلة البروتين. م، 1995. ت 1-5؛
- البروتينات. نيويورك، 1975-1979. 3 إد. خامسا 1-4.
ابحث عن شيء آخر مثير للاهتمام:
السناجب- مركبات عضوية ذات وزن جزيئي عالي تتكون من بقايا الأحماض الأمينية ألفا.
في تكوين البروتينيشمل الكربون والهيدروجين والنيتروجين والأكسجين والكبريت. تشكل بعض البروتينات مجمعات مع جزيئات أخرى تحتوي على الفوسفور والحديد والزنك والنحاس.
البروتينات لها وزن جزيئي كبير: زلال البيض - 36000، الهيموجلوبين - 152000، الميوسين - 500000. للمقارنة: الوزن الجزيئي للكحول هو 46، حمض الأسيتيك - 60، البنزين - 78.
تكوين الأحماض الأمينية للبروتينات
السناجب- البوليمرات غير الدورية، ومونومراتها الأحماض الأمينية ألفا. عادة، يُطلق على 20 نوعًا من الأحماض الأمينية ألفا اسم مونومرات البروتين، على الرغم من وجود أكثر من 170 منها في الخلايا والأنسجة.
اعتمادا على ما إذا كان يمكن تصنيع الأحماض الأمينية في جسم الإنسان والحيوانات الأخرى، فإنها تتميز: الأحماض الأمينية غير الأساسية- يمكن توليفها. الأحماض الأمينية الأساسية- لا يمكن توليفها. يجب توفير الأحماض الأمينية الأساسية للجسم عن طريق الطعام. تقوم النباتات بتصنيع جميع أنواع الأحماض الأمينية.
اعتمادا على تكوين الأحماض الأمينية. البروتينات هي: كاملة- تحتوي على مجموعة كاملة من الأحماض الأمينية. معيب- بعض الأحماض الأمينية مفقودة في تركيبها. إذا كانت البروتينات تتكون من أحماض أمينية فقط، فإنها تسمى بسيط. إذا كانت البروتينات تحتوي، بالإضافة إلى الأحماض الأمينية، على مكون حمض غير أميني (مجموعة صناعية)، فإنها تسمى معقد. يمكن تمثيل المجموعة الاصطناعية بالمعادن (البروتينات المعدنية)، والكربوهيدرات (البروتينات السكرية)، والدهون (البروتينات الدهنية)، والأحماض النووية (البروتينات النووية).
الجميع تحتوي على الأحماض الأمينية: 1) مجموعة الكربوكسيل (-COOH)، 2) المجموعة الأمينية (-NH 2)، 3) المجموعة الجذرية أو R (باقي الجزيء). يختلف هيكل الجذر باختلاف أنواع الأحماض الأمينية. اعتمادا على عدد المجموعات الأمينية ومجموعات الكربوكسيل المدرجة في تكوين الأحماض الأمينية، يتم تمييزها: الأحماض الأمينية المحايدةوجود مجموعة كربوكسيل واحدة ومجموعة أمينية واحدة؛ الأحماض الأمينية الأساسيةوجود أكثر من مجموعة أمينية واحدة؛ الأحماض الأمينية الحمضيةوجود أكثر من مجموعة كربوكسيل واحدة.
الأحماض الأمينية هي مركبات مذبذبةلأنها في المحلول يمكن أن تعمل كأحماض وقواعد. في المحاليل المائية، توجد الأحماض الأمينية في أشكال أيونية مختلفة.
السندات الببتيد
الببتيدات- مواد عضوية تتكون من بقايا الأحماض الأمينية المرتبطة بروابط الببتيد.
يحدث تكوين الببتيدات نتيجة تفاعل تكثيف الأحماض الأمينية. عندما تتفاعل المجموعة الأمينية لأحد الأحماض الأمينية مع المجموعة الكربوكسيلية لحمض أميني آخر، تحدث رابطة تساهمية بين النيتروجين والكربون، تسمى الببتيد. اعتمادا على عدد بقايا الأحماض الأمينية الموجودة في الببتيد، هناك ثنائي الببتيدات، ثلاثي الببتيدات، رباعي الببتيداتإلخ. يمكن تكرار تكوين الرابطة الببتيدية عدة مرات. وهذا يؤدي إلى التكوين الببتيدات. في أحد طرفي الببتيد توجد مجموعة أمينية حرة (تسمى النهاية N)، وفي الطرف الآخر توجد مجموعة كربوكسيل حرة (تسمى النهاية C).

التنظيم المكاني لجزيئات البروتين
يعتمد أداء بعض الوظائف المحددة بواسطة البروتينات على التكوين المكاني لجزيئاتها؛ بالإضافة إلى ذلك، من غير المواتي من الناحية الحيوية للخلية أن تحتفظ بالبروتينات في شكل غير مطوي، في شكل سلسلة، وبالتالي تخضع سلاسل البولي ببتيد للطي، وتكتسب بنية معينة ثلاثية الأبعاد، أو التشكل. هناك 4 مستويات التنظيم المكاني للبروتينات.
هيكل البروتين الأساسي- تسلسل ترتيب بقايا الأحماض الأمينية في سلسلة البولي ببتيد التي تشكل جزيء البروتين. الرابطة بين الأحماض الأمينية هي رابطة الببتيد.

إذا كان جزيء البروتين يتكون من 10 بقايا من الأحماض الأمينية فقط، فإن عدد المتغيرات الممكنة نظريًا لجزيئات البروتين التي تختلف في ترتيب تناوب الأحماض الأمينية هو 10 20. بوجود 20 من الأحماض الأمينية، يمكنك صنع مجموعات أكثر تنوعًا منها. تم العثور على حوالي عشرة آلاف بروتين مختلف في جسم الإنسان، والتي تختلف عن بعضها البعض وعن بروتينات الكائنات الحية الأخرى.
إن البنية الأساسية لجزيء البروتين هي التي تحدد خصائص جزيئات البروتين وتكوينها المكاني. يؤدي استبدال حمض أميني واحد فقط بآخر في سلسلة عديد الببتيد إلى تغيير في خصائص البروتين ووظائفه. على سبيل المثال، يؤدي استبدال الحمض الأميني الجلوتاميك السادس في الوحدة الفرعية للهيموجلوبين بفالين إلى حقيقة أن جزيء الهيموجلوبين ككل لا يمكنه أداء وظيفته الرئيسية - نقل الأكسجين؛ وفي مثل هذه الحالات يصاب الشخص بمرض يسمى فقر الدم المنجلي.
الهيكل الثانوي- أمر بطي سلسلة البولي ببتيد في شكل حلزوني (يشبه الزنبرك الممتد). يتم تقوية المنعطفات الحلزونية بواسطة الروابط الهيدروجينية التي تنشأ بين مجموعات الكربوكسيل والمجموعات الأمينية. تشارك جميع مجموعات CO وNH تقريبًا في تكوين الروابط الهيدروجينية. وهي أضعف من تلك الببتيدية، ولكنها، تكرر عدة مرات، تضفي الاستقرار والصلابة على هذا التكوين. على مستوى البنية الثانوية توجد البروتينات: الفيبروين (الحرير، شبكة العنكبوت)، الكيراتين (الشعر، الأظافر)، الكولاجين (الأوتار).



هيكل التعليم العالي- تعبئة سلاسل البولي ببتيد في الكريات الناتجة عن تكوين روابط كيميائية (الهيدروجين والأيونية وثاني كبريتيد) وإنشاء تفاعلات كارهة للماء بين جذور بقايا الأحماض الأمينية. يتم لعب الدور الرئيسي في تكوين الهيكل الثالث من خلال التفاعلات المحبة للماء والكارهة للماء. في المحاليل المائية، تميل الجذور الكارهة للماء إلى الاختباء من الماء، وتتجمع داخل الكرية، في حين تميل الجذور المحبة للماء، نتيجة للترطيب (التفاعل مع ثنائيات أقطاب الماء)، إلى الظهور على سطح الجزيء. في بعض البروتينات، يتم تثبيت البنية الثلاثية عن طريق روابط تساهمية ثاني كبريتيد تتشكل بين ذرات الكبريت لاثنين من بقايا السيستين. على مستوى البنية الثالثية توجد الإنزيمات والأجسام المضادة وبعض الهرمونات.

هيكل رباعيخاصية البروتينات المعقدة التي تتكون جزيئاتها من كرتين أو أكثر. يتم الاحتفاظ بالوحدات الفرعية في الجزيء عن طريق التفاعلات الأيونية والكارهة للماء والكهروستاتيكية. في بعض الأحيان، أثناء تكوين البنية الرباعية، تحدث روابط ثاني كبريتيد بين الوحدات الفرعية. البروتين الأكثر دراسة ذو البنية الرباعية هو الهيموجلوبين. يتكون من وحدتين فرعيتين α (141 وحدة من بقايا الأحماض الأمينية) ووحدتين فرعيتين (146 وحدة من بقايا الأحماض الأمينية). ويرتبط بكل وحدة فرعية جزيء الهيم الذي يحتوي على الحديد.
إذا انحرف التشكل المكاني للبروتينات عن المستوى الطبيعي لسبب ما، فلن يتمكن البروتين من أداء وظائفه. على سبيل المثال، سبب "مرض جنون البقر" (اعتلال الدماغ الإسفنجي) هو التشكل غير الطبيعي للبريونات، البروتينات السطحية للخلايا العصبية.
خصائص البروتينات
يحدده تكوين الأحماض الأمينية وبنية جزيء البروتين ملكيات. تجمع البروتينات بين الخصائص الأساسية والحمضية، والتي تحددها جذور الأحماض الأمينية: كلما زادت حمضية الأحماض الأمينية في البروتين، كانت خصائصه الحمضية أكثر وضوحًا. يتم تحديد إمكانية التبرع وإضافة H+ خصائص التخزين المؤقت للبروتينات; أحد أقوى الحواجز المؤقتة هو الهيموجلوبين في خلايا الدم الحمراء، والذي يحافظ على درجة حموضة الدم عند مستوى ثابت. هناك بروتينات قابلة للذوبان (الفيبرينوجين)، وهناك بروتينات غير قابلة للذوبان تؤدي وظائف ميكانيكية (الفبروين، الكيراتين، الكولاجين). هناك بروتينات نشطة كيميائيا (الإنزيمات)، وهناك بروتينات غير نشطة كيميائيا مقاومة لمختلف الظروف البيئية وتلك غير مستقرة للغاية.
العوامل الخارجية (الحرارة، الأشعة فوق البنفسجية، المعادن الثقيلة وأملاحها، تغيرات الرقم الهيدروجيني، الإشعاع، الجفاف)
يمكن أن يسبب تعطيل التنظيم الهيكلي لجزيء البروتين. تسمى عملية فقدان التشكل ثلاثي الأبعاد المتأصل في جزيء بروتين معين تمسخ. سبب تمسخ الطبيعة هو كسر الروابط التي تعمل على تثبيت بنية بروتينية معينة. في البداية، تنكسر الروابط الأضعف، وكلما أصبحت الظروف أكثر صرامة، تنكسر الروابط الأقوى. لذلك، يتم فقدان الهياكل الرباعية أولاً، ثم الهياكل الثلاثية والثانوية. يؤدي التغيير في التكوين المكاني إلى تغيير في خصائص البروتين، ونتيجة لذلك، يجعل من المستحيل على البروتين أداء وظائفه البيولوجية المتأصلة. إذا لم يكن التمسخ مصحوبًا بتدمير البنية الأساسية، فقد يكون كذلك تفريغ، في هذه الحالة يحدث التعافي الذاتي لخاصية التشكل للبروتين. على سبيل المثال، تخضع بروتينات مستقبلات الغشاء لمثل هذا التشوه. تسمى عملية استعادة بنية البروتين بعد تمسخه إعادة الطبيعة. إذا كانت استعادة التكوين المكاني للبروتين مستحيلة، فسيتم استدعاء تمسخ الطبيعة لا رجعة فيه.
وظائف البروتينات
| وظيفة | أمثلة وتفسيرات |
|---|---|
| بناء | تشارك البروتينات في تكوين الهياكل الخلوية وخارج الخلية: فهي جزء من أغشية الخلايا (البروتينات الدهنية والبروتينات السكرية) والشعر (الكيراتين) والأوتار (الكولاجين) وما إلى ذلك. |
| ينقل | يقوم بروتين الهيموجلوبين في الدم بربط الأكسجين ونقله من الرئتين إلى جميع الأنسجة والأعضاء، ومنها ينقل ثاني أكسيد الكربون إلى الرئتين؛ يتضمن تكوين أغشية الخلايا بروتينات خاصة تضمن النقل النشط والانتقائي الصارم لبعض المواد والأيونات من الخلية إلى البيئة الخارجية والعودة. |
| تنظيمية | تشارك هرمونات البروتين في تنظيم عمليات التمثيل الغذائي. على سبيل المثال، ينظم هرمون الأنسولين مستويات الجلوكوز في الدم، ويعزز تخليق الجليكوجين، ويزيد من تكوين الدهون من الكربوهيدرات. |
| محمي | ردا على تغلغل البروتينات الأجنبية أو الكائنات الحية الدقيقة (المستضدات) في الجسم، يتم تشكيل بروتينات خاصة - الأجسام المضادة التي يمكنها ربطها وتحييدها. يساعد الفيبرين، المتكون من الفيبرينوجين، على وقف النزيف. |
| محرك | توفر البروتينات المقلصة الأكتين والميوسين تقلص العضلات في الحيوانات متعددة الخلايا. |
| الإشارة | توجد في الغشاء السطحي للخلية جزيئات بروتينية قادرة على تغيير بنيتها الثلاثية استجابة للعوامل البيئية، وبالتالي استقبال الإشارات من البيئة الخارجية ونقل الأوامر إلى الخلية. |
| تخزين | في جسم الحيوانات، لا يتم تخزين البروتينات، كقاعدة عامة، باستثناء زلال البيض وكازين الحليب. ولكن بفضل البروتينات، يمكن تخزين بعض المواد في الجسم، على سبيل المثال، أثناء انهيار الهيموجلوبين، لا يتم إزالة الحديد من الجسم، ولكن يتم تخزينه، وتشكيل مركب مع بروتين الفيريتين. |
| طاقة | عندما يتحلل 1 جرام من البروتين إلى المنتجات النهائية، يتم تحرير 17.6 كيلوجول. أولاً، تنقسم البروتينات إلى أحماض أمينية، ثم إلى المنتجات النهائية - الماء وثاني أكسيد الكربون والأمونيا. ومع ذلك، يتم استخدام البروتينات كمصدر للطاقة فقط عند استخدام المصادر الأخرى (الكربوهيدرات والدهون). |
| المحفز | من أهم وظائف البروتينات. يتم توفيرها بواسطة البروتينات - الإنزيمات التي تعمل على تسريع التفاعلات الكيميائية الحيوية التي تحدث في الخلايا. على سبيل المثال، يحفز إنزيم كربوكسيلاز ثنائي فوسفات الريبولوز تثبيت ثاني أكسيد الكربون أثناء عملية التمثيل الضوئي. |
الانزيمات
الانزيمات، أو الانزيمات، هي فئة خاصة من البروتينات التي تعتبر محفزات بيولوجية. بفضل الإنزيمات، تحدث التفاعلات الكيميائية الحيوية بسرعة هائلة. سرعة التفاعلات الأنزيمية أعلى بعشرات الآلاف من المرات (وأحيانًا بالملايين) من سرعة التفاعلات التي تحدث بمشاركة المحفزات غير العضوية. تسمى المادة التي يعمل عليها الإنزيم المادة المتفاعلة.
الإنزيمات هي بروتينات كروية، السمات الهيكليةيمكن تقسيم الإنزيمات إلى مجموعتين: بسيطة ومعقدة. إنزيمات بسيطةهي بروتينات بسيطة، أي. تتكون فقط من الأحماض الأمينية. الانزيمات المعقدةهي بروتينات معقدة، أي. بالإضافة إلى الجزء البروتيني فهي تحتوي على مجموعة ذات طبيعة غير بروتينية - العامل المساعد. تستخدم بعض الإنزيمات الفيتامينات كعوامل مساعدة. يحتوي جزيء الإنزيم على جزء خاص يسمى المركز النشط. مركز نشط- قسم صغير من الإنزيم (من ثلاثة إلى اثني عشر بقايا من الأحماض الأمينية)، حيث يحدث ارتباط الركيزة أو الركائز لتشكيل مركب إنزيم-ركيزة. عند الانتهاء من التفاعل، يتحلل مركب الإنزيم والركيزة إلى الإنزيم ومنتج (منتجات) التفاعل. تحتوي بعض الإنزيمات (ما عدا النشطة) مراكز تفارغي- المناطق التي ترتبط بها منظمات سرعة الإنزيم ( الانزيمات allosteric).

تتميز تفاعلات الحفز الأنزيمي بما يلي: 1) الكفاءة العالية، 2) الانتقائية الصارمة واتجاه العمل، 3) خصوصية الركيزة، 4) التنظيم الدقيق والدقيق. تم شرح خصوصية الركيزة والتفاعل لتفاعلات الحفز الأنزيمي من خلال فرضيات E. Fischer (1890) وD. Koshland (1959).
هـ. فيشر (فرضية قفل المفتاح)اقترح أن التكوينات المكانية للمركز النشط للإنزيم والركيزة يجب أن تتوافق تمامًا مع بعضها البعض. تتم مقارنة الركيزة بـ "المفتاح"، والإنزيم بـ "القفل".
د. كوشلاند (فرضية قفاز اليد)اقترح أن المراسلات المكانية بين بنية الركيزة والمركز النشط للإنزيم يتم إنشاؤها فقط في لحظة تفاعلهما مع بعضهما البعض. وتسمى هذه الفرضية أيضا فرضية المراسلات المستحثة.
يعتمد معدل التفاعلات الأنزيمية على: 1) درجة الحرارة، 2) تركيز الإنزيم، 3) تركيز الركيزة، 4) الرقم الهيدروجيني. وينبغي التأكيد على أنه بما أن الإنزيمات عبارة عن بروتينات، فإن نشاطها يكون أعلى في ظل الظروف الطبيعية من الناحية الفسيولوجية.
يمكن لمعظم الإنزيمات أن تعمل فقط عند درجات حرارة تتراوح بين 0 و40 درجة مئوية. ضمن هذه الحدود، يزيد معدل التفاعل تقريبًا مرتين مع كل زيادة قدرها 10 درجات مئوية في درجة الحرارة. عند درجات حرارة أعلى من 40 درجة مئوية، يخضع البروتين لعملية تمسخ ويتناقص نشاط الإنزيم. في درجات حرارة قريبة من التجمد، يتم تعطيل الإنزيمات.
مع زيادة كمية الركيزة، يزداد معدل التفاعل الأنزيمي حتى يساوي عدد جزيئات الركيزة عدد جزيئات الإنزيم. مع زيادة أخرى في كمية الركيزة، لن تزيد السرعة، لأن المراكز النشطة للإنزيم مشبعة. تؤدي الزيادة في تركيز الإنزيم إلى زيادة النشاط التحفيزي، نظرًا لأن عددًا أكبر من جزيئات الركيزة يخضع لتحولات لكل وحدة زمنية.

لكل إنزيم قيمة الرقم الهيدروجيني الأمثل التي يظهر فيها أقصى نشاط (الببسين - 2.0، الأميليز اللعابي - 6.8، الليباز البنكرياس - 9.0). عند قيم pH أعلى أو أقل، ينخفض نشاط الإنزيم. مع التغيرات المفاجئة في الرقم الهيدروجيني، يتم تغيير طبيعة الإنزيم.
يتم تنظيم سرعة الإنزيمات التفارغية عن طريق المواد التي ترتبط بمراكز التفارغ. إذا أدت هذه المواد إلى تسريع التفاعل، فإنها تسمى المنشطات، إذا تباطأوا - مثبطات.
تصنيف الانزيمات
وفقًا لنوع التحولات الكيميائية التي تحفزها، تنقسم الإنزيمات إلى 6 فئات:
- إنزيمات الأكسدة(نقل ذرات الهيدروجين أو الأكسجين أو الإلكترون من مادة إلى أخرى - نازعة الهيدروجين)،
- نقل(نقل الميثيل أو الأسيل أو الفوسفات أو المجموعة الأمينية من مادة إلى أخرى - الترانساميناسات)،
- هيدرولاز(تفاعلات التحلل المائي التي يتم فيها تكوين منتجين من الركيزة - الأميليز والليباز)،
- lyases(إضافة غير متحللة إلى الركيزة أو انفصال مجموعة من الذرات عنها، وفي هذه الحالة يمكن كسر روابط CC وCN وCO وC-S - ديكاربوكسيلاز)،
- ايزوميراز(إعادة الترتيب داخل الجزيئات - الأيزوميراز)،
- إنزيمات دمج الجزيئات(اتصال جزيئين نتيجة لتكوين روابط CC و C-N و CO و C-S - سينثيتيز).
وتنقسم الفئات بدورها إلى فئات فرعية وفئات فرعية. وفي التصنيف الدولي الحالي، يكون لكل إنزيم رمز محدد، يتكون من أربعة أرقام مفصولة بنقاط. الرقم الأول هو الفئة، والثاني هو الفئة الفرعية، والثالث هو الفئة الفرعية، والرابع هو الرقم التسلسلي للإنزيم في هذه الفئة الفرعية، على سبيل المثال، رمز أرجيناز هو 3.5.3.1.
اذهب إلى المحاضرات رقم 2"بنية ووظائف الكربوهيدرات والدهون"
اذهب إلى المحاضرات رقم 4"هيكل ووظائف الأحماض النووية ATP"
في النصف الأول من القرن التاسع عشر. توصل العديد من الكيميائيين، ومن بينهم في المقام الأول ج. فون ليبج، تدريجيًا إلى استنتاج مفاده أن البروتينات تمثل فئة خاصة من المركبات النيتروجينية. اسم "البروتينات" (من اليونانية.
بروتوس أولاً) تم اقتراحه في عام 1840 من قبل الكيميائي الهولندي جي مولدر. الخصائص الفيزيائية تكون البروتينات بيضاء في الحالة الصلبة، ولكنها عديمة اللون في المحلول، إلا إذا كانت تحمل نوعًا ما من مجموعة الكروموفور (الملونة)، مثل الهيموجلوبين. تختلف قابلية الذوبان في الماء بشكل كبير بين البروتينات المختلفة. يتغير أيضًا اعتمادًا على الرقم الهيدروجيني وتركيز الأملاح في المحلول، لذلك من الممكن اختيار الظروف التي يترسب فيها بروتين واحد بشكل انتقائي في وجود بروتينات أخرى. تُستخدم طريقة "التمليح" هذه على نطاق واسع لعزل البروتينات وتنقيتها. غالبًا ما يترسب البروتين المنقى من المحلول على شكل بلورات.بالمقارنة مع المركبات الأخرى، فإن الوزن الجزيئي للبروتينات كبير جدًا، ويتراوح من عدة آلاف إلى عدة ملايين من الدالتونات. لذلك، أثناء الطرد المركزي الفائق، يتم ترسيب البروتينات، وبمعدلات مختلفة. ونظراً لوجود مجموعات موجبة وسالبة الشحنة في جزيئات البروتين، فإنها تتحرك بسرعات مختلفة وفي مجال كهربائي. هذا هو أساس الرحلان الكهربائي، وهي طريقة تستخدم لعزل البروتينات الفردية من الخلائط المعقدة. تتم تنقية البروتينات أيضًا بواسطة اللوني.
الخواص الكيميائية بناء. البروتينات هي بوليمرات، أي. يتم بناء الجزيئات على شكل سلاسل من وحدات المونومر المتكررة، أو الوحدات الفرعية، التي تلعب الدور الذي تؤديه أ -أحماض أمينية. الصيغة العامة للأحماض الأمينيةحيث ر ذرة هيدروجين أو مجموعة عضوية ما.يمكن أن يتكون جزيء البروتين (سلسلة عديد الببتيد) من عدد صغير نسبيًا من الأحماض الأمينية أو عدة آلاف من وحدات المونومر. من الممكن دمج الأحماض الأمينية في سلسلة لأن كل منها يحتوي على مجموعتين كيميائيتين مختلفتين: مجموعة أمينية ذات خصائص أساسية،
نه 2 ومجموعة الكربوكسيل الحمضية COOH. كل من هذه المجموعات تابعة ل أ - ذرة الكربون . يمكن لمجموعة الكربوكسيل لحمض أميني واحد أن تشكل رابطة أميد (ببتيد) مع المجموعة الأمينية لحمض أميني آخر: وبعد ربط حمضين أمينيين بهذه الطريقة، يمكن تمديد السلسلة بإضافة حمض ثالث إلى الحمض الأميني الثاني، وهكذا. كما يتبين من المعادلة أعلاه، عندما تتشكل الرابطة الببتيدية، يتم تحرير جزيء الماء. في وجود الأحماض أو القلويات أو الإنزيمات المحللة للبروتين، يستمر التفاعل في الاتجاه المعاكس: يتم تقسيم سلسلة البولي ببتيد إلى أحماض أمينية مع إضافة الماء. ويسمى هذا التفاعل التحلل المائي. يحدث التحلل المائي تلقائيًا، ويلزم توفير الطاقة لربط الأحماض الأمينية بسلسلة متعددة الببتيد.
وبعد ربط حمضين أمينيين بهذه الطريقة، يمكن تمديد السلسلة بإضافة حمض ثالث إلى الحمض الأميني الثاني، وهكذا. كما يتبين من المعادلة أعلاه، عندما تتشكل الرابطة الببتيدية، يتم تحرير جزيء الماء. في وجود الأحماض أو القلويات أو الإنزيمات المحللة للبروتين، يستمر التفاعل في الاتجاه المعاكس: يتم تقسيم سلسلة البولي ببتيد إلى أحماض أمينية مع إضافة الماء. ويسمى هذا التفاعل التحلل المائي. يحدث التحلل المائي تلقائيًا، ويلزم توفير الطاقة لربط الأحماض الأمينية بسلسلة متعددة الببتيد. توجد مجموعة الكربوكسيل ومجموعة الأميد (أو مجموعة إيميد مماثلة في حالة الحمض الأميني برولين) في جميع الأحماض الأمينية، ولكن الاختلافات بين الأحماض الأمينية تتحدد حسب طبيعة المجموعة، أو "السلسلة الجانبية". وهو ما هو موضح أعلاه بالحرف
ر . يمكن أن تلعب ذرة هيدروجين واحدة دور السلسلة الجانبية، كما هو الحال في الحمض الأميني الجلايسين، أو بواسطة مجموعة كبيرة الحجم، كما هو الحال في الهيستدين والتربتوفان. بعض السلاسل الجانبية خاملة كيميائيًا، بينما بعضها الآخر متفاعل بشكل ملحوظ.يمكن تصنيع عدة آلاف من الأحماض الأمينية المختلفة، ويوجد العديد من الأحماض الأمينية المختلفة في الطبيعة، ولكن يتم استخدام 20 نوعًا فقط من الأحماض الأمينية لتخليق البروتين: ألانين، أرجينين، أسباراجين، حمض الأسبارتيك، فالين، هيستيدين، جلايسين، جلوتامين، جلوتاميك. حمض، آيزوليوسين، ليوسين، ليسين، ميثيونين، برولين، سيرين، تيروزين، ثريونين، تريبتوفان، فينيل ألانين وسيستين (في البروتينات، قد يكون السيستين موجودًا على شكل ديمر
السيستين). صحيح أن بعض البروتينات تحتوي على أحماض أمينية أخرى بالإضافة إلى الأحماض الأمينية العشرين الموجودة بانتظام، ولكنها تتشكل نتيجة تعديل أحد الأحماض الأمينية العشرين المدرجة بعد إدراجه في البروتين.النشاط البصري. جميع الأحماض الأمينية، باستثناء الجلايسين، لديها أ تحتوي ذرة الكربون على أربع مجموعات مختلفة مرتبطة بها. من وجهة نظر الهندسة، يمكن ربط أربع مجموعات مختلفة بطريقتين، وبناءً على ذلك هناك تكوينان محتملان، أو متصاوغان، يرتبطان ببعضهما البعض كما يرتبط الجسم بصورته في المرآة، أي. مثل اليد اليسرى على اليمين. يُطلق على أحد التكوينات اسم اليد اليسرى أو اليد اليسرى (ل )، والحق الآخر، أو dextrorotatory (د )، لأن اثنين من هذه الأيزومرات يختلفان في اتجاه دوران مستوى الضوء المستقطب. وجدت فقط في البروتيناتل - الأحماض الأمينية (الاستثناء هو الجليسين؛ يمكن تمثيله في شكل واحد فقط، حيث أن مجموعتين من مجموعاته الأربع متماثلتان)، وجميعها نشطة بصريًا (نظرًا لوجود أيزومر واحد فقط).د -الأحماض الأمينية نادرة في الطبيعة؛ وهي موجودة في بعض المضادات الحيوية وفي جدار خلايا البكتيريا.تسلسل الأحماض الأمينية. لا يتم ترتيب الأحماض الأمينية في سلسلة البولي ببتيد بشكل عشوائي، بل بترتيب ثابت معين، وهذا الترتيب هو الذي يحدد وظائف البروتين وخصائصه. ومن خلال تغيير ترتيب الأنواع العشرين من الأحماض الأمينية، يمكنك إنشاء عدد كبير من البروتينات المختلفة، تمامًا كما يمكنك إنشاء العديد من النصوص المختلفة من الحروف الأبجدية.في الماضي، كان تحديد تسلسل الأحماض الأمينية للبروتين يستغرق في كثير من الأحيان عدة سنوات. لا يزال التحديد المباشر مهمة كثيفة العمالة، على الرغم من إنشاء أجهزة تسمح بتنفيذها تلقائيًا. عادة ما يكون من الأسهل تحديد تسلسل النيوكليوتيدات للجين المقابل واستنتاج تسلسل الأحماض الأمينية للبروتين منه. حتى الآن، تم بالفعل تحديد تسلسل الأحماض الأمينية لمئات البروتينات. عادة ما تكون وظائف البروتينات التي تم فك شفرتها معروفة، وهذا يساعد على تخيل الوظائف المحتملة للبروتينات المماثلة التي تتشكل، على سبيل المثال، في الأورام الخبيثة.
البروتينات المعقدة. تسمى البروتينات التي تتكون من الأحماض الأمينية فقط بالبسيطة. ومع ذلك، في كثير من الأحيان، ترتبط ذرة معدنية أو مركب كيميائي ليس حمضًا أمينيًا بسلسلة البولي ببتيد. تسمى هذه البروتينات معقدة. ومثال على ذلك الهيموجلوبين: فهو يحتوي على بورفيرين الحديد الذي يحدد لونه الأحمر ويسمح له بالعمل كحامل للأكسجين.تشير أسماء معظم البروتينات المعقدة إلى طبيعة المجموعات المرتبطة بها: البروتينات السكرية تحتوي على سكريات، والبروتينات الدهنية تحتوي على دهون. إذا كان النشاط التحفيزي للإنزيم يعتمد على المجموعة المرتبطة، فإنه يسمى مجموعة صناعية. غالبًا ما يلعب الفيتامين دور مجموعة صناعية أو يكون جزءًا من مجموعة. ففيتامين أ، على سبيل المثال، المرتبط بأحد البروتينات الموجودة في شبكية العين، يحدد حساسيتها للضوء.
هيكل التعليم العالي. ما يهم ليس تسلسل الأحماض الأمينية للبروتين نفسه (البنية الأولية)، ولكن الطريقة التي يتم بها وضعها في الفضاء. على طول طول سلسلة البولي ببتيد، تشكل أيونات الهيدروجين روابط هيدروجينية منتظمة، مما يمنحها شكل الحلزون أو الطبقة (البنية الثانوية). من مزيج هذه الحلزونات والطبقات، يظهر شكل مدمج من الترتيب التالي: البنية الثلاثية للبروتين. حول الروابط التي تحمل وحدات المونومر في السلسلة، من الممكن إجراء دورات بزوايا صغيرة. لذلك، من وجهة نظر هندسية بحتة، فإن عدد التكوينات الممكنة لأي سلسلة بولي ببتيد كبير بلا حدود. في الواقع، يوجد كل بروتين عادة في تكوين واحد فقط، يحدده تسلسل الأحماض الأمينية الخاصة به. هذا الهيكل ليس جامدا، كما لو كان « يتقلب "التنفس" حول تكوين متوسط معين. يتم طي الدائرة في تكوين تكون فيه الطاقة الحرة (القدرة على إنتاج شغل) في حدها الأدنى، تمامًا كما يضغط الزنبرك المتحرر فقط إلى حالة تتوافق مع الحد الأدنى من الطاقة الحرة. في كثير من الأحيان يتم ربط جزء من السلسلة بشكل صارم بآخر بواسطة ثاني كبريتيد (سس) الروابط بين اثنين من بقايا السيستين. وهذا هو السبب الذي يجعل السيستين يلعب دورًا مهمًا بشكل خاص بين الأحماض الأمينية.إن تعقيد بنية البروتينات كبير جدًا لدرجة أنه ليس من الممكن حتى الآن حساب البنية الثلاثية للبروتين، حتى لو كان تسلسل الأحماض الأمينية الخاص به معروفًا. ولكن إذا كان من الممكن الحصول على بلورات البروتين، فيمكن تحديد هيكلها الثالث عن طريق حيود الأشعة السينية.
في البروتينات الهيكلية والمقلصة وبعض البروتينات الأخرى، تكون السلاسل ممدودة والعديد من السلاسل المطوية قليلاً التي تقع بالقرب منها تشكل أليافًا ليفية؛ وتنطوي الألياف بدورها إلى تشكيلات أكبر من الألياف. ومع ذلك، فإن معظم البروتينات الموجودة في المحلول لها شكل كروي: حيث تلتف السلاسل في شكل كروي، مثل الخيوط في الكرة. تكون الطاقة الحرة بهذا التكوين ضئيلة، نظرًا لأن الأحماض الأمينية الكارهة للماء ("طاردة للماء") مخفية داخل الكرية، والأحماض الأمينية المحبة للماء ("جاذبة للماء") موجودة على سطحها.
العديد من البروتينات عبارة عن مجمعات من عدة سلاسل بولي ببتيد. ويسمى هذا الهيكل الهيكل الرباعي للبروتين. على سبيل المثال، يتكون جزيء الهيموجلوبين من أربع وحدات فرعية، كل منها عبارة عن بروتين كروي.
تشكل البروتينات الهيكلية، بسبب تكوينها الخطي، أليافًا ذات قوة شد عالية جدًا، بينما يسمح التكوين الكروي للبروتينات بالدخول في تفاعلات محددة مع مركبات أخرى. على سطح الكرة الأرضية، عندما يتم وضع السلاسل بشكل صحيح، تظهر تجاويف ذات شكل معين توجد فيها مجموعات كيميائية تفاعلية. إذا كان بروتين معين عبارة عن إنزيم، فإن جزيءًا آخر، عادةً ما يكون أصغر، من مادة ما يدخل مثل هذا التجويف، تمامًا كما يدخل المفتاح في القفل؛ في هذه الحالة، يتغير تكوين السحابة الإلكترونية للجزيء تحت تأثير المجموعات الكيميائية الموجودة في التجويف، وهذا يجبره على التفاعل بطريقة معينة. بهذه الطريقة، يحفز الإنزيم التفاعل. تحتوي جزيئات الجسم المضاد أيضًا على تجاويف ترتبط فيها مواد غريبة مختلفة وبالتالي تصبح غير ضارة. نموذج "القفل والمفتاح"، الذي يشرح تفاعل البروتينات مع المركبات الأخرى، يسمح لنا بفهم خصوصية الإنزيمات والأجسام المضادة، أي. قدرتها على التفاعل فقط مع مركبات معينة.
البروتينات في أنواع مختلفة من الكائنات الحية. البروتينات التي تؤدي نفس الوظيفة في أنواع مختلفة من النباتات والحيوانات، وبالتالي تحمل نفس الاسم، لها أيضًا تكوين مماثل. ومع ذلك، فهي تختلف إلى حد ما في تسلسل الأحماض الأمينية الخاصة بها. مع اختلاف الأنواع عن سلف مشترك، يتم استبدال بعض الأحماض الأمينية في مواقع معينة بطفرات بأخرى. يتم القضاء على الطفرات الضارة التي تسبب الأمراض الوراثية عن طريق الانتقاء الطبيعي، ولكن قد تستمر الطفرات المفيدة أو المحايدة على الأقل. كلما اقترب النوعان البيولوجيان من بعضهما البعض، قلت الاختلافات في بروتيناتهما.تتغير بعض البروتينات بسرعة نسبية، والبعض الآخر محفوظ للغاية. وهذا الأخير يشمل، على سبيل المثال، السيتوكروم معإنزيم تنفسي موجود في معظم الكائنات الحية. في البشر والشمبانزي، تسلسل الأحماض الأمينية متطابقة، وفي السيتوكروم معأما في القمح، فإن 38% فقط من الأحماض الأمينية كانت مختلفة. وحتى مقارنة البشر والبكتيريا، فإن تشابه السيتوكرومات مع(الاختلافات تؤثر على 65% من الأحماض الأمينية هنا) ولا يزال من الممكن رؤيتها، على الرغم من أن السلف المشترك للبكتيريا والبشر عاش على الأرض منذ حوالي ملياري سنة. في الوقت الحاضر، غالبًا ما تُستخدم مقارنة تسلسل الأحماض الأمينية لبناء شجرة النشوء والتطور (العائلة)، مما يعكس العلاقات التطورية بين الكائنات الحية المختلفة.
تمسخ. يكتسب جزيء البروتين المركب القابل للطي تكوينه المميز. ومع ذلك، يمكن تدمير هذا التكوين عن طريق التسخين، وتغيير الرقم الهيدروجيني، والتعرض للمذيبات العضوية، وحتى عن طريق هز المحلول ببساطة حتى تظهر الفقاعات على سطحه. يسمى البروتين المعدل بهذه الطريقة بالتحريف. فإنه يفقد نشاطه البيولوجي وعادة ما يصبح غير قابل للذوبان. من الأمثلة المعروفة على البروتين المشوه هو البيض المسلوق أو الكريمة المخفوقة. البروتينات الصغيرة التي تحتوي على حوالي مائة من الأحماض الأمينية فقط قادرة على إعادة تكوين طبيعتها، أي. استعادة التكوين الأصلي. لكن معظم البروتينات تتحول ببساطة إلى كتلة من سلاسل البولي ببتيد المتشابكة ولا تستعيد تكوينها السابق.إحدى الصعوبات الرئيسية في عزل البروتينات النشطة هي حساسيتها الشديدة للتمسخ. تجد خاصية البروتينات هذه تطبيقًا مفيدًا في حفظ الأغذية: حيث تؤدي درجة الحرارة المرتفعة إلى تغيير طبيعة إنزيمات الكائنات الحية الدقيقة بشكل لا رجعة فيه، وتموت الكائنات الحية الدقيقة.
تخليق البروتين لتخليق البروتين، يجب أن يكون لدى الكائن الحي نظام من الإنزيمات القادرة على ضم حمض أميني إلى آخر. هناك حاجة أيضًا إلى مصدر للمعلومات لتحديد الأحماض الأمينية التي يجب دمجها. نظرًا لوجود الآلاف من أنواع البروتينات في الجسم، ويتكون كل منها في المتوسط من عدة مئات من الأحماض الأمينية، فإن المعلومات المطلوبة يجب أن تكون هائلة حقًا. يتم تخزينه (على غرار كيفية تخزين التسجيل على شريط مغناطيسي) في جزيئات الحمض النووي التي تشكل الجينات. سم . وراثي أيضًا احماض نووية.تنشيط الانزيم. إن سلسلة البولي ببتيد التي يتم تصنيعها من الأحماض الأمينية لا تكون دائمًا بروتينًا في شكلها النهائي. يتم تصنيع العديد من الإنزيمات أولاً كسلائف غير نشطة وتصبح نشطة فقط بعد أن يزيل إنزيم آخر العديد من الأحماض الأمينية في أحد طرفي السلسلة. يتم تصنيع بعض الإنزيمات الهاضمة، مثل التربسين، في هذا الشكل غير النشط. يتم تنشيط هذه الإنزيمات في الجهاز الهضمي نتيجة إزالة الجزء الطرفي من السلسلة. يتم تصنيع هرمون الأنسولين، الذي يتكون جزيئه في شكله النشط من سلسلتين قصيرتين، في شكل سلسلة واحدة، ما يسمى. طليعة الأنسولين. يتم بعد ذلك إزالة الجزء الأوسط من هذه السلسلة، وترتبط الأجزاء المتبقية معًا لتشكل جزيء الهرمون النشط. تتشكل البروتينات المعقدة فقط بعد ارتباط مجموعة كيميائية معينة بالبروتين، وغالبًا ما يتطلب هذا الارتباط أيضًا إنزيمًا.الدورة الأيضية. بعد تغذية الحيوان بالأحماض الأمينية الموسومة بالنظائر المشعة للكربون أو النيتروجين أو الهيدروجين، يتم دمج الملصق بسرعة في بروتيناته. إذا توقفت الأحماض الأمينية المسماة عن دخول الجسم، فإن كمية التسمية في البروتينات تبدأ في الانخفاض. وتظهر هذه التجارب أن البروتينات الناتجة لا يتم الاحتفاظ بها في الجسم حتى نهاية الحياة. جميعها، مع استثناءات قليلة، في حالة ديناميكية، تتحلل باستمرار إلى أحماض أمينية ثم يتم تصنيعها مرة أخرى.تتحلل بعض البروتينات عندما تموت الخلايا ويتم تدميرها. يحدث هذا طوال الوقت، على سبيل المثال، مع خلايا الدم الحمراء والخلايا الظهارية التي تبطن السطح الداخلي للأمعاء. بالإضافة إلى ذلك، يحدث أيضًا تحلل البروتينات وإعادة تركيبها في الخلايا الحية. ومن الغريب أن ما نعرفه عن تحلل البروتينات أقل بكثير من ما نعرفه عن تركيبها. ومع ذلك، فمن الواضح أن التحلل يتضمن إنزيمات محللة للبروتين مشابهة لتلك التي تحلل البروتينات إلى أحماض أمينية في الجهاز الهضمي.
يختلف عمر النصف للبروتينات المختلفة من عدة ساعات إلى عدة أشهر. الاستثناء الوحيد هو جزيء الكولاجين. وبمجرد تكوينها، تظل مستقرة ولا يتم تجديدها أو استبدالها. ولكن مع مرور الوقت، تتغير بعض خصائصها، وخاصة المرونة، وبما أنها لا تتجدد، فإن ذلك يؤدي إلى حدوث بعض التغييرات المرتبطة بالعمر، مثل ظهور التجاعيد على الجلد.
البروتينات الاصطناعية. لقد تعلم الكيميائيون منذ زمن طويل بلمرة الأحماض الأمينية، ولكن يتم دمج الأحماض الأمينية بطريقة غير منظمة، بحيث لا تشبه منتجات هذه البلمرة المنتجات الطبيعية إلا قليلاً. صحيح أنه من الممكن دمج الأحماض الأمينية بترتيب معين، مما يجعل من الممكن الحصول على بعض البروتينات النشطة بيولوجيا، وخاصة الأنسولين. العملية معقدة للغاية، وبهذه الطريقة من الممكن الحصول فقط على تلك البروتينات التي تحتوي جزيئاتها على حوالي مائة من الأحماض الأمينية. ويفضل بدلاً من ذلك تصنيع أو عزل تسلسل النيوكليوتيدات لجين يتوافق مع تسلسل الأحماض الأمينية المطلوبة، ثم إدخال هذا الجين في بكتيريا، والتي ستنتج كميات كبيرة من المنتج المطلوب عن طريق التكرار. لكن هذه الطريقة لها عيوبها أيضًا. سم . وكذلك الهندسة الوراثية. البروتين والتغذية عندما يتم تقسيم البروتينات الموجودة في الجسم إلى أحماض أمينية، يمكن استخدام هذه الأحماض الأمينية مرة أخرى لتركيب البروتينات. وفي الوقت نفسه، تكون الأحماض الأمينية نفسها عرضة للانهيار، لذلك لا يتم إعادة استخدامها بالكامل. ومن الواضح أيضًا أنه أثناء النمو والحمل والتئام الجروح، يجب أن يتجاوز تخليق البروتين عملية التحلل. يفقد الجسم بعض البروتينات بشكل مستمر؛ هذه هي بروتينات الشعر والأظافر والطبقة السطحية من الجلد. لذلك، من أجل تصنيع البروتينات، يجب على كل كائن حي أن يتلقى الأحماض الأمينية من الغذاء. يتم تصنيع النباتات الخضراء من ثاني أكسيد الكربون 2 والماء والأمونيا أو النترات كلها من الأحماض الأمينية العشرين الموجودة في البروتينات. العديد من البكتيريا قادرة أيضًا على تصنيع الأحماض الأمينية في وجود السكر (أو ما يعادله) والنيتروجين الثابت، ولكن يتم توفير السكر في النهاية عن طريق النباتات الخضراء. لدى الحيوانات قدرة محدودة على تصنيع الأحماض الأمينية؛ يحصلون على الأحماض الأمينية عن طريق تناول النباتات الخضراء أو الحيوانات الأخرى. في الجهاز الهضمي، يتم تقسيم البروتينات الممتصة إلى أحماض أمينية، ويتم امتصاص هذه الأخيرة، ومنها يتم بناء البروتينات المميزة لكائن معين. لا يتم دمج أي من البروتين الممتص في هياكل الجسم على هذا النحو. الاستثناء الوحيد هو أنه في العديد من الثدييات، يمكن لبعض الأجسام المضادة الأمومية المرور سليمة عبر المشيمة إلى مجرى دم الجنين، ومن خلال حليب الأم (خاصة في المجترات) يمكن نقلها إلى الوليد مباشرة بعد الولادة.متطلبات البروتين. من الواضح أنه للحفاظ على الحياة، يجب أن يحصل الجسم على كمية معينة من البروتين من الطعام. ومع ذلك، فإن مدى هذه الحاجة يعتمد على عدد من العوامل. يحتاج الجسم إلى الغذاء كمصدر للطاقة (السعرات الحرارية) وكمادة لبناء هياكله. الحاجة إلى الطاقة تأتي في المقام الأول. وهذا يعني أنه عندما يكون هناك عدد قليل من الكربوهيدرات والدهون في النظام الغذائي، يتم استخدام البروتينات الغذائية ليس لتخليق البروتينات الخاصة بها، ولكن كمصدر للسعرات الحرارية. أثناء الصيام لفترات طويلة، يتم استخدام البروتينات الخاصة بك لتلبية احتياجات الطاقة. إذا كان هناك ما يكفي من الكربوهيدرات في النظام الغذائي، فيمكن تقليل استهلاك البروتين.توازن النيتروجين. في المتوسط تقريبا. 16% من الكتلة الكلية للبروتين عبارة عن نيتروجين. عندما يتم تكسير الأحماض الأمينية الموجودة في البروتينات، يتم إخراج النيتروجين الذي تحتويه من الجسم في البول و(بدرجة أقل) في البراز على شكل مركبات نيتروجينية مختلفة. ولذلك فمن المناسب استخدام مؤشر مثل توازن النيتروجين لتقييم جودة تغذية البروتين، أي. الفرق (بالجرام) بين كمية النيتروجين التي تدخل الجسم وكمية النيتروجين التي تفرز يوميًا. مع التغذية الطبيعية لدى شخص بالغ، تكون هذه المبالغ متساوية. في الكائن الحي المتنامي، تكون كمية النيتروجين المفرزة أقل من الكمية المتلقاة، أي. الرصيد إيجابي. إذا كان هناك نقص في البروتين في النظام الغذائي، فإن الرصيد سلبي. إذا كان هناك ما يكفي من السعرات الحرارية في النظام الغذائي، ولكن لا يوجد بروتينات فيه، فإن الجسم يحفظ البروتينات. وفي الوقت نفسه، يتباطأ استقلاب البروتين، ويحدث الاستخدام المتكرر للأحماض الأمينية في تخليق البروتين بأعلى كفاءة ممكنة. ومع ذلك، فإن الخسائر لا مفر منها، ولا تزال المركبات النيتروجينية تفرز في البول وجزئيًا في البراز. يمكن أن تكون كمية النيتروجين التي تفرز من الجسم يوميًا أثناء صيام البروتين بمثابة مقياس لنقص البروتين اليومي. ومن الطبيعي الافتراض أنه من خلال إدخال كمية من البروتين تعادل هذا النقص في النظام الغذائي، يمكن استعادة توازن النيتروجين. ومع ذلك، فهو ليس كذلك. بعد تلقي هذه الكمية من البروتين، يبدأ الجسم في استخدام الأحماض الأمينية بكفاءة أقل، لذلك يلزم بعض البروتين الإضافي لاستعادة توازن النيتروجين.إذا تجاوزت كمية البروتين في النظام الغذائي ما هو ضروري للحفاظ على توازن النيتروجين، فلا يبدو أن هناك أي ضرر. يتم استخدام الأحماض الأمينية الزائدة ببساطة كمصدر للطاقة. وكمثال صارخ بشكل خاص، يستهلك الأسكيمو القليل من الكربوهيدرات وحوالي عشرة أضعاف كمية البروتين اللازمة للحفاظ على توازن النيتروجين. ومع ذلك، في معظم الحالات، فإن استخدام البروتين كمصدر للطاقة ليس مفيدًا لأن كمية معينة من الكربوهيدرات يمكن أن تنتج سعرات حرارية أكثر بكثير من نفس الكمية من البروتين. في البلدان الفقيرة، يحصل الناس على السعرات الحرارية من الكربوهيدرات ويستهلكون كميات قليلة من البروتين.
إذا حصل الجسم على العدد المطلوب من السعرات الحرارية على شكل منتجات غير بروتينية، فإن الحد الأدنى لكمية البروتين لضمان الحفاظ على توازن النيتروجين هو تقريبًا. 30 جرام يوميا. يوجد هذا القدر من البروتين في أربع شرائح من الخبز أو 0.5 لتر من الحليب. عادةً ما يعتبر الرقم الأكبر قليلاً هو الأمثل؛ يوصى بـ 50 إلى 70 جرامًا.
الأحماض الأمينية الأساسية. حتى الآن، كان يعتبر البروتين ككل. وفي الوقت نفسه، لكي يحدث تخليق البروتين، يجب أن تكون جميع الأحماض الأمينية الضرورية موجودة في الجسم. جسم الحيوان نفسه قادر على تصنيع بعض الأحماض الأمينية. يطلق عليها اسم قابلة للاستبدال لأنه ليس من الضروري أن تكون موجودة في النظام الغذائي، فمن المهم فقط أن يكون الإمداد الإجمالي بالبروتين كمصدر للنيتروجين كافيًا؛ ومن ثم، إذا كان هناك نقص في الأحماض الأمينية غير الأساسية، فيمكن للجسم تصنيعها على حساب تلك الموجودة بكثرة. لا يمكن تصنيع الأحماض الأمينية "الأساسية" المتبقية ويجب توفيرها للجسم عن طريق الطعام. العناصر الأساسية للبشر هي حمض الفالين، والليوسين، والآيزوليوسين، والثريونين، والميثيونين، والفينيل ألانين، والتربتوفان، والهستيدين، والليسين، والأرجينين. (على الرغم من إمكانية تصنيع الأرجينين في الجسم، إلا أنه يصنف على أنه حمض أميني أساسي لأنه لا يتم إنتاجه بكميات كافية عند الأطفال حديثي الولادة والأطفال في طور النمو. ومن ناحية أخرى، قد تصبح بعض هذه الأحماض الأمينية من الطعام غير ضرورية لشخص بالغ شخص.)هذه القائمة من الأحماض الأمينية الأساسية هي نفسها تقريبًا في الفقاريات الأخرى وحتى الحشرات. عادة ما يتم تحديد القيمة الغذائية للبروتينات عن طريق إطعامها للفئران النامية ومراقبة زيادة وزن الحيوانات.
القيمة الغذائية للبروتينات. يتم تحديد القيمة الغذائية للبروتين من خلال الأحماض الأمينية الأساسية الأكثر نقصًا. دعونا نوضح هذا بمثال. تحتوي البروتينات الموجودة في أجسامنا في المتوسط على حوالي. 2% تريبتوفان (بالوزن). لنفترض أن النظام الغذائي يتضمن 10 جرام من البروتين يحتوي على 1% تريبتوفان، وأنه يحتوي على ما يكفي من الأحماض الأمينية الأساسية الأخرى. في حالتنا، 10 جرام من هذا البروتين غير المكتمل يعادل بشكل أساسي 5 جرام من البروتين الكامل؛ أما الـ 5 جرام المتبقية فيمكن استخدامها فقط كمصدر للطاقة. لاحظ أنه بما أن الأحماض الأمينية لا يتم تخزينها عمليا في الجسم، ولكي يحدث تخليق البروتين، يجب أن تكون جميع الأحماض الأمينية موجودة في نفس الوقت، ولا يمكن اكتشاف تأثير تناول الأحماض الأمينية الأساسية إلا إذا كانت جميعها دخول الجسم في نفس الوقت. متوسط تركيب معظم البروتينات الحيوانية قريب من متوسط تركيب البروتينات في جسم الإنسان، لذلك من غير المرجح أن نواجه نقص الأحماض الأمينية إذا كان نظامنا الغذائي غنيًا بأطعمة مثل اللحوم والبيض والحليب والجبن. ومع ذلك، هناك بروتينات، مثل الجيلاتين (منتج تمسخ الكولاجين)، التي تحتوي على عدد قليل جدًا من الأحماض الأمينية الأساسية. البروتينات النباتية، على الرغم من أنها أفضل من الجيلاتين بهذا المعنى، إلا أنها فقيرة أيضًا بالأحماض الأمينية الأساسية؛ فهي منخفضة بشكل خاص في اللايسين والتربتوفان. ومع ذلك، لا يمكن اعتبار النظام الغذائي النباتي البحت ضارًا على الإطلاق، إلا إذا كان يستهلك كمية أكبر قليلاً من البروتينات النباتية، كافية لتزويد الجسم بالأحماض الأمينية الأساسية. تحتوي النباتات على أكبر قدر من البروتين في بذورها، وخاصة في بذور القمح والبقوليات المختلفة. البراعم الصغيرة، مثل الهليون، غنية أيضًا بالبروتين.البروتينات الاصطناعية في النظام الغذائي. عن طريق إضافة كميات صغيرة من الأحماض الأمينية الأساسية الاصطناعية أو البروتينات الغنية بالأحماض الأمينية إلى البروتينات غير الكاملة، مثل بروتينات الذرة، يمكن زيادة القيمة الغذائية للأخيرة بشكل كبير، أي. وبالتالي زيادة كمية البروتين المستهلكة. والاحتمال الآخر هو نمو البكتيريا أو الخميرة على الهيدروكربونات النفطية مع إضافة النترات أو الأمونيا كمصدر للنيتروجين. يمكن أن يكون البروتين الميكروبي الذي يتم الحصول عليه بهذه الطريقة بمثابة علف للدواجن أو الماشية، أو يمكن أن يستهلكه الإنسان مباشرة. الطريقة الثالثة المستخدمة على نطاق واسع تستخدم فسيولوجيا الحيوانات المجترة. في المجترات، في الجزء الأولي من المعدة، ما يسمى. يسكن الكرش أشكال خاصة من البكتيريا والأوليات التي تحول البروتينات النباتية غير الكاملة إلى بروتينات ميكروبية أكثر اكتمالا، وهذه بدورها بعد الهضم والامتصاص تتحول إلى بروتينات حيوانية. ويمكن إضافة اليوريا، وهو مركب اصطناعي رخيص الثمن يحتوي على النيتروجين، إلى علف الماشية. تستخدم الكائنات الحية الدقيقة التي تعيش في الكرش نيتروجين اليوريا لتحويل الكربوهيدرات (التي يوجد منها الكثير في العلف) إلى بروتين. يمكن أن يأتي حوالي ثلث إجمالي النيتروجين الموجود في علف الماشية على شكل يوريا، وهو ما يعني بشكل أساسي، إلى حد ما، التخليق الكيميائي للبروتين. وفي الولايات المتحدة الأمريكية، تلعب هذه الطريقة دورًا مهمًا كإحدى طرق الحصول على البروتين.الأدب موراي آر، غرينر دي، مايز بي، رودويل دبليو. الكيمياء الحيوية البشرية، المجلد. 12. م، 1993ألبرتس ب، براي د، لويس ج، وآخرون. بيولوجيا الخلية الجزيئية، المجلد. 13. م، 1994
تذكرة 2. 1. العوامل الغذائية الأساسية ذات الطبيعة الدهنية.لا يتم تصنيع بعض الدهون في جسم الإنسان، وبالتالي فهي عوامل غذائية أساسية. وتشمل هذه الأحماض الدهنية التي تحتوي على رابطتين مزدوجتين أو أكثر (البوليين) - الأحماض الدهنية الأساسية.بعض هذه الأحماض عبارة عن ركائز لتخليق الهرمونات المحلية - الإيكوسانويدات (الموضوع 8.10).
الفيتامينات القابلة للذوبان في الدهونأداء وظائف مختلفة: فيتامين أيشارك في عملية الرؤية، وكذلك نمو الخلايا وتمايزها؛ وقد ثبت قدرته على تثبيط نمو أنواع معينة من الأورام؛ فيتامين كيشارك في تخثر الدم. فيتامين ديشارك في تنظيم استقلاب الكالسيوم. فيتامين ه- مضاد للأكسدة، يمنع تكوين الجذور الحرة وبالتالي يقاوم تلف الخلايا نتيجة بيروكسيد الدهون.
وثيقة
2. هيكل ومستويات التنظيم الهيكلي للبروتينات
هناك أربعة مستويات من التنظيم الهيكلي للبروتينات: الابتدائي والثانوي والثالث والرباعي. كل مستوى له خصائصه الخاصة.
هيكل البروتين الأساسي
البنية الأساسية للبروتينات هي سلسلة بولي ببتيد خطية من الأحماض الأمينية المرتبطة بروابط الببتيد. البنية الأولية هي أبسط مستوى من التنظيم الهيكلي لجزيء البروتين. يتم الحصول على ثبات عالٍ من خلال الروابط الببتيدية التساهمية بين مجموعة α-amino لحمض أميني واحد ومجموعة α-carboxyl لحمض أميني آخر. [يعرض].
إذا كانت مجموعة الإيمينو من البرولين أو الهيدروكسي برولين تشارك في تكوين الرابطة الببتيدية، فإن لها شكلًا مختلفًا [يعرض].
عندما تتشكل الروابط الببتيدية في الخلايا، يتم أولاً تنشيط مجموعة الكربوكسيل لأحد الأحماض الأمينية، ثم تتحد مع المجموعة الأمينية لحمض أميني آخر. يتم إجراء التوليف المختبري للبولي ببتيدات بنفس الطريقة تقريبًا.
الرابطة الببتيدية هي جزء متكرر من سلسلة البولي ببتيد. لديها عدد من الميزات التي لا تؤثر فقط على شكل البنية الأساسية، ولكن أيضًا على المستويات الأعلى لتنظيم سلسلة البولي ببتيد:

المستوى المشترك - جميع الذرات الموجودة في مجموعة الببتيد موجودة في نفس المستوى؛
القدرة على التواجد في شكلين رنينيين (شكل الكيتو أو الإينول)؛
موضع التحويل للبدائل بالنسبة إلى رابطة CN؛
القدرة على تكوين روابط هيدروجينية، ويمكن لكل مجموعة من المجموعات الببتيدية تكوين روابط هيدروجينية مع مجموعات أخرى، بما في ذلك المجموعات الببتيدية.
الاستثناء هو مجموعات الببتيد التي تتضمن المجموعة الأمينية من البرولين أو الهيدروكسي برولين. إنهم قادرون فقط على تكوين رابطة هيدروجينية واحدة (انظر أعلاه). وهذا يؤثر على تكوين البنية الثانوية للبروتين. تنحني سلسلة البولي ببتيد الموجودة في المنطقة التي يوجد بها البرولين أو الهيدروكسي برولين بسهولة، حيث لا يتم تثبيتها، كالعادة، بواسطة رابطة هيدروجينية ثانية.
تسميات الببتيدات والبولي ببتيدات. يتكون اسم الببتيدات من أسماء الأحماض الأمينية المكونة لها. اثنان من الأحماض الأمينية يشكلان ثنائي الببتيد، وثلاثة منها يشكلون ثلاثي الببتيد، وأربعة يشكلون رباعي الببتيد، وما إلى ذلك. تحتوي كل سلسلة من الببتيد أو متعدد الببتيد بأي طول على حمض أميني ذو طرف N يحتوي على مجموعة أمينية حرة وحمض أميني ذو طرف C يحتوي على كربوكسيل حر. مجموعة. عند تسمية عديدات الببتيدات، يتم إدراج جميع الأحماض الأمينية بالتسلسل، بدءًا من الطرف N، مع استبدال أسمائها، باستثناء الطرف C، باللاحقة -in بـ -yl (نظرًا لأن الأحماض الأمينية في الببتيدات لم تعد تحتوي على مجموعة الكربوكسيل، ولكن مجموعة الكربونيل). على سبيل المثال الاسم الموضح في الصورة. 1 ثلاثي الببتيد - ليوك الطميفينيلألان الطميثريون في.
ملامح الهيكل الأساسي للبروتين. في العمود الفقري لسلسلة البولي ببتيد، تتناوب الهياكل الصلبة (مجموعات الببتيد المسطحة) مع المناطق المتحركة نسبيًا (-CHR)، والتي تكون قادرة على الدوران حول الروابط. تؤثر هذه السمات الهيكلية لسلسلة البولي ببتيد على ترتيبها المكاني.
البنية الثانوية للبروتين
البنية الثانوية هي طريقة لطي سلسلة عديد الببتيد في بنية مرتبة بسبب تكوين روابط هيدروجينية بين مجموعات الببتيد من نفس السلسلة أو سلاسل عديد الببتيد المجاورة. وفقًا لتكوينها، تنقسم الهياكل الثانوية إلى حلزونية (حلزونية ألفا) ومطوية بطبقات (بنية بيتا وشكل متقاطع).


α-اللولب. هذا هو نوع من بنية البروتين الثانوية التي تشبه الحلزون العادي، والتي تتشكل بسبب روابط الهيدروجين بين الببتيد داخل سلسلة بولي ببتيد واحدة. تم اقتراح نموذج بنية حلزون ألفا (الشكل 2)، الذي يأخذ في الاعتبار جميع خصائص الرابطة الببتيدية، بواسطة بولينج وكوري. الملامح الرئيسية للحلزون α:
التكوين الحلزوني لسلسلة البولي ببتيد ذات التماثل الحلزوني؛
تكوين روابط هيدروجينية بين مجموعات الببتيد لكل بقايا حمض أميني الأول والرابع؛
انتظام المنعطفات الحلزونية
تكافؤ جميع بقايا الأحماض الأمينية في الحلزون ألفا، بغض النظر عن بنية جذورها الجانبية؛
لا تشارك الجذور الجانبية للأحماض الأمينية في تكوين الحلزون ألفا.
خارجيًا، يبدو حلزون ألفا وكأنه لولب ممتد قليلاً لموقد كهربائي. يحدد انتظام الروابط الهيدروجينية بين مجموعتي الببتيد الأولى والرابعة انتظام دورات سلسلة البولي ببتيد. يبلغ ارتفاع الدورة الواحدة، أو خطوة الحلزون ألفا، 0.54 نانومتر؛ يتضمن 3.6 بقايا حمض أميني، أي أن كل بقايا حمض أميني تتحرك على طول المحور (ارتفاع بقايا حمض أميني واحد) بمقدار 0.15 نانومتر (0.54:3.6 = 0.15 نانومتر)، مما يسمح لنا بالحديث عن تكافؤ جميع بقايا الأحماض الأمينية في الحلزون ألفا. فترة انتظام الحلزون ألفا هي 5 دورات أو 18 بقايا حمض أميني؛ طول الفترة الواحدة 2.7 نانومتر. أرز. 3. نموذج بولينج كوري الحلزوني
β-الهيكل. هذا هو نوع من البنية الثانوية التي لها تكوين منحني قليلاً لسلسلة البولي ببتيد وتتكون من روابط هيدروجينية بين الببتيد داخل أقسام فردية من سلسلة بولي ببتيد واحدة أو سلاسل بولي ببتيد مجاورة. ويسمى أيضًا هيكل الطبقات. هناك أنواع مختلفة من الهياكل β. تسمى المناطق ذات الطبقات المحدودة التي تتكون من سلسلة بولي ببتيد واحدة من البروتين بالشكل المتقاطع (بنية β قصيرة). تتشكل روابط الهيدروجين في الشكل المتقاطع بين مجموعات الببتيد في حلقات سلسلة البولي ببتيد. نوع آخر - البنية الكاملة - هو سمة من سمات سلسلة البولي ببتيد بأكملها، والتي لها شكل ممدود ومثبتة بواسطة روابط هيدروجينية بين الببتيد بين سلاسل البولي ببتيد المتوازية المجاورة (الشكل 3). يشبه هذا الهيكل منفاخ الأكورديون. علاوة على ذلك، فإن المتغيرات من هياكل β ممكنة: يمكن تشكيلها بواسطة سلاسل متوازية (يتم توجيه نهايات الطرف N لسلاسل البولي ببتيد في نفس الاتجاه) ومضادة للتوازي (يتم توجيه نهايات الطرف N في اتجاهات مختلفة). يتم وضع الجذور الجانبية لطبقة واحدة بين الجذور الجانبية لطبقة أخرى.
في البروتينات، تكون التحولات من هياكل ألفا إلى هياكل بيتا والعودة ممكنة بسبب إعادة ترتيب روابط الهيدروجين. بدلاً من روابط الهيدروجين المنتظمة بين الببتيد على طول السلسلة (بفضلها يتم لف سلسلة البولي ببتيد في شكل حلزوني) ، وتتفكك المقاطع الحلزونية وتغلق روابط الهيدروجين بين الأجزاء المطولة من سلاسل البولي ببتيد. تم العثور على هذا التحول في الكيراتين، بروتين الشعر. عند غسل الشعر بالمنظفات القلوية، يتم تدمير البنية الحلزونية للكيراتين بيتا بسهولة ويتحول إلى ألفا كيراتين (تمليس الشعر المجعد).
يُطلق على تدمير الهياكل الثانوية المنتظمة للبروتينات (حلزونات ألفا وهياكل بيتا)، قياسًا على ذوبان البلورة، اسم "ذوبان" البوليبيبتيدات. وفي هذه الحالة تنكسر الروابط الهيدروجينية، وتأخذ سلاسل البوليببتيد شكل تشابك عشوائي. ونتيجة لذلك، يتم تحديد استقرار الهياكل الثانوية من خلال روابط هيدروجينية بين الببتيد. لا تشارك الأنواع الأخرى من الروابط تقريبًا في هذا، باستثناء روابط ثاني كبريتيد على طول سلسلة البولي ببتيد في مواقع بقايا السيستين. يتم إغلاق الببتيدات القصيرة في دورات بسبب روابط ثاني كبريتيد. تحتوي العديد من البروتينات على مناطق ألفا حلزونية وهياكل بيتا. لا يوجد تقريبًا أي بروتينات طبيعية تتكون من 100% حلزون ألفا (الاستثناء هو الباراموسين، وهو بروتين عضلي يتكون من 96-100% حلزون ألفا)، في حين أن الببتيدات الاصطناعية تحتوي على حلزون 100%.
البروتينات الأخرى لها درجات متفاوتة من اللف. لوحظ ارتفاع وتيرة الهياكل الحلزونية ألفا في الباراميوزين والميوجلوبين والهيموجلوبين. في المقابل، في التربسين، الريبونوكلياز، يتم طي جزء كبير من سلسلة البولي ببتيد في هياكل بيتا ذات الطبقات. بروتينات الأنسجة الداعمة: الكيراتين (بروتين الشعر، الصوف)، الكولاجين (بروتين الأوتار، الجلد)، الفيبروين (بروتين الحرير الطبيعي) لها تكوين بيتا من سلاسل البولي ببتيد. تشير درجات الهليكوبتر المختلفة لسلاسل البروتينات متعددة الببتيد إلى أنه من الواضح أن هناك قوى تعطل جزئيًا الهليكوبتر أو "تكسر" الطي المنتظم لسلسلة البولي ببتيد. والسبب في ذلك هو طي سلسلة بولي ببتيد البروتين بشكل أكثر إحكاما في حجم معين، أي في البنية الثلاثية.
هيكل البروتين الثلاثي
البنية الثلاثية للبروتين هي الطريقة التي يتم بها ترتيب سلسلة البولي ببتيد في الفضاء. بناءً على شكل بنيتها الثلاثية، تنقسم البروتينات بشكل أساسي إلى كروية وليفية. غالبًا ما يكون للبروتينات الكروية شكل إهليلجي، والبروتينات الليفية (تشبه الخيط) لها شكل ممدود (شكل قضيب أو مغزل).
ومع ذلك، فإن تكوين البنية الثلاثية للبروتينات لا يعطي حتى الآن سببًا للاعتقاد بأن البروتينات الليفية لها بنية β فقط، وأن البروتينات الكروية لها بنية حلزونية α. هناك بروتينات ليفية لها بنية ثانوية حلزونية، وليست ذات طبقات، ومطوية. على سبيل المثال، α-keratin وparamyosin (بروتين العضلة المسدودة للرخويات)، والتروبوميوزين (بروتينات العضلات الهيكلية) تنتمي إلى البروتينات الليفية (لها شكل قضيب)، وبنيتها الثانوية هي α-helix؛ في المقابل، قد تحتوي البروتينات الكروية على عدد كبير من الهياكل بيتا.
يؤدي تصاعد سلسلة البولي ببتيد الخطية إلى تقليل حجمها بحوالي 4 مرات؛ والتعبئة في الهيكل الثالث تجعلها أكثر إحكاما بعشرات المرات من السلسلة الأصلية.
الروابط التي تثبت البنية الثلاثية للبروتين. تلعب الروابط بين الجذور الجانبية للأحماض الأمينية دورًا في تثبيت البنية الثلاثية. ويمكن تقسيم هذه الاتصالات إلى:
قوي (تساهمي) [يعرض].
ضعيف (قطبي وفان دير فالس) [يعرض].
تحدد الروابط العديدة بين الجذور الجانبية للأحماض الأمينية التكوين المكاني لجزيء البروتين.
ملامح تنظيم هيكل البروتين العالي. يتم تحديد شكل البنية الثلاثية لسلسلة البولي ببتيد من خلال خصائص الجذور الجانبية للأحماض الأمينية الموجودة فيها (والتي ليس لها تأثير ملحوظ على تكوين الهياكل الأولية والثانوية) والبيئة الدقيقة، أي بيئة. عند طيها، تميل سلسلة البولي ببتيد للبروتين إلى اتخاذ شكل نشط نشط، يتميز بحد أدنى من الطاقة الحرة. لذلك، فإن مجموعات R غير القطبية، "تتجنب" الماء، تشكل الجزء الداخلي من البنية الثلاثية للبروتين، حيث يقع الجزء الرئيسي من المخلفات الكارهة للماء لسلسلة البولي ببتيد. لا توجد جزيئات ماء تقريبًا في وسط كرية البروتين. توجد مجموعات R القطبية (المحبة للماء) للحمض الأميني خارج هذا اللب الكاره للماء وتحيط بها جزيئات الماء. تنحني سلسلة البولي ببتيد بشكل معقد في الفضاء ثلاثي الأبعاد. عندما ينحني، يتم تعطيل التشكل الحلزوني الثانوي. "تنكسر" السلسلة عند نقاط الضعف حيث يوجد البرولين أو الهيدروكسي برولين، لأن هذه الأحماض الأمينية أكثر قدرة على الحركة في السلسلة، وتشكل رابطة هيدروجينية واحدة فقط مع مجموعات الببتيد الأخرى. موقع الانحناء الآخر هو الجليسين، الذي يحتوي على مجموعة R صغيرة (الهيدروجين). لذلك، فإن مجموعات R من الأحماض الأمينية الأخرى، عند تكديسها، تميل إلى احتلال المساحة الحرة في موقع الجليسين. يساهم عدد من الأحماض الأمينية - ألانين، والليوسين، والغلوتامات، والهيستيدين - في الحفاظ على الهياكل الحلزونية المستقرة في البروتين، مثل الميثيونين، والفالين، والإيسولوسين، وحمض الأسبارتيك التي تساعد في تكوين الهياكل بيتا. في جزيء البروتين ذو التكوين الثالث، توجد مناطق على شكل حلزونات ألفا (حلزونية)، وهياكل بيتا (طبقات) وملف عشوائي. فقط الترتيب المكاني الصحيح للبروتين هو ما يجعله نشطًا؛ انتهاكه يؤدي إلى تغييرات في خصائص البروتين وفقدان النشاط البيولوجي.
هيكل البروتين الرباعي
البروتينات التي تتكون من سلسلة بولي ببتيد واحدة لها بنية ثلاثية فقط. وتشمل هذه الميوغلوبين - وهو بروتين الأنسجة العضلية المشاركة في ربط الأكسجين، وعدد من الإنزيمات (الليزوزيم، البيبسين، التربسين، وما إلى ذلك). ومع ذلك، يتم بناء بعض البروتينات من عدة سلاسل ببتيدية، كل منها له بنية ثلاثية. بالنسبة لمثل هذه البروتينات، تم تقديم مفهوم البنية الرباعية، وهو تنظيم عدة سلاسل ببتيد ذات بنية ثلاثية في جزيء بروتين وظيفي واحد. يُطلق على مثل هذا البروتين ذو البنية الرباعية اسم oligomer، وتسمى سلاسل البولي ببتيد ذات البنية الثلاثية البروتومرات أو الوحدات الفرعية (الشكل 4).

على المستوى التنظيمي الرباعي، تحتفظ البروتينات بالتكوين الأساسي للبنية الثلاثية (الكروي أو الليفي). على سبيل المثال، الهيموجلوبين هو بروتين ذو بنية رباعية ويتكون من أربع وحدات فرعية. كل وحدة فرعية عبارة عن بروتين كروي، وبشكل عام، يحتوي الهيموجلوبين أيضًا على تكوين كروي. بروتينات الشعر والصوف - الكيراتينات، المرتبطة في البنية الثلاثية بالبروتينات الليفية، لها شكل ليفي وبنية رباعية.
استقرار هيكل البروتين الرباعي. يتم عزل جميع البروتينات التي لها بنية رباعية على شكل جزيئات كبيرة فردية لا تنقسم إلى وحدات فرعية. الاتصالات بين أسطح الوحدات الفرعية ممكنة فقط بسبب المجموعات القطبية لبقايا الأحماض الأمينية، لأنه أثناء تكوين البنية الثلاثية لكل سلسلة من سلاسل البولي ببتيد، تتشكل الجذور الجانبية للأحماض الأمينية غير القطبية (التي تشكل غالبية جميع الأحماض الأمينية البروتينية) مخفية داخل الوحدة الفرعية. يتم تشكيل العديد من الروابط الأيونية (الملح)، والهيدروجين، وفي بعض الحالات ثاني كبريتيد بين مجموعاتها القطبية، والتي تحمل الوحدات الفرعية بقوة في شكل مجمع منظم. يؤدي استخدام المواد التي تكسر الروابط الهيدروجينية أو المواد التي تقلل جسور ثاني كبريتيد إلى تفكيك البروتومرات وتدمير البنية الرباعية للبروتين. في الجدول 1 يلخص البيانات المتعلقة بالروابط التي تعمل على تثبيت مستويات مختلفة من تنظيم جزيء البروتين [يعرض].
ملامح التنظيم الهيكلي لبعض البروتينات الليفية
يحتوي التنظيم الهيكلي للبروتينات الليفية على عدد من الميزات مقارنة بالبروتينات الكروية. ويمكن رؤية هذه الميزات في مثال الكيراتين والفيبروين والكولاجين. الكيراتين موجود في التشكلات α و β. يحتوي α-Keratins و fibroin على بنية ثانوية مطوية بطبقات، ومع ذلك، في الكيراتين تكون السلاسل متوازية، وفي fibroin تكون غير متوازية (انظر الشكل 3)؛ بالإضافة إلى ذلك، يحتوي الكيراتين على روابط ثاني كبريتيد بين السلاسل، بينما لا يحتوي عليها الفيبروين. يؤدي كسر روابط ثاني كبريتيد إلى انفصال سلاسل البوليببتيد في الكيراتين. على العكس من ذلك، فإن تكوين الحد الأقصى لعدد روابط ثاني كبريتيد في الكيراتين من خلال التعرض للعوامل المؤكسدة يخلق بنية مكانية قوية. بشكل عام، في البروتينات الليفية، على عكس البروتينات الكروية، يصعب أحيانًا التمييز بدقة بين مستويات التنظيم المختلفة. إذا قبلنا (كما هو الحال بالنسبة للبروتين الكروي) أن البنية الثلاثية يجب أن تتشكل عن طريق وضع سلسلة بولي ببتيد واحدة في الفضاء، والبنية الرباعية من خلال عدة سلاسل، فإن العديد من سلاسل البولي ببتيد في البروتينات الليفية تشارك بالفعل أثناء تكوين البنية الثانوية . من الأمثلة النموذجية للبروتين الليفي هو الكولاجين، وهو أحد البروتينات الأكثر وفرة في جسم الإنسان (حوالي ثلث كتلة جميع البروتينات). يوجد في الأنسجة ذات القوة العالية والقابلية للتمدد المنخفضة (العظام والأوتار والجلد والأسنان وغيرها). في الكولاجين، ثلث بقايا الأحماض الأمينية عبارة عن جليكاين، وحوالي ربعها أو أكثر قليلاً عبارة عن برولين أو هيدروكسي برولين.

تبدو سلسلة البولي ببتيد المعزولة من الكولاجين (البنية الأساسية) وكأنها خط مكسور. يحتوي على حوالي 1000 من الأحماض الأمينية ويبلغ وزنه الجزيئي حوالي 105 (الشكل 5، أ، ب). يتم بناء سلسلة البولي ببتيد من ثلاثي متكرر من الأحماض الأمينية (ثلاثية) من التركيبة التالية: gly-AB، حيث A و B عبارة عن أي أحماض أمينية غير الجلايسين (في أغلب الأحيان البرولين والهيدروكسي برولين). لا يمكن لسلاسل بولي ببتيد الكولاجين (أو سلاسل ألفا) أثناء تكوين الهياكل الثانوية والثالثية (الشكل 5 و ج و د) أن تنتج حلزونات ألفا نموذجية ذات تناظر حلزوني. يتداخل البرولين والهيدروكسي برولين والجليسين (الأحماض الأمينية المضادة للحلزون) مع هذا. لذلك، تشكل ثلاث سلاسل α، كما كانت، حلزونات ملتوية، مثل ثلاثة خيوط تلتف حول أسطوانة. تشكل ثلاث سلاسل ألفا حلزونية بنية كولاجين متكررة تسمى تروبوكولاجين (الشكل 5 د). Tropocollagen في تنظيمه هو البنية الثلاثية للكولاجين. الحلقات المسطحة من البرولين والهيدروكسي برولين التي تتناوب بانتظام على طول السلسلة تمنحها الصلابة، كما تفعل الروابط البينية بين سلاسل ألفا من التروبوكولاجين (وهذا هو سبب مقاومة الكولاجين للتمدد). Tropocollagen هو في الأساس وحدة فرعية من ألياف الكولاجين. يحدث وضع وحدات فرعية من التروبوكولاجين في البنية الرباعية للكولاجين بطريقة تدريجية (الشكل 5 هـ).
يحدث استقرار هياكل الكولاجين بسبب روابط الهيدروجين والأيونية وفان دير فال وعدد صغير من الروابط التساهمية.
سلاسل ألفا من الكولاجين لها هياكل كيميائية مختلفة. هناك أنواع مختلفة من سلاسل α 1 (I، II، III، IV) وسلاسل α 2. اعتمادًا على سلاسل α 1 - و α 2 - المشاركة في تكوين الحلزون ثلاثي الخيوط للتروبوكولاجين، يتم تمييز أربعة أنواع من الكولاجين:
النوع الأول - سلسلتان α 1 (I) وسلسلة α 2 واحدة؛
النوع الثاني - ثلاث سلاسل α 1 (II)؛
النوع الثالث - ثلاث سلاسل α 1 (III)؛
النوع الرابع - ثلاث سلاسل α 1 (IV).
الكولاجين الأكثر شيوعاً هو النوع الأول: ويوجد في أنسجة العظام، والجلد، والأوتار؛ يوجد الكولاجين من النوع 2 في أنسجة الغضاريف، وما إلى ذلك. ويمكن أن يحتوي نوع واحد من الأنسجة على أنواع مختلفة من الكولاجين.
يضمن التجميع المنظم لهياكل الكولاجين وصلابتها وخمولها قوة عالية لألياف الكولاجين. تحتوي بروتينات الكولاجين أيضًا على مكونات كربوهيدراتية، أي أنها عبارة عن مجمعات بروتينية كربوهيدراتية.
الكولاجين هو بروتين خارج الخلية يتكون من خلايا النسيج الضام الموجودة في جميع الأعضاء. لذلك، مع تلف الكولاجين (أو تعطيل تكوينه)، تحدث انتهاكات متعددة للوظائف الداعمة للنسيج الضام للأعضاء.
تنتهي سلسلة ألفا ببتيد بتركيبة الأحماض الأمينية فالين-ليوسين، وتنتهي سلسلة بيتا ببتيد بتركيبة فالين-هيستيدين-ليوسين. لا يتم ترتيب سلاسل ببتيد ألفا وبيتا في جزيء الهيموجلوبين خطيًا، وهذا هو الهيكل الأساسي. نظرًا لوجود قوى داخل الجزيئات، فإن سلاسل البولي ببتيد ملتوية على شكل حلزون ألفا (بنية ثانوية) نموذجية للبروتينات. ينحني حلزون ألفا نفسه مكانيًا لكل سلسلة ببتيد ألفا وبيتا، مكونًا ضفائر ذات شكل بيضاوي (بنية ثلاثية). يتم تمييز الأجزاء الفردية من حلزونات ألفا الحلزونية لسلاسل البولي ببتيد بأحرف لاتينية من A إلى H. وتقع جميع سلاسل ألفا وبيتا متعددة الببتيد الأربعة المنحنية بشكل مكاني في علاقة معينة - هيكل رباعي. وهي لا ترتبط بروابط كيميائية حقيقية، بل بقوى بين الجزيئات.
اتضح أن البشر لديهم ثلاثة أنواع رئيسية من الهيموجلوبين الطبيعي: الجنيني - U، الجنين - F والهيموجلوبين البالغ - A. HbU (سمي على اسم الحرف الأول من كلمة الرحم) يحدث في الجنين بين 7 و 12 أسبوعًا من الحياة، ثم يختفي ويظهر الهيموجلوبين الجنيني والذي بعد الشهر الثالث هو الهيموجلوبين الرئيسي للجنين. بعد ذلك، يظهر تدريجياً الهيموجلوبين البالغ العادي، المسمى HbA، بعد الحرف الأول من الكلمة الإنجليزية "adult". تتناقص كمية الهيموجلوبين الجنيني تدريجياً، بحيث أنه عند لحظة الولادة يكون 80% من الهيموجلوبين HbA و20% فقط HbF. بعد الولادة، يستمر الهيموجلوبين الجنيني في الانخفاض، وبعمر 2-3 سنوات يصل إلى 1-2% فقط. نفس الكمية من الهيموجلوبين الجنيني موجودة عند الشخص البالغ. تعتبر كمية HbF التي تتجاوز 2٪ مرضية بالنسبة للبالغين والأطفال الذين تزيد أعمارهم عن 3 سنوات.
بالإضافة إلى الأنواع الطبيعية من الهيموجلوبين، هناك أكثر من 50 نوعًا مرضيًا معروفًا حاليًا. تم تسميتهم لأول مرة بأحرف لاتينية. الحرف B غائب في تسمية أنواع الهيموجلوبين، لأنه كان يشير في الأصل إلى HbS.
الهيموجلوبين (خضاب الدم)- بروتين كروموبروتين موجود في خلايا الدم الحمراء ويشارك في نقل الأكسجين إلى الأنسجة. يسمى الهيموجلوبين عند البالغين بالهيموجلوبين A (Hb A). ويبلغ وزنه الجزيئي حوالي 65000 دا. يحتوي جزيء Hb A على بنية رباعية ويتضمن أربع وحدات فرعية - سلاسل متعددة الببتيد (المعينة α1 و α2 و β1 و β2، كل منها مرتبط بالهيم.
تذكر أن الهيموجلوبين هو بروتين تفارغي، ويمكن لجزيئاته أن تتغير بشكل عكسي من شكل إلى آخر. هذا يغير تقارب البروتين للروابط. يسمى التشكل ذو أقل تقارب لليجند بالصيغة المتوترة أو التشكل T. يُطلق على التشكل الذي يتمتع بأكبر قدر من التقارب لليجند اسم التشكل المريح أو R.
تكون التشكلات R و T لجزيء الهيموجلوبين في حالة توازن ديناميكي:
ويمكن للعوامل البيئية المختلفة أن تغير هذا التوازن في اتجاه أو آخر. منظمات اللوستريك التي تؤثر على تقارب Hb لـ O2 هي: 1) الأكسجين؛ 2) تركيز H+ (درجة الحموضة المتوسطة)؛ 3) ثاني أكسيد الكربون (CO2)؛ 4) 2،3 ثنائي فسفوغليسيرات (DPG). إن ارتباط جزيء الأكسجين بإحدى وحدات الهيموجلوبين الفرعية يعزز انتقال الشكل المتوتر إلى شكل مريح ويزيد من تقارب الأكسجين للوحدات الفرعية الأخرى من نفس جزيء الهيموجلوبين. وتسمى هذه الظاهرة التأثير التعاوني. تنعكس الطبيعة المعقدة لارتباط الهيموجلوبين بالأكسجين في منحنى تشبع الهيموجلوبين O2، الذي يتخذ شكل S (الشكل 3.1).

الشكل 3.1.منحنيات الميوجلوبين (1) والهيموجلوبين (2) تشبع الأكسجين.
الأشكال الجزيئيةيختلف الهيموجلوبين عن بعضها البعض في بنية سلاسل البولي ببتيد. مثال على مجموعة متنوعة من الهيموجلوبين الموجود في ظل الظروف الفسيولوجية هو الهيموجلوبين الجنيني (HbF)، موجود في الدم خلال المرحلة الجنينية لنمو الإنسان. على عكس HbA، يحتوي جزيئه على سلسلتين α و2 γ (أي يتم استبدال سلاسل β بسلاسل γ). مثل هذا الهيموجلوبين لديه تقارب أعلى للأكسجين. وهذا ما يسمح للجنين بتلقي الأكسجين من دم الأم عبر المشيمة. بعد فترة وجيزة من الولادة، يتم استبدال HbF في دم الطفل بـ HbA.
مثال على الهيموجلوبين غير الطبيعي أو المرضي هو الهيموجلوبين S المذكور سابقًا (انظر 2.4)، الموجود في المرضى الذين يعانون من فقر الدم المنجلي. كما تعلمون، فهو يختلف عن الهيموجلوبين A عن طريق استبدال الغلوتامات بالفالين في سلاسل بيتا. يؤدي استبدال الأحماض الأمينية هذا إلى انخفاض قابلية ذوبان HbS في الماء وانخفاض في تقاربه مع O2.
كما تعلمون، البروتينات هي أساس أصل الحياة على كوكبنا. لكن القطرة المتراكبة المكونة من جزيئات الببتيد هي التي أصبحت الأساس لأصل الكائنات الحية. وهذا ليس موضع شك، لأن تحليل التركيب الداخلي لأي ممثل للكتلة الحيوية يظهر أن هذه المواد موجودة في كل شيء: النباتات والحيوانات والكائنات الحية الدقيقة والفطريات والفيروسات. علاوة على ذلك، فهي متنوعة جدًا وذات طبيعة جزيئية كبيرة.
ولهذه البنى أربعة أسماء، كلها مترادفة:
- البروتينات.
- البروتينات.
- الببتيدات.
- الببتيدات.
جزيئات البروتين
عددهم لا يحصى حقا. في هذه الحالة يمكن تقسيم جميع جزيئات البروتين إلى مجموعتين كبيرتين:
- بسيطة - تتكون فقط من تسلسلات الأحماض الأمينية المرتبطة بروابط الببتيد.
- معقد - يتميز هيكل البروتين وبنيته بمجموعات بروتينية إضافية (اصطناعية)، تسمى أيضًا العوامل المساعدة.
وفي الوقت نفسه، للجزيئات المعقدة أيضًا تصنيفها الخاص.
تدرج الببتيدات المعقدة
- البروتينات السكرية هي مركبات وثيقة الصلة بالبروتين والكربوهيدرات. يتم نسج المجموعات الاصطناعية من عديدات السكاريد المخاطية في بنية الجزيء.
- البروتينات الدهنية هي مركب معقد من البروتين والدهون.
- البروتينات المعدنية - أيونات المعادن (الحديد والمنغنيز والنحاس وغيرها) تعمل كمجموعة صناعية.
- البروتينات النووية هي العلاقة بين البروتين والأحماض النووية (DNA، RNA).
- البروتينات الفسفورية - تشكيل البروتين وبقايا حمض الأرثوفوسفوريك.
- تشبه البروتينات الكروموبروتينات المعدنية إلى حد كبير، ومع ذلك، فإن العنصر الذي يشكل جزءًا من المجموعة الاصطناعية هو مركب ملون كامل (أحمر - الهيموجلوبين، أخضر - كلوروفيل، وما إلى ذلك).
في كل مجموعة، تختلف بنية وخصائص البروتينات. تختلف الوظائف التي تؤديها أيضًا اعتمادًا على نوع الجزيء.

التركيب الكيميائي للبروتينات
من وجهة النظر هذه، البروتينات عبارة عن سلسلة طويلة وضخمة من بقايا الأحماض الأمينية المرتبطة ببعضها البعض بواسطة روابط محددة تسمى الروابط الببتيدية. تمتد الفروع التي تسمى الجذور من الهياكل الجانبية للأحماض. اكتشف إي فيشر هذا التركيب الجزيئي في بداية القرن الحادي والعشرين.
وفي وقت لاحق، تمت دراسة البروتينات وبنية ووظائف البروتينات بمزيد من التفصيل. أصبح من الواضح أن هناك 20 حمضًا أمينيًا فقط تشكل بنية الببتيد، ولكن يمكن دمجها بعدة طرق. ومن هنا تنوع هياكل البولي ببتيد. بالإضافة إلى ذلك، في عملية الحياة وأداء وظائفها، تكون البروتينات قادرة على الخضوع لعدد من التحولات الكيميائية. ونتيجة لذلك، يغيرون البنية، ويظهر نوع جديد تمامًا من الاتصال.
لكسر الرابطة الببتيدية، أي تعطيل البروتين وبنية السلاسل، تحتاج إلى اختيار ظروف صارمة للغاية (درجات حرارة عالية، أحماض أو قلويات، محفز). ويرجع ذلك إلى القوة العالية في الجزيء، وبالتحديد في مجموعة الببتيد.

يتم الكشف عن بنية البروتين في المختبر باستخدام تفاعل البيوريت - التعرض للبولي ببتيد المترسب حديثًا (II). يعطي مجمع مجموعة الببتيد وأيون النحاس لونًا أرجوانيًا ساطعًا.
هناك أربع منظمات هيكلية رئيسية، لكل منها سماتها الهيكلية الخاصة بالبروتينات.
مستويات التنظيم: الهيكل الأساسي
كما ذكر أعلاه، الببتيد عبارة عن سلسلة من بقايا الأحماض الأمينية مع أو بدون شوائب أو إنزيمات مساعدة. لذا، فإن الأساس هو بنية الجزيء، وهو أحماض أمينية طبيعية وطبيعية ومرتبطة بروابط الببتيد، ولا شيء أكثر من ذلك. أي بولي ببتيد ذو بنية خطية. علاوة على ذلك، فإن السمات الهيكلية للبروتينات من هذا النوع هي أن هذا المزيج من الأحماض يعد حاسمًا لأداء وظائف جزيء البروتين. وبفضل وجود هذه الميزات، من الممكن ليس فقط تحديد الببتيد، ولكن أيضًا التنبؤ بخصائص ودور الببتيد الجديد تمامًا، الذي لم يتم اكتشافه بعد. ومن أمثلة الببتيدات ذات البنية الأولية الطبيعية الأنسولين والبيبسين والكيموتربسين وغيرها.

التشكل الثانوي
تختلف بنية وخصائص البروتينات في هذه الفئة إلى حد ما. يمكن أن يتشكل مثل هذا الهيكل في البداية بطبيعته أو عندما يتعرض الهيكل الأساسي للتحلل المائي الشديد أو درجة الحرارة أو ظروف أخرى.
وهذا التشكل له ثلاثة أنواع:
- دورات سلسة ومنتظمة ومجسمة، مبنية من بقايا الأحماض الأمينية، والتي تلتف حول المحور الرئيسي للاتصال. يتم تجميعها معًا فقط من خلال تلك الناشئة بين أكسجين مجموعة الببتيد وهيدروجين مجموعة أخرى. علاوة على ذلك، يعتبر التصميم صحيحا لأن المنعطفات تتكرر بالتساوي كل 4 روابط. يمكن أن يكون مثل هذا الهيكل إما أعسر أو أيمن. ولكن في معظم البروتينات المعروفة، يسود الأيزومر الدكستروريتوري. عادة ما تسمى هذه المطابقات بهياكل ألفا.
- يختلف تكوين وبنية البروتينات من النوع التالي عن النوع السابق من حيث أن الروابط الهيدروجينية لا تتشكل بين المخلفات المجاورة لجانب واحد من الجزيء، ولكن بين المخلفات البعيدة بشكل كبير، وعلى مسافة كبيرة إلى حد ما. لهذا السبب، يأخذ الهيكل بأكمله شكل عدة سلاسل ببتيدية متموجة تشبه الثعبان. هناك خاصية واحدة يجب أن يظهرها البروتين. يجب أن تكون بنية الأحماض الأمينية على الفروع قصيرة قدر الإمكان، مثل الجلايسين أو الألانين على سبيل المثال. يُطلق على هذا النوع من التشكل الثانوي اسم صفائح بيتا لقدرتها على الالتصاق معًا لتكوين بنية مشتركة.
- تشير علم الأحياء إلى النوع الثالث من بنية البروتين على أنه شظايا معقدة ومتناثرة وغير متجانسة ومضطربة لا تحتوي على انتظام مجسم وقادرة على تغيير البنية تحت تأثير الظروف الخارجية.
لم يتم تحديد أي أمثلة على البروتينات التي لها بنية ثانوية بشكل طبيعي.

التعليم العالي
هذا شكل معقد إلى حد ما يسمى "الكرة الكروية". ما هو هذا البروتين؟ يعتمد هيكلها على البنية الثانوية، ومع ذلك، يتم إضافة أنواع جديدة من التفاعلات بين ذرات المجموعات، ويبدو أن الجزيء بأكمله مطوي، وبالتالي يتم التركيز على حقيقة أن المجموعات المحبة للماء يتم توجيهها إلى الكرية، والمجموعات الكارهة للماء تلك إلى الخارج.
وهذا ما يفسر شحنة جزيء البروتين في المحاليل الغروية للماء. ما هي أنواع التفاعلات الموجودة هنا؟
- الروابط الهيدروجينية - تبقى دون تغيير بين نفس الأجزاء كما في البنية الثانوية.
- التفاعلات - تحدث عندما يذوب البولي ببتيد في الماء.
- تتشكل مناطق الجذب الأيونية بين مجموعات مشحونة بشكل مختلف من بقايا الأحماض الأمينية (الجذور).
- التفاعلات التساهمية - يمكن أن تتشكل بين مواقع حمضية محددة - جزيئات السيستين، أو بالأحرى ذيولها.
وبالتالي، يمكن وصف تكوين وبنية البروتينات ذات البنية الثلاثية على أنها سلاسل بولي ببتيد مطوية في كريات تحافظ على شكلها وتثبته بسبب أنواع مختلفة من التفاعلات الكيميائية. ومن أمثلة هذه الببتيدات: كيناز فوسفوغليسرات، الحمض الريبي النووي النقال، ألفا كيراتين، ألياف الحرير وغيرها.
هيكل رباعي
هذه هي واحدة من الكريات الأكثر تعقيدا التي تشكلها البروتينات. هيكل ووظائف البروتينات من هذا النوع متعددة الأوجه ومحددة للغاية.
ما هو هذا التشكيل؟ هذه عبارة عن عدة (في بعض الحالات العشرات) سلاسل بولي ببتيد كبيرة وصغيرة تتشكل بشكل مستقل عن بعضها البعض. ولكن بعد ذلك، وبسبب نفس التفاعلات التي أخذناها في الاعتبار بالنسبة للبنية الثلاثية، فإن كل هذه الببتيدات تلتف وتتشابك مع بعضها البعض. وبهذه الطريقة، يتم الحصول على الكريات المطابقة المعقدة، والتي يمكن أن تحتوي على ذرات معدنية ومجموعات دهنية وكربوهيدرات. ومن أمثلة هذه البروتينات: بوليميراز الحمض النووي، والقشرة البروتينية لفيروس التبغ، والهيموجلوبين وغيرها.

جميع الهياكل الببتيدية التي قمنا بفحصها لها طرق خاصة بها في التعرف عليها في المختبر، وذلك بالاعتماد على الإمكانيات الحديثة لاستخدام الكروماتوغرافيا والطرد المركزي والمجهر الإلكتروني والبصري وتقنيات الكمبيوتر العالية.
تم تنفيذ الوظائف
ترتبط بنية ووظائف البروتينات ارتباطًا وثيقًا ببعضها البعض. أي أن كل ببتيد يلعب دورًا محددًا وفريدًا ومحددًا. هناك أيضًا من هم قادرون على إجراء عدة عمليات مهمة مرة واحدة في خلية حية واحدة. ومع ذلك، فمن الممكن التعبير بشكل معمم عن الوظائف الرئيسية لجزيئات البروتين في الكائنات الحية:
- توفير الحركة. الكائنات الحية وحيدة الخلية، أو العضيات، أو بعض أنواع الخلايا قادرة على الحركة والانقباض والحركة. يتم ضمان ذلك عن طريق البروتينات التي تشكل بنية أجهزتهم الحركية: الأهداب والسوط والغشاء السيتوبلازمي. إذا تحدثنا عن الخلايا غير القادرة على الحركة، فيمكن أن تساهم البروتينات في تقلصها (الميوسين العضلي).
- وظيفة غذائية أو احتياطية. إنه تراكم جزيئات البروتين في البيض والأجنة وبذور النباتات لتجديد العناصر الغذائية المفقودة. عندما تتحلل الببتيدات، فإنها تنتج أحماض أمينية ومواد نشطة بيولوجيًا ضرورية للتطور الطبيعي للكائنات الحية.
- وظيفة الطاقة. بالإضافة إلى الكربوهيدرات، يمكن للبروتينات أيضًا أن توفر القوة للجسم. يؤدي انهيار 1 جرام من الببتيد إلى إطلاق 17.6 كيلوجول من الطاقة المفيدة على شكل حمض الأدينوزين ثلاثي الفوسفوريك (ATP)، والذي يتم إنفاقه على العمليات الحيوية.
- يتكون التأشير من مراقبة العمليات الجارية بعناية ونقل الإشارات من الخلايا إلى الأنسجة، ومنها إلى الأعضاء، ومن الأخيرة إلى الأنظمة، وما إلى ذلك. والمثال النموذجي هو الأنسولين، الذي يحدد بشكل صارم كمية الجلوكوز في الدم.
- وظيفة الاستقبال. ويتم ذلك عن طريق تغيير شكل الببتيد على أحد جانبي الغشاء وإشراك الطرف الآخر في إعادة الهيكلة. في نفس الوقت يتم إرسال الإشارة والمعلومات الضرورية. في أغلب الأحيان، يتم تضمين هذه البروتينات في أغشية الخلايا السيتوبلازمية وتمارس رقابة صارمة على جميع المواد التي تمر عبرها. كما أنها توفر معلومات حول التغيرات الكيميائية والفيزيائية في البيئة.
- وظيفة نقل الببتيدات. يتم تنفيذها بواسطة بروتينات القناة والبروتينات الناقلة. دورها واضح - نقل الجزيئات الضرورية إلى الأماكن ذات التركيز المنخفض من الأجزاء ذات التركيز العالي. والمثال النموذجي هو نقل الأكسجين وثاني أكسيد الكربون عبر الأعضاء والأنسجة بواسطة بروتين الهيموجلوبين. كما أنها تقوم بتوصيل المركبات ذات الوزن الجزيئي المنخفض عبر غشاء الخلية إلى الداخل.
- الوظيفة الهيكلية. من أهم الوظائف التي يؤديها البروتين. يتم ضمان بنية جميع الخلايا وعضياتها بواسطة الببتيدات. إنهم، مثل الإطار، يحددون الشكل والهيكل. بالإضافة إلى ذلك، فهم يدعمونها ويعدلونها إذا لزم الأمر. لذلك، من أجل النمو والتطور، تحتاج جميع الكائنات الحية إلى البروتينات في نظامها الغذائي. وتشمل هذه الببتيدات الإيلاستين والتوبولين والكولاجين والأكتين والكيراتين وغيرها.
- الوظيفة التحفيزية. يتم تنفيذه عن طريق الانزيمات. وهي عديدة ومتنوعة، فهي تعمل على تسريع جميع التفاعلات الكيميائية والكيميائية الحيوية في الجسم. بدون مشاركتهم، يمكن هضم تفاحة عادية في المعدة خلال يومين فقط، على الأرجح أنها تتعفن في هذه العملية. وتحت تأثير الكاتلاز والبيروكسيديز والإنزيمات الأخرى، تحدث هذه العملية خلال ساعتين. بشكل عام، بفضل هذا الدور الذي تلعبه البروتينات، يتم تنفيذ عملية الابتنائية والتقويض، أي البلاستيك و

دور وقائي
هناك عدة أنواع من التهديدات التي تم تصميم البروتينات منها لحماية الجسم.
أولا، الكواشف المؤلمة والغازات والجزيئات والمواد ذات أطياف العمل المختلفة. الببتيدات قادرة على التفاعل كيميائيًا معها، وتحويلها إلى شكل غير ضار أو ببساطة تحييدها.
ثانيا، التهديد الجسدي من الجروح - إذا لم يتحول بروتين الفيبرينوجين إلى الفيبرين في مكان الإصابة في الوقت المناسب، فلن يتجلط الدم، مما يعني أن الانسداد لن يحدث. بعد ذلك، على العكس من ذلك، سوف تحتاج إلى بلازمين الببتيد، الذي يمكنه إذابة الجلطة واستعادة سالكية الوعاء.
ثالثا، تهديد الحصانة. إن بنية وأهمية البروتينات التي تشكل الدفاع المناعي مهمة للغاية. الأجسام المضادة والجلوبيولين المناعي والإنترفيرون - كل هذه عناصر مهمة وهامة في الجهاز اللمفاوي والمناعي البشري. أي جسيم غريب أو جزيء ضار أو جزء ميت من الخلية أو بنية بأكملها تخضع للفحص الفوري بواسطة مركب الببتيد. ولهذا السبب يستطيع الإنسان بشكل مستقل، دون مساعدة من الأدوية، أن يحمي نفسه يومياً من الالتهابات والفيروسات البسيطة.
الخصائص الفيزيائية
بنية بروتين الخلية محددة للغاية وتعتمد على الوظيفة المنجزة. لكن الخصائص الفيزيائية لجميع الببتيدات متشابهة وتتلخص في الخصائص التالية.
- يصل وزن الجزيء إلى مليون دالتون.
- تتشكل الأنظمة الغروية في محلول مائي. هناك يكتسب الهيكل شحنة يمكن أن تختلف تبعًا لحموضة البيئة.
- عندما تتعرض لظروف قاسية (الإشعاع، الأحماض أو القلويات، درجة الحرارة، وما إلى ذلك) فإنها تكون قادرة على الانتقال إلى مستويات أخرى من المطابقة، أي التحلل. هذه العملية لا رجعة فيها في 90٪ من الحالات. ومع ذلك، هناك أيضًا تحول عكسي - إعادة الطبيعة.
هذه هي الخصائص الرئيسية للخصائص الفيزيائية للببتيدات.