To so visokomolekularne organske spojine, biopolimeri, zgrajeni iz 20 vrst L-?-aminokislinskih ostankov, povezanih v določenem zaporedju v dolge verige. Molekulska masa beljakovin se giblje od 5 tisoč do 1 milijona. Ime "beljak" je najprej dobilo snov ptičjih jajc, ki pri segrevanju koagulira v belo netopno maso. Izraz so kasneje razširili na druge snovi s podobnimi lastnostmi, izolirane iz živali in rastlin.
riž. 1. Najbolj kompleksni biopolimeri so proteini. Njihove makromolekule so sestavljene iz monomerov, ki so aminokisline. Vsaka aminokislina ima dve funkcionalni skupini: karboksilno skupino in amino skupino. Vsa raznolikost beljakovin nastane kot posledica različnih kombinacij 20 aminokislin.
Beljakovine prevladujejo nad vsemi drugimi spojinami v živih organizmih in običajno predstavljajo več kot polovico njihove suhe teže. Predvideva se, da je v naravi nekaj milijard posameznih proteinov (samo v bakteriji E. coli je npr. več kot 3 tisoč različnih proteinov).
Beljakovine igrajo ključno vlogo v življenjskih procesih katerega koli organizma. Beljakovine vključujejo encime, s sodelovanjem katerih se v celici pojavijo vse kemične transformacije (metabolizem); nadzorujejo delovanje genov; z njihovo udeležbo se realizira delovanje hormonov, izvaja se transmembranski transport, vključno s generiranjem živčnih impulzov. So sestavni del imunskega sistema (imunoglobulini) in koagulacijskega sistema, tvorijo osnovo kostnega in vezivnega tkiva ter sodelujejo pri preoblikovanju in izrabi energije.
Zgodovina raziskav beljakovin
Prvi poskusi izolacije beljakovin so bili narejeni že v 18. stoletju. Do začetka 19. stoletja so se pojavila prva dela o kemijskem preučevanju beljakovin. Francoska znanstvenika Joseph Louis Gay-Lussac in Louis Jacques Thénard sta poskušala ugotoviti elementarno sestavo beljakovin iz različnih virov, kar je pomenilo začetek sistematičnih analitičnih študij, zahvaljujoč katerim so ugotovili, da so si vsi proteini podobni v naboru elementov, vključenih v njihova sestava. Leta 1836 je nizozemski kemik G. J. Mulder predlagal prvo teorijo strukture beljakovinskih snovi, po kateri imajo vsi proteini določen hipotetični radikal (C 40 H 62 N 10 O 12), povezan v različnih razmerjih z atomi žvepla in fosforja. Ta radikal je imenoval "protein" (iz grškega proteina - prvi, glavni). Mulderjeva teorija je prispevala k povečanemu zanimanju za preučevanje beljakovin in izboljšanju metod kemije beljakovin. Razvite so bile tehnike izolacije proteinov z ekstrakcijo z raztopinami nevtralnih soli in prvič pridobljeni proteini v kristalni obliki (nekateri rastlinski proteini). Za analizo beljakovin so začeli uporabljati njihovo predhodno razgradnjo s kislinami in alkalijami.
Hkrati se je vse večja pozornost začela posvečati proučevanju delovanja beljakovin. Jens Jakob Berzelius je leta 1835 prvi predlagal, da imajo vlogo biokatalizatorjev. Kmalu so odkrili proteolitična encima - pepsin (T. Schwann, 1836) in tripsin (L. Corvisart, 1856), ki sta pritegnila pozornost k fiziologiji prebave in analizi produktov, ki nastanejo pri razgradnji hranil. Nadaljnje proučevanje zgradbe beljakovin in delo na kemični sintezi peptidov je povzročilo nastanek peptidne hipoteze, po kateri so vse beljakovine zgrajene iz aminokislin. Do konca 19. stoletja je bila raziskana večina aminokislin, ki sestavljajo beljakovine.
V začetku 20. stoletja je nemški kemik Emil Hermann Fischer prvi uporabil metode organske kemije za proučevanje beljakovin in dokazal, da so beljakovine sestavljene iz β-aminokislin, ki so med seboj povezane z amidno (peptidno) vezjo. Kasneje je bila zahvaljujoč uporabi fizikalno-kemijskih analiznih metod določena molekulska masa številnih proteinov, ugotovljena je bila sferična oblika globularnih proteinov, izvedena je bila rentgenska difrakcijska analiza aminokislin in peptidov ter metode kromatografske analize. razviti (glej kromatografijo).
Izoliran je bil prvi proteinski hormon (Frederick Grant Banting, John James Rickard McLeod, 1922), dokazana prisotnost gama globulinov v protitelesih in opisana encimska funkcija mišičnega proteina miozina (Vladimir Aleksandrovič Engelhardt, M. N. Lyubimova, 1939) . Prvič so bili encimi pridobljeni v kristalni obliki - ureaza (J.B. Saliner, 1926), pepsin (J.H. Nortron, 1929), lizocim (E.P. Abraham, Robert Robinson, 1937).

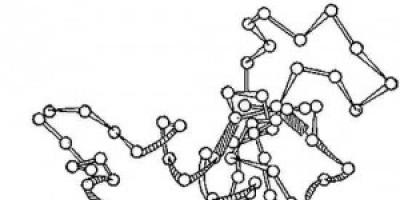
riž. 2. Shema tridimenzionalne zgradbe encima lizocima. Krogi - aminokisline; niti - peptidne vezi; osenčeni pravokotniki so disulfidne vezi. Vidni so spiralizirani in podolgovati odseki polipeptidne verige.
V petdesetih letih prejšnjega stoletja je bila dokazana trinivojska organizacija beljakovinskih molekul - prisotnost primarne, sekundarne in terciarne strukture; ustvaril avtomatski analizator aminokislin (Stanford Moore, William Howard Stein, 1950). V 60. letih prejšnjega stoletja so poskušali kemično sintetizirati beljakovine (insulin, ribonukleaza). Metode analize rentgenske difrakcije so bile bistveno izboljšane; nastala je naprava - sekvencer (P. Edman, G. Begg, 1967), ki je omogočil določitev zaporedja aminokislin v polipeptidni verigi. Posledica tega je bila vzpostavitev strukture več sto proteinov iz različnih virov. Med njimi so proteolitični encimi (pepsin, tripsin, kimotripsin, subtilizin, karboksipeptidaze), mioglobini, hemoglobini, citokromi, lizocimi, imunoglobulini, histoni, nevrotoksini, proteini virusne ovojnice, proteinsko-peptidni hormoni. Posledično so se pojavili predpogoji za reševanje perečih problemov v encimologiji, imunologiji, endokrinologiji in drugih področjih biološke kemije.
Ob koncu 20. stoletja je bil dosežen pomemben napredek pri preučevanju vloge proteinov v matrični sintezi biopolimerov, razumevanju mehanizmov njihovega delovanja v različnih življenjskih procesih organizmov ter ugotavljanju povezave med njihovo zgradbo in delovanjem. Izboljšanje raziskovalnih metod in pojav novih metod za ločevanje proteinov in peptidov je bilo zelo pomembno.
Razvoj učinkovite metode za analizo zaporedja nukleotidov v nukleinskih kislinah je omogočil bistveno poenostavitev in pospešitev določanja zaporedja aminokislin v proteinih. To se je izkazalo za možno, ker je vrstni red aminokislin v proteinu določen z zaporedjem nukleotidov v genu, ki kodira ta protein (fragment). Posledično lahko ob poznavanju razporeditve nukleotidov v tem genu in genetske kode natančno napovemo, v kakšnem vrstnem redu so aminokisline v polipeptidni verigi proteina. Skupaj z napredkom v strukturni analizi proteinov so bili doseženi pomembni rezultati pri proučevanju njihove prostorske organizacije, mehanizmov nastajanja in delovanja supramolekularnih kompleksov, vključno z ribosomi in drugimi celičnimi organeli, kromatinom, virusi itd.
Struktura beljakovin
Skoraj vse beljakovine so zgrajene iz 20 α-aminokislin, ki pripadajo L-seriji, in so skoraj v vseh organizmih enake. Aminokisline v beljakovinah so med seboj povezane s peptidno vezjo -CO-NH-, ki jo tvorita karboksilna in -amino skupina sosednjih aminokislinskih ostankov: dve aminokislini tvorita dipeptid, v katerem je terminalni karboksil (-COOH) in amino skupina (H 2 N-) ostanejo prosti, ki jim lahko dodamo nove aminokisline, da tvorimo polipeptidno verigo.
Odsek verige, na katerem se nahaja končna H 2 N-skupina, se imenuje N-terminal, del nasproti njega pa C-terminal. Velika raznolikost beljakovin je določena z zaporedjem razporeditve in številom aminokislinskih ostankov, ki jih vsebujejo. Čeprav ni jasne razlike, se kratke verige običajno imenujejo peptidi ali oligopeptidi (iz oligo...), polipeptidi (proteini) pa običajno razumejo kot verige, sestavljene iz 50 ali več. Najpogostejši proteini so tisti, ki vsebujejo 100-400 aminokislinskih ostankov, obstajajo pa tudi taki, katerih molekule sestavljajo 1000 ali več ostankov. Beljakovine so lahko sestavljene iz več polipeptidnih verig. V takih proteinih se vsaka polipeptidna veriga imenuje podenota.
Prostorska zgradba proteinov

riž. 3. Beljakovine v vseh organizmih so sestavljene iz 20 vrst aminokislin. Za vsako beljakovino je značilen določen izbor in količinsko razmerje aminokislin. V proteinskih molekulah so aminokisline med seboj povezane s peptidnimi vezmi (- CO - NH -) v linearnem zaporedju, ki sestavljajo tako imenovano primarno strukturo proteina. Zgornja vrstica - proste aminokisline s stranskimi skupinami R1, R2, R3; bistvo - aminokisline so povezane s peptidnimi vezmi.
Polipeptidna veriga je sposobna spontano oblikovati in vzdrževati posebno prostorsko strukturo. Glede na obliko beljakovinskih molekul delimo beljakovine na fibrilarne in globularne. Pri globularnih proteinih je ena ali več polipeptidnih verig zvitih v kompaktno sferično strukturo ali globulo. Običajno so ti proteini dobro topni v vodi. Ti vključujejo skoraj vse encime, krvne transportne beljakovine in številne skladiščne beljakovine. Fibrilarni proteini so nitaste molekule, ki jih držijo skupaj navzkrižne vezi in tvorijo dolga vlakna ali večplastne strukture. Imajo visoko mehansko trdnost, so netopni v vodi in opravljajo predvsem strukturne in zaščitne funkcije. Tipični predstavniki takih proteinov so lasni in volneni keratini, fibroin svile in tetivni kolagen.
Vrstni red kovalentno povezanih aminokislin v polipeptidni verigi imenujemo aminokislinsko zaporedje ali primarna struktura proteinov. Primarna struktura vsakega proteina, kodirana z ustreznim genom, je konstantna in nosi vse informacije, potrebne za tvorbo struktur na višji ravni. Potencialno število proteinov, ki se lahko tvorijo iz 20 aminokislin, je praktično neomejeno.
Zaradi interakcije stranskih skupin aminokislinskih ostankov posamezni relativno majhni odseki polipeptidne verige prevzamejo eno ali drugo konformacijo (vrsto zlaganja), znano kot sekundarna struktura proteinov. Njena najbolj značilna elementa sta periodično ponavljajoča se α-vijačnica in β-struktura. Sekundarna struktura je zelo stabilna. Ker je v veliki meri določen z aminokislinskim zaporedjem ustrezne beljakovinske regije, ga je mogoče z določeno stopnjo verjetnosti napovedati. Izraz »?-heliks« je uvedel ameriški biokemik, fizik in kemik Linus Carl Pauling, ki je opisal razporeditev polipeptidne verige v proteinu?-keratinu v obliki desnosučne vijačnice (?-vijačnica lahko primerjati s telefonskim kablom). Za vsak zavoj takšne vijačnice v beljakovini je 3,6 aminokislinskih ostankov. To pomeni, da skupina -C=O ene peptidne vezi tvori vodikovo vez s skupino -NH druge peptidne vezi, štiri aminokislinske ostanke, ki so oddaljeni od prvega. V povprečju vsaka α-spiralna regija vključuje do 15 aminokislin, kar ustreza 3-4 zavojem vijačnice. Toda v vsakem posameznem proteinu se lahko dolžina vijačnice močno razlikuje od te vrednosti. V prerezu ima α-vijačnica obliko diska, iz katerega so stranske verige aminokislin obrnjene navzven.
Struktura ali? -nagubana plast, lahko tvori več odsekov polipeptidne verige. Ti odseki so raztegnjeni in položeni vzporedno drug z drugim, povezani med seboj z vodikovimi vezmi, ki nastanejo med peptidnimi vezmi. Lahko so usmerjeni v isto ali nasprotno smer (smer gibanja vzdolž polipeptidne verige se običajno šteje od N-konca do C-konca). V prvem primeru se prepognjena plast imenuje vzporedna, v drugem - antiparalelna. Slednji nastane, ko se peptidna veriga ostro zavije nazaj in tvori upogib (?-upogib). Ali so stranske verige aminokislin usmerjene pravokotno na ravnino? -plast.
Relativna vsebina? -spiralni odseki in? - strukture se lahko med različnimi proteini zelo razlikujejo. Obstajajo beljakovine s prevlado α-vijačnic (približno 75% aminokislin v mioglobinu in hemoglobinu), glavna vrsta zvijanja verige v številnih fibrilarnih beljakovinah (vključno s svilenim fibroinom, β-keratinom) pa je α-vijačnica. -struktura. Področja polipeptidne verige, ki jih ni mogoče uvrstiti v nobeno od zgoraj opisanih konformacij, imenujemo povezovalne zanke. Njihovo strukturo določajo predvsem interakcije med stranskimi verigami aminokislin, v molekuli katerega koli proteina pa se prilega na strogo določen način.
Terciarna struktura se imenuje prostorska struktura globularnih proteinov. Toda pogosto se ta koncept nanaša na metodo zlaganja polipeptidne verige v prostoru, značilno za vsak določen protein. Terciarno strukturo tvori polipeptidna veriga proteina spontano, očitno vzdolž določene koagulacijske poti s predhodno tvorbo elementov sekundarne strukture. Če je stabilnost sekundarne strukture posledica vodikovih vezi, potem je terciarna struktura fiksirana z raznolikim sistemom nekovalentnih interakcij: vodikovimi, ionskimi, medmolekularnimi interakcijami, pa tudi hidrofobnimi stiki med stranskimi verigami nepolarnih amino kislinski ostanki.
V nekaterih proteinih se terciarna struktura dodatno stabilizira s tvorbo disulfidnih vezi (-S-S- vezi) med cisteinskimi ostanki. V notranjosti beljakovinske globule so praviloma v jedro sestavljene stranske verige hidrofobnih aminokislin (njihov prenos znotraj beljakovinske globule je termodinamično ugoden), na obrobju pa so hidrofilni ostanki in nekateri hidrofobni. Proteinsko globulo obdaja več sto molekul hidratacijske vode, ki je nujna za stabilnost beljakovinske molekule in je pogosto vpletena v njeno delovanje. Terciarna struktura je mobilna, njeni posamezni deli se lahko premikajo, kar vodi do konformacijskih prehodov, ki igrajo pomembno vlogo pri interakciji proteina z drugimi molekulami.
Terciarna struktura je osnova funkcionalnih lastnosti proteina. Določa nastanek sklopov funkcionalnih skupin v proteinu - aktivnih centrov in veznih con, jim daje potrebno geometrijo, omogoča ustvarjanje notranjega okolja, ki je predpogoj za potek številnih reakcij, in zagotavlja interakcijo z drugimi proteini. .
Terciarna struktura beljakovin jasno ustreza njihovi primarni strukturi; verjetno obstaja še nedešifrirana stereokemična koda, ki določa naravo zvijanja beljakovin. Vendar pa ena in ista metoda prostorske razporeditve običajno ne ustreza eni primarni strukturi, temveč celotni družini struktur, v katerih lahko sovpada le majhen del (do 20-30%) aminokislinskih ostankov, vendar v določenih mestih v verigi se ohrani podobnost aminokislinskih ostankov. Rezultat je nastanek velikih družin proteinov, za katere je značilna podobna terciarna in bolj ali manj podobna primarna struktura ter praviloma skupno delovanje. To so na primer proteini organizmov različnih vrst, ki imajo enako funkcijo in so si evolucijsko sorodni: mioglobini in hemoglobini, tripsin, kimotripsin, elastaza in druge živalske proteinaze.

riž. 4. Zaradi kombinacije več proteinskih makromolekul s terciarno strukturo se kvartarna proteinska struktura oblikuje v kompleksen kompleks. Primer takih kompleksnih beljakovin je hemoglobin, sestavljen iz štirih makromolekul.
Pogosto, zlasti pri velikih proteinih, pride do zvijanja polipeptidne verige s tvorbo posameznih odsekov verige bolj ali manj avtonomnih elementov prostorske strukture - domen, ki imajo lahko funkcionalno avtonomijo in so odgovorne za eno ali drugo biološko aktivnost beljakovine. Tako N-terminalne domene koagulacijskih proteinov krvi zagotavljajo njihovo pritrditev na celično membrano.
Obstaja veliko proteinov, katerih molekule so skupek kroglic (podenot), ki jih držijo skupaj hidrofobne interakcije, vodikove ali ionske vezi. Takšni kompleksi se imenujejo oligomerni, multimerni ali podenotni proteini. Razporeditev podenot v funkcionalno aktivnem proteinskem kompleksu imenujemo kvartarna struktura proteina. Nekateri proteini so sposobni tvoriti strukture višjega reda, na primer multiencimske komplekse, razširjene strukture (beljakovine plašča bakteriofaga), nadmolekularne komplekse, ki delujejo kot ena celota (na primer ribosomi ali komponente mitohondrijske dihalne verige).
Kvartarna struktura omogoča ustvarjanje molekul z nenavadno geometrijo. Tako ima feritin, ki ga tvori 24 podenot, notranjo votlino, zahvaljujoč kateri beljakovina uspe vezati do 3000 železovih ionov. Poleg tega kvartarna struktura omogoča izvajanje več različnih funkcij v eni molekuli. Triptofan sintetaza združuje encime, odgovorne za več zaporednih stopenj sinteze aminokisline triptofan.
Metode za preučevanje strukture beljakovin
Primarna struktura beljakovin določa vse ostale nivoje organizacije beljakovinske molekule. Zato je pri proučevanju biološkega delovanja različnih proteinov pomembno poznavanje te strukture. Prva beljakovina, za katero je bilo ugotovljeno zaporedje aminokislin, je bil hormon trebušne slinavke, insulin. To delo, ki je trajalo 11 let, je opravil angleški biokemik Frederick Sanger (1954). Določil je lokacijo 51 aminokislin v molekuli hormona in pokazal, da je sestavljena iz 2 verig, povezanih z disulfidnimi vezmi. Kasneje je bila večina dela pri ugotavljanju primarne strukture proteinov avtomatizirana.
Z razvojem metod genskega inženiringa je ta proces postalo mogoče še pospešiti z določanjem primarne strukture proteinov v skladu z rezultati analize nukleotidnega zaporedja v genih, ki kodirajo te proteine. Sekundarno in terciarno strukturo proteinov preučujemo s precej zapletenimi fizikalnimi metodami, na primer s krožnim dikroizmom ali rentgensko difrakcijsko analizo proteinskih kristalov. Terciarno strukturo je prvi ugotovil angleški biokemik John Cowdery Kendrew (1957) za mišični protein mioglobin.

riž. 5. Model molekule mioglobina (prostorska konfiguracija molekule)
Denaturacija beljakovin
Relativno šibke vezi, odgovorne za stabilizacijo sekundarne, terciarne in kvartarne strukture proteina, se zlahka uničijo, kar spremlja izguba njegove biološke aktivnosti. Uničenje prvotne (native) proteinske strukture, imenovano denaturacija, se pojavi v prisotnosti kislin in baz, s segrevanjem, spremembami ionske moči in drugimi vplivi. Denaturirane beljakovine so praviloma slabo ali sploh netopne v vodi. S kratkotrajnim učinkom in hitrim izločanjem denaturacijskih dejavnikov je možna renaturacija beljakovin s popolno ali delno obnovitvijo prvotne strukture in bioloških lastnosti.
Razvrstitev beljakovin
Kompleksnost zgradbe beljakovinskih molekul in izjemna raznolikost funkcij, ki jih opravljajo, otežujeta ustvarjanje njihove enotne in jasne klasifikacije, čeprav so bili poskusi, da bi to storili, vedno znova od konca 19. stoletja. Glede na kemično sestavo beljakovine delimo na enostavne in kompleksne (včasih jih imenujemo tudi proteini). Molekule prvega so sestavljene le iz aminokislin. Kompleksni proteini poleg same polipeptidne verige vsebujejo neproteinske komponente, ki jih predstavljajo ogljikovi hidrati (glikoproteini), lipidi (lipoproteini), nukleinske kisline (nukleoproteini), kovinski ioni (metaloproteini), fosfatna skupina (fosfoproteini), pigmenti (kromoproteini), itd.
Glede na funkcije, ki jih opravljajo, ločimo več razredov beljakovin. Najbolj raznolik in najbolj specializiran razred sestavljajo proteini s katalitsko funkcijo – encimi, ki imajo sposobnost pospeševanja kemičnih reakcij, ki potekajo v živih organizmih. V tej vlogi beljakovine sodelujejo v vseh procesih sinteze in razgradnje različnih spojin med presnovo, v biosintezi beljakovin in nukleinskih kislin, regulaciji celičnega razvoja in diferenciacije. Transportne beljakovine imajo sposobnost, da selektivno vežejo maščobne kisline, hormone in druge organske in anorganske spojine ter ione in jih nato s tokom prenašajo na želeno mesto (npr. hemoglobin sodeluje pri prenosu kisika iz pljuč do vseh celic telo). Transportne beljakovine izvajajo tudi aktivni transport ionov, lipidov, sladkorjev in aminokislin skozi biološke membrane.
Strukturni proteini opravljajo podporno ali zaščitno funkcijo; sodelujejo pri nastajanju celičnega ogrodja. Najpogostejši med njimi so kolagen vezivnega tkiva, keratin, nohti in perje, elastin žilnih celic in mnogi drugi. V kombinaciji z lipidi so strukturna osnova celičnih in znotrajceličnih membran.
Številne beljakovine opravljajo zaščitno funkcijo. Na primer, imunoglobulini (protitelesa) vretenčarjev, ki imajo sposobnost vezave tujih patogenih mikroorganizmov in snovi, nevtralizirajo njihove patogene učinke na telo in preprečujejo celično proliferacijo. Fibrinogen in trombin sodelujeta pri procesu strjevanja krvi. Številne beljakovinske snovi, ki jih izločajo bakterije, pa tudi sestavine nekaterih nevretenčarjev uvrščamo med toksine.
Nekatere beljakovine (regulatorne) sodelujejo pri uravnavanju fiziološke aktivnosti telesa kot celote, posameznih organov, celic ali procesov. Nadzorujejo transkripcijo genov in sintezo beljakovin; ti vključujejo peptidno-proteinske hormone, ki jih izločajo endokrine žleze. Beljakovine za shranjevanje semen zagotavljajo hranila za začetne faze razvoja zarodka. Sem sodijo tudi kazein, beljakov albumin (ovalbumin) in številni drugi. Zahvaljujoč beljakovinam mišične celice pridobijo sposobnost krčenja in končno zagotovijo gibanje telesu. Primeri takšnih kontraktilnih proteinov so aktin in miozin skeletnih mišic, pa tudi tubulin, ki sta sestavni del migetalk in bičkov enoceličnih organizmov; Zagotavljajo tudi razhajanje kromosomov med celično delitvijo.
Receptorski proteini so tarča hormonov in drugih biološko aktivnih spojin. Z njihovo pomočjo celica zaznava informacije o stanju zunanjega okolja. Imajo pomembno vlogo pri prenosu živčnega vzbujanja in pri usmerjenem gibanju celic (kemotaksi). Preoblikovanje in uporaba energije, ki vstopa v telo, pa tudi energija poteka tudi s sodelovanjem beljakovin bioenergetskega sistema (na primer vidnega pigmenta rodopsina, citokromov dihalne verige). Obstaja tudi veliko beljakovin z drugimi, včasih precej neobičajnimi funkcijami (na primer, plazma nekaterih antarktičnih rib vsebuje beljakovine, ki imajo lastnosti proti zmrzovanju).
Biosinteza beljakovin
Vse informacije o strukturi določenega proteina so "shranjene" v ustreznih genih v obliki zaporedja nukleotidov in se izvajajo v procesu sinteze šablone. Najprej se informacije prenesejo (preberejo) iz molekule DNA na messenger RNA (mRNA) s pomočjo encima DNA-odvisne RNA polimeraze, nato pa v ribosomu na mRNA, kot na matriki v skladu z genetsko kodo, s sodelovanjem transportnih RNA, ki prenašajo aminokisline, nastane polipeptidna veriga.
Sintetizirane polipeptidne verige, ki izhajajo iz ribosoma, se spontano zvijajo, prevzamejo konformacijo, značilno za protein, in so lahko predmet posttranslacijske modifikacije. Stranske verige posameznih aminokislin so lahko podvržene modifikacijam (hidroksilacija, fosforilacija itd.). Zato sta na primer hidroksiprolin in hidroksilizin v kolagenu (glej). Spremembo lahko spremlja tudi pretrganje polipeptidnih vezi. Na ta način na primer pride do tvorbe aktivne molekule insulina, sestavljene iz dveh verig, povezanih z disulfidnimi vezmi.

riž. 6. Splošna shema biosinteze beljakovin.
Pomen beljakovin v prehrani
Beljakovine so najpomembnejše sestavine živalske in človeške hrane. Hranilno vrednost beljakovin določa vsebnost esencialnih aminokislin, ki jih telo ne proizvaja samo. V tem pogledu so rastlinske beljakovine manj vredne od živalskih: revnejše so z lizinom, metioninom in triptofanom ter težje prebavljive v prebavilih. Pomanjkanje esencialnih aminokislin v hrani vodi do hudih motenj presnove dušika.
Beljakovine se razgradijo na proste aminokisline, ki po absorpciji v črevesju vstopijo in se razporedijo po vseh celicah. Nekateri od njih se razgradijo na preproste spojine s sproščanjem energije, ki jo celica porabi za različne potrebe, nekateri pa gredo za sintezo novih beljakovin, značilnih za določen organizem. (R. A. Matveeva, Enciklopedija Cirila in Metoda)
Štetje beljakovin
- amiloid - amiloid;
- anionski - anionski;
- protivirusno - protivirusno;
- avtoimunski - avtoimunski;
- avtologni - avtologni;
- bakterijski - bakterijski;
- beljakovine Bence Jones;
- virusno povzročeno - virusno povzročeno;
- virusni - virus;
- virusni nestrukturni - virus nestrukturni;
- virusni strukturni - strukturni virus;
- specifičen za virus - specifičen za virus;
- visoka molekulska masa - visoka molekulska masa;
- ki vsebuje hem - hem;
- heterologni - tuji;
- hibrid - hibrid;
- glikoziliran - glikiran;
- kroglast - kroglast;
- denaturiran - denaturiran;
- ki vsebuje železo - železo;
- rumenjak - rumenjak;
- živalske beljakovine - živalske beljakovine;
- zaščitno - obrambno;
- imunski - imunski;
- imunogeni – imunološko relevantni;
- vezava kalcija;
- kislo - kislo;
- korpuskularen - korpuskularen;
- membrana - membrana;
- mielom - mielom;
- mikrosomski - mikrosomski;
- mlečne beljakovine - mlečne beljakovine;
- monoklonski - monoklonski imunoglobulin;
- mišične beljakovine - mišične beljakovine;
- domačin - domačin;
- nehistonski - nehistonski;
- okvarjen - delno;
- netopno - netopno;
- neprebavljiv - netopen;
- neencimski - neencimski;
- nizka molekulska masa - nizka molekulska masa;
- nove beljakovine - nove beljakovine;
- splošno - celota;
- onkogeni - onkoprotein;
- protein glavne faze - anionski;
- protein akutne faze (vnetje) - protein akutne faze;
- hrana - hrana;
- beljakovine krvne plazme - plazemske beljakovine;
- posteljica - placenta;
- odklop - odklop;
- beljakovine regeneracijskega živca;
- regulativni - regulativni;
- rekombinacija - rekombinantna;
- receptor - receptor;
- ribosomski - ribosomski;
- vezava - vezava;
- sekretorni protein - sekretorni protein;
- C-reaktiven - C-reaktiven;
- sirotkine beljakovine - sirotkine beljakovine, laktoprotein;
- tkivo - tkivo;
- strupen - strupen;
- himerni - himerni;
- cel - cel;
- citosolni - citosolni;
- alkalna beljakovina - anionska beljakovina;
- eksogeni - eksogeni;
- endogeni - endogeni protein.
Več o beljakovinah preberite v literaturi:
- Volkenshtein M.V., Molekule in, M., 1965, pogl. 3 - 5;
- Gaurowitz F., Kemija in funkcije proteinov, trans. iz angleščine, Moskva, 1965;
- Sissakyan N. M. in Gladilin K. L., Biokemijski vidiki sinteze beljakovin, v knjigi: Napredek v biološki kemiji, zvezek 7, M., 1965, str. 3;
- Stepanov V. M. Molekularna biologija. Zgradba in funkcija beljakovin. M., 1996;
- Shamin A. N., Razvoj kemije beljakovin, M., 1966;
- Beljakovine in peptidi. M., 1995-2000. T. 1-3;
- Biosinteza beljakovin in nukleinskih kislin, ed. A. S. Spirina, M., 1965;
- Uvod v molekularno biologijo, prev. iz angleščine, M., 1967
- Molekule in celice. [sob. Art.], prev. iz angleščine, M., 1966, str. 7 - 27, 94 - 106;
- Osnove biokemije: Prevod iz angleščine M., 1981. T. 1;
- Problem beljakovin. M., 1995. T. 1-5;
- Beljakovine. New York, 1975-79. 3 izd. V. 1-4.
Poiščite še kaj zanimivega:
Veverice- organske spojine z visoko molekulsko maso, sestavljene iz ostankov α-aminokislin.
IN beljakovinska sestava vključuje ogljik, vodik, dušik, kisik, žveplo. Nekatere beljakovine tvorijo komplekse z drugimi molekulami, ki vsebujejo fosfor, železo, cink in baker.
Beljakovine imajo veliko molekulsko maso: jajčni albumin - 36 000, hemoglobin - 152 000, miozin - 500 000. Za primerjavo: molekulska masa alkohola je 46, ocetna kislina - 60, benzen - 78.
Aminokislinska sestava beljakovin
Veverice- neperiodični polimeri, katerih monomeri so α-aminokisline. Običajno se 20 vrst α-aminokislin imenuje proteinski monomeri, čeprav jih je več kot 170 v celicah in tkivih.
Glede na to, ali se aminokisline lahko sintetizirajo v telesu ljudi in drugih živali, jih ločimo: neesencialne aminokisline- lahko se sintetizira; esencialne aminokisline- ni mogoče sintetizirati. Esencialne aminokisline moramo v telo vnesti s hrano. Rastline sintetizirajo vse vrste aminokislin.
Glede na aminokislinsko sestavo, beljakovine so: popolne- vsebujejo celoten nabor aminokislin; okvarjen- v njihovi sestavi manjkajo nekatere aminokisline. Če so beljakovine sestavljene samo iz aminokislin, se imenujejo preprosto. Če proteini vsebujejo poleg aminokislin še neaminokislinsko komponento (prostetično skupino), jih imenujemo kompleksen. Protetično skupino lahko predstavljajo kovine (metaloproteini), ogljikovi hidrati (glikoproteini), lipidi (lipoproteini), nukleinske kisline (nukleoproteini).
Vse aminokisline vsebujejo: 1) karboksilna skupina (-COOH), 2) amino skupina (-NH 2), 3) radikal ali R-skupina (ostanek molekule). Struktura radikala je različna za različne vrste aminokislin. Glede na število amino skupin in karboksilnih skupin, vključenih v sestavo aminokislin, jih ločimo: nevtralne aminokisline z eno karboksilno skupino in eno amino skupino; bazične aminokisline z več kot eno amino skupino; kisle aminokisline z več kot eno karboksilno skupino.
Aminokisline so amfoterne spojine, saj lahko v raztopini delujejo kot kisline in baze. V vodnih raztopinah obstajajo aminokisline v različnih ionskih oblikah.
Peptidna vez
Peptidi- organske snovi, sestavljene iz aminokislinskih ostankov, povezanih s peptidnimi vezmi.
Nastajanje peptidov nastane kot posledica kondenzacijske reakcije aminokislin. Ko amino skupina ene aminokisline interagira s karboksilno skupino druge, se med njima pojavi kovalentna vez dušik-ogljik, ki jo imenujemo peptid. Glede na število aminokislinskih ostankov, vključenih v peptid, obstajajo dipeptidi, tripeptidi, tetrapeptidi itd. Tvorba peptidne vezi se lahko večkrat ponovi. To vodi do nastanka polipeptidi. Na enem koncu peptida je prosta amino skupina (imenovana N-konec), na drugem pa je prosta karboksilna skupina (imenovana C-konec).

Prostorska organizacija beljakovinskih molekul
Izvajanje določenih specifičnih funkcij beljakovin je odvisno od prostorske konfiguracije njihovih molekul, poleg tega pa je energijsko neugodno, da celica ohranja beljakovine v nezloženi obliki, v obliki verige, zato se polipeptidne verige zvijajo, pridobijo določeno tridimenzionalno strukturo ali konformacijo. Obstajajo 4 stopnje prostorska organizacija proteinov.
Primarna struktura beljakovin- zaporedje razporeditve aminokislinskih ostankov v polipeptidni verigi, ki sestavlja proteinsko molekulo. Vez med aminokislinami je peptidna vez.

Če je proteinska molekula sestavljena samo iz 10 aminokislinskih ostankov, potem je število teoretično možnih variant beljakovinskih molekul, ki se razlikujejo po vrstnem redu menjave aminokislin, 10 20. Ker imate 20 aminokislin, lahko iz njih sestavite še bolj raznolike kombinacije. V človeškem telesu so našli približno deset tisoč različnih beljakovin, ki se razlikujejo tako med seboj kot tudi od beljakovin drugih organizmov.
Primarna struktura beljakovinske molekule določa lastnosti beljakovinskih molekul in njihovo prostorsko konfiguracijo. Zamenjava samo ene aminokisline z drugo v polipeptidni verigi povzroči spremembo lastnosti in funkcij proteina. Na primer, zamenjava šeste glutaminske aminokisline z valinom v β-podenoti hemoglobina vodi do dejstva, da molekula hemoglobina kot celota ne more opravljati svoje glavne funkcije - transporta kisika; V takih primerih oseba razvije bolezen, imenovano anemija srpastih celic.
Sekundarna struktura- urejeno zvijanje polipeptidne verige v spiralo (izgleda kot podaljšana vzmet). Zavoji vijačnice so okrepljeni z vodikovimi vezmi, ki nastanejo med karboksilnimi in amino skupinami. Pri tvorbi vodikovih vezi sodelujejo skoraj vse skupine CO in NH. So šibkejši od peptidnih, vendar večkrat ponovljeni dajejo tej konfiguraciji stabilnost in togost. Na nivoju sekundarne strukture so beljakovine: fibroin (svila, pajkova mreža), keratin (lasje, nohti), kolagen (kite).



Terciarna struktura- pakiranje polipeptidnih verig v globule, ki je posledica tvorbe kemičnih vezi (vodikovih, ionskih, disulfidnih) in vzpostavitve hidrofobnih interakcij med radikali aminokislinskih ostankov. Glavno vlogo pri nastanku terciarne strukture igrajo hidrofilno-hidrofobne interakcije. V vodnih raztopinah se hidrofobni radikali skrivajo pred vodo in se združujejo v kroglico, medtem ko se hidrofilni radikali kot posledica hidratacije (interakcija z vodnimi dipoli) radi pojavljajo na površini molekule. V nekaterih proteinih je terciarna struktura stabilizirana z disulfidnimi kovalentnimi vezmi, ki nastanejo med atomi žvepla dveh cisteinskih ostankov. Na ravni terciarne strukture so encimi, protitelesa in nekateri hormoni.

Kvartarna struktura značilnost kompleksnih proteinov, katerih molekule tvorita dve ali več globul. Podenote se v molekuli zadržujejo z ionskimi, hidrofobnimi in elektrostatičnimi interakcijami. Včasih se med nastajanjem kvartarne strukture med podenotami pojavijo disulfidne vezi. Najbolj raziskan protein s kvartarno strukturo je hemoglobin. Tvorijo ga dve α-podenoti (141 aminokislinskih ostankov) in dve β-podenoti (146 aminokislinskih ostankov). Z vsako podenoto je povezana molekula hema, ki vsebuje železo.
Če iz nekega razloga prostorska konformacija beljakovin odstopa od normalne, beljakovina ne more opravljati svojih funkcij. Na primer, vzrok za "bolezen norih krav" (spongiformna encefalopatija) je nenormalna konformacija prionov, površinskih proteinov živčnih celic.
Lastnosti beljakovin
Aminokislinska sestava in struktura beljakovinske molekule jo določata lastnosti. Beljakovine združujejo bazične in kisle lastnosti, ki jih določajo aminokislinski radikali: bolj kot je kislih aminokislin v proteinu, bolj izrazite so njegove kisle lastnosti. Določena je sposobnost darovanja in dodajanja H + puferske lastnosti proteinov; Eden najmočnejših pufrov je hemoglobin v rdečih krvničkah, ki vzdržuje pH krvi na stalni ravni. Obstajajo topne beljakovine (fibrinogen) in netopne beljakovine, ki opravljajo mehanske funkcije (fibroin, keratin, kolagen). Obstajajo beljakovine, ki so kemično aktivne (encimi), obstajajo kemično neaktivne beljakovine, ki so odporne na različne okoljske razmere, in tiste, ki so izjemno nestabilne.
Zunanji dejavniki (toplota, ultravijolično sevanje, težke kovine in njihove soli, spremembe pH, sevanje, dehidracija)
lahko povzročijo motnje v strukturni organizaciji proteinske molekule. Proces izgube tridimenzionalne konformacije, ki je lastna določeni beljakovinski molekuli, se imenuje denaturacija. Vzrok denaturacije je pretrganje vezi, ki stabilizirajo določeno beljakovinsko strukturo. Sprva se potrgajo najšibkejše vezi, z zaostrovanjem razmer pa se potrgajo še močnejše. Zato se najprej izgubi kvartarna, nato terciarna in sekundarna struktura. Sprememba prostorske konfiguracije povzroči spremembo lastnosti proteina in posledično onemogoči, da bi protein opravljal svoje inherentne biološke funkcije. Če denaturacije ne spremlja uničenje primarne strukture, potem je lahko reverzibilen, v tem primeru pride do samoobnove konformacijske značilnosti proteina. Takšni denaturaciji so na primer podvrženi membranski receptorski proteini. Postopek obnavljanja strukture beljakovin po denaturaciji se imenuje renaturacija. Če ponovna vzpostavitev prostorske konfiguracije proteina ni mogoča, se imenuje denaturacija nepovraten.
Funkcije beljakovin
| funkcija | Primeri in razlage |
|---|---|
| Gradnja | Beljakovine sodelujejo pri tvorbi celičnih in zunajceličnih struktur: so del celičnih membran (lipoproteini, glikoproteini), las (keratin), tetiv (kolagen) itd. |
| Transport | Krvna beljakovina hemoglobin veže kisik in ga prenaša iz pljuč v vsa tkiva in organe, iz njih pa prenaša ogljikov dioksid v pljuča; Sestava celičnih membran vključuje posebne beljakovine, ki zagotavljajo aktiven in strogo selektiven prenos določenih snovi in ionov iz celice v zunanje okolje in nazaj. |
| Regulativni | Proteinski hormoni sodelujejo pri uravnavanju presnovnih procesov. Na primer, hormon inzulin uravnava raven glukoze v krvi, pospešuje sintezo glikogena in povečuje tvorbo maščob iz ogljikovih hidratov. |
| Zaščitna | Kot odgovor na prodiranje tujih beljakovin ali mikroorganizmov (antigenov) v telo nastanejo posebne beljakovine - protitelesa, ki jih lahko vežejo in nevtralizirajo. Fibrin, ki nastane iz fibrinogena, pomaga ustaviti krvavitev. |
| Motor | Kontraktilna proteina aktin in miozin zagotavljata krčenje mišic pri večceličnih živalih. |
| Signal | V površinsko membrano celice so vgrajene beljakovinske molekule, ki so sposobne spreminjati svojo terciarno strukturo kot odziv na okoljske dejavnike, s čimer sprejemajo signale iz zunanjega okolja in prenašajo ukaze celici. |
| Shranjevanje | V telesu živali se beljakovine praviloma ne shranjujejo, razen jajčnega albumina in mlečnega kazeina. Toda zahvaljujoč beljakovinam se lahko nekatere snovi shranijo v telesu; na primer, med razgradnjo hemoglobina se železo ne odstrani iz telesa, ampak se shrani in tvori kompleks z beljakovino feritinom. |
| Energija | Ko 1 g beljakovin razpade na končne produkte, se sprosti 17,6 kJ. Najprej se beljakovine razgradijo na aminokisline, nato pa na končne produkte – vodo, ogljikov dioksid in amoniak. Beljakovine pa se kot vir energije uporabljajo šele, ko se porabijo drugi viri (ogljikovi hidrati in maščobe). |
| Katalitično | Ena najpomembnejših funkcij beljakovin. Zagotavljajo ga beljakovine - encimi, ki pospešujejo biokemične reakcije v celicah. Na primer, ribuloza bifosfat karboksilaza katalizira fiksacijo CO 2 med fotosintezo. |
Encimi
Encimi, oz encimi, so poseben razred beljakovin, ki so biološki katalizatorji. Zahvaljujoč encimom se biokemične reakcije odvijajo z izjemno hitrostjo. Hitrost encimskih reakcij je desettisočkrat (in včasih milijone) višja od hitrosti reakcij, ki potekajo s sodelovanjem anorganskih katalizatorjev. Snov, na katero deluje encim, se imenuje substrat.
Encimi so globularni proteini, strukturne značilnosti Encime lahko razdelimo v dve skupini: enostavne in kompleksne. Preprosti encimi so enostavni proteini, tj. sestavljena samo iz aminokislin. Kompleksni encimi so kompleksne beljakovine, tj. Poleg beljakovinskega dela vsebujejo skupino neproteinske narave - kofaktor. Nekateri encimi uporabljajo vitamine kot kofaktorje. Molekula encima vsebuje poseben del, imenovan aktivni center. Aktivni center- majhen del encima (od treh do dvanajstih aminokislinskih ostankov), kjer pride do vezave substrata ali substratov, da se tvori kompleks encim-substrat. Po končani reakciji se kompleks encim-substrat razgradi na encim in reakcijski produkt(-e). Nekateri encimi imajo (razen aktivnih) alosterični centri- območja, na katera so pritrjeni regulatorji hitrosti encimov ( alosterični encimi).

Za reakcije encimske katalize je značilno: 1) visoka učinkovitost, 2) stroga selektivnost in usmerjenost delovanja, 3) substratna specifičnost, 4) fina in natančna regulacija. Specifičnost substrata in reakcije encimskih kataliznih reakcij pojasnjujeta hipotezi E. Fischerja (1890) in D. Koshlanda (1959).
E. Fisher (hipoteza ključ-ključavnica) predlagal, da morata prostorski konfiguraciji aktivnega mesta encima in substrata natančno ustrezati drug drugemu. Substrat primerjamo s »ključem«, encim s »ključavnico«.
D. Koshland (hipoteza rokavice) predlagal, da se prostorska korespondenca med strukturo substrata in aktivnim središčem encima ustvari šele v trenutku njihove medsebojne interakcije. Ta hipoteza se imenuje tudi hipoteza inducirane korespondence.
Hitrost encimskih reakcij je odvisna od: 1) temperature, 2) koncentracije encima, 3) koncentracije substrata, 4) pH. Poudariti je treba, da so encimi beljakovine, zato je njihova aktivnost največja v fiziološko normalnih pogojih.
Večina encimov lahko deluje le pri temperaturah med 0 in 40°C. Znotraj teh meja se hitrost reakcije poveča približno 2-krat z vsakim povišanjem temperature za 10 °C. Pri temperaturah nad 40 °C se beljakovine denaturirajo in aktivnost encimov se zmanjša. Pri temperaturah blizu ledišča se encimi inaktivirajo.
Ko se količina substrata poveča, se hitrost encimske reakcije poveča, dokler se število substratnih molekul ne izenači s številom encimskih molekul. Z nadaljnjim povečanjem količine substrata se hitrost ne poveča, saj so aktivni centri encima nasičeni. Povečanje koncentracije encima povzroči povečano katalitično aktivnost, saj se na enoto časa transformira večje število substratnih molekul.

Za vsak encim obstaja optimalna vrednost pH, pri kateri ima največjo aktivnost (pepsin - 2,0, amilaza v slini - 6,8, pankreasna lipaza - 9,0). Pri višjih ali nižjih vrednostih pH se aktivnost encimov zmanjša. Pri nenadnih spremembah pH se encim denaturira.
Hitrost alosteričnih encimov uravnavajo snovi, ki se vežejo na alosterične centre. Če te snovi pospešijo reakcijo, se imenujejo aktivatorji, če se upočasnijo - zaviralci.
Razvrstitev encimov
Glede na vrsto kemičnih transformacij, ki jih katalizirajo, so encimi razdeljeni v 6 razredov:
- oksireduktaze(prenos atomov vodika, kisika ali elektronov iz ene snovi v drugo - dehidrogenaza),
- transferaze(prenos metilne, acilne, fosfatne ali amino skupine iz ene snovi v drugo - transaminaza),
- hidrolaze(hidrolizne reakcije, pri katerih iz substrata nastaneta dva produkta - amilaza, lipaza),
- liaze(nehidrolitična adicija na substrat ali odcepitev skupine atomov od njega, pri čemer se lahko prekinejo vezi C-C, C-N, C-O, C-S - dekarboksilaza),
- izomeraze(intramolekularna preureditev - izomeraza),
- ligaze(povezava dveh molekul kot posledica tvorbe C-C, C-N, C-O, C-S vezi - sintetaza).
Razredi so nato razdeljeni na podrazrede in podrazrede. V trenutni mednarodni klasifikaciji ima vsak encim posebno kodo, sestavljeno iz štirih številk, ločenih s pikami. Prva številka je razred, druga je podrazred, tretja je podrazred, četrta je serijska številka encima v tem podrazredu, na primer koda arginaze je 3.5.3.1.
Pojdi do predavanja št. 2"Zgradba in funkcije ogljikovih hidratov in lipidov"
Pojdi do predavanja št. 4"Zgradba in funkcije nukleinskih kislin ATP"
V prvi polovici 19. stol. številni kemiki, med njimi predvsem J. von Liebig, so postopoma prišli do zaključka, da proteini predstavljajo poseben razred dušikovih spojin. Ime "beljakovine" (iz grščine.
protos prvi) je leta 1840 predlagal nizozemski kemik G. Mulder. FIZIČNE LASTNOSTI Beljakovine so bele v trdnem stanju, vendar brezbarvne v raztopini, razen če nosijo neke vrste kromoforne (obarvane) skupine, kot je hemoglobin. Topnost v vodi se med različnimi beljakovinami zelo razlikuje. Spreminja se tudi glede na pH in koncentracijo soli v raztopini, zato je mogoče izbrati pogoje, pod katerimi se bo en protein selektivno oboril v prisotnosti drugih proteinov. Ta metoda "soljenja" se pogosto uporablja za izolacijo in čiščenje beljakovin. Prečiščena beljakovina se pogosto obori iz raztopine kot kristali.V primerjavi z drugimi spojinami je molekulska masa beljakovin zelo velika in se giblje od nekaj tisoč do več milijonov daltonov. Zato se med ultracentrifugiranjem beljakovine sedimentirajo in to z različnimi hitrostmi. Zaradi prisotnosti pozitivno in negativno nabitih skupin v beljakovinskih molekulah se te gibljejo z različnimi hitrostmi in v električnem polju. To je osnova elektroforeze, metode, ki se uporablja za izolacijo posameznih beljakovin iz kompleksnih mešanic. Beljakovine čistimo tudi s kromatografijo.
KEMIJSKE LASTNOSTI Struktura. Beljakovine so polimeri, tj. molekule, zgrajene kot verige iz ponavljajočih se monomernih enot ali podenot, katerih vlogo igrajo a -amino kisline. Splošna formula aminokislin kjer R atom vodika ali kakšna organska skupina.Molekula beljakovine (polipeptidna veriga) je lahko sestavljena iz le relativno majhnega števila aminokislin ali več tisoč monomernih enot. Kombinacija aminokislin v verigi je mogoča, ker ima vsaka od njih dve različni kemijski skupini: amino skupino z bazičnimi lastnostmi,
NH 2 in kislo karboksilno skupino, COOH. Obe skupini sta povezani z a - atom ogljika. Karboksilna skupina ene aminokisline lahko tvori amidno (peptidno) vez z amino skupino druge aminokisline: Ko sta bili dve aminokislini povezani na ta način, je mogoče verigo podaljšati tako, da drugi aminokislini dodamo tretjo in tako naprej. Kot je razvidno iz zgornje enačbe, ko nastane peptidna vez, se sprosti molekula vode. V prisotnosti kislin, alkalij ali proteolitičnih encimov poteka reakcija v nasprotni smeri: polipeptidna veriga se z dodatkom vode razcepi na aminokisline. To reakcijo imenujemo hidroliza. Hidroliza poteka spontano, za povezovanje aminokislin v polipeptidno verigo pa je potrebna energija.
Ko sta bili dve aminokislini povezani na ta način, je mogoče verigo podaljšati tako, da drugi aminokislini dodamo tretjo in tako naprej. Kot je razvidno iz zgornje enačbe, ko nastane peptidna vez, se sprosti molekula vode. V prisotnosti kislin, alkalij ali proteolitičnih encimov poteka reakcija v nasprotni smeri: polipeptidna veriga se z dodatkom vode razcepi na aminokisline. To reakcijo imenujemo hidroliza. Hidroliza poteka spontano, za povezovanje aminokislin v polipeptidno verigo pa je potrebna energija. Karboksilna skupina in amidna skupina (ali podobna imidna skupina v primeru aminokisline prolin) sta prisotni v vseh aminokislinah, vendar so razlike med aminokislinami določene z naravo skupine ali "stranske verige", ki je zgoraj označen s črko
R . Vlogo stranske verige lahko igra en vodikov atom, kot je v aminokislini glicin, ali neka zajetna skupina, kot je histidin in triptofan. Nekatere stranske verige so kemično inertne, druge pa izrazito reaktivne.Sintetizirati je mogoče več tisoč različnih aminokislin in v naravi se pojavlja veliko različnih aminokislin, vendar se za sintezo beljakovin uporablja le 20 vrst aminokislin: alanin, arginin, asparagin, asparaginska kislina, valin, histidin, glicin, glutamin, glutaminska kislina, izolevcin, levcin, lizin, metionin, prolin, serin, tirozin, treonin, triptofan, fenilalanin in cistein (v beljakovinah je cistein lahko prisoten kot dimer
cistin). Res je, da nekatere beljakovine poleg dvajsetih, ki se običajno pojavljajo, vsebujejo še druge aminokisline, vendar nastanejo kot posledica modifikacije ene od naštetih dvajsetih, potem ko je bila vključena v beljakovino.Optična dejavnost. Vse aminokisline, razen glicina, imajo a -Ogljikov atom ima štiri različne skupine, ki so vezane nanj. Z vidika geometrije lahko štiri različne skupine povežemo na dva načina in temu primerno obstajata dve možni konfiguraciji ali dva izomera, ki sta med seboj povezana tako, kot je predmet s svojo zrcalno sliko, tj. kot leva roka na desno. Ena konfiguracija se imenuje leva ali levičarska ( L ), druga pa desna ali desnorotatorna ( D ), saj se dva taka izomera razlikujeta v smeri vrtenja ravnine polarizirane svetlobe. Najdemo ga le v beljakovinah L -aminokisline (izjema je glicin; lahko ga predstavimo samo v eni obliki, saj sta dve od njegovih štirih skupin enaki), vse pa so optično aktivne (ker je le en izomer). D -aminokisline so v naravi redke; najdemo jih v nekaterih antibiotikih in celični steni bakterij.Zaporedje aminokislin. Aminokisline v polipeptidni verigi niso razporejene naključno, ampak v določenem fiksnem vrstnem redu in ta vrstni red določa funkcije in lastnosti proteina. S spreminjanjem vrstnega reda 20 vrst aminokislin lahko ustvarite ogromno število različnih beljakovin, tako kot lahko ustvarite veliko različnih besedil iz črk abecede.V preteklosti je določanje aminokislinskega zaporedja beljakovine pogosto trajalo več let. Neposredna določitev je še vedno precej delovno intenzivna naloga, čeprav so bile ustvarjene naprave, ki omogočajo avtomatsko izvedbo. Običajno je lažje določiti nukleotidno zaporedje ustreznega gena in iz njega razbrati aminokislinsko zaporedje proteina. Do danes so bila aminokislinska zaporedja več sto proteinov že določena. Funkcije dešifriranih proteinov so običajno znane, kar pomaga predstavljati možne funkcije podobnih proteinov, ki nastanejo na primer pri malignih novotvorbah.
Kompleksne beljakovine. Beljakovine, sestavljene samo iz aminokislin, imenujemo enostavne. Pogosto pa je na polipeptidno verigo vezan kovinski atom ali kakšna kemična spojina, ki ni aminokislina. Takšne beljakovine imenujemo kompleksne. Primer je hemoglobin: vsebuje železov porfirin, ki določa njegovo rdečo barvo in omogoča, da deluje kot prenašalec kisika.Imena najbolj kompleksnih beljakovin kažejo na naravo povezanih skupin: glikoproteini vsebujejo sladkorje, lipoproteine vsebujejo maščobe. Če je katalitična aktivnost encima odvisna od vezane skupine, se imenuje prostetična skupina. Pogosto ima vitamin vlogo prostetične skupine ali pa je njen del. Vitamin A, na primer, vezan na enega od proteinov v mrežnici, določa njeno občutljivost na svetlobo.
Terciarna struktura. Pomembna ni toliko aminokislinska sekvenca same beljakovine (primarna struktura), temveč način, kako je razporejena v prostoru. Po vsej dolžini polipeptidne verige tvorijo vodikovi ioni pravilne vodikove vezi, ki ji dajejo obliko vijačnice ali plasti (sekundarna struktura). Iz kombinacije takih vijačnic in plasti nastane kompaktna oblika naslednjega reda: terciarna struktura proteina. Okoli vezi, ki držijo monomerne enote verige, so možne rotacije pod majhnimi koti. Zato je s čisto geometrijskega vidika število možnih konfiguracij za katero koli polipeptidno verigo neskončno veliko. V resnici vsak protein običajno obstaja samo v eni konfiguraciji, ki jo določa njegovo aminokislinsko zaporedje. Ta struktura ni toga, je kot da « diha« niha okoli določene povprečne konfiguracije. Vezje je zloženo v konfiguracijo, v kateri je prosta energija (zmožnost proizvajanja dela) minimalna, tako kot se sproščena vzmet stisne le do stanja, ki ustreza minimalni prosti energiji. Pogosto je en del verige togo povezan z drugim z disulfidom ( SS) vezi med dvema cisteinskima ostankoma. Delno tudi zato ima cistein posebno pomembno vlogo med aminokislinami.Kompleksnost strukture proteinov je tako velika, da še ni mogoče izračunati terciarne strukture proteina, tudi če je znano njegovo aminokislinsko zaporedje. Če pa je mogoče dobiti kristale proteina, potem lahko njegovo terciarno strukturo določimo z rentgensko difrakcijo.
V strukturnih, kontraktilnih in nekaterih drugih proteinih so verige podolgovate in več rahlo nagubanih verig, ki ležijo v bližini, tvori fibrile; fibrile pa se zvijejo v večje tvorbe vlaken. Vendar ima večina beljakovin v raztopini kroglasto obliko: verige so zvite v kroglo, kot preja v kroglo. Prosta energija pri tej konfiguraciji je minimalna, saj so hidrofobne (»vodoodbojne«) aminokisline skrite znotraj globule, hidrofilne (»vodoodbojne«) aminokisline pa so na njeni površini.
Mnogi proteini so kompleksi več polipeptidnih verig. To strukturo imenujemo kvartarna struktura proteina. Molekula hemoglobina je na primer sestavljena iz štirih podenot, od katerih je vsaka globularna beljakovina.
Strukturni proteini zaradi svoje linearne konfiguracije tvorijo vlakna, ki imajo zelo visoko natezno trdnost, medtem ko globularna konfiguracija proteinom omogoča, da vstopijo v specifične interakcije z drugimi spojinami. Na površini globule, ko so verige pravilno razporejene, se pojavijo votline določene oblike, v katerih se nahajajo reaktivne kemične skupine. Če je določena beljakovina encim, potem v tako votlino vstopi druga, običajno manjša molekula neke snovi, tako kot ključ vstopi v ključavnico; v tem primeru se konfiguracija elektronskega oblaka molekule spremeni pod vplivom kemičnih skupin, ki se nahajajo v votlini, in to jo prisili, da reagira na določen način. Na ta način encim katalizira reakcijo. Molekule protiteles imajo tudi votline, v katere se vežejo različne tuje snovi in tako postanejo neškodljive. Model »ključavnice in ključa«, ki pojasnjuje interakcijo proteinov z drugimi spojinami, nam omogoča razumevanje specifičnosti encimov in protiteles, tj. njihova sposobnost, da reagirajo samo z določenimi spojinami.
Beljakovine v različnih vrstah organizmov. Podobno konfiguracijo imajo tudi proteini, ki opravljajo isto funkcijo pri različnih vrstah rastlin in živali in zato nosijo isto ime. Vendar se nekoliko razlikujejo v zaporedju aminokislin. Ko se vrste ločijo od skupnega prednika, se nekatere aminokisline na določenih položajih z mutacijami nadomestijo z drugimi. Škodljive mutacije, ki povzročajo dedne bolezni, odpravi naravna selekcija, koristne ali vsaj nevtralne pa lahko ostanejo. Čim bližje sta si dve vrsti, manj je razlik v njunih beljakovinah.Nekateri proteini se razmeroma hitro spreminjajo, drugi so zelo ohranjeni. Slednji vključuje na primer citokrom z dihalni encim, ki ga najdemo v večini živih organizmov. Pri ljudeh in šimpanzih so njegove aminokislinske sekvence enake, v citokromu pa z V pšenici je bilo le 38 % aminokislin drugačnih. Tudi če primerjamo ljudi in bakterije, podobnost citokromov z(razlike zadevajo 65 % aminokislin tukaj) je še vedno mogoče videti, čeprav je skupni prednik bakterij in ljudi živel na Zemlji pred približno dvema milijardama let. Dandanes se primerjava aminokislinskih zaporedij pogosto uporablja za izdelavo filogenetskega (družinskega) drevesa, ki odraža evolucijska razmerja med različnimi organizmi.
Denaturacija. Sintetizirana beljakovinska molekula, zvijanje, pridobi svojo značilno konfiguracijo. To konfiguracijo pa je mogoče uničiti s segrevanjem, s spreminjanjem pH, z izpostavljenostjo organskim topilom in celo s preprostim stresanjem raztopine, dokler se na njeni površini ne pojavijo mehurčki. Tako spremenjeni protein se imenuje denaturiran; izgubi svojo biološko aktivnost in običajno postane netopna. Dobro znani primeri denaturiranih beljakovin so kuhana jajca ali stepena smetana. Majhne beljakovine, ki vsebujejo le okoli sto aminokislin, so sposobne renaturacije, tj. ponovno pridobite prvotno konfiguracijo. Toda večina proteinov se preprosto spremeni v množico zapletenih polipeptidnih verig in ne obnovi svoje prejšnje konfiguracije.Ena od glavnih težav pri izolaciji aktivnih beljakovin je njihova izjemna občutljivost na denaturacijo. Ta lastnost beljakovin najde koristno uporabo pri konzerviranju hrane: visoka temperatura nepovratno denaturira encime mikroorganizmov in mikroorganizmi umrejo.
SINTEZA BELJAKOVIN Za sintezo beljakovin mora imeti živ organizem sistem encimov, ki so sposobni povezati eno aminokislino z drugo. Za določitev, katere aminokisline je treba kombinirati, je potreben tudi vir informacij. Ker je v telesu na tisoče vrst beljakovin in je vsaka v povprečju sestavljena iz več sto aminokislin, mora biti zahtevanih informacij res ogromno. Shranjen je (podobno kot se posnetek shrani na magnetnem traku) v molekulah nukleinskih kislin, ki sestavljajo gene. Cm . tudi DEDNO; NUKLEINSKA KISLINA.Aktivacija encimov. Polipeptidna veriga, sintetizirana iz aminokislin, ni vedno protein v končni obliki. Mnogi encimi se najprej sintetizirajo kot neaktivni prekurzorji in postanejo aktivni šele potem, ko drug encim odstrani več aminokislin na enem koncu verige. Nekateri prebavni encimi, kot je tripsin, se sintetizirajo v tej neaktivni obliki; ti encimi se aktivirajo v prebavnem traktu kot posledica odstranitve končnega fragmenta verige. Hormon inzulin, katerega molekula je v aktivni obliki sestavljena iz dveh kratkih verig, se sintetizira v obliki ene verige, ti. proinsulin. Srednji del te verige se nato odstrani, preostali delci pa se vežejo skupaj in tvorijo aktivno molekulo hormona. Kompleksne beljakovine nastanejo šele, ko se na beljakovino veže določena kemijska skupina, ta pritrditev pa pogosto zahteva tudi encim.Presnovna cirkulacija. Po hranjenju živali z aminokislinami, označenimi z radioaktivnimi izotopi ogljika, dušika ali vodika, se oznaka hitro vgradi v njene beljakovine. Če označene aminokisline prenehajo vstopati v telo, se začne količina označenih beljakovin zmanjševati. Ti poskusi kažejo, da se nastale beljakovine v telesu ne zadržijo do konca življenja. Vsi, razen redkih izjem, so v dinamičnem stanju, nenehno razpadajo na aminokisline in se nato ponovno sintetizirajo.Nekatere beljakovine se razgradijo, ko celice umrejo in so uničene. To se dogaja ves čas, na primer z rdečimi krvnimi celicami in epitelnimi celicami, ki obdajajo notranjo površino črevesja. Poleg tega pride do razgradnje in ponovne sinteze beljakovin tudi v živih celicah. Nenavadno je, da je manj znanega o razgradnji beljakovin kot o njihovi sintezi. Jasno pa je, da pri razgradnji sodelujejo proteolitični encimi, podobni tistim, ki v prebavnem traktu razgradijo beljakovine v aminokisline.
Razpolovna doba različnih beljakovin se giblje od nekaj ur do več mesecev. Edina izjema je molekula kolagena. Ko so oblikovani, ostanejo stabilni in se ne obnavljajo ali zamenjajo. Sčasoma pa se spremenijo nekatere njihove lastnosti, predvsem elastičnost, in ker se ne obnavljajo, to povzroči nekatere starostne spremembe, kot je na primer pojav gub na koži.
Sintetične beljakovine. Kemiki so se že dolgo naučili polimerizirati aminokisline, vendar so aminokisline združene na neurejen način, tako da so produkti takšne polimerizacije malo podobni naravnim. Res je, da je mogoče kombinirati aminokisline v določenem vrstnem redu, kar omogoča pridobivanje nekaterih biološko aktivnih beljakovin, zlasti insulina. Postopek je precej zapleten, na ta način pa je mogoče pridobiti le tiste beljakovine, katerih molekule vsebujejo približno sto aminokislin. Namesto tega je bolje sintetizirati ali izolirati nukleotidno zaporedje gena, ki ustreza želenemu zaporedju aminokislin, in nato ta gen vnesti v bakterijo, ki bo z replikacijo proizvedla velike količine želenega produkta. Ta metoda pa ima tudi svoje pomanjkljivosti. Cm . tudi GENSKI INŽENIRING. BELJAKOVINE IN PREHRANA Ko se beljakovine v telesu razgradijo na aminokisline, se lahko te aminokisline ponovno uporabijo za sintezo beljakovin. Hkrati so same aminokisline podvržene razgradnji, zato se ne ponovno v celoti uporabijo. Jasno je tudi, da mora med rastjo, nosečnostjo in celjenjem ran sinteza beljakovin preseči razgradnjo. Telo nenehno izgublja nekaj beljakovin; To so beljakovine las, nohtov in površinske plasti kože. Zato mora vsak organizem za sintezo beljakovin prejeti aminokisline s hrano. Zelene rastline sintetizirajo iz CO 2 , voda in amoniak ali nitrati so vseh 20 aminokislin, ki jih najdemo v beljakovinah. Številne bakterije so prav tako sposobne sintetizirati aminokisline v prisotnosti sladkorja (ali kakšnega ekvivalenta) in vezanega dušika, vendar sladkor končno dobavljajo zelene rastline. Živali imajo omejeno sposobnost sintetiziranja aminokislin; aminokisline pridobivajo z uživanjem zelenih rastlin ali drugih živali. V prebavnem traktu se absorbirane beljakovine razgradijo na aminokisline, slednje se absorbirajo in iz njih zgradijo beljakovine, značilne za določen organizem. Noben od absorbiranih proteinov ni vgrajen v telesne strukture kot tak. Edina izjema je, da lahko pri mnogih sesalcih nekatera materina protitelesa nedotaknjena preidejo skozi placento v fetalni krvni obtok in se z materinim mlekom (zlasti pri prežvekovalcih) prenesejo na novorojenčka takoj po rojstvu.Potreba po beljakovinah. Jasno je, da mora telo za ohranitev življenja prejeti določeno količino beljakovin s hrano. Vendar pa je obseg te potrebe odvisen od številnih dejavnikov. Telo potrebuje hrano kot vir energije (kalorije) in kot material za gradnjo svojih struktur. Potreba po energiji je na prvem mestu. To pomeni, da ko je v prehrani malo ogljikovih hidratov in maščob, se prehranske beljakovine ne uporabljajo za sintezo lastnih beljakovin, temveč kot vir kalorij. Med dolgotrajnim postom se za zadovoljevanje energijskih potreb porabijo tudi lastne beljakovine. Če je v prehrani dovolj ogljikovih hidratov, se lahko zmanjša poraba beljakovin.Ravnovesje dušika. V povprečju cca. 16% celotne mase beljakovin je dušik. Ko se aminokisline, ki jih vsebujejo beljakovine, razgradijo, se dušik, ki ga vsebujejo, izloči iz telesa z urinom in (v manjši meri) z blatom v obliki različnih dušikovih spojin. Zato je za oceno kakovosti beljakovinske prehrane primerno uporabiti kazalnik, kot je bilanca dušika, tj. razlika (v gramih) med količino dušika, ki vstopi v telo, in količino dušika, ki se dnevno izloči. Pri normalni prehrani odrasle osebe so te količine enake. V rastočem organizmu je količina izločenega dušika manjša od prejete količine, tj. bilanca je pozitivna. Če v prehrani primanjkuje beljakovin, je bilanca negativna. Če je v prehrani dovolj kalorij, vendar v njej ni beljakovin, telo prihrani beljakovine. Hkrati se metabolizem beljakovin upočasni, ponavljajoča se uporaba aminokislin v sintezi beljakovin pa se pojavi z največjo možno učinkovitostjo. Vendar so izgube neizogibne, dušikove spojine pa se še vedno izločajo z urinom in deloma z blatom. Količina dušika, ki se dnevno izloči iz telesa med beljakovinskim postom, lahko služi kot merilo dnevnega pomanjkanja beljakovin. Naravno je domnevati, da je mogoče z uvedbo količine beljakovin v prehrano, ki ustreza tej pomanjkljivosti, ponovno vzpostaviti dušikovo ravnovesje. Vendar pa ni. Po prejemu te količine beljakovin začne telo manj učinkovito porabljati aminokisline, zato je za ponovno vzpostavitev ravnovesja dušika potrebno nekaj dodatnih beljakovin.Če količina beljakovin v prehrani presega tisto, kar je potrebno za vzdrževanje dušikovega ravnovesja, se zdi, da ni škode. Odvečne aminokisline preprosto uporabimo kot vir energije. Posebej osupljiv primer je, da Eskimi zaužijejo malo ogljikovih hidratov in približno desetkratno količino beljakovin, potrebnih za vzdrževanje dušikovega ravnovesja. V večini primerov pa uporaba beljakovin kot vira energije ni koristna, saj lahko določena količina ogljikovih hidratov proizvede veliko več kalorij kot enaka količina beljakovin. V revnih državah ljudje dobivajo kalorije iz ogljikovih hidratov in zaužijejo minimalne količine beljakovin.
Če telo prejme zahtevano število kalorij v obliki neproteinskih izdelkov, potem je minimalna količina beljakovin za vzdrževanje dušikovega ravnovesja pribl. 30 g na dan. Približno toliko beljakovin vsebujejo štiri rezine kruha ali 0,5 litra mleka. Nekoliko večje število običajno velja za optimalno; Priporočljivo je 50 do 70 g.
Esencialne aminokisline. Doslej so beljakovine obravnavali kot celoto. Medtem, da pride do sinteze beljakovin, morajo biti v telesu prisotne vse potrebne aminokisline. Telo živali je sposobno sintetizirati nekatere aminokisline. Imenujemo jih nadomestne, ker ni nujno, da so prisotni v prehrani, pomembno je le, da je skupna zaloga beljakovin kot vira dušika zadostna; potem, če pride do pomanjkanja neesencialnih aminokislin, jih telo lahko sintetizira na račun tistih, ki so prisotne v presežku. Preostalih, »esencialnih« aminokislin ni mogoče sintetizirati in jih mora telo vnesti s hrano. Za človeka so bistveni valin, levcin, izolevcin, treonin, metionin, fenilalanin, triptofan, histidin, lizin in arginin. (Čeprav se arginin lahko sintetizira v telesu, ga uvrščamo med esencialne aminokisline, ker se pri novorojenčkih in odraščajočih otrocih ne proizvaja v zadostnih količinah. Po drugi strani pa lahko nekatere od teh aminokislin iz hrane odraslim postanejo nepotrebne oseba.)Ta seznam esencialnih aminokislin je približno enak pri drugih vretenčarjih in celo žuželkah. Hranilno vrednost beljakovin običajno določimo tako, da z njimi hranimo rastoče podgane in spremljamo pridobivanje teže živali.
Hranilna vrednost beljakovin. Hranilno vrednost beljakovine določa esencialna aminokislina, ki je najbolj primanjkuje. Naj to ponazorimo s primerom. Beljakovine v našem telesu vsebujejo povprečno cca. 2 % triptofana (po teži). Recimo, da je v prehrani 10 g beljakovin, ki vsebujejo 1 % triptofana, in da je v njih dovolj drugih esencialnih aminokislin. V našem primeru je 10 g te nepopolne beljakovine v bistvu enakovrednih 5 g popolne beljakovine; preostalih 5 g lahko služi le kot vir energije. Upoštevajte, da ker aminokisline praktično niso shranjene v telesu in da lahko pride do sinteze beljakovin, morajo biti vse aminokisline prisotne hkrati, je učinek vnosa esencialnih aminokislin mogoče zaznati le, če so vse vstopijo v telo hkrati. Povprečna sestava večine živalskih beljakovin je blizu povprečni sestavi beljakovin v človeškem telesu, zato je malo verjetno, da bi se soočili s pomanjkanjem aminokislin, če je naša prehrana bogata z živili, kot so meso, jajca, mleko in sir. Vendar pa obstajajo beljakovine, kot je želatina (produkt denaturacije kolagena), ki vsebujejo zelo malo esencialnih aminokislin. Rastlinske beljakovine so, čeprav so v tem smislu boljše od želatine, revne tudi z esencialnimi aminokislinami; Še posebej imajo malo lizina in triptofana. Kljub temu povsem vegetarijanske prehrane nikakor ne moremo šteti za škodljivo, razen če zaužijemo nekoliko večjo količino rastlinskih beljakovin, ki zadostujejo za oskrbo telesa z esencialnimi aminokislinami. Največ beljakovin rastline vsebujejo v svojih semenih, predvsem v semenih pšenice in raznih stročnic. Z beljakovinami so bogati tudi mladi poganjki, na primer šparglji.Sintetične beljakovine v prehrani. Z dodajanjem majhnih količin sintetičnih esencialnih aminokislin ali z aminokislinami bogatih beljakovin nepopolnim beljakovinam, kot so koruzne beljakovine, lahko slednjim bistveno povečamo hranilno vrednost, t.j. s čimer se poveča količina zaužitih beljakovin. Druga možnost je gojenje bakterij ali kvasovk na naftnih ogljikovodikih z dodatkom nitratov ali amoniaka kot vira dušika. Tako pridobljene mikrobne beljakovine lahko služijo kot krma za perutnino ali živino ali pa jih neposredno zaužijejo ljudje. Tretja, široko uporabljena metoda uporablja fiziologijo prežvekovalcev. Pri prežvekovalcih je v začetnem delu želodca t.i. V vampu živijo posebne oblike bakterij in praživali, ki pretvarjajo nepopolne rastlinske beljakovine v popolnejše mikrobne beljakovine, te pa se po prebavi in absorpciji spremenijo v živalske beljakovine. Urea, poceni sintetična spojina, ki vsebuje dušik, se lahko doda krmi za živino. V vampu živeči mikroorganizmi uporabljajo sečninski dušik za pretvorbo ogljikovih hidratov (ki jih je v krmi veliko več) v beljakovine. Približno tretjina vsega dušika v krmi za živino lahko pride v obliki sečnine, kar v bistvu pomeni do določene mere kemično sintezo beljakovin. V ZDA ima ta metoda pomembno vlogo kot eden od načinov pridobivanja beljakovin.LITERATURA Murray R., Grenner D., Mayes P., Rodwell W. Človeška biokemija, vol. 12. M., 1993Alberts B, Bray D, Lewis J, et al. Molekularna celična biologija, vol. 13. M., 1994
Vstopnica 2. 1. Bistveni prehranski dejavniki lipidne narave. Nekateri lipidi se v človeškem telesu ne sintetizirajo in so zato bistveni prehranski dejavniki. Sem spadajo maščobne kisline z dvema ali več dvojnimi vezmi (polieni) - esencialne maščobne kisline. Nekatere od teh kislin so substrati za sintezo lokalnih hormonov – eikozanoidov (tema 8.10).
V maščobi topni vitamini opravlja različne funkcije: vitamin A sodeluje pri procesu vida, pa tudi pri rasti in diferenciaciji celic; dokazana je njegova sposobnost zaviranja rasti nekaterih vrst tumorjev; vitamin K sodeluje pri strjevanju krvi; vitamin D sodeluje pri uravnavanju metabolizma kalcija; vitamin E- antioksidant, zavira nastajanje prostih radikalov in tako preprečuje poškodbe celic zaradi peroksidacije lipidov.
Dokument
2.Zgradba in stopnje strukturne organizacije proteinov
Obstajajo štiri ravni strukturne organizacije beljakovin: primarna, sekundarna, terciarna in kvartarna. Vsak nivo ima svoje značilnosti.
Primarna struktura beljakovin
Primarna struktura beljakovin je linearna polipeptidna veriga aminokislin, povezanih s peptidnimi vezmi. Primarna struktura je najenostavnejša raven strukturne organizacije beljakovinske molekule. Visoko stabilnost mu dajejo kovalentne peptidne vezi med α-amino skupino ene aminokisline in α-karboksilno skupino druge aminokisline. [pokaži].
Če je imino skupina prolina ali hidroksiprolina vključena v tvorbo peptidne vezi, potem ima drugačno obliko [pokaži].
Ko se v celicah tvorijo peptidne vezi, se karboksilna skupina ene aminokisline najprej aktivira, nato pa se združi z amino skupino druge. Laboratorijska sinteza polipeptidov poteka približno na enak način.
Peptidna vez je ponavljajoči se fragment polipeptidne verige. Ima številne značilnosti, ki vplivajo ne le na obliko primarne strukture, temveč tudi na višje ravni organizacije polipeptidne verige:

koplanarnost - vsi atomi, vključeni v peptidno skupino, so v isti ravnini;
sposobnost obstoja v dveh resonančnih oblikah (keto ali enolna oblika);
transpozicija substituentov glede na C-N vez;
sposobnost tvorbe vodikovih vezi, vsaka od peptidnih skupin pa lahko tvori dve vodikovi vezi z drugimi skupinami, tudi s peptidnimi.
Izjema so peptidne skupine, ki vključujejo amino skupino prolina ali hidroksiprolina. Lahko tvorijo samo eno vodikovo vez (glej zgoraj). To vpliva na nastanek sekundarne strukture proteina. Polipeptidna veriga v območju, kjer se nahaja prolin ali hidroksiprolin, se zlahka upogne, saj je ne drži, kot običajno, druga vodikova vez.
Nomenklatura peptidov in polipeptidov. Ime peptidov je sestavljeno iz imen njihovih sestavnih aminokislin. Dve aminokislini tvorita dipeptid, tri tvorita tripeptid, štiri tvorita tetrapeptid itd. Vsak peptid ali polipeptidna veriga katere koli dolžine ima N-terminalno aminokislino, ki vsebuje prosto amino skupino, in C-terminalno aminokislino, ki vsebuje prosti karboksil skupina. Pri poimenovanju polipeptidov zaporedno navajamo vse aminokisline, začenši z N-terminalno, pri čemer v njihovih imenih, razen C-terminalne, zamenjamo končnico -in z -il (ker aminokisline v peptidih nimajo več karboksilna skupina, ampak karbonilna). Na primer, ime, prikazano na sl. 1 tripeptid - lev mulj fenilalana mulj treon v.
Značilnosti primarne strukture beljakovin. V hrbtenici polipeptidne verige se izmenjujejo toge strukture (ploščate peptidne skupine) z relativno mobilnimi regijami (-CHR), ki se lahko vrtijo okoli vezi. Takšne strukturne značilnosti polipeptidne verige vplivajo na njeno prostorsko razporeditev.
Sekundarna struktura beljakovin
Sekundarna struktura je način zvijanja polipeptidne verige v urejeno strukturo zaradi tvorbe vodikovih vezi med peptidnimi skupinami iste verige ali sosednjih polipeptidnih verig. Glede na konfiguracijo delimo sekundarne strukture na vijačne (α-vijačnice) in plastno-nagubane (β-struktura in križna β-oblika).


α-vijačnica. To je vrsta sekundarne beljakovinske strukture, ki izgleda kot pravilna vijačnica, ki nastane zaradi interpeptidnih vodikovih vezi znotraj ene polipeptidne verige. Model strukture α-vijačnice (slika 2), ki upošteva vse lastnosti peptidne vezi, sta predlagala Pauling in Corey. Glavne značilnosti α-vijačnice:
spiralna konfiguracija polipeptidne verige, ki ima spiralno simetrijo;
tvorba vodikovih vezi med peptidnimi skupinami vsakega prvega in četrtega aminokislinskega ostanka;
pravilnost spiralnih zavojev;
enakovrednost vseh aminokislinskih ostankov v α-vijačnici, ne glede na strukturo njihovih stranskih radikalov;
stranski radikali aminokislin ne sodelujejo pri tvorbi α-vijačnice.
Navzven je α-vijačnica videti kot rahlo raztegnjena spirala električnega štedilnika. Pravilnost vodikovih vezi med prvo in četrto peptidno skupino določa pravilnost zavojev polipeptidne verige. Višina enega obrata ali korak vijačnice α je 0,54 nm; vključuje 3,6 aminokislinskih ostankov, to pomeni, da se vsak aminokislinski ostanek premakne vzdolž osi (višina enega aminokislinskega ostanka) za 0,15 nm (0,54:3,6 = 0,15 nm), kar nam omogoča, da govorimo o enakovrednosti vseh aminokislinskih ostankov. v α-vijačnici. Obdobje pravilnosti α-vijačnice je 5 zavojev ali 18 aminokislinskih ostankov; dolžina ene periode je 2,7 nm. riž. 3. Pauling-Coreyjev model a-vijačnice
β-struktura. To je vrsta sekundarne strukture, ki ima rahlo ukrivljeno konfiguracijo polipeptidne verige in jo tvorijo interpeptidne vodikove vezi znotraj posameznih odsekov ene polipeptidne verige ali sosednjih polipeptidnih verig. Imenuje se tudi slojevito-gubana struktura. Obstajajo različne β-strukture. Omejene plastne regije, ki jih tvori ena polipeptidna veriga proteina, se imenujejo križna β oblika (kratka β struktura). Med peptidnimi skupinami zank polipeptidne verige se tvorijo vodikove vezi v navzkrižni β obliki. Druga vrsta - popolna β-struktura - je značilna za celotno polipeptidno verigo, ki ima podolgovato obliko in jo držijo interpeptidne vodikove vezi med sosednjimi vzporednimi polipeptidnimi verigami (slika 3). Ta struktura spominja na meh harmonike. Poleg tega so možne različice β-struktur: lahko jih tvorijo vzporedne verige (N-terminalni konci polipeptidnih verig so usmerjeni v isto smer) in antiparalelni (N-terminalni konci so usmerjeni v različnih smereh). Stranski radikali ene plasti so nameščeni med stranske radikale druge plasti.
V proteinih so prehodi iz α-struktur v β-strukture in nazaj možni zaradi preureditve vodikovih vezi. Namesto rednih interpeptidnih vodikovih vezi vzdolž verige (zaradi katerih je polipeptidna veriga zavita v spiralo), se vijačni odseki odvijejo in vodikove vezi zaprejo med podolgovatimi fragmenti polipeptidnih verig. Ta prehod najdemo v keratinu, beljakovini las. Pri umivanju las z alkalnimi detergenti se vijačna struktura β-keratina zlahka uniči in se spremeni v α-keratin (skodrani lasje se zravnajo).
Uničenje pravilnih sekundarnih struktur proteinov (α-vijačnic in β-struktur), po analogiji s taljenjem kristala, imenujemo "taljenje" polipeptidov. V tem primeru se vodikove vezi prekinejo in polipeptidne verige dobijo obliko naključnega prepleta. Posledično je stabilnost sekundarnih struktur določena z interpeptidnimi vodikovimi vezmi. Druge vrste vezi pri tem skoraj ne sodelujejo, z izjemo disulfidnih vezi vzdolž polipeptidne verige na mestih cisteinskih ostankov. Kratki peptidi so zaradi disulfidnih vezi sklenjeni v cikle. Mnogi proteini vsebujejo tako α-vijačne regije kot β-strukture. Naravnih proteinov, sestavljenih iz 100% α-vijačnice, skoraj ni (izjema je paramiozin, mišični protein, ki je 96-100% α-vijačnice), sintetični polipeptidi pa imajo 100% vijačnico.
Drugi proteini imajo različne stopnje zvijanja. Visoko frekvenco α-vijačnih struktur opazimo v paramiozinu, mioglobinu in hemoglobinu. Nasprotno pa je pri tripsinu, ribonukleazi, pomemben del polipeptidne verige zvit v večplastne β-strukture. Beljakovine podpornih tkiv: keratin (beljakovine dlake, volne), kolagen (beljakovine tetiv, kože), fibroin (beljakovine naravne svile) imajo β-konfiguracijo polipeptidnih verig. Različne stopnje vijačnosti polipeptidnih verig proteinov kažejo, da očitno obstajajo sile, ki delno motijo vijačnost oziroma »zlomijo« pravilno zvijanje polipeptidne verige. Razlog za to je bolj kompaktno zvijanje polipeptidne verige beljakovin v določenem volumnu, to je v terciarno strukturo.
Terciarna struktura beljakovin
Terciarna struktura proteina je način, kako je polipeptidna veriga razporejena v prostoru. Glede na obliko terciarne strukture proteine delimo predvsem na globularne in fibrilarne. Globularni proteini imajo najpogosteje elipsoidno obliko, fibrilarni (nitasti) proteini pa podolgovato (paličasto ali vretenasto).
Vendar pa konfiguracija terciarne strukture proteinov še ne daje razloga za domnevo, da imajo fibrilarni proteini le β-strukturo, globularni proteini pa α-vijačno strukturo. Obstajajo fibrilarni proteini, ki imajo vijačno, namesto večplastno, zloženo sekundarno strukturo. Na primer, α-keratin in paramiozin (protein obturatorne mišice mehkužcev), tropomiozini (proteini skeletnih mišic) pripadajo fibrilarnim proteinom (imajo paličasto obliko), njihova sekundarna struktura pa je α-vijačnica; nasprotno pa lahko globularni proteini vsebujejo veliko število β-struktur.
Spiralizacija linearne polipeptidne verige zmanjša njeno velikost za približno 4-krat; in pakiranje v terciarno strukturo jo naredi desetkrat bolj kompaktno od prvotne verige.
Vezi, ki stabilizirajo terciarno strukturo proteina. Vezi med stranskimi radikali aminokislin igrajo vlogo pri stabilizaciji terciarne strukture. Te povezave lahko razdelimo na:
močna (kovalentna) [pokaži].
šibka (polarna in van der Waalsova) [pokaži].
Številne vezi med stranskimi radikali aminokislin določajo prostorsko konfiguracijo proteinske molekule.
Značilnosti organizacije terciarne strukture beljakovin. Konformacijo terciarne strukture polipeptidne verige določajo lastnosti stranskih radikalov aminokislin, ki so v njej (ki nimajo opaznega vpliva na tvorbo primarnih in sekundarnih struktur) in mikrookolja, tj. okolju. Ko je polipeptidna veriga proteina prepognjena, želi prevzeti energijsko ugodno obliko, za katero je značilna minimalna prosta energija. Zato nepolarne R-skupine, ki se "izogibajo" vodi, tvorijo tako rekoč notranji del terciarne strukture proteina, kjer se nahaja glavni del hidrofobnih ostankov polipeptidne verige. V središču beljakovinske globule skorajda ni vodnih molekul. Polarne (hidrofilne) skupine R aminokisline se nahajajo zunaj tega hidrofobnega jedra in so obdane z molekulami vode. Polipeptidna veriga je v tridimenzionalnem prostoru zapleteno upognjena. Ko se upogne, je sekundarna vijačna konformacija motena. Veriga se »pretrga« na šibkih točkah, kjer se nahajata prolin ali hidroksiprolin, saj sta ti aminokislini bolj mobilni v verigi in tvorita samo eno vodikovo vez z drugimi peptidnimi skupinami. Drugo mesto upogiba je glicin, ki ima majhno skupino R (vodik). Zato R-skupine drugih aminokislin, ko so zložene, ponavadi zasedejo prosti prostor na mestu glicina. Številne aminokisline - alanin, levcin, glutamat, histidin - prispevajo k ohranjanju stabilnih spiralnih struktur v beljakovinah, kot so metionin, valin, izolevcin, asparaginska kislina pa spodbujajo nastanek β-struktur. V proteinski molekuli s terciarno konfiguracijo obstajajo regije v obliki α-vijačnic (helikalne), β-struktur (plastne) in naključne tuljave. Le pravilna prostorska razporeditev proteina ga naredi aktivnega; njegova kršitev vodi do sprememb v lastnostih beljakovin in izgube biološke aktivnosti.
Kvartarna struktura beljakovin
Beljakovine, sestavljene iz ene polipeptidne verige, imajo samo terciarno strukturo. Sem spadajo mioglobin - beljakovina mišičnega tkiva, ki sodeluje pri vezavi kisika, številni encimi (lizocim, pepsin, tripsin itd.). Nekateri proteini pa so zgrajeni iz več polipeptidnih verig, od katerih ima vsaka terciarno strukturo. Za takšne proteine je bil uveden koncept kvartarne strukture, ki je organizacija več polipeptidnih verig s terciarno strukturo v eno samo funkcionalno proteinsko molekulo. Takšen protein s kvartarno strukturo imenujemo oligomer, njegove polipeptidne verige s terciarno strukturo pa protomeri ali podenote (slika 4).

Na kvartarni ravni organizacije proteini ohranijo osnovno konfiguracijo terciarne strukture (globularno ali fibrilarno). Na primer, hemoglobin je protein s kvartarno strukturo in je sestavljen iz štirih podenot. Vsaka od podenot je globularni protein in na splošno ima tudi hemoglobin globularno konfiguracijo. Proteini las in volne – keratini, ki so po terciarni strukturi povezani s fibrilarnimi proteini, imajo fibrilarno konformacijo in kvartarno strukturo.
Stabilizacija kvartarne strukture beljakovin. Vse beljakovine, ki imajo kvartarno strukturo, so izolirane v obliki posameznih makromolekul, ki ne razpadejo na podenote. Stiki med površinami podenot so mogoči le zaradi polarnih skupin aminokislinskih ostankov, saj med tvorbo terciarne strukture vsake od polipeptidnih verig stranski radikali nepolarnih aminokislin (ki sestavljajo večino vse proteinogene aminokisline) so skrite znotraj podenote. Med njihovimi polarnimi skupinami se tvorijo številne ionske (solne), vodikove in v nekaterih primerih disulfidne vezi, ki trdno držijo podenote v obliki organiziranega kompleksa. Uporaba snovi, ki prekinjajo vodikove vezi, ali snovi, ki reducirajo disulfidne mostove, povzroči razgradnjo protomerov in uničenje kvartarne strukture proteina. V tabeli 1 povzema podatke o vezeh, ki stabilizirajo različne nivoje organizacije proteinske molekule [pokaži].
Značilnosti strukturne organizacije nekaterih fibrilarnih proteinov
Strukturna organizacija fibrilarnih proteinov ima številne značilnosti v primerjavi s globularnimi proteini. Te značilnosti lahko vidimo na primeru keratina, fibroina in kolagena. Keratini obstajajo v α- in β-konformacijah. α-Keratini in fibroin imajo slojevito-zloženo sekundarno strukturo, vendar so v keratinu verige vzporedne, v fibroinu pa antiparalelne (glej sliko 3); Poleg tega keratin vsebuje medverižne disulfidne vezi, fibroin pa jih nima. Pretrganje disulfidnih vezi povzroči ločitev polipeptidnih verig v keratinih. Nasprotno, tvorba največjega števila disulfidnih vezi v keratinih zaradi izpostavljenosti oksidantom ustvari močno prostorsko strukturo. Na splošno je pri fibrilarnih proteinih, za razliko od globularnih proteinov, včasih težko natančno razlikovati med različnimi nivoji organizacije. Če sprejmemo (kot pri globularnem proteinu), da mora biti terciarna struktura oblikovana s polaganjem ene polipeptidne verige v prostoru, kvartarna struktura pa z več verigami, potem je v fibrilarnih proteinih več polipeptidnih verig vključenih že med tvorbo sekundarne strukture. . Tipičen primer fibrilarnega proteina je kolagen, ki je eden najpogostejših proteinov v človeškem telesu (približno 1/3 mase vseh proteinov). Najdemo ga v tkivih, ki imajo visoko trdnost in majhno razteznost (kosti, kite, koža, zobje itd.). V kolagenu je tretjina aminokislinskih ostankov glicin, približno četrtina ali malo več pa prolin ali hidroksiprolin.

Izolirana polipeptidna veriga kolagena (primarna struktura) izgleda kot prekinjena črta. Vsebuje približno 1000 aminokislin in ima molekulsko maso približno 10 5 (slika 5, a, b). Polipeptidna veriga je zgrajena iz ponavljajočega se tria aminokislin (tripleta) naslednje sestave: gly-A-B, kjer sta A in B kateri koli aminokislini razen glicina (najpogosteje prolin in hidroksiprolin). Kolagenske polipeptidne verige (ali α-verige) med tvorbo sekundarnih in terciarnih struktur (sl. 5, c in d) ne morejo proizvesti tipičnih α-vijačnic s vijačno simetrijo. Prolin, hidroksiprolin in glicin (antihelikalne aminokisline) to motijo. Zato tri α-verige tvorijo tako rekoč zavite spirale, kot tri niti, ki se ovijajo okoli valja. Tri spiralne verige α tvorijo ponavljajočo se kolagensko strukturo, imenovano tropokolagen (slika 5d). Tropokolagen je po svoji organizaciji terciarna struktura kolagena. Ploščati obroči prolina in hidroksiprolina, ki se redno izmenjujejo vzdolž verige, ji dajejo togost, prav tako medverižne vezi med α-verigami tropokolagena (zato je kolagen odporen na raztezanje). Tropokolagen je v bistvu podenota kolagenskih vlaken. Polaganje tropokolagenskih podenot v kvaterno strukturo kolagena poteka postopoma (slika 5e).
Stabilizacija kolagenskih struktur nastane zaradi medverižnih vodikovih, ionskih in van der Waalsovih vezi ter majhnega števila kovalentnih vezi.
α-verige kolagena imajo različne kemijske strukture. Obstajajo različne vrste α 1 verig (I, II, III, IV) in α 2 verig. Glede na to, katere α 1 - in α 2 -verige sodelujejo pri tvorbi triverižne vijačnice tropokolagena, ločimo štiri vrste kolagena:
prvi tip - dve α 1 (I) in ena α 2 veriga;
druga vrsta - tri verige α 1 (II);
tretji tip - tri verige α 1 (III);
četrti tip - tri verige α 1 (IV).
Najpogostejši kolagen je prva vrsta: najdemo ga v kostnem tkivu, koži, kitah; kolagen tipa 2 se nahaja v hrustančnem tkivu itd. Ena vrsta tkiva lahko vsebuje različne vrste kolagena.
Urejena agregacija kolagenskih struktur, njihova togost in inertnost zagotavljajo visoko trdnost kolagenskih vlaken. Beljakovine kolagena vsebujejo tudi komponente ogljikovih hidratov, torej so beljakovinsko-ogljikohidratni kompleksi.
Kolagen je zunajcelični protein, ki ga tvorijo celice vezivnega tkiva v vseh organih. Zato se s poškodbo kolagena (ali motnjami njegove tvorbe) pojavijo večkratne kršitve podpornih funkcij vezivnega tkiva organov.
Polipeptidna veriga alfa se konča s kombinacijo aminokislin valin-levcin, polipeptidna veriga beta pa s kombinacijo valin-histidin-levcin. Polipeptidne verige alfa in beta v molekuli hemoglobina niso razporejene linearno, to je primarna struktura. Zaradi obstoja intramolekularnih sil so polipeptidne verige zvite v obliki alfa-vijačnice (sekundarne strukture), značilne za proteine. Sama vijačnica alfa-heliksa se za vsako alfa in beta polipeptidno verigo prostorsko upogne in tvori pleksuse jajčaste oblike (terciarna struktura). Posamezni deli vijačnic alfa-vijačnice polipeptidnih verig so označeni z latiničnimi črkami od A do H. Vse štiri terciarno ukrivljene alfa in beta polipeptidne verige se prostorsko nahajajo v določenem razmerju – kvartarni strukturi. Ne povezujejo jih prave kemične vezi, ampak medmolekularne sile.
Izkazalo se je, da imamo ljudje tri glavne vrste normalnega hemoglobina: embrionalni - U, fetalni - F in odrasli hemoglobin - A. HbU (imenovan po začetni črki besede uterus) se pojavi v zarodku med 7. in 12. tednom življenja, nato izgine in pojavi se fetalni hemoglobin, ki je po tretjem mesecu glavni hemoglobin ploda. Nato se postopoma pojavi navaden hemoglobin odraslega, imenovan HbA, po začetni črki angleške besede »adult«. Količina fetalnega hemoglobina postopoma upada, tako da je v trenutku rojstva 80% hemoglobina HbA in le 20% HbF. Po rojstvu se fetalni hemoglobin še naprej znižuje in do 2–3 let življenja znaša le 1–2 %. Enaka količina fetalnega hemoglobina je pri odraslem. Količina HbF, ki presega 2%, velja za patologijo pri odraslih in otrocih, starejših od 3 let.
Poleg normalnih vrst hemoglobina je trenutno znanih več kot 50 patoloških različic. Najprej so jih poimenovali z latinskimi črkami. Črka B pri označevanju vrst hemoglobina ni, saj je prvotno označevala HbS.
Hemoglobin (Hb)- kromoprotein, ki je prisoten v rdečih krvničkah in sodeluje pri transportu kisika do tkiv. Hemoglobin pri odraslih se imenuje hemoglobin A (Hb A). Njegova molekulska masa je približno 65.000 Da. Molekula Hb A ima kvartarno strukturo in vključuje štiri podenote - polipeptidne verige (označene z α1, α2, β1 in β2, od katerih je vsaka povezana s hemom.
Ne pozabite, da je hemoglobin alosterični protein; njegove molekule se lahko reverzibilno spreminjajo iz ene konformacije v drugo. To spremeni afiniteto proteina za ligande. Konformacija z najmanjšo afiniteto do liganda se imenuje napeta ali T-konformacija. Konformacija z največjo afiniteto do liganda se imenuje sproščena ali R-konformacija.
R- in T-konformacije molekule hemoglobina sta v stanju dinamičnega ravnovesja:
Različni okoljski dejavniki lahko to ravnotežje premaknejo v eno ali drugo smer. Alosterični regulatorji, ki vplivajo na afiniteto Hb za O2, so: 1) kisik; 2) koncentracija H+ (srednji pH); 3) ogljikov dioksid (CO2); 4) 2,3-difosfoglicerat (DPG). Pritrditev molekule kisika na eno od podenot hemoglobina spodbuja prehod napete konformacije v sproščeno in poveča afiniteto do kisika drugih podenot iste molekule hemoglobina. Ta pojav se imenuje kooperativni učinek. Kompleksno naravo vezave hemoglobina na kisik odraža krivulja nasičenosti hemoglobina z O2, ki ima obliko črke S (slika 3.1).

Slika 3.1. Krivulji nasičenosti mioglobina (1) in hemoglobina (2) s kisikom.
Molekularne oblike hemoglobina se med seboj razlikujejo po strukturi polipeptidnih verig. Primer takšne sorte hemoglobina, ki obstaja v fizioloških pogojih, je fetalni hemoglobin (HbF), prisoten v krvi v embrionalni fazi človekovega razvoja. Za razliko od HbA njegova molekula vsebuje 2 α- in 2 γ-verigi (to pomeni, da so β-verige nadomeščene z γ-verigami). Takšen hemoglobin ima večjo afiniteto do kisika. To je tisto, kar omogoča, da zarodek prejema kisik iz materine krvi skozi posteljico. Kmalu po rojstvu se HbF v otrokovi krvi nadomesti s HbA.
Primer nenormalnega ali patološkega hemoglobina je že omenjeni (glej 2.4.) hemoglobin S, ki ga najdemo pri bolnikih z anemijo srpastih celic. Kot že veste, se od hemoglobina A razlikuje po tem, da v β-verigah nadomešča glutamat z valinom. Ta aminokislinska zamenjava povzroči zmanjšanje topnosti HbS v vodi in zmanjšanje njegove afinitete za O2.
Kot veste, so beljakovine osnova za nastanek življenja na našem planetu. Toda koacervatna kapljica, sestavljena iz peptidnih molekul, je postala osnova za nastanek živih bitij. To ni dvoma, saj analiza notranje sestave katerega koli predstavnika biomase kaže, da so te snovi prisotne v vsem: rastlinah, živalih, mikroorganizmih, glivah, virusih. Poleg tega so zelo raznolike in makromolekularne narave.
Te strukture imajo štiri imena, vsa so sinonimi:
- beljakovine;
- beljakovine;
- polipeptidi;
- peptidi.
Beljakovinske molekule
Njihovo število je res nešteto. V tem primeru lahko vse beljakovinske molekule razdelimo v dve veliki skupini:
- preprosti - sestavljeni so samo iz aminokislinskih zaporedij, povezanih s peptidnimi vezmi;
- kompleks - za strukturo in strukturo proteina so značilne dodatne protolitične (prostetske) skupine, imenovane tudi kofaktorji.
Hkrati imajo kompleksne molekule tudi svojo klasifikacijo.
Gradacija kompleksnih peptidov
- Glikoproteini so tesno povezane spojine beljakovin in ogljikovih hidratov. V strukturo molekule so vtkane protetične skupine mukopolisaharidov.
- Lipoproteini so kompleksna spojina beljakovin in lipidov.
- Metaloproteini - kovinski ioni (železo, mangan, baker in drugi) delujejo kot protetična skupina.
- Nukleoproteini so povezava med beljakovinami in nukleinskimi kislinami (DNA, RNA).
- Fosfoproteini - konformacija proteina in ostanka ortofosforne kisline.
- Kromoproteini so zelo podobni metaloproteinom, vendar je element, ki je del protetične skupine, celoten barvni kompleks (rdeča - hemoglobin, zelena - klorofil itd.).
V vsaki obravnavani skupini so zgradba in lastnosti beljakovin drugačne. Funkcije, ki jih opravljajo, se razlikujejo tudi glede na vrsto molekule.

Kemična struktura beljakovin
S tega vidika so beljakovine dolga masivna veriga aminokislinskih ostankov, ki so med seboj povezani s posebnimi vezmi, imenovanimi peptidne vezi. Veje, imenovane radikali, segajo iz stranskih struktur kislin. To molekularno strukturo je odkril E. Fischer na začetku 21. stoletja.
Kasneje so proteine, zgradbo in funkcije proteinov podrobneje proučevali. Postalo je jasno, da obstaja le 20 aminokislin, ki tvorijo strukturo peptida, vendar jih je mogoče kombinirati na različne načine. Od tod tudi raznolikost polipeptidnih struktur. Poleg tega so beljakovine v procesu življenja in opravljanju svojih funkcij sposobne opraviti številne kemične transformacije. Posledično spremenijo strukturo in pojavi se popolnoma nova vrsta povezave.
Za prekinitev peptidne vezi, to je za motnje beljakovin in strukture verig, morate izbrati zelo stroge pogoje (visoke temperature, kisline ali alkalije, katalizator). To je posledica visoke trdnosti v molekuli, in sicer v peptidni skupini.

Odkrivanje strukture beljakovin v laboratoriju se izvaja z biuretno reakcijo - izpostavljenostjo sveže oborjenemu polipeptidu (II). Kompleks peptidne skupine in bakrovega iona daje svetlo vijolično barvo.
Obstajajo štiri glavne strukturne organizacije, od katerih ima vsaka svoje strukturne značilnosti beljakovin.
Ravni organiziranosti: primarna struktura
Kot je navedeno zgoraj, je peptid zaporedje aminokislinskih ostankov z ali brez vključkov, koencimov. Torej, primarna je struktura molekule, ki je naravna, naravne, resnično aminokisline, povezane s peptidnimi vezmi, in nič več. To je polipeptid z linearno strukturo. Še več, strukturne značilnosti beljakovin te vrste so, da je takšna kombinacija kislin odločilna za opravljanje funkcij beljakovinske molekule. Zahvaljujoč prisotnosti teh lastnosti je mogoče ne samo identificirati peptid, ampak tudi napovedati lastnosti in vlogo popolnoma novega, še neodkritega. Primeri peptidov z naravno primarno strukturo so insulin, pepsin, kimotripsin in drugi.

Sekundarna konformacija
Struktura in lastnosti beljakovin v tej kategoriji se nekoliko razlikujejo. Takšna struktura se lahko najprej oblikuje po naravi ali ko je primarna izpostavljena hudi hidrolizi, temperaturi ali drugim pogojem.
Ta konformacija ima tri različice:
- Gladki, pravilni, stereopravilni zavoji, zgrajeni iz aminokislinskih ostankov, ki se zvijajo okoli glavne osi povezave. Skupaj jih držijo samo tisti, ki nastanejo med kisikom ene peptidne skupine in vodikom druge. Poleg tega se struktura šteje za pravilno zaradi dejstva, da se zavoji enakomerno ponavljajo vsake 4 povezave. Takšna struktura je lahko levo ali desno. Toda v večini znanih proteinov prevladuje desnosučni izomer. Takšne konformacije običajno imenujemo alfa strukture.
- Sestava in struktura beljakovin naslednje vrste se od prejšnje razlikuje po tem, da se vodikove vezi ne tvorijo med ostanki, ki mejijo na eno stran molekule, temveč med bistveno oddaljenimi in na precej veliki razdalji. Zaradi tega ima celotna struktura več valovitih, kačam podobnih polipeptidnih verig. Beljakovine morajo imeti eno lastnost. Struktura aminokislin na vejah naj bo čim krajša, kot na primer glicin ali alanin. To vrsto sekundarne konformacije imenujemo beta plošče zaradi njihove sposobnosti, da se držijo skupaj in tvorijo skupno strukturo.
- Biologija tretjo vrsto beljakovinske strukture imenuje kompleksne, heterogeno razpršene, neurejene fragmente, ki nimajo stereopravilnosti in lahko spreminjajo strukturo pod vplivom zunanjih pogojev.
Primeri beljakovin, ki imajo naravno sekundarno strukturo, niso bili identificirani.

Terciarno izobraževanje
To je precej zapletena konformacija, imenovana "globula". Kaj je ta beljakovina? Njegova struktura temelji na sekundarni strukturi, vendar se dodajajo nove vrste interakcij med atomi skupin in zdi se, da se celotna molekula zvija, s čimer se osredotoča na dejstvo, da so hidrofilne skupine usmerjene v globulo, hidrofobne pa tiste navzven.
To pojasnjuje naboj proteinske molekule v koloidnih raztopinah vode. Katere vrste interakcij so tukaj prisotne?
- Vodikove vezi – ostanejo nespremenjene med istimi deli kot v sekundarni strukturi.
- interakcije – nastanejo, ko se polipeptid raztopi v vodi.
- Med različno nabitimi skupinami aminokislinskih ostankov (radikalov) nastanejo ionske privlačnosti.
- Kovalentne interakcije - lahko nastanejo med specifičnimi kislimi mesti - molekulami cisteina ali bolje rečeno njihovimi repi.
Tako lahko sestavo in strukturo proteinov s terciarno strukturo opišemo kot polipeptidne verige, zvite v globule, ki obdržijo in stabilizirajo svojo konformacijo zaradi različnih vrst kemičnih interakcij. Primeri takih peptidov: fosfoglicerat kenaza, tRNA, alfa-keratin, fibroin svile in drugi.
Kvartarna struktura
To je ena najbolj zapletenih globul, ki jih tvorijo beljakovine. Struktura in funkcije beljakovin te vrste so zelo večplastne in specifične.
Kakšna je ta konformacija? To je več (v nekaterih primerih na desetine) velikih in majhnih polipeptidnih verig, ki nastajajo neodvisno druga od druge. Potem pa se zaradi istih interakcij, ki smo jih upoštevali za terciarno strukturo, vsi ti peptidi zvijajo in prepletajo drug z drugim. Na ta način dobimo kompleksne konformacijske globule, ki lahko vsebujejo kovinske atome, lipidne skupine in ogljikove hidrate. Primeri takih proteinov: DNA polimeraza, beljakovinska ovojnica virusa tobaka, hemoglobin in drugi.

Vse peptidne strukture, ki smo jih pregledali, imajo lastne metode identifikacije v laboratoriju, ki temeljijo na sodobnih zmožnostih uporabe kromatografije, centrifugiranja, elektronske in optične mikroskopije ter visokih računalniških tehnologij.
Opravljene funkcije
Struktura in funkcije beljakovin so med seboj tesno povezane. To pomeni, da ima vsak peptid specifično vlogo, edinstveno in specifično. Obstajajo tudi takšni, ki so sposobni izvajati več pomembnih operacij hkrati v eni živi celici. Vendar pa je mogoče v posplošeni obliki izraziti glavne funkcije beljakovinskih molekul v živih organizmih:
- Zagotavljanje gibanja. Enocelični organizmi ali organeli ali nekatere vrste celic so sposobni gibanja, krčenja in gibanja. To zagotavljajo beljakovine, ki sestavljajo strukturo njihovega motoričnega aparata: cilije, flagele in citoplazmatsko membrano. Če govorimo o celicah, ki niso sposobne gibanja, lahko beljakovine prispevajo k njihovemu krčenju (mišični miozin).
- Prehranska ali rezervna funkcija. Gre za kopičenje beljakovinskih molekul v jajcih, zarodkih in semenih rastlin za nadaljnjo dopolnitev manjkajočih hranil. Pri razgradnji peptidov nastanejo aminokisline in biološko aktivne snovi, ki so potrebne za normalen razvoj živih organizmov.
- Energijska funkcija. Poleg ogljikovih hidratov lahko telesu dajejo moč tudi beljakovine. Pri razpadu 1 g peptida se sprosti 17,6 kJ koristne energije v obliki adenozin trifosforne kisline (ATP), ki se porabi za vitalne procese.
- Signalizacija je sestavljena iz skrbnega spremljanja potekajočih procesov in prenosa signalov od celic do tkiv, od njih do organov, od slednjih do sistemov itd. Tipičen primer je insulin, ki strogo določa količino glukoze v krvi.
- Funkcija receptorja. Izvaja se tako, da spremenimo konformacijo peptida na eni strani membrane in vključimo drugi konec v prestrukturiranje. Hkrati se prenašajo signal in potrebne informacije. Najpogosteje so takšni proteini vgrajeni v citoplazemske membrane celic in izvajajo strog nadzor nad vsemi snovmi, ki prehajajo skozi njih. Zagotavljajo tudi informacije o kemičnih in fizikalnih spremembah v okolju.
- Transportna funkcija peptidov. Izvajajo ga kanalski proteini in transportni proteini. Njihova vloga je očitna – transport potrebnih molekul na mesta z nizko koncentracijo iz delov z visoko koncentracijo. Tipičen primer je transport kisika in ogljikovega dioksida skozi organe in tkiva s pomočjo beljakovine hemoglobina. Izvajajo tudi dostavo spojin z nizko molekulsko maso skozi celično membrano v notranjost.
- Strukturna funkcija. Ena najpomembnejših funkcij, ki jih opravljajo beljakovine. Strukturo vseh celic in njihovih organelov zagotavljajo peptidi. Tako kot okvir določajo obliko in strukturo. Poleg tega ga podpirajo in po potrebi spreminjajo. Zato vsi živi organizmi potrebujejo za rast in razvoj beljakovine v svoji prehrani. Takšni peptidi vključujejo elastin, tubulin, kolagen, aktin, keratin in druge.
- Katalitska funkcija. Izvajajo jo encimi. Številne in raznolike pospešujejo vse kemične in biokemične reakcije v telesu. Brez njihove udeležbe bi navadno jabolko v želodcu lahko prebavili v samo dveh dneh in pri tem najverjetneje zgnilo. Pod vplivom katalaze, peroksidaze in drugih encimov se ta proces zgodi v dveh urah. Na splošno se zahvaljujoč tej vlogi beljakovin izvajata anabolizem in katabolizem, to je plastična in

Zaščitna vloga
Obstaja več vrst groženj, pred katerimi so proteini zasnovani za zaščito telesa.
Prvič, travmatični reagenti, plini, molekule, snovi različnih spektrov delovanja. Peptidi lahko kemično sodelujejo z njimi, jih pretvorijo v neškodljivo obliko ali jih preprosto nevtralizirajo.
Drugič, fizična grožnja zaradi ran - če se beljakovina fibrinogen na mestu poškodbe pravočasno ne pretvori v fibrin, se kri ne strdi, kar pomeni, da ne bo prišlo do zamašitve. Potem boste, nasprotno, potrebovali peptidni plazmin, ki lahko raztopi strdek in obnovi prehodnost žile.
Tretjič, grožnja imuniteti. Struktura in pomen beljakovin, ki tvorijo imunsko obrambo, je izjemno pomembna. Protitelesa, imunoglobulini, interferoni - vse to so pomembni in pomembni elementi človeškega limfnega in imunskega sistema. Vsak tuj delec, škodljiva molekula, odmrli del celice ali celotna struktura je predmet takojšnje preiskave s peptidno spojino. Zato se lahko oseba samostojno, brez pomoči zdravil, vsak dan zaščiti pred okužbami in preprostimi virusi.
Fizične lastnosti
Struktura celičnega proteina je zelo specifična in odvisna od opravljene funkcije. Toda fizikalne lastnosti vseh peptidov so podobne in se skrčijo na naslednje značilnosti.
- Teža molekule je do 1.000.000 Daltonov.
- Koloidni sistemi nastanejo v vodni raztopini. Tam struktura pridobi naboj, ki se lahko spreminja glede na kislost okolja.
- Ko so izpostavljeni težkim pogojem (obsevanje, kislina ali alkalija, temperatura itd.), se lahko premaknejo na druge ravni konformacije, to je denaturacijo. Ta proces je nepovraten v 90% primerov. Vendar pa obstaja tudi obratni premik - renaturacija.
To so glavne lastnosti fizikalnih značilnosti peptidov.