Ce sont des composés organiques de haut poids moléculaire, des biopolymères, construits à partir de 20 types de résidus d'acides aminés L-?-liés dans une certaine séquence en longues chaînes. Le poids moléculaire des protéines varie de 5 000 à 1 million. Le nom « blancs » a été donné pour la première fois à la substance des œufs d’oiseaux, qui coagule lorsqu’elle est chauffée en une masse blanche insoluble. Le terme a ensuite été étendu à d’autres substances ayant des propriétés similaires isolées d’animaux et de plantes.
Riz. 1. Les biopolymères les plus complexes sont les protéines. Leurs macromolécules sont constituées de monomères, qui sont des acides aminés. Chaque acide aminé possède deux groupes fonctionnels : un groupe carboxyle et un groupe amino. Toute la diversité des protéines est créée grâce à différentes combinaisons de 20 acides aminés.
Les protéines prédominent sur tous les autres composés présents dans les organismes vivants, représentant généralement plus de la moitié de leur poids sec. On suppose qu'il existe plusieurs milliards de protéines individuelles dans la nature (par exemple, plus de 3 000 protéines différentes sont présentes dans la seule bactérie E. coli).
Les protéines jouent un rôle clé dans les processus vitaux de tout organisme. Les protéines comprennent des enzymes, avec la participation desquelles toutes les transformations chimiques se produisent dans la cellule (métabolisme) ; ils contrôlent l'action des gènes ; avec leur participation, l'action des hormones est réalisée, le transport transmembranaire est effectué, y compris la génération de l'influx nerveux. Ils font partie intégrante du système immunitaire (immunoglobulines) et du système de coagulation, constituent la base des os et du tissu conjonctif et participent à la transformation et à l'utilisation de l'énergie.
Histoire de la recherche sur les protéines
Les premières tentatives d’isolement de protéines remontent au XVIIIe siècle. Au début du XIXe siècle, paraissent les premiers travaux sur l’étude chimique des protéines. Les scientifiques français Joseph Louis Gay-Lussac et Louis Jacques Thénard ont tenté d'établir la composition élémentaire des protéines provenant de différentes sources, ce qui a marqué le début d'études analytiques systématiques, grâce auxquelles il a été conclu que toutes les protéines sont similaires dans l'ensemble des éléments inclus dans leur composition. En 1836, le chimiste néerlandais G. J. Mulder proposa la première théorie de la structure des substances protéiques, selon laquelle toutes les protéines possèdent un certain radical hypothétique (C 40 H 62 N 10 O 12), associé dans diverses proportions à des atomes de soufre et de phosphore. Il a appelé ce radical « protéine » (du grec protéine – premier, principal). La théorie de Mulder a contribué à accroître l'intérêt pour l'étude des protéines et à améliorer les méthodes de chimie des protéines. Des techniques d'isolement des protéines par extraction avec des solutions de sels neutres ont été développées et des protéines ont été obtenues pour la première fois sous forme cristalline (certaines protéines végétales). Pour analyser les protéines, ils ont commencé à utiliser leur digestion préalable avec des acides et des alcalis.
Dans le même temps, une attention croissante a commencé à être accordée à l’étude de la fonction des protéines. Jens Jakob Berzelius fut le premier à suggérer en 1835 qu'ils jouent le rôle de biocatalyseurs. Bientôt, des enzymes protéolytiques furent découvertes - la pepsine (T. Schwann, 1836) et la trypsine (L. Corvisart, 1856), qui attirèrent l'attention sur la physiologie de la digestion et l'analyse des produits formés lors de la dégradation des nutriments. Des études plus approfondies sur la structure des protéines et des travaux sur la synthèse chimique des peptides ont abouti à l'émergence de l'hypothèse peptidique, selon laquelle toutes les protéines sont construites à partir d'acides aminés. À la fin du XIXe siècle, la plupart des acides aminés constituant les protéines étaient étudiés.
Au début du XXe siècle, le chimiste allemand Emil Hermann Fischer fut le premier à utiliser les méthodes de la chimie organique pour étudier les protéines et démontra que les protéines sont constituées d'acides β-aminés liés les uns aux autres par une liaison amide (peptide). Plus tard, grâce à l'utilisation de méthodes d'analyse physico-chimiques, la masse moléculaire de nombreuses protéines a été déterminée, la forme sphérique des protéines globulaires a été établie, une analyse par diffraction des rayons X des acides aminés et des peptides a été réalisée et des méthodes d'analyse chromatographique ont été réalisées. développé (voir chromatographie).
La première hormone protéique a été isolée (Frederick Grant Banting, John James Rickard McLeod, 1922), la présence de gammaglobulines dans les anticorps a été prouvée et la fonction enzymatique de la protéine musculaire myosine a été décrite (Vladimir Aleksandrovich Engelhardt, M. N. Lyubimova, 1939) . Pour la première fois, des enzymes ont été obtenues sous forme cristalline - uréase (J.B. Saliner, 1926), pepsine (J.H. Nortron, 1929), lysozyme (E.P. Abraham, Robert Robinson, 1937).

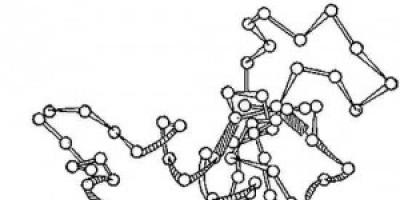
Riz. 2. Schéma de la structure tridimensionnelle de l'enzyme lysozyme. Cercles - acides aminés ; brins - liaisons peptidiques; les rectangles ombrés sont des liaisons disulfure. Des sections spiralées et allongées de la chaîne polypeptidique sont visibles.
Dans les années 1950, l'organisation à trois niveaux des molécules protéiques a été prouvée : la présence d'une structure primaire, secondaire et tertiaire ; créé un analyseur automatique d'acides aminés (Stanford Moore, William Howard Stein, 1950). Dans les années 60, des tentatives ont été faites pour synthétiser chimiquement des protéines (insuline, ribonucléase). Les méthodes d'analyse par diffraction des rayons X ont été considérablement améliorées ; un appareil a été créé - un séquenceur (P. Edman, G. Begg, 1967), qui a permis de déterminer la séquence d'acides aminés dans une chaîne polypeptidique. La conséquence en a été l’établissement de la structure de plusieurs centaines de protéines provenant de diverses sources. Parmi eux figurent les enzymes protéolytiques (pepsine, trypsine, chymotrypsine, subtilisine, carboxypeptidases), les myoglobines, les hémoglobines, les cytochromes, les lysozymes, les immunoglobulines, les histones, les neurotoxines, les protéines de l'enveloppe virale, les hormones protéines-peptides. En conséquence, des conditions préalables sont apparues pour résoudre des problèmes urgents en enzymologie, en immunologie, en endocrinologie et dans d'autres domaines de la chimie biologique.
À la fin du XXe siècle, des progrès significatifs ont été réalisés dans l'étude du rôle des protéines dans la synthèse matricielle des biopolymères, dans la compréhension des mécanismes de leur action dans divers processus vitaux des organismes et dans l'établissement du lien entre leur structure et leur fonction. L'amélioration des méthodes de recherche et l'émergence de nouvelles méthodes de séparation des protéines et des peptides étaient d'une grande importance.
Le développement d'une méthode efficace d'analyse de la séquence des nucléotides dans les acides nucléiques a permis de simplifier et d'accélérer considérablement la détermination de la séquence d'acides aminés dans les protéines. Cela s'est avéré possible car l'ordre des acides aminés dans une protéine est déterminé par la séquence de nucléotides dans le gène codant pour cette protéine (fragment). Par conséquent, connaissant la disposition des nucléotides dans ce gène et le code génétique, on peut prédire avec précision dans quel ordre se trouvent les acides aminés dans la chaîne polypeptidique d'une protéine. Parallèlement aux progrès dans l'analyse structurale des protéines, des résultats significatifs ont été obtenus dans l'étude de leur organisation spatiale, des mécanismes de formation et d'action de complexes supramoléculaires, notamment les ribosomes et autres organites cellulaires, la chromatine, les virus, etc.
Structure des protéines
Presque toutes les protéines sont constituées de 20 acides aminés α appartenant à la série L et sont les mêmes dans presque tous les organismes. Les acides aminés des protéines sont reliés les uns aux autres par une liaison peptidique -CO-NH-, qui est formée par le groupe carboxyle et -amino de résidus d'acides aminés voisins : deux acides aminés forment un dipeptide dans lequel le carboxyle terminal (-COOH) et le groupe amino (H 2 N-) restent libres, auxquels de nouveaux acides aminés peuvent être ajoutés pour former une chaîne polypeptidique.
La section de la chaîne sur laquelle se trouve le groupe terminal H 2 N est appelée N-terminal, et la partie opposée est appelée C-terminal. La grande variété de protéines est déterminée par la séquence de leur disposition et le nombre de résidus d'acides aminés qu'elles contiennent. Bien qu'il n'y ait pas de distinction claire, les chaînes courtes sont généralement appelées peptides ou oligopeptides (de oligo...), et les polypeptides (protéines) sont généralement compris comme des chaînes composées de 50 ou plus. Les protéines les plus courantes sont celles contenant 100 à 400 résidus d'acides aminés, mais il existe également celles dont les molécules sont formées de 1 000 résidus ou plus. Les protéines peuvent être constituées de plusieurs chaînes polypeptidiques. Dans ces protéines, chaque chaîne polypeptidique est appelée une sous-unité.
Structure spatiale des protéines

Riz. 3. Les protéines de tous les organismes sont constituées de 20 types d'acides aminés. Chaque protéine est caractérisée par un certain assortiment et un certain rapport quantitatif d'acides aminés. Dans les molécules protéiques, les acides aminés sont reliés les uns aux autres par des liaisons peptidiques (- CO - NH -) dans une séquence linéaire, constituant ce qu'on appelle la structure primaire de la protéine. Ligne supérieure - acides aminés libres avec groupes latéraux R1, R2, R3 ; En fin de compte, les acides aminés sont reliés par des liaisons peptidiques.
La chaîne polypeptidique est capable de former et de maintenir spontanément une structure spatiale particulière. En fonction de la forme des molécules protéiques, les protéines sont divisées en fibrillaires et globulaires. Dans les protéines globulaires, une ou plusieurs chaînes polypeptidiques sont repliées en une structure sphérique compacte, ou globule. Ces protéines sont généralement très solubles dans l’eau. Ceux-ci comprennent presque toutes les enzymes, les protéines de transport sanguin et de nombreuses protéines de stockage. Les protéines fibrillaires sont des molécules filiformes maintenues ensemble par des liaisons croisées et forment de longues fibres ou des structures en couches. Ils ont une résistance mécanique élevée, sont insolubles dans l'eau et remplissent principalement des fonctions structurelles et protectrices. Les représentants typiques de ces protéines sont les kératines des cheveux et de la laine, la fibroïne de soie et le collagène des tendons.
L’ordre des acides aminés liés de manière covalente dans une chaîne polypeptidique est appelé séquence d’acides aminés, ou structure primaire des protéines. La structure primaire de chaque protéine, codée par le gène correspondant, est constante et porte toutes les informations nécessaires à la formation de structures de niveau supérieur. Le nombre potentiel de protéines pouvant être formées à partir de 20 acides aminés est pratiquement illimité.
En raison de l'interaction des groupes latéraux de résidus d'acides aminés, des sections individuelles relativement petites de la chaîne polypeptidique prennent l'une ou l'autre conformation (type de repliement), connue sous le nom de structure secondaire des protéines. Ses éléments les plus caractéristiques sont l'hélice α et la structure β qui se répètent périodiquement. La structure secondaire est très stable. Puisqu’elle est largement déterminée par la séquence d’acides aminés de la région protéique correspondante, il devient possible de la prédire avec un certain degré de probabilité. Le terme « ?-hélice » a été introduit par le biochimiste, physicien et chimiste américain Linus Carl Pauling, qui a décrit l'arrangement de la chaîne polypeptidique dans la protéine ?-kératine sous la forme d'une hélice droite (l'?-hélice peut être comparé à un cordon téléphonique). Pour chaque tour d’une telle hélice dans une protéine, il y a 3,6 résidus d’acides aminés. Cela signifie que le groupe -C = O d'une liaison peptidique forme une liaison hydrogène avec le groupe -NH d'une autre liaison peptidique, quatre résidus d'acides aminés distants du premier. En moyenne, chaque région d'hélice α comprend jusqu'à 15 acides aminés, ce qui correspond à 3 à 4 tours d'hélice. Mais dans chaque protéine individuelle, la longueur de l'hélice peut différer considérablement de cette valeur. En coupe transversale, l'hélice α a la forme d'un disque à partir duquel les chaînes latérales des acides aminés pointent vers l'extérieur.
Structure, ou ? -couche repliée, peut être formée de plusieurs sections de la chaîne polypeptidique. Ces sections sont étirées et disposées parallèlement les unes aux autres, reliées les unes aux autres par des liaisons hydrogène qui se produisent entre les liaisons peptidiques. Ils peuvent être orientés dans des directions identiques ou opposées (la direction du mouvement le long de la chaîne polypeptidique est généralement considérée comme allant de l'extrémité N à l'extrémité C). Dans le premier cas, la couche pliée est dite parallèle, dans le second, antiparallèle. Ce dernier se forme lorsque la chaîne peptidique fait un brusque retour en arrière, formant une courbure (?-courbe). Les chaînes latérales des acides aminés sont-elles orientées perpendiculairement au plan ? -couche.
Contenu relatif ? -sections en spirale et ? -les structures peuvent varier considérablement selon les différentes protéines. Il existe des protéines avec une prédominance d'hélices α (environ 75 % des acides aminés dans la myoglobine et l'hémoglobine), et le principal type de repliement de chaîne dans de nombreuses protéines fibrillaires (y compris la fibroïne de soie, la β-kératine) est l'hélice α. -structure. Les régions de la chaîne polypeptidique qui ne peuvent être classées dans aucune des conformations décrites ci-dessus sont appelées boucles de connexion. Leur structure est déterminée principalement par les interactions entre les chaînes latérales des acides aminés, et dans la molécule de toute protéine, elle s'intègre d'une manière strictement définie.
La structure tertiaire est appelée structure spatiale des protéines globulaires. Mais souvent, ce concept fait référence à la méthode de repliement de la chaîne polypeptidique dans l'espace, caractéristique de chaque protéine spécifique. La structure tertiaire est formée par la chaîne polypeptidique d'une protéine spontanément, apparemment, le long d'un certain(s) chemin(s) de coagulation avec la formation préalable d'éléments de structure secondaires. Si la stabilité de la structure secondaire est due aux liaisons hydrogène, alors la structure tertiaire est fixée par un système diversifié d'interactions non covalentes : interactions hydrogène, ioniques, intermoléculaires, ainsi que contacts hydrophobes entre les chaînes latérales des acides aminés non polaires. résidus acides.
Dans certaines protéines, la structure tertiaire est en outre stabilisée par la formation de liaisons disulfure (liaisons -S-S-) entre les résidus de cystéine. En règle générale, à l'intérieur du globule protéique se trouvent des chaînes latérales d'acides aminés hydrophobes assemblés dans le noyau (leur transfert à l'intérieur du globule protéique est thermodynamiquement favorable), et à la périphérie se trouvent des résidus hydrophiles et certains hydrophobes. Le globule protéique est entouré de plusieurs centaines de molécules d’eau d’hydratation, nécessaire à la stabilité de la molécule protéique et souvent impliquée dans son fonctionnement. La structure tertiaire est mobile, ses sections individuelles peuvent se déplacer, ce qui conduit à des transitions conformationnelles qui jouent un rôle important dans l'interaction de la protéine avec d'autres molécules.
La structure tertiaire est à la base des propriétés fonctionnelles d'une protéine. Il détermine la formation d'ensembles de groupes fonctionnels dans la protéine - centres actifs et zones de liaison, leur donne la géométrie nécessaire, permet la création d'un environnement interne, condition préalable à l'apparition de nombreuses réactions, et assure l'interaction avec d'autres protéines. .
La structure tertiaire des protéines correspond clairement à sa structure primaire ; il existe probablement un code stéréochimique encore non déchiffré qui détermine la nature du repliement des protéines. Cependant, une seule et même méthode d'agencement spatial correspond généralement non pas à une seule structure primaire, mais à toute une famille de structures dans lesquelles seule une petite fraction (jusqu'à 20-30 %) des résidus d'acides aminés peut coïncider, mais dans certains À certains endroits de la chaîne, la similitude des résidus d'acides aminés est préservée. Le résultat est la formation de grandes familles de protéines caractérisées par une structure tertiaire similaire et primaire plus ou moins similaire et, en règle générale, une fonction commune. Il s'agit par exemple de protéines d'organismes d'espèces différentes qui ont la même fonction et sont liées au cours de l'évolution : myoglobines et hémoglobines, trypsine, chymotrypsine, élastase et autres protéinases animales.

Riz. 4. À la suite de la combinaison de plusieurs macromolécules protéiques avec une structure tertiaire, une structure protéique quaternaire se forme en un complexe complexe. Un exemple de telles protéines complexes est l’hémoglobine, constituée de quatre macromolécules.
Souvent, en particulier dans les grandes protéines, le repliement d'une chaîne polypeptidique se produit par la formation par des sections individuelles de la chaîne d'éléments plus ou moins autonomes de la structure spatiale - des domaines qui peuvent avoir une autonomie fonctionnelle, étant responsables de l'une ou l'autre activité biologique du protéine. Ainsi, les domaines N-terminaux des protéines de la coagulation sanguine assurent leur fixation à la membrane cellulaire.
Il existe de nombreuses protéines dont les molécules sont un ensemble de globules (sous-unités) maintenus ensemble par des interactions hydrophobes, des liaisons hydrogène ou ioniques. De tels complexes sont appelés protéines oligomères, multimères ou sous-unités. La disposition des sous-unités dans un complexe protéique fonctionnellement actif est appelée structure quaternaire de la protéine. Certaines protéines sont capables de former des structures d'ordres supérieurs, par exemple des complexes multienzymatiques, des structures étendues (protéines d'enveloppe des bactériophages), des complexes supramoléculaires qui fonctionnent comme un tout (par exemple, des ribosomes ou des composants de la chaîne respiratoire mitochondriale).
La structure quaternaire permet la création de molécules aux géométries inhabituelles. Ainsi, la ferritine, formée de 24 sous-unités, possède une cavité interne grâce à laquelle la protéine parvient à lier jusqu'à 3000 ions fer. De plus, la structure quaternaire permet de remplir plusieurs fonctions différentes dans une seule molécule. La tryptophane synthétase regroupe des enzymes responsables de plusieurs étapes successives de la synthèse de l'acide aminé tryptophane.
Méthodes d'étude de la structure des protéines
La structure primaire des protéines détermine tous les autres niveaux d'organisation de la molécule protéique. Par conséquent, lors de l’étude de la fonction biologique de diverses protéines, la connaissance de cette structure est importante. La première protéine dont la séquence d’acides aminés a été établie était l’hormone pancréatique, l’insuline. Ce travail, qui a duré 11 ans, a été réalisé par le biochimiste anglais Frederick Sanger (1954). Il a déterminé l'emplacement de 51 acides aminés dans la molécule hormonale et a montré qu'elle est constituée de 2 chaînes reliées par des liaisons disulfure. Plus tard, la plupart des travaux visant à établir la structure primaire des protéines ont été automatisés.
Avec le développement des méthodes de génie génétique, il est devenu possible d'accélérer encore ce processus en déterminant la structure primaire des protéines conformément aux résultats de l'analyse de la séquence nucléotidique des gènes codant pour ces protéines. La structure secondaire et tertiaire des protéines est étudiée à l'aide de méthodes physiques assez complexes, par exemple le dichroïsme circulaire ou l'analyse par diffraction des rayons X des cristaux de protéines. La structure tertiaire a été établie pour la première fois par le biochimiste anglais John Cowdery Kendrew (1957) pour la myoglobine, une protéine musculaire.

Riz. 5. Modèle de la molécule de myoglobine (configuration spatiale de la molécule)
Dénaturation des protéines
Les liaisons relativement faibles responsables de la stabilisation des structures secondaires, tertiaires et quaternaires de la protéine sont facilement détruites, ce qui s'accompagne d'une perte de son activité biologique. La destruction de la structure protéique originale (native), appelée dénaturation, se produit en présence d'acides et de bases, avec chauffage, modifications de la force ionique et autres influences. En règle générale, les protéines dénaturées sont peu ou pas du tout solubles dans l’eau. Avec un effet à court terme et une élimination rapide des facteurs dénaturants, la renaturation des protéines est possible avec restauration complète ou partielle de la structure d'origine et des propriétés biologiques.
Classement des protéines
La complexité de la structure des molécules protéiques et l'extrême variété des fonctions qu'elles remplissent rendent difficile la création d'une classification unifiée et claire de celles-ci, bien que des tentatives dans ce sens aient été faites à plusieurs reprises depuis la fin du XIXe siècle. En fonction de leur composition chimique, les protéines sont divisées en protéines simples et complexes (parfois appelées protéides). Les molécules des premiers sont constituées uniquement d’acides aminés. En plus de la chaîne polypeptidique elle-même, les protéines complexes contiennent des composants non protéiques représentés par des glucides (glycoprotéines), des lipides (lipoprotéines), des acides nucléiques (nucléoprotéines), des ions métalliques (métalloprotéines), un groupe phosphate (phosphoprotéines), des pigments (chromoprotéines), etc. .
Selon les fonctions qu'elles remplissent, on distingue plusieurs classes de protéines. La classe la plus diversifiée et la plus spécialisée est constituée de protéines ayant une fonction catalytique - des enzymes capables d'accélérer les réactions chimiques se produisant dans les organismes vivants. A ce titre, les protéines participent à tous les processus de synthèse et de dégradation de divers composés au cours du métabolisme, à la biosynthèse des protéines et des acides nucléiques, à la régulation du développement et de la différenciation cellulaire. Les protéines de transport ont la capacité de lier sélectivement les acides gras, les hormones et d'autres composés et ions organiques et inorganiques, puis de les transporter avec du courant vers l'emplacement souhaité (par exemple, l'hémoglobine est impliquée dans le transfert de l'oxygène des poumons vers toutes les cellules de le corps). Les protéines de transport assurent également le transport actif des ions, des lipides, des sucres et des acides aminés à travers les membranes biologiques.
Les protéines structurelles remplissent une fonction de soutien ou de protection ; ils participent à la formation du squelette cellulaire. Les plus courants d'entre eux sont le collagène du tissu conjonctif, la kératine, les ongles et les plumes, l'élastine des cellules vasculaires et bien d'autres. En combinaison avec les lipides, ils constituent la base structurelle des membranes cellulaires et intracellulaires.
Un certain nombre de protéines remplissent une fonction protectrice. Par exemple, les immunoglobulines (anticorps) des vertébrés, ayant la capacité de se lier à des micro-organismes et substances pathogènes étrangers, neutralisent leurs effets pathogènes sur l'organisme et empêchent la prolifération cellulaire. Le fibrinogène et la thrombine sont impliqués dans le processus de coagulation sanguine. De nombreuses substances protéiques sécrétées par les bactéries, ainsi que les composants de certains invertébrés, sont classées comme toxines.
Certaines protéines (régulatrices) sont impliquées dans la régulation de l'activité physiologique du corps dans son ensemble, des organes, cellules ou processus individuels. Ils contrôlent la transcription des gènes et la synthèse des protéines ; ceux-ci incluent les hormones peptidiques-protéiques sécrétées par les glandes endocrines. Les protéines de stockage des graines fournissent des nutriments pour les premières étapes du développement de l'embryon. Ceux-ci incluent également la caséine, l’albumine de blanc d’œuf (ovalbumine) et bien d’autres. Grâce aux protéines, les cellules musculaires acquièrent la capacité de se contracter et finalement de fournir du mouvement au corps. Des exemples de telles protéines contractiles sont l'actine et la myosine des muscles squelettiques, ainsi que la tubuline, qui sont des composants des cils et des flagelles des organismes unicellulaires ; Ils assurent également la divergence des chromosomes lors de la division cellulaire.
Les protéines réceptrices sont la cible des hormones et d’autres composés biologiquement actifs. Avec leur aide, la cellule perçoit des informations sur l'état de l'environnement extérieur. Ils jouent un rôle important dans la transmission de l’excitation nerveuse et dans le mouvement cellulaire orienté (chimiotaxie). La transformation et l'utilisation de l'énergie entrant dans l'organisme, ainsi que de l'énergie, se produisent également avec la participation de protéines du système bioénergétique (par exemple, le pigment visuel rhodopsine, les cytochromes de la chaîne respiratoire). Il existe également de nombreuses protéines ayant d'autres fonctions, parfois assez inhabituelles (par exemple, le plasma de certains poissons de l'Antarctique contient des protéines qui ont des propriétés antigel).
Biosynthèse des protéines
Toutes les informations sur la structure d'une protéine particulière sont « stockées » dans les gènes correspondants sous la forme d'une séquence de nucléotides et sont mises en œuvre dans le processus de synthèse de matrices. Tout d'abord, l'information est transférée (lue) de la molécule d'ADN à l'ARN messager (ARNm) à l'aide de l'enzyme ARN polymérase ADN-dépendante, puis dans le ribosome sur l'ARNm, comme sur une matrice conformément au code génétique, avec la participation d'ARN de transport délivrant des acides aminés, se produit la formation d'une chaîne polypeptidique.
Les chaînes polypeptidiques synthétisées émergeant du ribosome, se repliant spontanément, prennent la conformation caractéristique de la protéine et peuvent être sujettes à des modifications post-traductionnelles. Les chaînes latérales des acides aminés individuels peuvent subir des modifications (hydroxylation, phosphorylation, etc.). C'est pourquoi, par exemple, l'hydroxyproline et l'hydroxylysine se trouvent dans le collagène (voir). La modification peut également s'accompagner de la rupture des liaisons polypeptidiques. De cette manière, par exemple, se produit la formation d'une molécule d'insuline active, constituée de deux chaînes reliées par des liaisons disulfure.

Riz. 6. Schéma général de la biosynthèse des protéines.
L'importance des protéines dans la nutrition
Les protéines sont les composants les plus importants de l’alimentation animale et humaine. La valeur nutritionnelle des protéines est déterminée par leur teneur en acides aminés essentiels, qui ne sont pas produits par l’organisme lui-même. À cet égard, les protéines végétales sont moins précieuses que les protéines animales : elles sont plus pauvres en lysine, méthionine et tryptophane, et sont plus difficiles à digérer dans le tractus gastro-intestinal. Le manque d'acides aminés essentiels dans les aliments entraîne de graves troubles du métabolisme de l'azote.
Les protéines sont décomposées en acides aminés libres qui, après absorption dans l'intestin, pénètrent et sont distribués dans toutes les cellules. Certains d'entre eux se décomposent en composés simples avec libération d'énergie, utilisée pour divers besoins par la cellule, et certains vont à la synthèse de nouvelles protéines caractéristiques d'un organisme donné. (R. A. Matveeva, Encyclopédie Cyrille et Méthode)
Dénombrement des protéines
- amyloïde - amyloïde;
- anionique - anionique;
- antivirus - antiviral ;
- auto-immune - auto-immune ;
- autologue - autologique;
- bactérien - bactérien;
- protéine de Bence Jones ;
- induit par un virus - induit par un virus ;
- viral - virus;
- viral non structurel - virus non structurel ;
- structure virale - structure virale ;
- spécifique au virus - spécifique au virus ;
- poids moléculaire élevé - poids moléculaire élevé;
- contenant de l'hème - hème ;
- hétérologue - étranger;
- hybride - hybride;
- glycosylé - glyqué;
- globulaire - globulaire;
- dénaturé - dénaturé;
- contenant du fer - fer;
- jaune - jaune;
- protéine animale - protéine animale ;
- protecteur - défensif;
- immunitaire - immunitaire;
- immunogène - pertinent sur le plan immunologique ;
- liaison au calcium;
- aigre - acide;
- corpusculaire - corpusculaire;
- membrane - membrane;
- myélome - myélome;
- microsomal - microsomal;
- protéine de lait - protéine de lait ;
- monoclonal - immunoglobuline monoclonale;
- protéine musculaire - protéine musculaire ;
- natif - natif ;
- nonhistone - nonhistone ;
- défectueux - partiel ;
- insoluble - insoluble;
- indigeste - insoluble;
- non enzymatique - non enzymatique ;
- faible poids moléculaire - faible poids moléculaire ;
- nouvelle protéine - nouvelle protéine ;
- général - entier;
- oncogène - oncoprotéine;
- protéine de phase principale - anionique ;
- protéine de phase aiguë (inflammation) - protéine de phase aiguë ;
- nourriture - nourriture;
- protéine plasmatique sanguine - protéine plasmatique;
- placentaire - placenta;
- découplage - découplage;
- protéine de nerf régénérateur;
- réglementaire - réglementaire ;
- recombinaison - recombinante ;
- récepteur - récepteur;
- ribosomique - ribosomal;
- reliure - reliure ;
- protéine sécrétoire - protéine sécrétoire ;
- C-réactif - C-réactif ;
- protéine de lactosérum - protéine de lactosérum, lactoprotéine ;
- tissu - tissu;
- toxique - toxique;
- chimérique - chimérique;
- entier - entier ;
- cytosolique - cytosolique;
- protéine alcaline - protéine anionique ;
- exogène - exogène;
- endogène - protéine endogène.
En savoir plus sur les protéines dans la littérature :
- Volkenshtein M.V., Molécules et, M., 1965, ch. 3 à 5 ;
- Gaurowitz F., Chimie et fonctions des protéines, trans. de l'anglais, Moscou, 1965 ;
- Sissakyan N. M. et Gladilin K. L., Aspects biochimiques de la synthèse des protéines, dans le livre : Advances in biologique chemistry, tome 7, M., 1965, p. 3 ;
- Stepanov V. M. Biologie moléculaire. Structure et fonction des protéines. M., 1996 ;
- Shamin A. N., Développement de la chimie des protéines, M., 1966 ;
- Protéines et peptides. M., 1995-2000. T. 1-3 ;
- Biosynthèse des protéines et des acides nucléiques, éd. A.S. Spirina, M., 1965 ;
- Introduction à la biologie moléculaire, trad. de l'anglais, M., 1967
- Molécules et cellules. [Assis. Art.], trad. de l'anglais, M., 1966, p. 7-27, 94-106 ;
- Fondements de la biochimie : Traduction de l'anglais M., 1981. T. 1 ;
- Le problème des protéines. M., 1995. T. 1-5 ;
- Les Protéines. New York, 1975-79. 3 éd. V. 1-4.
Trouvez autre chose d'intéressant :
Écureuils- des composés organiques de haut poids moléculaire constitués de résidus d'acides α-aminés.
DANS composition protéique comprend le carbone, l'hydrogène, l'azote, l'oxygène et le soufre. Certaines protéines forment des complexes avec d'autres molécules contenant du phosphore, du fer, du zinc et du cuivre.
Les protéines ont un poids moléculaire élevé : albumine d'œuf - 36 000, hémoglobine - 152 000, myosine - 500 000. A titre de comparaison : le poids moléculaire de l'alcool est de 46, l'acide acétique - 60, le benzène - 78.
Composition en acides aminés des protéines
Écureuils- les polymères non périodiques dont les monomères sont acides α-aminés. Généralement, 20 types d’acides α-aminés sont appelés monomères protéiques, bien que plus de 170 d’entre eux se trouvent dans les cellules et les tissus.
Selon que les acides aminés peuvent être synthétisés dans le corps de l'homme et d'autres animaux, on les distingue : acides aminés non essentiels- peut être synthétisé ; acides aminés essentiels- ne peut pas être synthétisé. Les acides aminés essentiels doivent être apportés à l’organisme par l’alimentation. Les plantes synthétisent tous les types d’acides aminés.
Selon la composition en acides aminés, les protéines sont : complètes- contenir l'ensemble des acides aminés ; défectueux- certains acides aminés manquent dans leur composition. Si les protéines sont constituées uniquement d’acides aminés, elles sont appelées simple. Si les protéines contiennent, en plus des acides aminés, un composant non acide aminé (groupe prothétique), elles sont appelées complexe. Le groupe prothétique peut être représenté par des métaux (métalloprotéines), des glucides (glycoprotéines), des lipides (lipoprotéines), des acides nucléiques (nucléoprotéines).
Tous les acides aminés contiennent: 1) groupe carboxyle (-COOH), 2) groupe amino (-NH 2), 3) radical ou groupe R (le reste de la molécule). La structure du radical est différente selon les types d’acides aminés. Selon le nombre de groupes aminés et de groupes carboxyles entrant dans la composition des acides aminés, on les distingue : acides aminés neutres ayant un groupe carboxyle et un groupe amino ; acides aminés basiques ayant plus d'un groupe amino ; acides aminés acides ayant plus d'un groupe carboxyle.
Les acides aminés sont composés amphotères, car en solution, ils peuvent agir à la fois comme acides et comme bases. Dans les solutions aqueuses, les acides aminés existent sous différentes formes ioniques.
Liaison peptidique
Peptides- des substances organiques constituées de résidus d'acides aminés reliés par des liaisons peptidiques.
La formation de peptides résulte de la réaction de condensation des acides aminés. Lorsque le groupe amino d'un acide aminé interagit avec le groupe carboxyle d'un autre, une liaison covalente azote-carbone se produit entre eux, appelée peptide. Selon le nombre de résidus d'acides aminés inclus dans le peptide, il existe dipeptides, tripeptides, tétrapeptides etc. La formation d’une liaison peptidique peut être répétée plusieurs fois. Cela conduit à la formation polypeptides. À une extrémité du peptide se trouve un groupe amino libre (appelé extrémité N) et à l’autre extrémité, un groupe carboxyle libre (appelé extrémité C).

Organisation spatiale des molécules de protéines
L'exécution de certaines fonctions spécifiques par les protéines dépend de la configuration spatiale de leurs molécules ; de plus, il est énergétiquement défavorable pour la cellule de maintenir les protéines sous une forme dépliée, sous forme de chaîne, c'est pourquoi les chaînes polypeptidiques subissent un repliement, acquérant ainsi une certaine structure ou conformation tridimensionnelle. Il y a 4 niveaux organisation spatiale des protéines.
Structure protéique primaire- la séquence d'arrangement des résidus d'acides aminés dans la chaîne polypeptidique qui constitue la molécule protéique. La liaison entre les acides aminés est une liaison peptidique.

Si une molécule protéique est constituée de seulement 10 résidus d'acides aminés, alors le nombre de variantes théoriquement possibles de molécules protéiques qui diffèrent par l'ordre d'alternance des acides aminés est de 10 à 20. Ayant 20 acides aminés, vous pouvez en faire des combinaisons encore plus diverses. Environ dix mille protéines différentes ont été trouvées dans le corps humain, qui diffèrent à la fois les unes des autres et des protéines d'autres organismes.
C'est la structure primaire de la molécule protéique qui détermine les propriétés des molécules protéiques et sa configuration spatiale. Le remplacement d'un seul acide aminé par un autre dans une chaîne polypeptidique entraîne une modification des propriétés et des fonctions de la protéine. Par exemple, le remplacement du sixième acide aminé glutamique par de la valine dans la sous-unité β de l'hémoglobine conduit au fait que la molécule d'hémoglobine dans son ensemble ne peut pas remplir sa fonction principale - le transport de l'oxygène ; Dans de tels cas, la personne développe une maladie appelée drépanocytose.
Structure secondaire- pliage ordonné de la chaîne polypeptidique en spirale (ressemble à un ressort allongé). Les tours de l'hélice sont renforcés par des liaisons hydrogène qui naissent entre les groupes carboxyle et les groupes amino. Presque tous les groupes CO et NH participent à la formation des liaisons hydrogène. Ils sont plus faibles que les peptides, mais, répétés plusieurs fois, confèrent stabilité et rigidité à cette configuration. Au niveau de la structure secondaire, on trouve des protéines : fibroïne (soie, toile d'araignée), kératine (cheveux, ongles), collagène (tendons).



Structure tertiaire- le regroupement de chaînes polypeptidiques en globules, résultant de la formation de liaisons chimiques (hydrogène, ionique, disulfure) et de l'établissement d'interactions hydrophobes entre les radicaux des résidus d'acides aminés. Le rôle principal dans la formation de la structure tertiaire est joué par les interactions hydrophiles-hydrophobes. Dans les solutions aqueuses, les radicaux hydrophobes ont tendance à se cacher de l'eau et se regroupent à l'intérieur du globule, tandis que les radicaux hydrophiles, du fait de l'hydratation (interaction avec les dipôles de l'eau), ont tendance à apparaître à la surface de la molécule. Dans certaines protéines, la structure tertiaire est stabilisée par des liaisons covalentes disulfure formées entre les atomes de soufre de deux résidus de cystéine. Au niveau de la structure tertiaire se trouvent des enzymes, des anticorps et certaines hormones.

Structure quaternaire caractéristique des protéines complexes dont les molécules sont formées de deux ou plusieurs globules. Les sous-unités sont retenues dans la molécule par des interactions ioniques, hydrophobes et électrostatiques. Parfois, lors de la formation d'une structure quaternaire, des liaisons disulfure se produisent entre les sous-unités. La protéine de structure quaternaire la plus étudiée est hémoglobine. Il est formé de deux sous-unités α (141 résidus d'acides aminés) et de deux sous-unités β (146 résidus d'acides aminés). À chaque sous-unité est associée une molécule hème contenant du fer.
Si, pour une raison quelconque, la conformation spatiale des protéines s'écarte de la normale, la protéine ne peut pas remplir ses fonctions. Par exemple, la cause de la « maladie de la vache folle » (encéphalopathie spongiforme) est la conformation anormale des prions, les protéines de surface des cellules nerveuses.
Propriétés des protéines
La composition en acides aminés et la structure de la molécule protéique la déterminent propriétés. Les protéines combinent des propriétés basiques et acides, déterminées par les radicaux d'acides aminés : plus les acides aminés d'une protéine sont acides, plus ses propriétés acides sont prononcées. La capacité de faire un don et d'ajouter du H + est déterminée propriétés tampons des protéines; L’un des tampons les plus puissants est l’hémoglobine présente dans les globules rouges, qui maintient le pH du sang à un niveau constant. Il existe des protéines solubles (fibrinogène) et des protéines insolubles qui remplissent des fonctions mécaniques (fibroïne, kératine, collagène). Il existe des protéines chimiquement actives (enzymes), des protéines chimiquement inactives qui résistent à diverses conditions environnementales et d'autres qui sont extrêmement instables.
Facteurs externes (chaleur, rayonnement ultraviolet, métaux lourds et leurs sels, changements de pH, rayonnement, déshydratation)
peut perturber l’organisation structurelle de la molécule protéique. Le processus de perte de la conformation tridimensionnelle inhérente à une molécule protéique donnée est appelé dénaturation. La cause de la dénaturation est la rupture des liaisons qui stabilisent une certaine structure protéique. Au départ, les liens les plus faibles sont rompus, et à mesure que les conditions deviennent plus strictes, les liens encore plus forts sont rompus. Par conséquent, les structures quaternaire, puis tertiaire et secondaire sont perdues. Un changement dans la configuration spatiale entraîne une modification des propriétés de la protéine et, par conséquent, rend impossible à la protéine de remplir ses fonctions biologiques inhérentes. Si la dénaturation ne s'accompagne pas d'une destruction de la structure primaire, elle peut alors être réversible, dans ce cas, l'auto-récupération de la conformation caractéristique de la protéine se produit. Par exemple, les protéines des récepteurs membranaires subissent une telle dénaturation. Le processus de restauration de la structure des protéines après dénaturation est appelé renaturation. Si la restauration de la configuration spatiale de la protéine est impossible, alors la dénaturation est appelée irréversible.
Fonctions des protéines
| Fonction | Exemples et explications |
|---|---|
| Construction | Les protéines participent à la formation des structures cellulaires et extracellulaires : elles font partie des membranes cellulaires (lipoprotéines, glycoprotéines), des cheveux (kératine), des tendons (collagène), etc. |
| Transport | L'hémoglobine, une protéine du sang, fixe l'oxygène et le transporte des poumons vers tous les tissus et organes, et d'eux transfère le dioxyde de carbone vers les poumons ; La composition des membranes cellulaires comprend des protéines spéciales qui assurent le transfert actif et strictement sélectif de certaines substances et ions de la cellule vers l'environnement extérieur et inversement. |
| Réglementaire | Les hormones protéiques participent à la régulation des processus métaboliques. Par exemple, l’hormone insuline régule la glycémie, favorise la synthèse du glycogène et augmente la formation de graisses à partir des glucides. |
| Protecteur | En réponse à la pénétration de protéines ou de micro-organismes étrangers (antigènes) dans le corps, des protéines spéciales se forment - des anticorps qui peuvent les lier et les neutraliser. La fibrine, formée à partir du fibrinogène, aide à arrêter les saignements. |
| Moteur | Les protéines contractiles actine et myosine assurent la contraction musculaire chez les animaux multicellulaires. |
| Signal | Construites dans la membrane superficielle de la cellule se trouvent des molécules protéiques capables de modifier leur structure tertiaire en réponse à des facteurs environnementaux, recevant ainsi des signaux de l'environnement externe et transmettant des commandes à la cellule. |
| Stockage | En règle générale, dans le corps des animaux, les protéines ne sont pas stockées, à l'exception de l'albumine d'œuf et de la caséine du lait. Mais grâce aux protéines, certaines substances peuvent être stockées dans l'organisme : par exemple, lors de la dégradation de l'hémoglobine, le fer n'est pas éliminé de l'organisme, mais est stocké, formant un complexe avec la protéine ferritine. |
| Énergie | Lorsque 1 g de protéine se décompose en produits finaux, 17,6 kJ sont libérés. Tout d'abord, les protéines se décomposent en acides aminés, puis en produits finaux - eau, dioxyde de carbone et ammoniac. Cependant, les protéines ne sont utilisées comme source d’énergie que lorsque les autres sources (glucides et graisses) sont épuisées. |
| Catalytique | L'une des fonctions les plus importantes des protéines. Fourni par des protéines - des enzymes qui accélèrent les réactions biochimiques se produisant dans les cellules. Par exemple, la ribulose biphosphate carboxylase catalyse la fixation du CO 2 lors de la photosynthèse. |
Enzymes
Enzymes, ou enzymes, constituent une classe spéciale de protéines qui sont des catalyseurs biologiques. Grâce aux enzymes, les réactions biochimiques se produisent à une vitesse fulgurante. La vitesse des réactions enzymatiques est des dizaines de milliers de fois (et parfois des millions) supérieure à la vitesse des réactions se produisant avec la participation de catalyseurs inorganiques. La substance sur laquelle agit l’enzyme est appelée substrat.
Les enzymes sont des protéines globulaires, caractéristiques structurelles les enzymes peuvent être divisées en deux groupes : simples et complexes. Enzymes simples sont des protéines simples, c'est-à-dire constitué uniquement d’acides aminés. Enzymes complexes sont des protéines complexes, c'est-à-dire En plus de la partie protéique, ils contiennent un groupe de nature non protéique - cofacteur. Certaines enzymes utilisent des vitamines comme cofacteurs. La molécule d’enzyme contient une partie spéciale appelée centre actif. Centre actif- une petite section de l'enzyme (de trois à douze résidus d'acides aminés), où se produit la liaison du ou des substrats pour former un complexe enzyme-substrat. Une fois la réaction terminée, le complexe enzyme-substrat se décompose en l'enzyme et le(s) produit(s) de réaction. Certaines enzymes ont (sauf actives) centres allostériques- les zones auxquelles sont fixés les régulateurs de vitesse enzymatiques ( enzymes allostériques).

Les réactions de catalyse enzymatique sont caractérisées par : 1) une efficacité élevée, 2) une sélectivité et une direction d'action strictes, 3) une spécificité du substrat, 4) une régulation fine et précise. La spécificité du substrat et de la réaction des réactions de catalyse enzymatique est expliquée par les hypothèses de E. Fischer (1890) et D. Koshland (1959).
E. Fisher (hypothèse du verrouillage par clé) ont suggéré que les configurations spatiales du site actif de l'enzyme et du substrat doivent correspondre exactement les unes aux autres. Le substrat est comparé à la « clé », l’enzyme à la « serrure ».
D. Koshland (hypothèse du gant) a suggéré que la correspondance spatiale entre la structure du substrat et le centre actif de l'enzyme n'est créée qu'au moment de leur interaction les uns avec les autres. Cette hypothèse est aussi appelée hypothèse de correspondance induite.
La vitesse des réactions enzymatiques dépend de : 1) la température, 2) la concentration en enzyme, 3) la concentration en substrat, 4) le pH. Il convient de souligner que les enzymes étant des protéines, leur activité est maximale dans des conditions physiologiques normales.
La plupart des enzymes ne peuvent fonctionner qu’à des températures comprises entre 0 et 40°C. Dans ces limites, la vitesse de réaction augmente environ 2 fois pour chaque augmentation de température de 10 °C. À des températures supérieures à 40 °C, la protéine subit une dénaturation et l'activité enzymatique diminue. À des températures proches du point de congélation, les enzymes sont inactivées.
À mesure que la quantité de substrat augmente, la vitesse de la réaction enzymatique augmente jusqu'à ce que le nombre de molécules de substrat soit égal au nombre de molécules d'enzyme. Avec une nouvelle augmentation de la quantité de substrat, la vitesse n'augmentera pas, car les centres actifs de l'enzyme sont saturés. Une augmentation de la concentration en enzyme entraîne une activité catalytique accrue, puisqu'un plus grand nombre de molécules de substrat subissent des transformations par unité de temps.

Pour chaque enzyme, il existe une valeur de pH optimale à laquelle elle présente une activité maximale (pepsine - 2,0, amylase salivaire - 6,8, lipase pancréatique - 9,0). À des valeurs de pH plus élevées ou plus basses, l'activité enzymatique diminue. Avec des changements brusques de pH, l’enzyme se dénature.
La vitesse des enzymes allostériques est régulée par des substances qui s'attachent aux centres allostériques. Si ces substances accélèrent une réaction, on les appelle activateurs, s'ils ralentissent - inhibiteurs.
Classification des enzymes
Selon le type de transformations chimiques qu’elles catalysent, les enzymes sont divisées en 6 classes :
- oxiréductases(transfert d'atomes d'hydrogène, d'oxygène ou d'électrons d'une substance à une autre - déshydrogénase),
- transferts(transfert de groupe méthyle, acyle, phosphate ou amino d'une substance à une autre - transaminase),
- hydrolases(réactions d'hydrolyse dans lesquelles deux produits sont formés à partir du substrat - amylase, lipase),
- lyases(addition non hydrolytique au substrat ou détachement d'un groupe d'atomes de celui-ci, auquel cas les liaisons C-C, C-N, C-O, C-S peuvent être rompues - décarboxylase),
- isomérases(réarrangement intramoléculaire - isomérase),
- ligases(la connexion de deux molécules résultant de la formation de liaisons C-C, C-N, C-O, C-S - synthétase).
Les classes sont à leur tour subdivisées en sous-classes et sous-sous-classes. Dans la classification internationale actuelle, chaque enzyme possède un code spécifique, composé de quatre chiffres séparés par des points. Le premier numéro est la classe, le deuxième est la sous-classe, le troisième est la sous-sous-classe, le quatrième est le numéro de série de l'enzyme dans cette sous-classe, par exemple, le code de l'arginase est 3.5.3.1.
Aller à cours n°2"Structure et fonctions des glucides et des lipides"
Aller à conférences n°4"Structure et fonctions des acides nucléiques ATP"
Dans la première moitié du XIXe siècle. de nombreux chimistes, et parmi eux principalement J. von Liebig, sont progressivement arrivés à la conclusion que les protéines représentent une classe particulière de composés azotés. Le nom « protéines » (du grec.
protos premier) a été proposé en 1840 par le chimiste néerlandais G. Mulder. PROPRIÉTÉS PHYSIQUES Les protéines sont blanches à l'état solide, mais incolores en solution, à moins qu'elles ne portent une sorte de groupe chromophore (coloré), tel que l'hémoglobine. La solubilité dans l’eau varie considérablement selon les différentes protéines. Cela change également en fonction du pH et de la concentration de sels dans la solution, il est donc possible de sélectionner des conditions dans lesquelles une protéine précipitera sélectivement en présence d'autres protéines. Cette méthode de « relargage » est largement utilisée pour isoler et purifier les protéines. La protéine purifiée précipite souvent hors de la solution sous forme de cristaux.Comparé à d’autres composés, le poids moléculaire des protéines est très élevé, allant de plusieurs milliers à plusieurs millions de daltons. Par conséquent, lors de l’ultracentrifugation, les protéines sédimentent, et à des rythmes différents. En raison de la présence de groupes chargés positivement et négativement dans les molécules de protéines, celles-ci se déplacent à des vitesses différentes et dans un champ électrique. C'est la base de l'électrophorèse, une méthode utilisée pour isoler des protéines individuelles à partir de mélanges complexes. Les protéines sont également purifiées par chromatographie.
PROPRIÉTÉS CHIMIQUES Structure. Les protéines sont des polymères, c'est-à-dire molécules construites comme des chaînes à partir d'unités monomères répétitives, ou sous-unités, dont elles jouent le rôle un -acides aminés. Formule générale des acides aminés où R un atome d'hydrogène ou un groupe organique.Une molécule protéique (chaîne polypeptidique) peut être constituée d'un nombre relativement faible d'acides aminés ou de plusieurs milliers d'unités monomères. La combinaison d'acides aminés dans une chaîne est possible car chacun d'eux possède deux groupes chimiques différents: un groupe aminé aux propriétés basiques,
NH2 , et un groupe carboxyle acide, COOH. Ces deux groupes sont affiliés à un -atome de carbone. Le groupe carboxyle d'un acide aminé peut former une liaison amide (peptide) avec le groupe amino d'un autre acide aminé : Une fois que deux acides aminés ont été ainsi liés, la chaîne peut être allongée en ajoutant un troisième au deuxième acide aminé, et ainsi de suite. Comme le montre l’équation ci-dessus, lorsqu’une liaison peptidique est formée, une molécule d’eau est libérée. En présence d'acides, d'alcalis ou d'enzymes protéolytiques, la réaction se déroule dans le sens inverse : la chaîne polypeptidique est divisée en acides aminés avec l'ajout d'eau. Cette réaction est appelée hydrolyse. L'hydrolyse se produit spontanément et de l'énergie est nécessaire pour relier les acides aminés en une chaîne polypeptidique.
Une fois que deux acides aminés ont été ainsi liés, la chaîne peut être allongée en ajoutant un troisième au deuxième acide aminé, et ainsi de suite. Comme le montre l’équation ci-dessus, lorsqu’une liaison peptidique est formée, une molécule d’eau est libérée. En présence d'acides, d'alcalis ou d'enzymes protéolytiques, la réaction se déroule dans le sens inverse : la chaîne polypeptidique est divisée en acides aminés avec l'ajout d'eau. Cette réaction est appelée hydrolyse. L'hydrolyse se produit spontanément et de l'énergie est nécessaire pour relier les acides aminés en une chaîne polypeptidique. Un groupe carboxyle et un groupe amide (ou un groupe imide similaire dans le cas de l'acide aminé proline) sont présents dans tous les acides aminés, mais les différences entre les acides aminés sont déterminées par la nature du groupe, ou « chaîne latérale ». qui est indiqué ci-dessus par la lettre
R. . Le rôle de la chaîne latérale peut être joué par un atome d'hydrogène, comme dans l'acide aminé glycine, ou par un groupe volumineux, comme dans l'histidine et le tryptophane. Certaines chaînes latérales sont chimiquement inertes, tandis que d’autres sont nettement réactives.Plusieurs milliers d'acides aminés différents peuvent être synthétisés et de nombreux acides aminés différents sont présents dans la nature, mais seuls 20 types d'acides aminés sont utilisés pour la synthèse des protéines : alanine, arginine, asparagine, acide aspartique, valine, histidine, glycine, glutamine, glutamique. acide, isoleucine, leucine, lysine, méthionine, proline, sérine, tyrosine, thréonine, tryptophane, phénylalanine et cystéine (dans les protéines, la cystéine peut être présente sous forme de dimère
cystine). Certes, certaines protéines contiennent d'autres acides aminés en plus des vingt acides aminés habituels, mais ils sont formés à la suite de la modification de l'un des vingt répertoriés après son inclusion dans la protéine.Activité optique. Tous les acides aminés, à l'exception de la glycine, ont un L’atome de carbone est doté de quatre groupes différents. Du point de vue de la géométrie, quatre groupes différents peuvent être rattachés de deux manières, et par conséquent il existe deux configurations possibles, ou deux isomères, liés l'un à l'autre comme un objet l'est à son image dans un miroir, c'est-à-dire comme la main gauche vers la droite. Une configuration est appelée gauche ou gaucher ( L ), et l'autre droite, ou dextrogyre ( D ), puisque deux de ces isomères diffèrent par le sens de rotation du plan de la lumière polarisée. Trouvé uniquement dans les protéines L -les acides aminés (à l'exception de la glycine ; elle ne peut être représentée que sous une seule forme, puisque deux de ses quatre groupes sont identiques), et tous sont optiquement actifs (puisqu'il n'y a qu'un seul isomère). D -les acides aminés sont rares dans la nature ; on les trouve dans certains antibiotiques et dans la paroi cellulaire des bactéries.Séquence d'acides aminés. Les acides aminés d'une chaîne polypeptidique ne sont pas disposés de manière aléatoire, mais dans un certain ordre fixe, et c'est cet ordre qui détermine les fonctions et les propriétés de la protéine. En variant l’ordre des 20 types d’acides aminés, vous pouvez créer un grand nombre de protéines différentes, tout comme vous pouvez créer de nombreux textes différents à partir des lettres de l’alphabet.Dans le passé, déterminer la séquence d’acides aminés d’une protéine prenait souvent plusieurs années. La détermination directe est encore une tâche assez laborieuse, bien que des dispositifs aient été créés pour permettre son exécution automatique. Il est généralement plus facile de déterminer la séquence nucléotidique du gène correspondant et d’en déduire la séquence d’acides aminés de la protéine. À ce jour, les séquences d’acides aminés de plusieurs centaines de protéines ont déjà été déterminées. Les fonctions des protéines déchiffrées sont généralement connues, ce qui permet d'imaginer les fonctions possibles de protéines similaires formées, par exemple, dans les tumeurs malignes.
Protéines complexes. Les protéines constituées uniquement d’acides aminés sont dites simples. Souvent, cependant, un atome métallique ou un composé chimique qui n’est pas un acide aminé est attaché à la chaîne polypeptidique. Ces protéines sont appelées complexes. Un exemple est l’hémoglobine : elle contient de la porphyrine de fer, qui détermine sa couleur rouge et lui permet d’agir comme transporteur d’oxygène.Les noms des protéines les plus complexes indiquent la nature des groupes attachés : les glycoprotéines contiennent des sucres, les lipoprotéines contiennent des graisses. Si l’activité catalytique d’une enzyme dépend du groupe attaché, on parle alors de groupe prothétique. Souvent, une vitamine joue le rôle d’un groupe prothétique ou en fait partie. La vitamine A, par exemple, attachée à l’une des protéines de la rétine, détermine sa sensibilité à la lumière.
Structure tertiaire. Ce qui est important n’est pas tant la séquence d’acides aminés de la protéine elle-même (la structure primaire), mais la façon dont elle est disposée dans l’espace. Sur toute la longueur de la chaîne polypeptidique, les ions hydrogène forment des liaisons hydrogène régulières, qui lui donnent la forme d'une hélice ou d'une couche (structure secondaire). De la combinaison de ces hélices et couches, émerge une forme compacte de l’ordre suivant : la structure tertiaire de la protéine. Autour des liaisons retenant les unités monomères de la chaîne, des rotations sous de petits angles sont possibles. Par conséquent, d’un point de vue purement géométrique, le nombre de configurations possibles pour toute chaîne polypeptidique est infiniment grand. En réalité, chaque protéine n’existe normalement que dans une seule configuration, déterminée par sa séquence d’acides aminés. Cette structure n'est pas rigide, c'est comme si « respire » fluctue autour d’une certaine configuration moyenne. Le circuit est plié dans une configuration dans laquelle l'énergie libre (la capacité de produire du travail) est minimale, tout comme un ressort relâché se comprime uniquement jusqu'à un état correspondant à l'énergie libre minimale. Souvent, une partie de la chaîne est liée rigidement à une autre par le disulfure ( SS) liaisons entre deux résidus de cystéine. C'est en partie pourquoi la cystéine joue un rôle particulièrement important parmi les acides aminés.La complexité de la structure des protéines est si grande qu'il n'est pas encore possible de calculer la structure tertiaire d'une protéine, même si sa séquence d'acides aminés est connue. Mais s'il est possible d'obtenir des cristaux de protéines, alors sa structure tertiaire peut être déterminée par diffraction des rayons X.
Dans les protéines structurelles, contractiles et dans certaines autres protéines, les chaînes sont allongées et plusieurs chaînes légèrement pliées situées à proximité forment des fibrilles ; les fibrilles, à leur tour, se replient en formations de fibres plus grandes. Cependant, la plupart des protéines en solution ont une forme globulaire : les chaînes sont enroulées dans un globule, comme du fil dans une pelote. L'énergie libre avec cette configuration est minime, car les acides aminés hydrophobes (« hydrofuges ») sont cachés à l'intérieur du globule et les acides aminés hydrophiles (« attirant l'eau ») se trouvent à sa surface.
De nombreuses protéines sont des complexes de plusieurs chaînes polypeptidiques. Cette structure est appelée structure quaternaire de la protéine. La molécule d’hémoglobine, par exemple, est constituée de quatre sous-unités, chacune étant une protéine globulaire.
Les protéines structurelles, en raison de leur configuration linéaire, forment des fibres qui ont une très haute résistance à la traction, tandis que la configuration globulaire permet aux protéines d'entrer dans des interactions spécifiques avec d'autres composés. A la surface du globule, lorsque les chaînes sont correctement disposées, des cavités d'une certaine forme apparaissent dans lesquelles se trouvent des groupes chimiques réactifs. Si une protéine donnée est une enzyme, alors une autre molécule, généralement plus petite, d'une substance quelconque pénètre dans une telle cavité, tout comme une clé entre dans une serrure ; dans ce cas, la configuration du nuage électronique de la molécule change sous l'influence des groupements chimiques situés dans la cavité, ce qui l'oblige à réagir d'une certaine manière. De cette façon, l’enzyme catalyse la réaction. Les molécules d'anticorps possèdent également des cavités dans lesquelles diverses substances étrangères se lient et sont ainsi rendues inoffensives. Le modèle « serrure et clé », qui explique l'interaction des protéines avec d'autres composés, permet de comprendre la spécificité des enzymes et des anticorps, c'est-à-dire leur capacité à réagir uniquement avec certains composés.
Protéines dans différents types d'organismes. Les protéines qui remplissent la même fonction chez différentes espèces de plantes et d’animaux et portent donc le même nom ont également une configuration similaire. Ils diffèrent cependant quelque peu par leur séquence d’acides aminés. À mesure que les espèces s'écartent d'un ancêtre commun, certains acides aminés situés à certaines positions sont remplacés par des mutations par d'autres. Les mutations nuisibles qui causent des maladies héréditaires sont éliminées par la sélection naturelle, mais des mutations bénéfiques ou au moins neutres peuvent persister. Plus deux espèces sont proches l’une de l’autre, moins on trouve de différences dans leurs protéines.Certaines protéines évoluent relativement rapidement, d'autres sont très conservées. Ce dernier comprend, par exemple, le cytochrome Avec une enzyme respiratoire présente dans la plupart des organismes vivants. Chez l'homme et le chimpanzé, ses séquences d'acides aminés sont identiques, et dans le cytochrome Avec Dans le blé, seulement 38 % des acides aminés étaient différents. Même en comparant les humains et les bactéries, la similitude des cytochromes Avec(les différences affectent ici 65 % des acides aminés) sont encore visibles, bien que l'ancêtre commun des bactéries et des humains vivait sur Terre il y a environ deux milliards d'années. De nos jours, la comparaison des séquences d’acides aminés est souvent utilisée pour construire un arbre phylogénétique (généalogique), reflétant les relations évolutives entre différents organismes.
Dénaturation. La molécule protéique synthétisée, en se repliant, acquiert sa configuration caractéristique. Cette configuration peut cependant être détruite par chauffage, par modification du pH, par exposition à des solvants organiques et même par simple agitation de la solution jusqu'à ce que des bulles apparaissent à sa surface. Une protéine ainsi modifiée est dite dénaturée ; il perd son activité biologique et devient généralement insoluble. Des exemples bien connus de protéines dénaturées sont les œufs durs ou la crème fouettée. Les petites protéines contenant seulement une centaine d'acides aminés sont capables de renaturation, c'est-à-dire réacquérir la configuration d'origine. Mais la plupart des protéines se transforment simplement en une masse de chaînes polypeptidiques enchevêtrées et ne restaurent pas leur configuration antérieure.L’une des principales difficultés lors de l’isolement des protéines actives est leur extrême sensibilité à la dénaturation. Cette propriété des protéines trouve une application utile dans la conservation des aliments : la température élevée dénature de manière irréversible les enzymes des micro-organismes et les micro-organismes meurent.
SYNTHÈSE DES PROTÉINES Pour synthétiser des protéines, un organisme vivant doit disposer d’un système d’enzymes capables de lier un acide aminé à un autre. Une source d’information est également nécessaire pour déterminer quels acides aminés doivent être combinés. Comme il existe des milliers de types de protéines dans le corps et que chacune d’entre elles est constituée en moyenne de plusieurs centaines d’acides aminés, les informations requises doivent être vraiment énormes. Il est stocké (de la même manière qu’un enregistrement est stocké sur une bande magnétique) dans les molécules d’acide nucléique qui composent les gènes. Cm . également HÉRÉDITAIRE ; ACIDES NUCLÉIQUES.Activation enzymatique. Une chaîne polypeptidique synthétisée à partir d’acides aminés n’est pas toujours une protéine dans sa forme finale. De nombreuses enzymes sont d'abord synthétisées sous forme de précurseurs inactifs et ne deviennent actives qu'après qu'une autre enzyme ait éliminé plusieurs acides aminés à une extrémité de la chaîne. Certaines enzymes digestives, comme la trypsine, sont synthétisées sous cette forme inactive ; ces enzymes sont activées dans le tube digestif suite à l'élimination du fragment terminal de la chaîne. L'hormone insuline, dont la molécule dans sa forme active est constituée de deux chaînes courtes, est synthétisée sous la forme d'une chaîne, appelée. proinsuline. La partie médiane de cette chaîne est ensuite retirée et les fragments restants se lient pour former la molécule d’hormone active. Les protéines complexes ne se forment qu’après qu’un groupe chimique spécifique soit attaché à la protéine, et cet attachement nécessite souvent également une enzyme.Circulation métabolique. Après avoir nourri un animal avec des acides aminés marqués avec des isotopes radioactifs de carbone, d’azote ou d’hydrogène, le marqueur est rapidement incorporé à ses protéines. Si les acides aminés marqués cessent de pénétrer dans l’organisme, la quantité de marqueur dans les protéines commence à diminuer. Ces expériences montrent que les protéines résultantes ne sont pas retenues dans l’organisme jusqu’à la fin de la vie. Tous, à quelques exceptions près, sont dans un état dynamique, se décomposant constamment en acides aminés puis synthétisés à nouveau.Certaines protéines se décomposent lorsque les cellules meurent et sont détruites. Cela se produit tout le temps, par exemple avec les globules rouges et les cellules épithéliales tapissant la surface interne de l’intestin. De plus, la dégradation et la resynthèse des protéines se produisent également dans les cellules vivantes. Curieusement, on en sait moins sur la dégradation des protéines que sur leur synthèse. Il est clair, cependant, que la dégradation implique des enzymes protéolytiques similaires à celles qui décomposent les protéines en acides aminés dans le tube digestif.
La demi-vie de différentes protéines varie de quelques heures à plusieurs mois. La seule exception est la molécule de collagène. Une fois formés, ils restent stables et ne sont ni renouvelés ni remplacés. Cependant, avec le temps, certaines de leurs propriétés évoluent, notamment l'élasticité, et comme elles ne se renouvellent pas, cela entraîne certains changements liés à l'âge, comme l'apparition de rides sur la peau.
Protéines synthétiques. Les chimistes ont appris depuis longtemps à polymériser les acides aminés, mais les acides aminés sont combinés de manière désordonnée, de sorte que les produits d'une telle polymérisation ressemblent peu aux produits naturels. Certes, il est possible de combiner des acides aminés dans un ordre donné, ce qui permet d'obtenir certaines protéines biologiquement actives, notamment l'insuline. Le processus est assez compliqué et il est ainsi possible d'obtenir uniquement des protéines dont les molécules contiennent une centaine d'acides aminés. Il est préférable de synthétiser ou d'isoler la séquence nucléotidique d'un gène correspondant à la séquence d'acides aminés souhaitée, puis d'introduire ce gène dans une bactérie, qui produira par réplication de grandes quantités du produit recherché. Cette méthode présente cependant également des inconvénients. Cm . également GÉNIE GÉNÉTIQUE. PROTÉINES ET NUTRITION Lorsque les protéines du corps sont décomposées en acides aminés, ces acides aminés peuvent être à nouveau utilisés pour synthétiser des protéines. Dans le même temps, les acides aminés eux-mêmes sont sujets à dégradation et ne sont donc pas entièrement réutilisés. Il est également clair que pendant la croissance, la grossesse et la cicatrisation des plaies, la synthèse des protéines doit dépasser la dégradation. Le corps perd continuellement certaines protéines ; Ce sont les protéines des cheveux, des ongles et de la couche superficielle de la peau. Par conséquent, pour synthétiser des protéines, chaque organisme doit recevoir des acides aminés provenant de l’alimentation. Les plantes vertes synthétisent du CO 2 , l'eau et l'ammoniaque ou les nitrates sont tous les 20 acides aminés présents dans les protéines. De nombreuses bactéries sont également capables de synthétiser des acides aminés en présence de sucre (ou d'un équivalent) et d'azote fixe, mais le sucre est finalement fourni par les plantes vertes. Les animaux ont une capacité limitée à synthétiser les acides aminés ; ils obtiennent des acides aminés en mangeant des plantes vertes ou d’autres animaux. Dans le tube digestif, les protéines absorbées sont décomposées en acides aminés, ces derniers sont absorbés et à partir d'eux sont construites les protéines caractéristiques d'un organisme donné. Aucune des protéines absorbées n’est incorporée dans les structures corporelles en tant que telles. La seule exception est que chez de nombreux mammifères, certains anticorps maternels peuvent passer intacts à travers le placenta dans la circulation sanguine fœtale et, via le lait maternel (en particulier chez les ruminants), peuvent être transférés au nouveau-né immédiatement après la naissance.Besoin en protéines. Il est clair que pour maintenir la vie, le corps doit recevoir une certaine quantité de protéines provenant des aliments. Toutefois, l’ampleur de ce besoin dépend d’un certain nombre de facteurs. Le corps a besoin de nourriture à la fois comme source d’énergie (calories) et comme matériau pour construire ses structures. Le besoin d’énergie vient en premier. Cela signifie que lorsqu'il y a peu de glucides et de graisses dans l'alimentation, les protéines alimentaires ne sont pas utilisées pour la synthèse de leurs propres protéines, mais comme source de calories. Lors d’un jeûne prolongé, même vos propres protéines sont utilisées pour satisfaire les besoins énergétiques. Si l’alimentation contient suffisamment de glucides, la consommation de protéines peut être réduite.Bilan azoté. En moyenne env. 16 % de la masse totale de protéines est constituée d’azote. Lorsque les acides aminés contenus dans les protéines sont décomposés, l'azote qu'elles contiennent est excrété par l'organisme dans les urines et (dans une moindre mesure) dans les selles sous forme de divers composés azotés. Il convient donc d'utiliser un indicateur tel que le bilan azoté pour évaluer la qualité de la nutrition protéique, c'est-à-dire la différence (en grammes) entre la quantité d'azote entrant dans l'organisme et la quantité d'azote excrétée par jour. Avec une alimentation normale chez un adulte, ces quantités sont égales. Dans un organisme en croissance, la quantité d'azote excrétée est inférieure à la quantité reçue, c'est-à-dire le solde est positif. S’il y a un manque de protéines dans l’alimentation, le bilan est négatif. S'il y a suffisamment de calories dans l'alimentation, mais qu'il ne contient pas de protéines, le corps stocke des protéines. Dans le même temps, le métabolisme des protéines ralentit et l'utilisation répétée des acides aminés dans la synthèse des protéines se produit avec la plus grande efficacité possible. Cependant, les pertes sont inévitables et les composés azotés sont toujours excrétés dans les urines et en partie dans les selles. La quantité d'azote excrétée par le corps par jour pendant le jeûne protéique peut servir de mesure de la carence quotidienne en protéines. Il est naturel de supposer qu’en introduisant dans l’alimentation une quantité de protéines équivalente à cette carence, l’équilibre azoté peut être rétabli. Cependant, ce n’est pas le cas. Après avoir reçu cette quantité de protéines, le corps commence à utiliser les acides aminés de manière moins efficace. Des protéines supplémentaires sont donc nécessaires pour rétablir l’équilibre azoté.Si la quantité de protéines dans l’alimentation dépasse ce qui est nécessaire pour maintenir l’équilibre azoté, il ne semble y avoir aucun danger. Les acides aminés en excès sont simplement utilisés comme source d’énergie. À titre d'exemple particulièrement frappant, les Esquimaux consomment peu de glucides et environ dix fois la quantité de protéines nécessaire au maintien de l'équilibre azoté. Cependant, dans la plupart des cas, l’utilisation des protéines comme source d’énergie n’est pas bénéfique, car une quantité donnée de glucides peut produire beaucoup plus de calories que la même quantité de protéines. Dans les pays pauvres, les gens tirent leurs calories des glucides et consomment des quantités minimes de protéines.
Si le corps reçoit le nombre requis de calories sous forme de produits non protéiques, la quantité minimale de protéines pour assurer le maintien de l'équilibre azoté est d'env. 30 g par jour. Quatre tranches de pain ou 0,5 litre de lait contiennent environ autant de protéines. Un nombre légèrement plus élevé est généralement considéré comme optimal ; 50 à 70 g sont recommandés.
Acides aminés essentiels. Jusqu’à présent, les protéines étaient considérées comme un tout. Pendant ce temps, pour que la synthèse des protéines se produise, tous les acides aminés nécessaires doivent être présents dans l’organisme. Le corps de l’animal lui-même est capable de synthétiser certains acides aminés. Ils sont dits remplaçables car ils ne doivent pas nécessairement être présents dans l'alimentation, il est seulement important que l'apport global en protéines comme source d'azote soit suffisant ; puis, en cas de pénurie d’acides aminés non essentiels, l’organisme peut les synthétiser au détriment de ceux qui sont présents en excès. Les acides aminés « essentiels » restants ne peuvent pas être synthétisés et doivent être apportés à l’organisme par l’alimentation. Les substances essentielles pour l'homme sont la valine, la leucine, l'isoleucine, la thréonine, la méthionine, la phénylalanine, le tryptophane, l'histidine, la lysine et l'arginine. (Bien que l'arginine puisse être synthétisée dans l'organisme, elle est classée comme acide aminé essentiel car elle n'est pas produite en quantité suffisante chez les nouveau-nés et les enfants en pleine croissance. D'autre part, certains de ces acides aminés provenant de l'alimentation peuvent devenir inutiles pour un adulte. personne.)Cette liste d’acides aminés essentiels est à peu près la même chez les autres vertébrés et même chez les insectes. La valeur nutritionnelle des protéines est généralement déterminée en les nourrissant à des rats en croissance et en surveillant leur prise de poids.
Valeur nutritionnelle des protéines. La valeur nutritionnelle d’une protéine est déterminée par l’acide aminé essentiel le plus déficient. Illustrons cela avec un exemple. Les protéines de notre corps contiennent en moyenne env. 2% de tryptophane (en poids). Disons que le régime comprend 10 g de protéines contenant 1% de tryptophane et qu'il contient suffisamment d'autres acides aminés essentiels. Dans notre cas, 10 g de cette protéine incomplète équivaut essentiellement à 5 g de protéine complète ; les 5 g restants ne peuvent servir que de source d’énergie. Notez que comme les acides aminés ne sont pratiquement pas stockés dans l'organisme et que pour que la synthèse des protéines se produise, tous les acides aminés doivent être présents en même temps, l'effet de l'apport d'acides aminés essentiels ne peut être détecté que si tous entrer dans le corps en même temps. La composition moyenne de la plupart des protéines animales est proche de la composition moyenne des protéines du corps humain. Il est donc peu probable que nous soyons confrontés à une carence en acides aminés si notre alimentation est riche en aliments tels que la viande, les œufs, le lait et le fromage. Cependant, certaines protéines, comme la gélatine (produit de la dénaturation du collagène), contiennent très peu d’acides aminés essentiels. Les protéines végétales, bien que meilleures que la gélatine en ce sens, sont également pauvres en acides aminés essentiels ; Ils sont particulièrement pauvres en lysine et en tryptophane. Néanmoins, un régime purement végétarien ne peut pas du tout être considéré comme nocif, à moins qu'il ne consomme une quantité légèrement plus importante de protéines végétales, suffisantes pour fournir à l'organisme les acides aminés essentiels. Les plantes contiennent le plus de protéines dans leurs graines, en particulier dans les graines de blé et diverses légumineuses. Les jeunes pousses, comme les asperges, sont également riches en protéines.Protéines synthétiques dans l'alimentation. En ajoutant de petites quantités d'acides aminés essentiels synthétiques ou de protéines riches en acides aminés à des protéines incomplètes, telles que les protéines de maïs, la valeur nutritionnelle de ces dernières peut être considérablement augmentée, c'est-à-dire augmentant ainsi la quantité de protéines consommées. Une autre possibilité consiste à cultiver des bactéries ou des levures sur des hydrocarbures pétroliers en ajoutant des nitrates ou de l'ammoniac comme source d'azote. La protéine microbienne ainsi obtenue peut servir d’aliment pour la volaille ou le bétail, ou peut être directement consommée par l’homme. La troisième méthode, largement utilisée, utilise la physiologie des ruminants. Chez les ruminants, dans la partie initiale de l'estomac, ce qu'on appelle. Le rumen est habité par des formes spéciales de bactéries et de protozoaires qui convertissent les protéines végétales incomplètes en protéines microbiennes plus complètes, et celles-ci, à leur tour, après digestion et absorption, se transforment en protéines animales. L'urée, un composé azoté synthétique bon marché, peut être ajoutée aux aliments du bétail. Les micro-organismes vivant dans le rumen utilisent l'azote uréique pour convertir les glucides (qui sont beaucoup plus présents dans l'aliment) en protéines. Environ un tiers de tout l’azote présent dans l’alimentation du bétail peut se présenter sous forme d’urée, ce qui correspond essentiellement, dans une certaine mesure, à la synthèse chimique des protéines. Aux États-Unis, cette méthode joue un rôle important comme moyen d’obtention de protéines.LITTÉRATURE Murray R., Grenner D., Mayes P., Rodwell W. Biochimie humaine, vol. 12. M., 1993Alberts B, Bray D, Lewis J et al. Biologie cellulaire moléculaire, vol. 13. M., 1994
Billet 2. 1. Facteurs nutritionnels essentiels de nature lipidique. Certains lipides ne sont pas synthétisés dans le corps humain et constituent donc des facteurs nutritionnels essentiels. Ceux-ci comprennent les acides gras avec deux ou plusieurs doubles liaisons (polyène) - acides gras essentiels. Certains de ces acides sont des substrats pour la synthèse d'hormones locales - les eicosanoïdes (thème 8.10).
Vitamines liposolubles remplir diverses fonctions : vitamine A participe au processus de vision, ainsi qu'à la croissance et à la différenciation cellulaire ; sa capacité à inhiber la croissance de certains types de tumeurs a été prouvée ; vitamine K participe à la coagulation du sang; Vitamine D participe à la régulation du métabolisme du calcium ; vitamine E- antioxydant, inhibe la formation de radicaux libres et neutralise ainsi les dommages cellulaires dus à la peroxydation lipidique.
Document
2.Structure et niveaux d'organisation structurelle des protéines
Il existe quatre niveaux d'organisation structurelle des protéines : primaire, secondaire, tertiaire et quaternaire. Chaque niveau a ses propres caractéristiques.
Structure protéique primaire
La structure principale des protéines est une chaîne polypeptidique linéaire d'acides aminés reliés par des liaisons peptidiques. La structure primaire est le niveau le plus simple d’organisation structurelle d’une molécule protéique. Une grande stabilité lui est conférée par les liaisons peptidiques covalentes entre le groupe α-amino d'un acide aminé et le groupe α-carboxyle d'un autre acide aminé. [montrer].
Si le groupe imino de la proline ou de l'hydroxyproline est impliqué dans la formation d'une liaison peptidique, alors il a une forme différente [montrer].
Lorsque des liaisons peptidiques se forment dans les cellules, le groupe carboxyle d’un acide aminé est d’abord activé, puis il se combine avec le groupe amino d’un autre. La synthèse en laboratoire des polypeptides s'effectue à peu près de la même manière.
Une liaison peptidique est un fragment répétitif d’une chaîne polypeptidique. Il présente un certain nombre de caractéristiques qui affectent non seulement la forme de la structure primaire, mais également les niveaux supérieurs d'organisation de la chaîne polypeptidique :

coplanarité - tous les atomes inclus dans le groupe peptidique sont dans le même plan ;
la capacité d'exister sous deux formes de résonance (forme céto ou énol) ;
position trans des substituants par rapport à la liaison C-N ;
la capacité de former des liaisons hydrogène, et chacun des groupes peptidiques peut former deux liaisons hydrogène avec d'autres groupes, y compris des groupes peptidiques.
L'exception concerne les groupes peptidiques impliquant le groupe amino de la proline ou de l'hydroxyproline. Ils ne sont capables de former qu’une seule liaison hydrogène (voir ci-dessus). Cela affecte la formation de la structure secondaire de la protéine. La chaîne polypeptidique dans la zone où se trouve la proline ou l'hydroxyproline se plie facilement, car elle n'est pas maintenue, comme d'habitude, par une deuxième liaison hydrogène.
Nomenclature des peptides et polypeptides. Le nom des peptides est composé des noms de leurs acides aminés constitutifs. Deux acides aminés forment un dipeptide, trois forment un tripeptide, quatre forment un tétrapeptide, etc. Chaque peptide ou chaîne polypeptidique de n'importe quelle longueur possède un acide aminé N-terminal contenant un groupe amino libre et un acide aminé C-terminal contenant un carboxyle libre. groupe. Lors de la dénomination des polypeptides, tous les acides aminés sont répertoriés séquentiellement, en commençant par celui N-terminal, en remplaçant dans leurs noms, à l'exception de celui C-terminal, le suffixe -in par -yl (puisque les acides aminés des peptides n'ont plus de groupe carboxyle, mais un groupe carbonyle). Par exemple, le nom montré sur la Fig. 1 tripeptide - leuc limon phénylalane limon thréo dans.
Caractéristiques de la structure primaire de la protéine. Dans le squelette de la chaîne polypeptidique, des structures rigides (groupes peptidiques plats) alternent avec des régions relativement mobiles (-CHR), capables de tourner autour des liaisons. De telles caractéristiques structurelles de la chaîne polypeptidique affectent sa disposition spatiale.
Structure secondaire des protéines
La structure secondaire est un moyen de replier une chaîne polypeptidique en une structure ordonnée en raison de la formation de liaisons hydrogène entre les groupes peptidiques de la même chaîne ou les chaînes polypeptidiques adjacentes. Selon leur configuration, les structures secondaires sont divisées en hélices (hélice α) et en couches pliées (structure β et forme β croisée).


α-Hélix. Il s’agit d’un type de structure protéique secondaire qui ressemble à une hélice régulière, formée en raison de liaisons hydrogène interpeptidiques au sein d’une chaîne polypeptidique. Le modèle de structure de l'hélice α (Fig. 2), qui prend en compte toutes les propriétés de la liaison peptidique, a été proposé par Pauling et Corey. Principales caractéristiques de l’hélice α :
configuration hélicoïdale de la chaîne polypeptidique ayant une symétrie hélicoïdale ;
la formation de liaisons hydrogène entre les groupes peptidiques de chaque premier et quatrième résidu d'acide aminé ;
régularité des tours en spirale;
l'équivalence de tous les résidus d'acides aminés dans l'hélice α, quelle que soit la structure de leurs radicaux latéraux ;
les radicaux latéraux des acides aminés ne participent pas à la formation de l'hélice α.
Extérieurement, l'hélice α ressemble à la spirale légèrement étirée d'une cuisinière électrique. La régularité des liaisons hydrogène entre les premier et quatrième groupes peptidiques détermine la régularité des tours de la chaîne polypeptidique. La hauteur d'un tour, ou le pas de l'hélice α, est de 0,54 nm ; il comprend 3,6 résidus d'acides aminés, c'est-à-dire que chaque résidu d'acide aminé se déplace le long de l'axe (la hauteur d'un résidu d'acide aminé) de 0,15 nm (0,54 : 3,6 = 0,15 nm), ce qui nous permet de parler d'équivalence de tous les résidus d'acides aminés dans l'hélice α. La période de régularité d'une hélice α est de 5 tours ou 18 résidus d'acides aminés ; la durée d'une période est de 2,7 nm. Riz. 3. Modèle à hélice a de Pauling-Corey
Structure β. Il s'agit d'un type de structure secondaire qui présente une configuration légèrement incurvée de la chaîne polypeptidique et est formée par des liaisons hydrogène interpeptidiques au sein de sections individuelles d'une chaîne polypeptidique ou de chaînes polypeptidiques adjacentes. On l'appelle également une structure à plis en couches. Il existe des variétés de structures β. Les régions en couches limitées formées par une chaîne polypeptidique d’une protéine sont appelées forme β croisée (structure β courte). Des liaisons hydrogène sous forme β croisée se forment entre les groupes peptidiques des boucles de la chaîne polypeptidique. Un autre type - la structure β complète - est caractéristique de l'ensemble de la chaîne polypeptidique, qui a une forme allongée et est maintenue par des liaisons hydrogène interpeptidiques entre des chaînes polypeptidiques parallèles adjacentes (Fig. 3). Cette structure ressemble au soufflet d'un accordéon. De plus, des variantes de structures β sont possibles : elles peuvent être formées de chaînes parallèles (les extrémités N-terminales des chaînes polypeptidiques sont dirigées dans la même direction) et antiparallèles (les extrémités N-terminales sont dirigées dans des directions différentes). Les radicaux latéraux d'une couche sont placés entre les radicaux latéraux d'une autre couche.
Dans les protéines, les transitions des structures α aux structures β et inversement sont possibles en raison du réarrangement des liaisons hydrogène. Au lieu de liaisons hydrogène interpeptidiques régulières le long de la chaîne (grâce auxquelles la chaîne polypeptidique est tordue en spirale), les sections hélicoïdales se déroulent et les liaisons hydrogène se ferment entre les fragments allongés des chaînes polypeptidiques. Cette transition se retrouve dans la kératine, la protéine du cheveu. Lors du lavage des cheveux avec des détergents alcalins, la structure hélicoïdale de la β-kératine est facilement détruite et se transforme en α-kératine (les cheveux bouclés se lissent).
La destruction des structures secondaires régulières des protéines (hélices α et structures β), par analogie avec la fusion d'un cristal, est appelée « fusion » des polypeptides. Dans ce cas, les liaisons hydrogène sont rompues et les chaînes polypeptidiques prennent la forme d'un enchevêtrement aléatoire. Par conséquent, la stabilité des structures secondaires est déterminée par les liaisons hydrogène interpeptides. D'autres types de liaisons n'y participent presque pas, à l'exception des liaisons disulfure le long de la chaîne polypeptidique aux emplacements des résidus de cystéine. Les peptides courts sont fermés en cycles en raison des liaisons disulfure. De nombreuses protéines contiennent à la fois des régions hélicoïdales α et des structures β. Il n'existe presque pas de protéines naturelles constituées à 100 % d'hélice α (à l'exception de la paramyosine, une protéine musculaire qui contient 96 à 100 % d'hélice α), tandis que les polypeptides synthétiques ont 100 % d'hélice.
D’autres protéines présentent différents degrés d’enroulement. Une fréquence élevée de structures hélicoïdales α est observée dans la paramyosine, la myoglobine et l'hémoglobine. En revanche, dans la trypsine, une ribonucléase, une partie importante de la chaîne polypeptidique est repliée en structures β en couches. Les protéines des tissus de soutien : la kératine (protéine des cheveux, de la laine), le collagène (protéine des tendons, de la peau), la fibroïne (protéine de la soie naturelle) ont une configuration β de chaînes polypeptidiques. Les différents degrés d'hélicité des chaînes polypeptidiques des protéines indiquent qu'il existe évidemment des forces qui perturbent partiellement l'hélicité ou « brisent » le repliement régulier de la chaîne polypeptidique. La raison en est un repliement plus compact de la chaîne polypeptidique protéique dans un certain volume, c'est-à-dire dans une structure tertiaire.
Structure tertiaire des protéines
La structure tertiaire d’une protéine correspond à la manière dont la chaîne polypeptidique est disposée dans l’espace. En fonction de la forme de leur structure tertiaire, les protéines sont principalement divisées en globulaires et fibrillaires. Les protéines globulaires ont le plus souvent une forme ellipsoïde et les protéines fibrillaires (en forme de fil) ont une forme allongée (en forme de bâtonnet ou de fuseau).
Cependant, la configuration de la structure tertiaire des protéines ne donne pas encore de raisons de penser que les protéines fibrillaires n'ont qu'une structure β et que les protéines globulaires ont une structure en hélice α. Il existe des protéines fibrillaires qui ont une structure secondaire repliée en hélice plutôt qu'en couches. Par exemple, l'α-kératine et la paramyosine (protéine du muscle obturateur des mollusques), les tropomyosines (protéines des muscles squelettiques) appartiennent aux protéines fibrillaires (ont la forme d'un bâtonnet) et leur structure secondaire est l'hélice α ; en revanche, les protéines globulaires peuvent contenir un grand nombre de structures β.
La spiralisation d'une chaîne polypeptidique linéaire réduit sa taille d'environ 4 fois ; et son emballage dans la structure tertiaire la rend des dizaines de fois plus compacte que la chaîne d'origine.
Liaisons qui stabilisent la structure tertiaire d'une protéine. Les liaisons entre les radicaux latéraux des acides aminés jouent un rôle dans la stabilisation de la structure tertiaire. Ces connexions peuvent être divisées en :
fort (covalent) [montrer].
faible (polaire et van der Waals) [montrer].
De nombreuses liaisons entre les radicaux latéraux des acides aminés déterminent la configuration spatiale de la molécule protéique.
Caractéristiques de l'organisation de la structure tertiaire des protéines. La conformation de la structure tertiaire de la chaîne polypeptidique est déterminée par les propriétés des radicaux latéraux des acides aminés qu'elle contient (qui n'ont pas d'effet notable sur la formation de structures primaires et secondaires) et du microenvironnement, c'est-à-dire le environnement. Une fois repliée, la chaîne polypeptidique d'une protéine a tendance à prendre une forme énergétiquement favorable, caractérisée par un minimum d'énergie libre. Par conséquent, les groupes R non polaires, « évitant » l'eau, forment pour ainsi dire la partie interne de la structure tertiaire de la protéine, où se trouve la partie principale des résidus hydrophobes de la chaîne polypeptidique. Il n'y a presque pas de molécules d'eau au centre du globule protéique. Les groupes R polaires (hydrophiles) de l’acide aminé sont situés à l’extérieur de ce noyau hydrophobe et sont entourés de molécules d’eau. La chaîne polypeptidique est complexement courbée dans l’espace tridimensionnel. Lorsqu’il se plie, la conformation hélicoïdale secondaire est perturbée. La chaîne « se brise » aux points faibles où se trouvent la proline ou l'hydroxyproline, car ces acides aminés sont plus mobiles dans la chaîne, ne formant qu'une seule liaison hydrogène avec les autres groupes peptidiques. Un autre site de courbure est la glycine, qui possède un petit groupe R (hydrogène). Par conséquent, les groupes R des autres acides aminés, lorsqu’ils sont empilés, ont tendance à occuper l’espace libre à l’emplacement de la glycine. Un certain nombre d'acides aminés - alanine, leucine, glutamate, histidine - contribuent à la préservation de structures hélicoïdales stables dans les protéines, et comme la méthionine, la valine, l'isoleucine, l'acide aspartique favorisent la formation de structures β. Dans une molécule protéique de configuration tertiaire, il existe des régions sous forme d'hélices α (hélicoïdales), de structures β (en couches) et d'une bobine aléatoire. Seule la disposition spatiale correcte de la protéine la rend active ; sa violation entraîne des modifications des propriétés des protéines et une perte d'activité biologique.
Structure protéique quaternaire
Les protéines constituées d'une chaîne polypeptidique n'ont qu'une structure tertiaire. Il s'agit notamment de la myoglobine, une protéine du tissu musculaire impliquée dans la liaison de l'oxygène, d'un certain nombre d'enzymes (lysozyme, pepsine, trypsine, etc.). Cependant, certaines protéines sont construites à partir de plusieurs chaînes polypeptidiques, chacune possédant une structure tertiaire. Pour de telles protéines, le concept de structure quaternaire a été introduit, qui est l'organisation de plusieurs chaînes polypeptidiques de structure tertiaire en une seule molécule protéique fonctionnelle. Une telle protéine à structure quaternaire est appelée oligomère, et ses chaînes polypeptidiques à structure tertiaire sont appelées protomères ou sous-unités (Fig. 4).

Au niveau quaternaire d'organisation, les protéines conservent la configuration de base de la structure tertiaire (globulaire ou fibrillaire). Par exemple, l’hémoglobine est une protéine de structure quaternaire et composée de quatre sous-unités. Chacune des sous-unités est une protéine globulaire et, en général, l'hémoglobine a également une configuration globulaire. Protéines des cheveux et de la laine - les kératines, liées en structure tertiaire aux protéines fibrillaires, ont une conformation fibrillaire et une structure quaternaire.
Stabilisation de la structure quaternaire des protéines. Toutes les protéines ayant une structure quaternaire sont isolées sous forme de macromolécules individuelles qui ne se décomposent pas en sous-unités. Les contacts entre les surfaces des sous-unités ne sont possibles que grâce aux groupes polaires de résidus d'acides aminés, puisque lors de la formation de la structure tertiaire de chacune des chaînes polypeptidiques, les radicaux latéraux des acides aminés non polaires (qui constituent la majorité des tous les acides aminés protéinogènes) sont cachés à l’intérieur de la sous-unité. De nombreuses liaisons ioniques (sel), hydrogène et dans certains cas disulfure se forment entre leurs groupes polaires, qui maintiennent fermement les sous-unités sous la forme d'un complexe organisé. L'utilisation de substances qui rompent les liaisons hydrogène ou de substances qui réduisent les ponts disulfure provoque la désagrégation des protomères et la destruction de la structure quaternaire de la protéine. Dans le tableau 1 résume les données sur les liaisons qui stabilisent différents niveaux d'organisation de la molécule protéique [montrer].
Caractéristiques de l'organisation structurelle de certaines protéines fibrillaires
L'organisation structurelle des protéines fibrillaires présente un certain nombre de caractéristiques par rapport aux protéines globulaires. Ces caractéristiques peuvent être observées dans l’exemple de la kératine, de la fibroïne et du collagène. Les kératines existent dans les conformations α et β. Les α-kératines et la fibroïne ont une structure secondaire pliée en couches, cependant, dans la kératine, les chaînes sont parallèles et dans la fibroïne, elles sont antiparallèles (voir Fig. 3) ; De plus, la kératine contient des liaisons disulfure interchaînes, alors que la fibroïne n'en possède pas. La rupture des liaisons disulfure conduit à la séparation des chaînes polypeptidiques dans les kératines. Au contraire, la formation d’un nombre maximum de liaisons disulfure dans les kératines par exposition à des agents oxydants crée une structure spatiale forte. De manière générale, dans les protéines fibrillaires, contrairement aux protéines globulaires, il est parfois difficile de distinguer strictement les différents niveaux d'organisation. Si nous acceptons (comme pour une protéine globulaire) que la structure tertiaire doit être formée en posant une chaîne polypeptidique dans l'espace et la structure quaternaire par plusieurs chaînes, alors dans les protéines fibrillaires, plusieurs chaînes polypeptidiques sont déjà impliquées lors de la formation de la structure secondaire. . Un exemple typique de protéine fibrillaire est le collagène, qui est l’une des protéines les plus abondantes dans le corps humain (environ 1/3 de la masse de toutes les protéines). On le retrouve dans les tissus à haute résistance et faible extensibilité (os, tendons, peau, dents, etc.). Dans le collagène, un tiers des résidus d'acides aminés sont de la glycine et environ un quart ou un peu plus sont de la proline ou de l'hydroxyproline.

La chaîne polypeptidique isolée du collagène (structure primaire) ressemble à une ligne brisée. Il contient environ 1 000 acides aminés et a un poids moléculaire d'environ 10 5 (Fig. 5, a, b). La chaîne polypeptidique est construite à partir d'un trio répétitif d'acides aminés (triplet) de la composition suivante : gly-A-B, où A et B sont des acides aminés autres que la glycine (le plus souvent la proline et l'hydroxyproline). Les chaînes polypeptidiques du collagène (ou chaînes α) lors de la formation de structures secondaires et tertiaires (Fig. 5, c et d) ne peuvent pas produire d'hélices α typiques à symétrie hélicoïdale. La proline, l'hydroxyproline et la glycine (acides aminés antihélicoïdaux) interfèrent avec cela. Par conséquent, trois chaînes α forment pour ainsi dire des spirales torsadées, comme trois fils s’enroulant autour d’un cylindre. Trois chaînes α hélicoïdales forment une structure de collagène répétitive appelée tropocollagène (Fig. 5d). Le tropocollagène dans son organisation est la structure tertiaire du collagène. Les anneaux plats de proline et d'hydroxyproline alternant régulièrement le long de la chaîne lui confèrent de la rigidité, tout comme les liaisons interchaînes entre les chaînes α du tropocollagène (c'est pourquoi le collagène résiste à l'étirement). Le tropocollagène est essentiellement une sous-unité des fibrilles de collagène. La pose des sous-unités de tropocollagène dans la structure quaternaire du collagène se fait par étapes (Fig. 5e).
La stabilisation des structures de collagène est due aux liaisons hydrogène, ioniques et de Van der Waals entre chaînes et à un petit nombre de liaisons covalentes.
Les chaînes α du collagène ont des structures chimiques différentes. Il existe différents types de chaînes α 1 (I, II, III, IV) et α 2. Selon les chaînes α 1 - et α 2 impliquées dans la formation de l'hélice à trois brins du tropocollagène, on distingue quatre types de collagène :
le premier type - deux chaînes α 1 (I) et une chaîne α 2 ;
le deuxième type - trois chaînes α 1 (II);
troisième type - trois chaînes α 1 (III);
quatrième type - trois chaînes α 1 (IV).
Le collagène le plus courant est le premier type : on le trouve dans les tissus osseux, la peau, les tendons ; le collagène de type 2 se trouve dans les tissus cartilagineux, etc. Un type de tissu peut contenir différents types de collagène.
L'agrégation ordonnée des structures de collagène, leur rigidité et leur inertie assurent la haute résistance des fibres de collagène. Les protéines de collagène contiennent également des composants glucidiques, c'est-à-dire qu'il s'agit de complexes protéines-glucides.
Le collagène est une protéine extracellulaire formée par les cellules du tissu conjonctif présentes dans tous les organes. Par conséquent, en cas de dommages au collagène (ou de perturbation de sa formation), de multiples violations des fonctions de soutien du tissu conjonctif des organes se produisent.
La chaîne polypeptidique alpha se termine par la combinaison d'acides aminés valine-leucine, et la chaîne polypeptidique bêta se termine par la combinaison valine-histidine-leucine. Les chaînes polypeptidiques alpha et bêta de la molécule d’hémoglobine ne sont pas disposées de manière linéaire ; c’est la structure primaire. En raison de l'existence de forces intramoléculaires, les chaînes polypeptidiques sont tordues sous la forme d'une hélice alpha (structure secondaire) typique des protéines. L'hélice alpha-hélice elle-même se plie spatialement pour chaque chaîne polypeptidique alpha et bêta, formant des plexus de forme ovoïde (structure tertiaire). Les parties individuelles des hélices alpha des chaînes polypeptidiques sont marquées par des lettres latines de A à H. Les quatre chaînes polypeptidiques alpha et bêta incurvées tertiaires sont situées spatialement dans une certaine relation - une structure quaternaire. Ils ne sont pas reliés par de véritables liaisons chimiques, mais par des forces intermoléculaires.
Il s'est avéré que les humains ont trois principaux types d'hémoglobine normale : embryonnaire - U, fœtale - F et adulte - A. L'HbU (du nom de la lettre initiale du mot utérus) apparaît dans l'embryon entre 7 et 12 semaines de vie, puis elle disparaît et apparaît l'hémoglobine fœtale, qui après le troisième mois est l'hémoglobine principale du fœtus. Ensuite, apparaît progressivement l’hémoglobine adulte ordinaire, appelée HbA, après la première lettre du mot anglais « adult ». La quantité d'hémoglobine fœtale diminue progressivement, de sorte qu'au moment de la naissance, 80 % de l'hémoglobine est de l'HbA et seulement 20 % de l'HbF. Après la naissance, l'hémoglobine fœtale continue de diminuer et au bout de 2 à 3 ans de vie, elle n'est plus que de 1 à 2 %. La même quantité d'hémoglobine fœtale se trouve chez un adulte. Une quantité d'HbF supérieure à 2 % est considérée comme pathologique chez l'adulte et chez l'enfant de plus de 3 ans.
En plus des types normaux d'hémoglobine, plus de 50 variantes pathologiques sont actuellement connues. Ils ont d'abord été nommés avec des lettres latines. La lettre B est absente dans la désignation des types d'hémoglobine, puisqu'elle désignait à l'origine HbS.
Hémoglobine (Hb)- une chromoprotéine présente dans les globules rouges et impliquée dans le transport de l'oxygène vers les tissus. L'hémoglobine chez l'adulte est appelée hémoglobine A (Hb A). Son poids moléculaire est d'environ 65 000 Da. La molécule Hb A a une structure quaternaire et comprend quatre sous-unités - des chaînes polypeptidiques (désignées α1, α2, β1 et β2, dont chacune est associée à l'hème.
Rappelons que l'hémoglobine est une protéine allostérique ; ses molécules peuvent changer de manière réversible d'une conformation à une autre. Cela modifie l'affinité de la protéine pour les ligands. La conformation ayant la moindre affinité pour le ligand est appelée la conformation tendue ou T-conformation. La conformation ayant la plus grande affinité pour le ligand est appelée conformation détendue ou R.
Les conformations R et T de la molécule d'hémoglobine sont dans un état d'équilibre dynamique :
Divers facteurs environnementaux peuvent modifier cet équilibre dans un sens ou dans l’autre. Les régulateurs allostériques affectant l'affinité de l'Hb pour l'O2 sont : 1) l'oxygène ; 2) concentration H+ (pH moyen) ; 3) dioxyde de carbone (CO2) ; 4) 2,3-diphosphoglycérate (DPG). L'attachement d'une molécule d'oxygène à l'une des sous-unités de l'hémoglobine favorise la transition d'une conformation tendue vers une conformation détendue et augmente l'affinité pour l'oxygène des autres sous-unités de la même molécule d'hémoglobine. Ce phénomène est appelé effet coopératif. La nature complexe de la liaison de l'hémoglobine à l'oxygène se reflète dans la courbe de saturation de l'hémoglobine en O2, qui a la forme d'un S (Figure 3.1).

Graphique 3.1. Courbes de saturation en oxygène de la myoglobine (1) et de l'hémoglobine (2).
Formes moléculaires l'hémoglobine diffère les unes des autres par la structure des chaînes polypeptidiques. Un exemple d'une telle variété d'hémoglobine qui existe dans des conditions physiologiques est hémoglobine fœtale (HbF), présent dans le sang au stade embryonnaire du développement humain. Contrairement à l'HbA, sa molécule contient 2 chaînes α et 2 chaînes γ (c'est-à-dire que les chaînes β sont remplacées par des chaînes γ). Cette hémoglobine a une affinité plus élevée pour l'oxygène. C'est ce qui permet à l'embryon de recevoir l'oxygène du sang de la mère via le placenta. Peu de temps après la naissance, l'HbF présente dans le sang du bébé est remplacée par l'HbA.
Un exemple d'hémoglobine anormale ou pathologique est l'hémoglobine S déjà mentionnée (voir 2.4.), trouvée chez les patients atteints d'anémie falciforme. Comme vous le savez déjà, elle diffère de l'hémoglobine A en remplaçant le glutamate par de la valine dans les chaînes β. Cette substitution d'acides aminés provoque une diminution de la solubilité de l'HbS dans l'eau et une diminution de son affinité pour l'O2.
Comme vous le savez, les protéines sont à la base de l’origine de la vie sur notre planète. Mais c'est la gouttelette de coacervat, constituée de molécules peptidiques, qui est devenue la base de l'origine des êtres vivants. Cela ne fait aucun doute, car l'analyse de la composition interne de tout représentant de la biomasse montre que ces substances sont présentes dans tout : plantes, animaux, micro-organismes, champignons, virus. De plus, ils sont très divers et de nature macromoléculaire.
Ces structures portent quatre noms, tous synonymes :
- protéines;
- protéines;
- les polypeptides ;
- peptides.
Molécules de protéines
Leur nombre est vraiment innombrable. Dans ce cas, toutes les molécules protéiques peuvent être divisées en deux grands groupes :
- simple - constitué uniquement de séquences d'acides aminés reliées par des liaisons peptidiques ;
- complexe - la structure et la structure de la protéine sont caractérisées par des groupes protolytiques (prothétiques) supplémentaires, également appelés cofacteurs.
Dans le même temps, les molécules complexes ont également leur propre classification.
Gradation de peptides complexes
- Les glycoprotéines sont des composés étroitement liés de protéines et de glucides. Des groupes prothétiques de mucopolysaccharides sont intégrés à la structure de la molécule.
- Les lipoprotéines sont un composé complexe de protéines et de lipides.
- Métalloprotéines - les ions métalliques (fer, manganèse, cuivre et autres) agissent comme un groupe prothétique.
- Les nucléoprotéines constituent le lien entre les protéines et les acides nucléiques (ADN, ARN).
- Phosphoprotéines - conformation d'une protéine et d'un résidu d'acide orthophosphorique.
- Les chromoprotéines sont très similaires aux métalloprotéines, cependant, l'élément qui fait partie du groupe prothétique est un complexe coloré complet (rouge - hémoglobine, vert - chlorophylle, etc.).
Dans chaque groupe considéré, la structure et les propriétés des protéines sont différentes. Les fonctions qu’ils remplissent varient également selon le type de molécule.

Structure chimique des protéines
De ce point de vue, les protéines sont une chaîne longue et massive de résidus d’acides aminés reliés entre eux par des liaisons spécifiques appelées liaisons peptidiques. Des branches appelées radicaux s'étendent à partir des structures latérales des acides. Cette structure moléculaire a été découverte par E. Fischer au début du 21e siècle.
Plus tard, les protéines, leur structure et leurs fonctions ont été étudiées plus en détail. Il est devenu clair qu'il n'y a que 20 acides aminés qui forment la structure du peptide, mais ils peuvent être combinés de différentes manières. D'où la variété des structures polypeptidiques. De plus, au cours de la vie et dans l'exercice de leurs fonctions, les protéines sont capables de subir un certain nombre de transformations chimiques. En conséquence, ils modifient la structure et un tout nouveau type de connexion apparaît.
Pour rompre la liaison peptidique, c'est-à-dire perturber la protéine et la structure des chaînes, il faut sélectionner des conditions très strictes (températures élevées, acides ou alcalis, catalyseur). Cela est dû à la force élevée de la molécule, notamment du groupe peptidique.

La détection de la structure des protéines en laboratoire est réalisée à l'aide de la réaction du biuret - exposition au polypeptide (II) fraîchement précipité. Le complexe du groupe peptidique et de l’ion cuivre donne une couleur violet vif.
Il existe quatre organisations structurelles principales, chacune ayant ses propres caractéristiques structurelles des protéines.
Niveaux d'organisation : structure primaire
Comme mentionné ci-dessus, un peptide est une séquence de résidus d'acides aminés avec ou sans inclusions, coenzymes. Ainsi, le primaire est la structure d'une molécule naturelle, naturelle, véritablement composée d'acides aminés reliés par des liaisons peptidiques, et rien de plus. C'est-à-dire un polypeptide avec une structure linéaire. De plus, les caractéristiques structurelles des protéines de ce type sont qu'une telle combinaison d'acides est décisive pour remplir les fonctions de la molécule protéique. Grâce à la présence de ces caractéristiques, il est possible non seulement d'identifier un peptide, mais également de prédire les propriétés et le rôle d'un peptide complètement nouveau, non encore découvert. Des exemples de peptides ayant une structure primaire naturelle sont l'insuline, la pepsine, la chymotrypsine et autres.

Forme secondaire
La structure et les propriétés des protéines de cette catégorie varient quelque peu. Une telle structure peut être formée initialement par la nature ou lorsque la structure primaire est exposée à une hydrolyse, une température ou d'autres conditions sévères.
Cette conformation comporte trois variétés :
- Tours lisses, réguliers et stéréoréguliers, construits à partir de résidus d'acides aminés, qui s'enroulent autour de l'axe principal de la connexion. Ils sont maintenus ensemble uniquement par ceux qui apparaissent entre l’oxygène d’un groupe peptidique et l’hydrogène d’un autre. De plus, la structure est considérée comme correcte du fait que les tours sont répétés uniformément tous les 4 maillons. Une telle structure peut être soit gauchère, soit droitière. Mais dans la plupart des protéines connues, l’isomère dextrogyre prédomine. De telles conformations sont généralement appelées structures alpha.
- La composition et la structure des protéines du type suivant diffèrent du précédent en ce que des liaisons hydrogène ne se forment pas entre des résidus adjacents à un côté de la molécule, mais entre des résidus significativement éloignés et à une distance assez grande. Pour cette raison, la structure entière prend la forme de plusieurs chaînes polypeptidiques ondulées ressemblant à des serpents. Il y a une caractéristique qu’une protéine doit présenter. La structure des acides aminés sur les branches doit être la plus courte possible, comme la glycine ou l'alanine par exemple. Ce type de conformation secondaire est appelé feuillets bêta en raison de leur capacité à se coller pour former une structure commune.
- La biologie fait référence au troisième type de structure protéique comme étant des fragments complexes, dispersés de manière hétérogène et désordonnés qui n'ont pas de stéréorégularité et sont capables de changer de structure sous l'influence de conditions externes.
Aucun exemple de protéines possédant naturellement une structure secondaire n’a été identifié.

Éducation tertiaire
Il s'agit d'une conformation assez complexe appelée « globule ». Quelle est cette protéine ? Sa structure est basée sur la structure secondaire, cependant, de nouveaux types d'interactions entre les atomes des groupes s'ajoutent et la molécule entière semble se replier, se concentrant ainsi sur le fait que les groupes hydrophiles sont dirigés vers le globule et que les groupes hydrophobes sont dirigés vers le globule. ceux vers l’extérieur.
Ceci explique la charge de la molécule protéique dans les solutions colloïdales d'eau. Quels types d’interactions sont présents ici ?
- Liaisons hydrogène - restent inchangées entre les mêmes parties que dans la structure secondaire.
- interactions - se produisent lorsque le polypeptide est dissous dans l'eau.
- Les attractions ioniques se forment entre des groupes de résidus d'acides aminés (radicaux) chargés différemment.
- Interactions covalentes - peuvent se former entre des sites acides spécifiques - les molécules de cystéine, ou plutôt leurs queues.
Ainsi, la composition et la structure des protéines de structure tertiaire peuvent être décrites comme des chaînes polypeptidiques repliées en globules qui conservent et stabilisent leur conformation en raison de divers types d'interactions chimiques. Exemples de tels peptides : phosphoglycérate kénase, ARNt, alpha-kératine, fibroïne de soie et autres.
Structure quaternaire
C’est l’un des globules les plus complexes que forment les protéines. La structure et les fonctions des protéines de ce type sont très multiformes et spécifiques.
Quelle est cette conformation ? Il s’agit de plusieurs (dans certains cas des dizaines) grandes et petites chaînes polypeptidiques formées indépendamment les unes des autres. Mais ensuite, en raison des mêmes interactions que celles que nous avons prises en compte pour la structure tertiaire, tous ces peptides se tordent et s’entrelacent les uns avec les autres. De cette manière, on obtient des globules conformationnels complexes, qui peuvent contenir des atomes métalliques, des groupes lipidiques et des glucides. Exemples de telles protéines : ADN polymérase, enveloppe protéique du virus du tabac, hémoglobine et autres.

Toutes les structures peptidiques que nous avons examinées disposent de leurs propres méthodes d'identification en laboratoire, basées sur les capacités modernes d'utilisation de la chromatographie, de la centrifugation, de la microscopie électronique et optique et des hautes technologies informatiques.
Fonctions exercées
La structure et les fonctions des protéines sont étroitement liées les unes aux autres. Autrement dit, chaque peptide joue un rôle spécifique, unique et spécifique. Il existe également ceux qui sont capables d'effectuer plusieurs opérations importantes à la fois dans une seule cellule vivante. Cependant, il est possible d'exprimer sous une forme généralisée les principales fonctions des molécules protéiques dans les organismes vivants :
- Assurer le mouvement. Les organismes unicellulaires, ou organites, ou certains types de cellules sont capables de mouvement, de contraction et de mouvement. Ceci est assuré par les protéines qui composent la structure de leur appareil moteur : cils, flagelles et membrane cytoplasmique. Si l'on parle de cellules incapables de bouger, alors les protéines peuvent contribuer à leur contraction (myosine musculaire).
- Fonction nutritionnelle ou de réserve. Il s’agit de l’accumulation de molécules protéiques dans les œufs, les embryons et les graines des plantes pour reconstituer davantage les nutriments manquants. Une fois décomposés, les peptides produisent des acides aminés et des substances biologiquement actives nécessaires au développement normal des organismes vivants.
- Fonction énergétique. En plus des glucides, les protéines peuvent également apporter de la force au corps. La dégradation de 1 g de peptide libère 17,6 kJ d'énergie utile sous forme d'acide adénosine triphosphorique (ATP), qui est dépensée pour les processus vitaux.
- La signalisation consiste à surveiller attentivement les processus en cours et à transmettre des signaux des cellules aux tissus, de ceux-ci aux organes, de ces derniers aux systèmes, etc. Un exemple typique est l’insuline, qui fixe strictement la quantité de glucose dans le sang.
- Fonction récepteur. Elle est réalisée en modifiant la conformation du peptide d'un côté de la membrane et en impliquant l'autre extrémité dans la restructuration. Dans le même temps, le signal et les informations nécessaires sont transmis. Le plus souvent, ces protéines sont intégrées dans les membranes cytoplasmiques des cellules et exercent un contrôle strict sur toutes les substances qui les traversent. Ils fournissent également des informations sur les changements chimiques et physiques de l'environnement.
- Fonction de transport des peptides. Elle est réalisée par des protéines canaux et des protéines transporteuses. Leur rôle est évident : transporter les molécules nécessaires vers des endroits à faible concentration à partir de parties à forte concentration. Un exemple typique est le transport de l’oxygène et du dioxyde de carbone à travers les organes et les tissus par la protéine hémoglobine. Ils assurent également l'apport de composés de faible poids moléculaire à travers la membrane cellulaire vers l'intérieur.
- Fonction structurelle. L'une des fonctions les plus importantes remplies par les protéines. La structure de toutes les cellules et de leurs organites est assurée par des peptides. Comme un cadre, ils définissent la forme et la structure. De plus, ils le supportent et le modifient si nécessaire. Par conséquent, pour leur croissance et leur développement, tous les organismes vivants ont besoin de protéines dans leur alimentation. Ces peptides comprennent l'élastine, la tubuline, le collagène, l'actine, la kératine et autres.
- Fonction catalytique. Elle est réalisée par des enzymes. Nombreuses et variées, elles accélèrent toutes les réactions chimiques et biochimiques de l’organisme. Sans leur participation, une pomme ordinaire dans l'estomac pourrait être digérée en seulement deux jours, pourrissant probablement au cours du processus. Sous l'influence de la catalase, de la peroxydase et d'autres enzymes, ce processus se déroule en deux heures. De manière générale, c'est grâce à ce rôle des protéines que s'effectuent l'anabolisme et le catabolisme, c'est-à-dire la plastique et

Rôle protecteur
Il existe plusieurs types de menaces contre lesquelles les protéines sont conçues pour protéger l’organisme.
Premièrement, des réactifs traumatiques, des gaz, des molécules, des substances aux spectres d'action variés. Les peptides sont capables d'interagir chimiquement avec eux, les transformant en une forme inoffensive ou simplement les neutralisant.
Deuxièmement, la menace physique des blessures - si la protéine fibrinogène n'est pas transformée à temps en fibrine sur le site de la blessure, le sang ne coagulera pas, ce qui signifie qu'il n'y aura pas de blocage. Ensuite, au contraire, vous aurez besoin du peptide plasmine, qui peut dissoudre le caillot et restaurer la perméabilité du vaisseau.
Troisièmement, une menace pour l’immunité. La structure et l’importance des protéines qui forment la défense immunitaire sont extrêmement importantes. Anticorps, immunoglobulines, interférons - tous ces éléments sont des éléments importants et significatifs du système lymphatique et immunitaire humain. Toute particule étrangère, molécule nocive, partie morte d’une cellule ou d’une structure entière est soumise à un examen immédiat par le composé peptidique. C'est pourquoi une personne peut, de manière indépendante, sans l'aide de médicaments, se protéger quotidiennement contre les infections et les virus simples.
Propriétés physiques
La structure d'une protéine cellulaire est très spécifique et dépend de la fonction exercée. Mais les propriétés physiques de tous les peptides sont similaires et se résument aux caractéristiques suivantes.
- Le poids de la molécule peut atteindre 1 000 000 de Daltons.
- Les systèmes colloïdaux se forment dans une solution aqueuse. Là, la structure acquiert une charge qui peut varier en fonction de l'acidité du milieu.
- Lorsqu'ils sont exposés à des conditions difficiles (irradiation, acide ou alcali, température, etc.), ils sont capables de passer à d'autres niveaux de conformation, c'est-à-dire de se dénaturer. Ce processus est irréversible dans 90 % des cas. Cependant, il existe également un changement inverse : la renaturation.
Ce sont les principales propriétés des caractéristiques physiques des peptides.