สิ่งเหล่านี้คือสารประกอบอินทรีย์โมเลกุลสูง หรือไบโอโพลีเมอร์ ที่สร้างขึ้นจากสารตกค้างของกรด L-?-อะมิโน 20 ชนิดที่เชื่อมต่อกันในลำดับที่แน่นอนเป็นสายโซ่ยาว น้ำหนักโมเลกุลของโปรตีนแตกต่างกันไปตั้งแต่ 5,000 ถึง 1 ล้าน ในตอนแรกชื่อ "ไข่ขาว" มาจากสารในไข่นก ซึ่งจะจับตัวเป็นก้อนเมื่อถูกความร้อนจนกลายเป็นมวลสีขาวที่ไม่ละลายน้ำ ต่อมาได้ขยายไปยังสารอื่นๆ ที่มีคุณสมบัติคล้ายคลึงกันซึ่งแยกได้จากสัตว์และพืช
ข้าว. 1. ไบโอโพลีเมอร์ที่ซับซ้อนที่สุดคือโปรตีน โมเลกุลขนาดใหญ่ประกอบด้วยโมโนเมอร์ซึ่งเป็นกรดอะมิโน กรดอะมิโนแต่ละตัวมีหมู่ฟังก์ชัน 2 หมู่ คือ หมู่คาร์บอกซิล และหมู่อะมิโน ความหลากหลายของโปรตีนถูกสร้างขึ้นจากการรวมกันของกรดอะมิโน 20 ชนิดที่แตกต่างกัน
โปรตีนมีอิทธิพลเหนือกว่าสารประกอบอื่นๆ ทั้งหมดที่มีอยู่ในสิ่งมีชีวิต ซึ่งโดยปกติแล้วจะมีน้ำหนักมากกว่าครึ่งหนึ่งของน้ำหนักแห้ง สันนิษฐานว่ามีโปรตีนหลายพันล้านชนิดในธรรมชาติ (เช่น มีโปรตีนที่แตกต่างกันมากกว่า 3,000 ชนิดอยู่ในแบคทีเรีย E. coli เพียงอย่างเดียว)
โปรตีนมีบทบาทสำคัญในกระบวนการชีวิตของสิ่งมีชีวิตทุกชนิด โปรตีนรวมถึงเอนไซม์โดยมีส่วนร่วมซึ่งการเปลี่ยนแปลงทางเคมีทั้งหมดเกิดขึ้นในเซลล์ (การเผาผลาญ) พวกเขาควบคุมการกระทำของยีน เมื่อมีส่วนร่วมจะตระหนักถึงการกระทำของฮอร์โมนการขนส่งของเยื่อหุ้มเซลล์รวมถึงการสร้างแรงกระตุ้นของเส้นประสาท พวกมันเป็นส่วนสำคัญของระบบภูมิคุ้มกัน (อิมมูโนโกลบูลิน) และระบบการแข็งตัวของเลือด เป็นพื้นฐานของกระดูกและเนื้อเยื่อเกี่ยวพัน และมีส่วนร่วมในการเปลี่ยนแปลงและการใช้พลังงาน
ประวัติการวิจัยโปรตีน
ความพยายามครั้งแรกในการแยกโปรตีนเกิดขึ้นในศตวรรษที่ 18 เมื่อต้นศตวรรษที่ 19 มีผลงานชิ้นแรกเกี่ยวกับการศึกษาทางเคมีของโปรตีนปรากฏขึ้น นักวิทยาศาสตร์ชาวฝรั่งเศส Joseph Louis Gay-Lussac และ Louis Jacques Thénardพยายามสร้างองค์ประกอบองค์ประกอบของโปรตีนจากแหล่งต่าง ๆ ซึ่งเป็นจุดเริ่มต้นของการศึกษาเชิงวิเคราะห์อย่างเป็นระบบด้วยการสรุปได้ว่าโปรตีนทั้งหมดมีความคล้ายคลึงกันในชุดองค์ประกอบที่รวมอยู่ใน องค์ประกอบของพวกเขา ในปี พ.ศ. 2379 นักเคมีชาวดัตช์ G. J. Mulder เสนอทฤษฎีแรกของโครงสร้างของสารโปรตีนตามที่โปรตีนทั้งหมดมีอนุมูลสมมุติฐานที่แน่นอน (C 40 H 62 N 10 O 12) ซึ่งสัมพันธ์กันในสัดส่วนต่าง ๆ กับอะตอมของกำมะถันและฟอสฟอรัส เขาเรียกสิ่งนี้ว่า "โปรตีน" ที่ต่างไปจากเดิมอย่างสิ้นเชิง (จากโปรตีนกรีก - อันดับแรกหลัก) ทฤษฎีของ Mulder มีส่วนทำให้ความสนใจในการศึกษาโปรตีนเพิ่มขึ้นและปรับปรุงวิธีการทางเคมีของโปรตีน เทคนิคการแยกโปรตีนโดยการสกัดด้วยสารละลายเกลือที่เป็นกลางได้รับการพัฒนาและได้รับโปรตีนในรูปแบบผลึกเป็นครั้งแรก (โปรตีนจากพืชบางชนิด) ในการวิเคราะห์โปรตีน พวกเขาเริ่มใช้การย่อยเบื้องต้นด้วยกรดและด่าง
ในเวลาเดียวกัน เริ่มให้ความสนใจกับการศึกษาการทำงานของโปรตีนมากขึ้น Jens Jakob Berzelius เป็นคนแรกที่แนะนำในปี 1835 ว่าพวกเขามีบทบาทเป็นตัวเร่งปฏิกิริยาชีวภาพ ในไม่ช้าก็มีการค้นพบเอนไซม์โปรตีโอไลติก - เปปซิน (T. Schwann, 1836) และทริปซิน (L. Corvisart, 1856) ซึ่งดึงดูดความสนใจไปที่สรีรวิทยาของการย่อยอาหารและการวิเคราะห์ผลิตภัณฑ์ที่เกิดขึ้นระหว่างการสลายสารอาหาร การศึกษาเพิ่มเติมเกี่ยวกับโครงสร้างโปรตีนและการทำงานเกี่ยวกับการสังเคราะห์ทางเคมีของเปปไทด์ส่งผลให้เกิดสมมติฐานของเปปไทด์ ซึ่งโปรตีนทั้งหมดถูกสร้างขึ้นจากกรดอะมิโน เมื่อถึงปลายศตวรรษที่ 19 มีการศึกษากรดอะมิโนส่วนใหญ่ที่ประกอบเป็นโปรตีน
ในตอนต้นของศตวรรษที่ 20 นักเคมีชาวเยอรมัน เอมิล แฮร์มันน์ ฟิสเชอร์ เป็นคนแรกที่ใช้วิธีการเคมีอินทรีย์เพื่อศึกษาโปรตีน และพิสูจน์ว่าโปรตีนประกอบด้วยกรด β-อะมิโนที่เชื่อมโยงถึงกันด้วยพันธะเอไมด์ (เปปไทด์) ต่อมาด้วยการใช้วิธีการวิเคราะห์ทางเคมีกายภาพ มวลโมเลกุลของโปรตีนหลายชนิดจึงถูกกำหนด รูปร่างทรงกลมของโปรตีนทรงกลมถูกสร้างขึ้น การวิเคราะห์การเลี้ยวเบนรังสีเอกซ์ของกรดอะมิโนและเปปไทด์ และวิธีการวิเคราะห์โครมาโตกราฟี พัฒนาแล้ว (ดูโครมาโทกราฟี)
ฮอร์โมนโปรตีนตัวแรกถูกแยกออก (Frederick Grant Banting, John James Rickard McLeod, 1922), การมีอยู่ของแกมมาโกลบูลินในแอนติบอดีได้รับการพิสูจน์และอธิบายการทำงานของเอนไซม์ของโปรตีนกล้ามเนื้อ myosin (Vladimir Aleksandrovich Engelhardt, M. N. Lyubimova, 1939) . เป็นครั้งแรกที่ได้รับเอนไซม์ในรูปแบบผลึก - ยูรีเอส (J.B. Saliner, 1926), เปปซิน (J.H. Nortron, 1929), ไลโซไซม์ (E.P. Abraham, Robert Robinson, 1937)

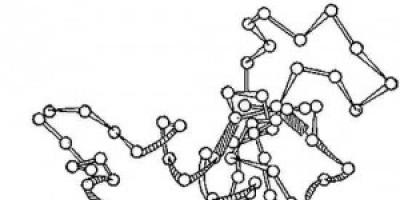
ข้าว. 2. โครงการโครงสร้างสามมิติของเอนไซม์ไลโซไซม์ วงกลม - กรดอะมิโน เส้น - พันธะเปปไทด์; สี่เหลี่ยมสีเทาคือพันธะซัลไฟด์ มองเห็นส่วนที่เป็นเกลียวและยาวของสายโซ่โพลีเปปไทด์
ในปี 1950 มีการพิสูจน์การจัดระเบียบโมเลกุลโปรตีนสามระดับ - การมีอยู่ของโครงสร้างหลัก, ทุติยภูมิและตติยภูมิ; สร้างเครื่องวิเคราะห์กรดอะมิโนอัตโนมัติ (Stanford Moore, William Howard Stein, 1950) ในยุค 60 มีความพยายามในการสังเคราะห์โปรตีนทางเคมี (อินซูลิน, ไรโบนิวคลีเอส) วิธีการวิเคราะห์การเลี้ยวเบนของรังสีเอกซ์ได้รับการปรับปรุงอย่างมีนัยสำคัญ มีการสร้างอุปกรณ์ - ซีเควนเซอร์ (P. Edman, G. Begg, 1967) ซึ่งทำให้สามารถกำหนดลำดับของกรดอะมิโนในสายโซ่โพลีเปปไทด์ได้ ผลที่ตามมาคือการสร้างโครงสร้างของโปรตีนหลายร้อยชนิดจากแหล่งต่างๆ ในหมู่พวกเขามีเอนไซม์โปรตีโอไลติก (เปปซิน, ทริปซิน, ไคโมทริปซิน, ซับติลิซิน, คาร์บอกซีเพปทิเดส), ไมโอโกลบิน, เฮโมโกลบิน, ไซโตโครม, ไลโซไซม์, อิมมูโนโกลบูลิน, ฮิสโตน, นิวโรทอกซิน, โปรตีนซองจดหมายของไวรัส, ฮอร์โมนโปรตีนเปปไทด์ เป็นผลให้มีข้อกำหนดเบื้องต้นสำหรับการแก้ปัญหาเร่งด่วนในด้านเอนไซม์ ภูมิคุ้มกันวิทยา ต่อมไร้ท่อ และสาขาอื่นๆ ของเคมีชีวภาพ
ในตอนท้ายของศตวรรษที่ 20 มีความก้าวหน้าที่สำคัญในการศึกษาบทบาทของโปรตีนในการสังเคราะห์เมทริกซ์ของโพลีเมอร์ชีวภาพ การทำความเข้าใจกลไกการออกฤทธิ์ในกระบวนการชีวิตต่างๆ ของสิ่งมีชีวิต และสร้างการเชื่อมโยงระหว่างโครงสร้างและหน้าที่ของพวกมัน การปรับปรุงวิธีการวิจัยและการเกิดขึ้นของวิธีการใหม่ในการแยกโปรตีนและเปปไทด์มีความสำคัญอย่างยิ่ง
การพัฒนาวิธีที่มีประสิทธิภาพในการวิเคราะห์ลำดับของนิวคลีโอไทด์ในกรดนิวคลีอิกทำให้สามารถลดความซับซ้อนและเร่งความเร็วในการกำหนดลำดับกรดอะมิโนในโปรตีนได้อย่างมีนัยสำคัญ สิ่งนี้เกิดขึ้นได้เนื่องจากลำดับของกรดอะมิโนในโปรตีนถูกกำหนดโดยลำดับของนิวคลีโอไทด์ในยีนที่เข้ารหัสโปรตีนนี้ (ชิ้นส่วน) ด้วยเหตุนี้ เมื่อทราบการจัดเรียงนิวคลีโอไทด์ในยีนนี้และรหัสพันธุกรรม จึงสามารถคาดเดาได้อย่างแม่นยำว่ากรดอะมิโนอยู่ในลำดับใดในสายโซ่โพลีเปปไทด์ของโปรตีน นอกเหนือจากความก้าวหน้าในการวิเคราะห์โครงสร้างของโปรตีนแล้ว ยังได้รับผลลัพธ์ที่สำคัญในการศึกษาการจัดโครงสร้างเชิงพื้นที่ กลไกการก่อตัวและการออกฤทธิ์ของสารเชิงซ้อนซูปราโมเลคิวลาร์ รวมถึงไรโบโซมและออร์แกเนลล์ของเซลล์อื่นๆ โครมาติน ไวรัส ฯลฯ
โครงสร้างโปรตีน
โปรตีนเกือบทั้งหมดถูกสร้างขึ้นจากกรดอะมิโน 20 ตัวที่อยู่ในซีรีย์ L และเหมือนกันในสิ่งมีชีวิตเกือบทั้งหมด กรดอะมิโนในโปรตีนเชื่อมต่อถึงกันด้วยพันธะเปปไทด์ -CO-NH- ซึ่งเกิดขึ้นจากกลุ่มคาร์บอกซิลและ -อะมิโนของกรดอะมิโนที่ตกค้างใกล้เคียงกัน กรดอะมิโนสองตัวก่อตัวเป็นไดเปปไทด์ โดยที่ขั้วคาร์บอกซิล (-COOH) และหมู่อะมิโน (H 2 N-) ยังคงเป็นอิสระซึ่งสามารถเติมกรดอะมิโนใหม่เพื่อสร้างสายโซ่โพลีเปปไทด์ได้
ส่วนของโซ่ซึ่งเป็นที่ตั้งของกลุ่ม H 2 N เรียกว่า N-terminal และส่วนที่อยู่ตรงข้ามเรียกว่า C-terminal โปรตีนหลากหลายชนิดถูกกำหนดโดยลำดับของการจัดเรียงและจำนวนกรดอะมิโนที่ตกค้างอยู่ แม้ว่าจะไม่มีความแตกต่างที่ชัดเจน แต่สายโซ่สั้นมักเรียกว่าเปปไทด์หรือโอลิโกเปปไทด์ (จากโอลิโก...) และมักจะเข้าใจว่าโพลีเปปไทด์ (โปรตีน) เป็นสายโซ่ที่ประกอบด้วย 50 สายหรือมากกว่า โปรตีนที่พบมากที่สุดคือโปรตีนที่มีกรดอะมิโนตกค้าง 100-400 ตัว แต่ก็มีโปรตีนที่มีโมเลกุลเกิดขึ้นจากสารตกค้าง 1,000 ตัวหรือมากกว่านั้นด้วย โปรตีนอาจประกอบด้วยสายโพลีเปปไทด์หลายสาย ในโปรตีนดังกล่าว แต่ละสายโซ่โพลีเปปไทด์เรียกว่าหน่วยย่อย
โครงสร้างเชิงพื้นที่ของโปรตีน

ข้าว. 3. โปรตีนในสิ่งมีชีวิตทุกชนิดประกอบด้วยกรดอะมิโน 20 ชนิด โปรตีนแต่ละชนิดมีลักษณะเฉพาะด้วยการแบ่งประเภทและอัตราส่วนเชิงปริมาณของกรดอะมิโน ในโมเลกุลโปรตีนกรดอะมิโนเชื่อมต่อกันด้วยพันธะเปปไทด์ (- CO - NH -) ในลำดับเชิงเส้นซึ่งประกอบขึ้นเป็นโครงสร้างหลักที่เรียกว่าโปรตีน บรรทัดบนสุด - กรดอะมิโนอิสระที่มีกลุ่มข้าง R1, R2, R3; บรรทัดล่าง - กรดอะมิโนเชื่อมต่อกันด้วยพันธะเปปไทด์
สายโพลีเปปไทด์สามารถสร้างและรักษาโครงสร้างเชิงพื้นที่พิเศษได้เอง ขึ้นอยู่กับรูปร่างของโมเลกุลโปรตีน โปรตีนจะถูกแบ่งออกเป็นไฟบริลลาร์และทรงกลม ในโปรตีนทรงกลม สายโพลีเปปไทด์ตั้งแต่หนึ่งเส้นขึ้นไปจะพับรวมกันเป็นโครงสร้างทรงกลมขนาดกะทัดรัดหรือหรือทรงกลม โดยทั่วไปแล้วโปรตีนเหล่านี้จะละลายในน้ำได้สูง ซึ่งรวมถึงเอนไซม์เกือบทั้งหมด โปรตีนในการขนส่งเลือด และโปรตีนที่สะสมหลายชนิด โปรตีนไฟบริลลาร์เป็นโมเลกุลที่มีลักษณะคล้ายเกลียวซึ่งยึดเข้าด้วยกันโดยการเชื่อมโยงข้ามและสร้างเส้นใยยาวหรือโครงสร้างเป็นชั้น มีความแข็งแรงเชิงกลสูง ไม่ละลายในน้ำ และทำหน้าที่ด้านโครงสร้างและการป้องกันเป็นหลัก ตัวแทนทั่วไปของโปรตีนดังกล่าว ได้แก่ เคราตินสำหรับเส้นผมและขนสัตว์ ซิลค์ไฟโบรอิน และคอลลาเจนจากเอ็น
ลำดับของกรดอะมิโนที่เชื่อมโยงด้วยโควาเลนต์ในสายโซ่โพลีเปปไทด์เรียกว่าลำดับกรดอะมิโนหรือโครงสร้างปฐมภูมิของโปรตีน โครงสร้างปฐมภูมิของโปรตีนแต่ละชนิดซึ่งเข้ารหัสโดยยีนที่เกี่ยวข้องนั้นมีความคงที่และนำข้อมูลทั้งหมดที่จำเป็นสำหรับการก่อตัวของโครงสร้างระดับสูงขึ้น จำนวนโปรตีนที่เป็นไปได้ที่สามารถสร้างขึ้นจากกรดอะมิโน 20 ชนิดนั้นแทบไม่มีขีดจำกัด
จากการทำงานร่วมกันของกลุ่มด้านข้างของกรดอะมิโนที่ตกค้าง แต่ละส่วนที่ค่อนข้างเล็กของสายโซ่โพลีเปปไทด์จึงเกิดโครงสร้างอย่างใดอย่างหนึ่ง (ประเภทของการพับ) ที่เรียกว่าโครงสร้างรองของโปรตีน องค์ประกอบที่เป็นลักษณะเฉพาะมากที่สุดของมันคือโครงสร้างα-helix และ β ที่ทำซ้ำเป็นระยะๆ โครงสร้างรองมีความเสถียรมาก เนื่องจากส่วนใหญ่ถูกกำหนดโดยลำดับกรดอะมิโนของบริเวณโปรตีนที่เกี่ยวข้อง จึงเป็นไปได้ที่จะคาดการณ์ด้วยความน่าจะเป็นในระดับหนึ่ง คำว่า “?-helix” ถูกนำมาใช้โดยนักชีวเคมี นักฟิสิกส์ และนักเคมีชาวอเมริกัน Linus Carl Pauling ซึ่งบรรยายถึงการจัดเรียงสายโซ่โพลีเปปไทด์ในโปรตีน?-เคราตินในรูปของเกลียวทางขวา (the?-helix can เปรียบได้กับสายโทรศัพท์) ในแต่ละรอบของเกลียวในโปรตีนจะมีกรดอะมิโนตกค้าง 3.6 ตัว ซึ่งหมายความว่ากลุ่ม -C=O ของพันธะเปปไทด์หนึ่งพันธะจะสร้างพันธะไฮโดรเจนกับกลุ่ม -NH ของพันธะเปปไทด์อีกพันธะหนึ่ง ซึ่งมีกรดอะมิโนสี่ตัวตกค้างอยู่ห่างจากพันธะตัวแรก โดยเฉลี่ย แต่ละบริเวณ α-helical จะมีกรดอะมิโนมากถึง 15 ตัว ซึ่งสอดคล้องกับ 3-4 รอบของเกลียว แต่ในโปรตีนแต่ละชนิด ความยาวของเกลียวอาจแตกต่างกันอย่างมากจากค่านี้ ในภาพตัดขวาง α-helix มีรูปร่างเหมือนจาน ซึ่งโซ่ด้านข้างของกรดอะมิโนชี้ออกไปด้านนอก
โครงสร้างหรือ? -ชั้นพับสามารถเกิดขึ้นได้จากหลายส่วนของสายโซ่โพลีเปปไทด์ ส่วนเหล่านี้ถูกยืดและวางขนานกัน เชื่อมต่อกันด้วยพันธะไฮโดรเจนที่เกิดขึ้นระหว่างพันธะเปปไทด์ พวกมันสามารถวางทิศทางในทิศทางเดียวกันหรือตรงกันข้าม (ทิศทางการเคลื่อนที่ไปตามสายโซ่โพลีเปปไทด์มักจะถือว่ามาจากปลาย N ไปยังปลาย C) ในกรณีแรกชั้นพับเรียกว่าขนานในส่วนที่สอง - ขนานกัน หลังเกิดขึ้นเมื่อโซ่เปปไทด์หมุนกลับอย่างแหลมคมทำให้เกิดโค้งงอ (?-bend) สายโซ่ด้านข้างของกรดอะมิโนตั้งฉากกับระนาบหรือไม่? -ชั้น.
เนื้อหาที่เกี่ยวข้อง? -ส่วนเกลียวและ? - โครงสร้างอาจแตกต่างกันไปตามโปรตีนต่างๆ มีโปรตีนที่มีความเด่นของα-helices (ประมาณ 75% ของกรดอะมิโนใน myoglobin และ hemoglobin) และประเภทหลักของการพับโซ่ในโปรตีนไฟบริลลาร์หลายชนิด (รวมถึงไฟโบรอินไหม, β-เคราติน) คือα-helix -โครงสร้าง. บริเวณของสายโพลีเปปไทด์ที่ไม่สามารถจำแนกได้เป็นรูปแบบที่อธิบายไว้ข้างต้นใดๆ เรียกว่าลูปเชื่อมต่อ โครงสร้างของพวกมันถูกกำหนดโดยปฏิกิริยาระหว่างสายโซ่ด้านข้างของกรดอะมิโนเป็นหลักและในโมเลกุลของโปรตีนใด ๆ ที่มันพอดีในลักษณะที่กำหนดไว้อย่างเคร่งครัด
โครงสร้างระดับอุดมศึกษาเรียกว่าโครงสร้างเชิงพื้นที่ของโปรตีนทรงกลม แต่บ่อยครั้งที่แนวคิดนี้อ้างถึงวิธีการพับสายโซ่โพลีเปปไทด์ในอวกาศ ซึ่งเป็นลักษณะของโปรตีนแต่ละชนิด โครงสร้างระดับตติยภูมิถูกสร้างขึ้นโดยสายโซ่โพลีเปปไทด์ของโปรตีนตามธรรมชาติตามเส้นทางการแข็งตัวของเลือดพร้อมกับการก่อตัวเบื้องต้นขององค์ประกอบโครงสร้างรอง หากความเสถียรของโครงสร้างทุติยภูมิเกิดจากพันธะไฮโดรเจน โครงสร้างตติยภูมิจะได้รับการแก้ไขโดยระบบที่หลากหลายของปฏิกิริยาที่ไม่ใช่โควาเลนต์: ไฮโดรเจน, ไอออนิก, ปฏิกิริยาระหว่างโมเลกุลตลอดจนการสัมผัสที่ไม่ชอบน้ำระหว่างโซ่ด้านข้างของอะมิโนที่ไม่มีขั้ว กรดตกค้าง
ในโปรตีนบางชนิดโครงสร้างตติยภูมิจะมีความเสถียรยิ่งขึ้นโดยการก่อตัวของพันธะไดซัลไฟด์ (พันธะ -S-S-) ระหว่างซิสเตอีนที่ตกค้าง ตามกฎแล้วภายในโปรตีนโกลบูลจะมีโซ่ด้านข้างของกรดอะมิโนที่ไม่ชอบน้ำรวมตัวกันเป็นแกนกลาง (การถ่ายโอนของพวกมันภายในโปรตีนโกลบูลนั้นเอื้ออำนวยต่ออุณหพลศาสตร์) และที่ขอบรอบข้างจะมีสารตกค้างที่ชอบน้ำและบางชนิดที่ไม่ชอบน้ำ โปรตีนโกลบูลล้อมรอบด้วยน้ำไฮเดรชั่นหลายร้อยโมเลกุล ซึ่งจำเป็นต่อความเสถียรของโมเลกุลโปรตีน และมักเกี่ยวข้องกับการทำงานของมัน โครงสร้างระดับตติยภูมิเป็นแบบเคลื่อนที่ได้ แต่ละส่วนของมันสามารถเปลี่ยนแปลงได้ ซึ่งนำไปสู่การเปลี่ยนแปลงโครงสร้างที่มีบทบาทสำคัญในปฏิสัมพันธ์ของโปรตีนกับโมเลกุลอื่น ๆ
โครงสร้างตติยภูมิเป็นพื้นฐานของคุณสมบัติเชิงหน้าที่ของโปรตีน กำหนดการก่อตัวของกลุ่มฟังก์ชันในโปรตีน - ศูนย์กลางที่ใช้งานอยู่และโซนที่มีผลผูกพันทำให้พวกเขามีรูปทรงเรขาคณิตที่จำเป็นช่วยให้สามารถสร้างสภาพแวดล้อมภายในซึ่งเป็นข้อกำหนดเบื้องต้นสำหรับการเกิดปฏิกิริยาหลายอย่างและรับประกันการมีปฏิสัมพันธ์กับโปรตีนอื่น ๆ .
โครงสร้างระดับตติยภูมิของโปรตีนสอดคล้องกับโครงสร้างหลักอย่างชัดเจน อาจมีรหัสสเตอริโอเคมีที่ยังไม่ได้ถอดรหัสซึ่งกำหนดลักษณะของการพับโปรตีน อย่างไรก็ตาม วิธีการจัดเรียงเชิงพื้นที่วิธีเดียวกันมักจะไม่สอดคล้องกับโครงสร้างหลักเดียว แต่กับโครงสร้างทั้งตระกูลซึ่งมีเพียงเศษเสี้ยวเล็กน้อย (มากถึง 20-30%) ของกรดอะมิโนที่ตกค้างอาจเกิดขึ้นพร้อมกัน แต่ในบางอย่าง ในสายโซ่จะรักษาความคล้ายคลึงกันของกรดอะมิโนที่ตกค้างไว้ ผลที่ตามมาคือการก่อตัวของตระกูลโปรตีนขนาดใหญ่ที่มีโครงสร้างระดับตติยภูมิที่คล้ายกันและโครงสร้างหลักที่คล้ายกันไม่มากก็น้อยและตามกฎแล้วฟังก์ชันทั่วไป ตัวอย่างเช่น โปรตีนของสิ่งมีชีวิตในสายพันธุ์ต่าง ๆ ที่มีหน้าที่เหมือนกันและเกี่ยวข้องกับวิวัฒนาการ: ไมโอโกลบินและฮีโมโกลบิน, ทริปซิน, ไคโมทริปซิน, อีลาสเทส และโปรตีเอสจากสัตว์อื่น ๆ

ข้าว. 4. จากการรวมกันของโมเลกุลขนาดใหญ่ของโปรตีนหลายชนิดที่มีโครงสร้างตติยภูมิ โครงสร้างโปรตีนควอเทอร์นารีจึงก่อตัวเป็นคอมเพล็กซ์เชิงซ้อน ตัวอย่างของโปรตีนเชิงซ้อนดังกล่าวคือเฮโมโกลบินซึ่งประกอบด้วยโมเลกุลขนาดใหญ่สี่โมเลกุล
บ่อยครั้ง โดยเฉพาะอย่างยิ่งในโปรตีนขนาดใหญ่ การพับของสายโซ่โพลีเปปไทด์เกิดขึ้นผ่านการก่อตัวโดยแต่ละส่วนของสายโซ่ขององค์ประกอบอิสระของโครงสร้างเชิงพื้นที่ไม่มากก็น้อย - โดเมนที่สามารถมีอิสระในการทำงาน โดยรับผิดชอบต่อกิจกรรมทางชีวภาพอย่างใดอย่างหนึ่งของ โปรตีน. ดังนั้นโดเมนที่ปลาย N ของโปรตีนการแข็งตัวของเลือดจึงช่วยให้แน่ใจว่าพวกมันจะเกาะติดกับเยื่อหุ้มเซลล์
มีโปรตีนหลายชนิดที่มีโมเลกุลรวมตัวกันเป็นทรงกลม (หน่วยย่อย) ซึ่งยึดติดกันโดยปฏิกิริยาที่ไม่ชอบน้ำ พันธะไฮโดรเจนหรือไอออนิก คอมเพล็กซ์ดังกล่าวเรียกว่าโปรตีนโอลิโกเมอริก, มัลติเมอริกหรือหน่วยย่อย การจัดเรียงหน่วยย่อยในคอมเพล็กซ์โปรตีนเชิงฟังก์ชันเรียกว่าโครงสร้างควอเทอร์นารีของโปรตีน โปรตีนบางชนิดสามารถสร้างโครงสร้างที่มีลำดับสูงกว่าได้ ตัวอย่างเช่น สารเชิงซ้อนหลายเอนไซม์ โครงสร้างที่ขยายออก (โปรตีนเคลือบแบคทีเรีย) สารเชิงซ้อนซูปราโมเลคิวลาร์ที่ทำหน้าที่เป็นสารตัวเดียว (เช่น ไรโบโซมหรือส่วนประกอบของห่วงโซ่ระบบทางเดินหายใจของไมโตคอนเดรีย)
โครงสร้างควอเทอร์นารีช่วยให้สามารถสร้างโมเลกุลที่มีรูปทรงเรขาคณิตที่ผิดปกติได้ ดังนั้นเฟอร์ริตินซึ่งเกิดจาก 24 หน่วยย่อยจึงมีโพรงภายในซึ่งโปรตีนสามารถจับไอออนของเหล็กได้มากถึง 3,000 ไอออน นอกจากนี้โครงสร้างควอเทอร์นารียังช่วยให้สามารถทำหน้าที่ต่างๆ ได้หลายอย่างในโมเลกุลเดียว ทริปโตเฟนซินเทเทสรวมเอนไซม์ที่รับผิดชอบในการสังเคราะห์กรดอะมิโนทริปโตเฟนหลายขั้นตอนติดต่อกัน
วิธีการศึกษาโครงสร้างโปรตีน
โครงสร้างปฐมภูมิของโปรตีนเป็นตัวกำหนดระดับอื่นๆ ของการจัดระเบียบของโมเลกุลโปรตีน ดังนั้นเมื่อศึกษาการทำงานทางชีววิทยาของโปรตีนชนิดต่างๆ ความรู้เกี่ยวกับโครงสร้างนี้จึงเป็นสิ่งสำคัญ โปรตีนชนิดแรกที่สร้างลำดับกรดอะมิโนคือฮอร์โมนตับอ่อน อินซูลิน งานนี้ซึ่งใช้เวลา 11 ปีดำเนินการโดยนักชีวเคมีชาวอังกฤษ Frederick Sanger (1954) เขาพิจารณาตำแหน่งของกรดอะมิโน 51 ตัวในโมเลกุลฮอร์โมนและพบว่าประกอบด้วยสายโซ่ 2 เส้นที่เชื่อมต่อกันด้วยพันธะไดซัลไฟด์ ต่อมา งานส่วนใหญ่ในการสร้างโครงสร้างปฐมภูมิของโปรตีนเป็นไปโดยอัตโนมัติ
ด้วยการพัฒนาวิธีการทางพันธุวิศวกรรม จึงเป็นไปได้ที่จะเร่งกระบวนการนี้ต่อไปโดยการกำหนดโครงสร้างปฐมภูมิของโปรตีนตามผลการวิเคราะห์ลำดับนิวคลีโอไทด์ในยีนที่เข้ารหัสโปรตีนเหล่านี้ โครงสร้างทุติยภูมิและตติยภูมิของโปรตีนได้รับการศึกษาโดยใช้วิธีการทางกายภาพที่ค่อนข้างซับซ้อน เช่น การวิเคราะห์ไดโครอิซึมแบบวงกลมหรือการวิเคราะห์การเลี้ยวเบนรังสีเอกซ์ของผลึกโปรตีน โครงสร้างระดับตติยภูมิก่อตั้งขึ้นครั้งแรกโดยนักชีวเคมีชาวอังกฤษ John Cowdery Kendrew (1957) สำหรับโปรตีนไมโอโกลบินในกล้ามเนื้อ

ข้าว. 5. แบบจำลองของโมเลกุลไมโอโกลบิน (การกำหนดค่าเชิงพื้นที่ของโมเลกุล)
การเสื่อมสภาพของโปรตีน
พันธะที่ค่อนข้างอ่อนแอซึ่งรับผิดชอบในการรักษาเสถียรภาพของโครงสร้างทุติยภูมิ ตติยภูมิ และควอเทอร์นารีของโปรตีนจะถูกทำลายได้ง่ายซึ่งมาพร้อมกับการสูญเสียกิจกรรมทางชีวภาพ การทำลายโครงสร้างโปรตีนดั้งเดิม (ดั้งเดิม) ที่เรียกว่าการสูญเสียสภาพธรรมชาติ เกิดขึ้นเมื่อกรดและเบสอยู่ด้วย เมื่อได้รับความร้อน การเปลี่ยนแปลงความแรงของไอออนิก และอิทธิพลอื่นๆ ตามกฎแล้วโปรตีนที่เสียสภาพจะละลายได้ไม่ดีในน้ำหรือไม่ละลายเลย ด้วยผลในระยะสั้นและการกำจัดปัจจัยที่ทำให้เกิดการสูญเสียสภาพอย่างรวดเร็ว การเปลี่ยนสภาพโปรตีนจึงเป็นไปได้ด้วยการฟื้นฟูโครงสร้างดั้งเดิมและคุณสมบัติทางชีวภาพทั้งหมดหรือบางส่วน
การจำแนกประเภทโปรตีน
ความซับซ้อนของโครงสร้างโมเลกุลโปรตีนและฟังก์ชันที่หลากหลายอย่างมากทำให้ยากต่อการสร้างการจำแนกประเภทที่เป็นหนึ่งเดียวและชัดเจน แม้ว่าจะมีการพยายามทำเช่นนี้ซ้ำแล้วซ้ำเล่าตั้งแต่ปลายศตวรรษที่ 19 ขึ้นอยู่กับองค์ประกอบทางเคมี โปรตีนจะถูกแบ่งออกเป็นแบบง่ายและซับซ้อน (บางครั้งเรียกว่าโปรตีน) โมเลกุลของสารแรกประกอบด้วยกรดอะมิโนเท่านั้น นอกเหนือจากสายโซ่โพลีเปปไทด์แล้ว โปรตีนที่ซับซ้อนยังมีส่วนประกอบที่ไม่ใช่โปรตีนซึ่งแสดงโดยคาร์โบไฮเดรต (ไกลโคโปรตีน), ไขมัน (ไลโปโปรตีน), กรดนิวคลีอิก (นิวคลีโอโปรตีน), ไอออนของโลหะ (โลหะ), กลุ่มฟอสเฟต (ฟอสโฟโปรตีน), เม็ดสี (โครโมโปรตีน) ฯลฯ .
โปรตีนหลายประเภทมีความโดดเด่นขึ้นอยู่กับหน้าที่ที่พวกเขาทำ. คลาสที่มีความหลากหลายและเชี่ยวชาญที่สุดประกอบด้วยโปรตีนที่มีฟังก์ชันตัวเร่งปฏิกิริยา - เอนไซม์ที่มีความสามารถในการเร่งปฏิกิริยาเคมีที่เกิดขึ้นในสิ่งมีชีวิต ในแง่นี้ โปรตีนมีส่วนร่วมในกระบวนการทั้งหมดของการสังเคราะห์และการสลายสารประกอบต่างๆ ในระหว่างเมแทบอลิซึม ในการสังเคราะห์ทางชีวภาพของโปรตีนและกรดนิวคลีอิก การควบคุมการพัฒนาของเซลล์และการสร้างความแตกต่าง โปรตีนในการขนส่งมีความสามารถในการจับกับกรดไขมัน ฮอร์โมน และสารประกอบและไอออนอินทรีย์และอนินทรีย์อื่นๆ และไอออน จากนั้นจึงขนส่งพวกมันด้วยกระแสไปยังตำแหน่งที่ต้องการ (เช่น เฮโมโกลบินเกี่ยวข้องกับการถ่ายโอนออกซิเจนจากปอดไปยังเซลล์ทั้งหมดของ ร่างกาย). โปรตีนขนส่งยังทำหน้าที่ขนส่งไอออน ไขมัน น้ำตาล และกรดอะมิโนแบบแอคทีฟผ่านเยื่อหุ้มชีวภาพ
โปรตีนโครงสร้างทำหน้าที่สนับสนุนหรือป้องกัน มีส่วนร่วมในการก่อตัวของโครงกระดูกเซลล์ ที่พบมากที่สุด ได้แก่ คอลลาเจนของเนื้อเยื่อเกี่ยวพัน เคราติน เล็บและขนนก อีลาสตินของเซลล์หลอดเลือด และอื่นๆ อีกมากมาย เมื่อรวมกับไขมันแล้วพวกมันจะเป็นพื้นฐานโครงสร้างของเยื่อหุ้มเซลล์และในเซลล์
โปรตีนจำนวนหนึ่งทำหน้าที่ป้องกัน ตัวอย่างเช่น อิมมูโนโกลบูลิน (แอนติบอดี) ของสัตว์มีกระดูกสันหลังซึ่งมีความสามารถในการจับกับจุลินทรีย์และสารที่ทำให้เกิดโรคจากต่างประเทศ ทำให้ผลที่ทำให้เกิดโรคในร่างกายเป็นกลางและป้องกันการแพร่กระจายของเซลล์ ไฟบริโนเจนและทรอมบินเกี่ยวข้องกับกระบวนการแข็งตัวของเลือด สารโปรตีนหลายชนิดที่ถูกหลั่งออกมาจากแบคทีเรีย รวมถึงส่วนประกอบของสัตว์ไม่มีกระดูกสันหลังบางชนิด ถูกจัดประเภทเป็นสารพิษ
โปรตีนบางชนิด (ตามข้อบังคับ) เกี่ยวข้องกับการควบคุมกิจกรรมทางสรีรวิทยาของร่างกายโดยรวม แต่ละอวัยวะ เซลล์ หรือกระบวนการต่างๆ พวกเขาควบคุมการถอดรหัสยีนและการสังเคราะห์โปรตีน ซึ่งรวมถึงฮอร์โมนเปปไทด์โปรตีนที่หลั่งจากต่อมไร้ท่อ โปรตีนกักเก็บเมล็ดจะให้สารอาหารในระยะเริ่มแรกของการพัฒนาเอ็มบริโอ ซึ่งรวมถึงเคซีน อัลบูมินไข่ขาว (โอวัลบูมิน) และอื่นๆ อีกมากมาย ต้องขอบคุณโปรตีนที่ทำให้เซลล์กล้ามเนื้อมีความสามารถในการหดตัวและทำให้ร่างกายเคลื่อนไหวได้ในที่สุด ตัวอย่างของโปรตีนที่หดตัวดังกล่าว ได้แก่ แอกตินของกล้ามเนื้อโครงร่างและไมโอซิน เช่นเดียวกับทูบูลินซึ่งเป็นส่วนประกอบของซีเลียและแฟลเจลลาของสิ่งมีชีวิตเซลล์เดียว พวกเขายังรับประกันความแตกต่างของโครโมโซมในระหว่างการแบ่งเซลล์
โปรตีนของตัวรับเป็นเป้าหมายของฮอร์โมนและสารประกอบออกฤทธิ์ทางชีวภาพอื่นๆ ด้วยความช่วยเหลือเซลล์จะรับรู้ข้อมูลเกี่ยวกับสถานะของสภาพแวดล้อมภายนอก มีบทบาทสำคัญในการถ่ายทอดการกระตุ้นประสาทและการเคลื่อนไหวของเซลล์แบบมุ่งเน้น (เคมีบำบัด) การเปลี่ยนแปลงและการใช้พลังงานที่เข้าสู่ร่างกายเช่นเดียวกับพลังงานก็เกิดขึ้นจากการมีส่วนร่วมของโปรตีนของระบบพลังงานชีวภาพ (ตัวอย่างเช่น rhodopsin เม็ดสีที่มองเห็น, ไซโตโครมของห่วงโซ่ทางเดินหายใจ) นอกจากนี้ยังมีโปรตีนหลายชนิดที่มีคุณสมบัติอื่น ๆ ซึ่งบางครั้งก็ค่อนข้างผิดปกติ (เช่นพลาสมาของปลาแอนตาร์กติกบางชนิดมีโปรตีนที่มีคุณสมบัติป้องกันการแข็งตัว)
การสังเคราะห์โปรตีน
ข้อมูลทั้งหมดเกี่ยวกับโครงสร้างของโปรตีนชนิดใดชนิดหนึ่งจะถูก "จัดเก็บ" ในยีนที่เกี่ยวข้องในรูปแบบของลำดับนิวคลีโอไทด์และนำไปใช้ในกระบวนการสังเคราะห์เทมเพลต ขั้นแรก ข้อมูลจะถูกถ่ายโอน (อ่าน) จากโมเลกุล DNA ไปยัง Messenger RNA (mRNA) โดยใช้เอนไซม์ RNA polymerase ที่ขึ้นกับ DNA และจากนั้นในไรโบโซมบน mRNA เช่นเดียวกับบนเมทริกซ์ตามรหัสพันธุกรรมโดยมีส่วนร่วม ของการขนส่ง RNA ที่ส่งกรดอะมิโน การก่อตัวเกิดขึ้นจากสายโซ่โพลีเปปไทด์
สายพอลิเปปไทด์สังเคราะห์ที่โผล่ออกมาจากไรโบโซมซึ่งพับงอได้เอง มีลักษณะเฉพาะโครงสร้างของโปรตีนและอาจมีการดัดแปลงหลังการแปลความหมายได้ สายด้านข้างของกรดอะมิโนแต่ละตัวสามารถเกิดการเปลี่ยนแปลงได้ (ไฮดรอกซิเลชัน, ฟอสโฟรีเลชั่น ฯลฯ ) นั่นคือเหตุผลว่าทำไมไฮดรอกซีโพรลีนและไฮดรอกซีไลซีนจึงพบได้ในคอลลาเจน (ดู) การดัดแปลงยังอาจมาพร้อมกับการแตกของพันธะโพลีเปปไทด์ ตัวอย่างเช่นด้วยวิธีนี้การก่อตัวของโมเลกุลอินซูลินที่แอคทีฟเกิดขึ้นซึ่งประกอบด้วยสองสายที่เชื่อมต่อกันด้วยพันธะไดซัลไฟด์

ข้าว. 6. รูปแบบทั่วไปของการสังเคราะห์โปรตีน
ความสำคัญของโปรตีนในด้านโภชนาการ
โปรตีนเป็นส่วนประกอบที่สำคัญที่สุดของอาหารสัตว์และมนุษย์ คุณค่าทางโภชนาการของโปรตีนนั้นพิจารณาจากปริมาณกรดอะมิโนที่จำเป็นซึ่งไม่ได้ผลิตในร่างกายเอง ในเรื่องนี้โปรตีนจากพืชมีคุณค่าน้อยกว่าโปรตีนจากสัตว์: มีไลซีน, เมไทโอนีนและทริปโตเฟนน้อยกว่าและย่อยยากกว่าในทางเดินอาหาร การขาดกรดอะมิโนที่จำเป็นในอาหารทำให้เกิดความผิดปกติอย่างรุนแรงของการเผาผลาญไนโตรเจน
โปรตีนจะถูกย่อยสลายเป็นกรดอะมิโนอิสระ ซึ่งหลังจากการดูดซึมในลำไส้จะเข้าไปและกระจายไปยังเซลล์ทั้งหมด บางส่วนสลายตัวเป็นสารประกอบง่ายๆ โดยปล่อยพลังงานออกมา ซึ่งใช้สำหรับความต้องการต่างๆ ของเซลล์ และบางส่วนก็ไปที่การสังเคราะห์โปรตีนใหม่ที่มีลักษณะเฉพาะของสิ่งมีชีวิตที่กำหนด (R. A. Matveeva, สารานุกรม Cyril และ Methodius)
การแจกแจงโปรตีน
- อะไมลอยด์ - อะไมลอยด์;
- ประจุลบ - ประจุลบ;
- แอนติไวรัส - แอนติไวรัส;
- แพ้ภูมิตัวเอง - แพ้ภูมิตัวเอง;
- อัตโนมัติ - autologic;
- แบคทีเรีย - แบคทีเรีย;
- โปรตีนเบนซ์โจนส์;
- เกิดจากไวรัส - เกิดจากไวรัส;
- ไวรัส - ไวรัส;
- ไวรัสไม่มีโครงสร้าง - ไวรัสไม่มีโครงสร้าง;
- โครงสร้างไวรัส - โครงสร้างไวรัส
- เฉพาะไวรัส - เฉพาะไวรัส
- น้ำหนักโมเลกุลสูง - น้ำหนักโมเลกุลสูง
- ที่ประกอบด้วยฮีม - ฮีม;
- ต่างกัน - ต่างประเทศ;
- ไฮบริด - ไฮบริด;
- ไกลโคซิเลต - ไกลโคซิเลต;
- ทรงกลม - ทรงกลม;
- แปลงสภาพ - แปลงสภาพ;
- ที่มีธาตุเหล็ก - เหล็ก;
- ไข่แดง - ไข่แดง;
- โปรตีนจากสัตว์ - โปรตีนจากสัตว์;
- ป้องกัน - ป้องกัน;
- ภูมิคุ้มกัน - ภูมิคุ้มกัน;
- ภูมิคุ้มกัน - เกี่ยวข้องกับภูมิคุ้มกัน;
- การจับแคลเซียม
- เปรี้ยว - เป็นกรด;
- กล้ามเนื้อ - กล้ามเนื้อ;
- เมมเบรน - เมมเบรน;
- myeloma - myeloma;
- ไมโครโซมอล - ไมโครโซมอล;
- โปรตีนนม - โปรตีนนม;
- โมโนโคลนอล - โมโนโคลนอลอิมมูโนโกลบูลิน;
- โปรตีนของกล้ามเนื้อ - โปรตีนของกล้ามเนื้อ;
- พื้นเมือง - พื้นเมือง;
- ไม่ใช่ฮิสโตน - ไม่ใช่ฮิสโตน;
- ชำรุด - บางส่วน;
- ไม่ละลายน้ำ - ไม่ละลายน้ำ;
- ย่อยไม่ได้ - ไม่ละลาย;
- ไม่ใช่เอนไซม์ - ไม่มีเอนไซม์;
- น้ำหนักโมเลกุลต่ำ - น้ำหนักโมเลกุลต่ำ
- โปรตีนใหม่ - โปรตีนใหม่
- ทั่วไป - ทั้งหมด;
- oncogenic - oncoprotein;
- โปรตีนเฟสหลัก - ประจุลบ;
- โปรตีนระยะเฉียบพลัน (การอักเสบ) - โปรตีนระยะเฉียบพลัน;
- อาหาร - อาหาร;
- โปรตีนในพลาสมาในเลือด - โปรตีนในพลาสมา;
- รก - รก;
- การแยกส่วน - การแยกส่วน;
- โปรตีนของการสร้างเส้นประสาทใหม่
- กฎระเบียบ - กฎระเบียบ;
- การรวมตัวกันอีกครั้ง - การรวมตัวกันอีกครั้ง;
- ตัวรับ - ตัวรับ;
- ไรโบโซม - ไรโบโซม;
- มีผลผูกพัน - มีผลผูกพัน;
- โปรตีนหลั่ง - โปรตีนหลั่ง;
- C-ปฏิกิริยา - C-ปฏิกิริยา;
- เวย์โปรตีน - เวย์โปรตีน, แลคโตโปรตีน;
- เนื้อเยื่อ - เนื้อเยื่อ;
- เป็นพิษ - เป็นพิษ;
- เพ้อฝัน - เพ้อฝัน;
- ทั้งหมด - ทั้งหมด;
- ไซโตซิลิก - ไซโตซิลิก;
- โปรตีนอัลคาไลน์ - โปรตีนประจุลบ
- ภายนอก - ภายนอก;
- ภายนอก - โปรตีนภายนอก
อ่านเพิ่มเติมเกี่ยวกับโปรตีนในวรรณคดี:
- Volkenshtein M.V., โมเลกุลและ, M. , 1965, ch. 3 - 5;
- Gaurowitz F. เคมีและหน้าที่ของโปรตีน ทรานส์ จากภาษาอังกฤษ มอสโก 2508;
- Sissakyan N. M. และ Gladilin K. L. ด้านชีวเคมีของการสังเคราะห์โปรตีนในหนังสือ: ความก้าวหน้าในเคมีชีวภาพ เล่ม 7, M. , 1965, p. 3;
- Stepanov V. M. อณูชีววิทยา โครงสร้างและหน้าที่ของโปรตีน ม. , 1996;
- Shamin A. N. การพัฒนาเคมีโปรตีน, M. , 1966;
- โปรตีนและเปปไทด์ ม., 2538-2543. ต. 1-3;
- การสังเคราะห์โปรตีนและกรดนิวคลีอิก, เอ็ด. A. S. Spirina, M. , 1965;
- ความรู้เบื้องต้นเกี่ยวกับอณูชีววิทยา ทรานส์ จากภาษาอังกฤษ ม. 2510
- โมเลกุลและเซลล์ [นั่ง. ศิลปะ], ทรานส์. จากภาษาอังกฤษ, M., 1966, p. 7 - 27, 94 - 106;
- ชีวเคมีพื้นฐาน: แปลจากภาษาอังกฤษ M. , 1981. ต. 1;
- ปัญหาโปรตีน. ม. , 1995 ต. 1-5;
- โปรตีน. นิวยอร์ก พ.ศ. 2518-2522 3 เอ็ด ว. 1-4.
ค้นหาสิ่งอื่นที่น่าสนใจ:
กระรอก- สารประกอบอินทรีย์ที่มีน้ำหนักโมเลกุลสูงประกอบด้วยสารตกค้างของกรดα-อะมิโน
ใน องค์ประกอบโปรตีนได้แก่คาร์บอน ไฮโดรเจน ไนโตรเจน ออกซิเจน ซัลเฟอร์ โปรตีนบางชนิดก่อตัวเป็นสารเชิงซ้อนกับโมเลกุลอื่นๆ ที่ประกอบด้วยฟอสฟอรัส เหล็ก สังกะสี และทองแดง
โปรตีนมีน้ำหนักโมเลกุลมาก: อัลบูมินไข่ - 36,000, เฮโมโกลบิน - 152,000, ไมโอซิน - 500,000 สำหรับการเปรียบเทียบ: น้ำหนักโมเลกุลของแอลกอฮอล์คือ 46, กรดอะซิติก - 60, เบนซิน - 78
องค์ประกอบของกรดอะมิโนของโปรตีน
กระรอก- โพลีเมอร์ที่ไม่ใช่คาบซึ่งมีโมโนเมอร์อยู่ กรดอะมิโน. โดยทั่วไปแล้ว กรดอะมิโน 20 ชนิดเรียกว่าโปรตีนโมโนเมอร์ แม้ว่าจะพบมากกว่า 170 ชนิดในเซลล์และเนื้อเยื่อก็ตาม
ขึ้นอยู่กับว่ากรดอะมิโนสามารถสังเคราะห์ในร่างกายของมนุษย์และสัตว์อื่น ๆ ได้หรือไม่: กรดอะมิโนที่ไม่จำเป็น- สามารถสังเคราะห์ได้ กรดอะมิโนที่จำเป็น- ไม่สามารถสังเคราะห์ได้ กรดอะมิโนจำเป็นจะต้องส่งเข้าสู่ร่างกายผ่านทางอาหาร พืชสังเคราะห์กรดอะมิโนทุกชนิด
ขึ้นอยู่กับองค์ประกอบของกรดอะมิโน โปรตีนคือ: สมบูรณ์- มีกรดอะมิโนครบชุด มีข้อบกพร่อง- กรดอะมิโนบางชนิดขาดหายไปในองค์ประกอบ ถ้าโปรตีนประกอบด้วยกรดอะมิโนเพียงอย่างเดียวก็จะเรียกว่าโปรตีนนั้น เรียบง่าย. หากโปรตีนมีส่วนประกอบที่ไม่ใช่กรดอะมิโน (กลุ่มเทียม) นอกเหนือจากกรดอะมิโน พวกมันจะถูกเรียกว่า ซับซ้อน. กลุ่มเทียมสามารถแสดงได้ด้วยโลหะ (metalloproteins), คาร์โบไฮเดรต (glycoproteins), ไขมัน (lipoproteins), กรดนิวคลีอิก (nucleoproteins)
ทั้งหมด กรดอะมิโนประกอบด้วย: 1) หมู่คาร์บอกซิล (-COOH) 2) หมู่อะมิโน (-NH 2) 3) อนุมูลหรือหมู่ R (ส่วนที่เหลือของโมเลกุล) โครงสร้างของอนุมูลจะแตกต่างกันไปตามกรดอะมิโนประเภทต่างๆ ขึ้นอยู่กับจำนวนกลุ่มอะมิโนและกลุ่มคาร์บอกซิลที่รวมอยู่ในองค์ประกอบของกรดอะมิโนนั้นมีความโดดเด่น: กรดอะมิโนที่เป็นกลางมีหมู่คาร์บอกซิลหนึ่งหมู่และหมู่อะมิโนหนึ่งหมู่ กรดอะมิโนพื้นฐานมีหมู่อะมิโนมากกว่าหนึ่งหมู่ กรดอะมิโนที่เป็นกรดมีหมู่คาร์บอกซิลมากกว่าหนึ่งหมู่
กรดอะมิโนนั้น สารประกอบแอมโฟเทอริกเนื่องจากในสารละลายสามารถทำหน้าที่เป็นทั้งกรดและเบสได้ ในสารละลายที่เป็นน้ำ กรดอะมิโนมีอยู่ในรูปแบบไอออนิกต่างๆ
พันธะเปปไทด์
เปปไทด์- สารอินทรีย์ที่ประกอบด้วยกรดอะมิโนที่ตกค้างเชื่อมต่อกันด้วยพันธะเปปไทด์
การก่อตัวของเปปไทด์เกิดขึ้นจากปฏิกิริยาการควบแน่นของกรดอะมิโน เมื่อหมู่อะมิโนของกรดอะมิโนตัวหนึ่งทำปฏิกิริยากับหมู่คาร์บอกซิลของอีกกลุ่มหนึ่ง จะเกิดพันธะโควาเลนต์ไนโตรเจน-คาร์บอนระหว่างพวกมัน เรียกว่า เปปไทด์. ขึ้นอยู่กับจำนวนกรดอะมิโนที่ตกค้างรวมอยู่ในเปปไทด์นั่นเอง ไดเปปไทด์, ไตรเปปไทด์, เตตราเปปไทด์ฯลฯ การก่อตัวของพันธะเปปไทด์สามารถเกิดซ้ำได้หลายครั้ง สิ่งนี้นำไปสู่การก่อตัว โพลีเปปไทด์. ที่ปลายด้านหนึ่งของเปปไทด์จะมีหมู่อะมิโนอิสระ (เรียกว่า ปลายเอ็น) และอีกด้านหนึ่งมีหมู่คาร์บอกซิลอิสระ (เรียกว่า ปลายซี)

การจัดระเบียบเชิงพื้นที่ของโมเลกุลโปรตีน
ประสิทธิภาพของการทำงานเฉพาะบางอย่างของโปรตีนขึ้นอยู่กับการกำหนดค่าเชิงพื้นที่ของโมเลกุล นอกจากนี้ เซลล์จะเก็บโปรตีนไว้ในรูปแบบที่กางออกในรูปของสายโซ่ ดังนั้น โซ่โพลีเปปไทด์จึงต้องพับงอจึงได้รับ a โครงสร้างสามมิติหรือโครงสร้างบางอย่าง มี 4 ระดับ การจัดระเบียบเชิงพื้นที่ของโปรตีน.
โครงสร้างโปรตีนปฐมภูมิ- ลำดับการจัดเรียงของกรดอะมิโนที่ตกค้างในสายโซ่โพลีเปปไทด์ที่ประกอบเป็นโมเลกุลโปรตีน พันธะระหว่างกรดอะมิโนคือพันธะเปปไทด์

หากโมเลกุลโปรตีนประกอบด้วยกรดอะมิโนตกค้างเพียง 10 ตัว จำนวนตัวแปรที่เป็นไปได้ทางทฤษฎีของโมเลกุลโปรตีนที่แตกต่างกันตามลำดับการสลับของกรดอะมิโนคือ 10 20 การมีกรดอะมิโน 20 ชนิด คุณสามารถสร้างส่วนผสมที่หลากหลายยิ่งขึ้นจากกรดอะมิโนเหล่านั้น พบโปรตีนต่างๆ ประมาณหมื่นชนิดในร่างกายมนุษย์ ซึ่งแตกต่างกันทั้งจากกันและจากโปรตีนของสิ่งมีชีวิตอื่น
เป็นโครงสร้างหลักของโมเลกุลโปรตีนที่กำหนดคุณสมบัติของโมเลกุลโปรตีนและการกำหนดค่าเชิงพื้นที่ การแทนที่กรดอะมิโนเพียงตัวเดียวด้วยอีกตัวหนึ่งในสายโซ่โพลีเปปไทด์ทำให้เกิดการเปลี่ยนแปลงคุณสมบัติและหน้าที่ของโปรตีน ตัวอย่างเช่นการแทนที่กรดอะมิโนกลูตามิกตัวที่หกในหน่วยβ-subunit ของเฮโมโกลบินด้วยวาลีนนำไปสู่ความจริงที่ว่าโมเลกุลของฮีโมโกลบินโดยรวมไม่สามารถทำหน้าที่หลักได้นั่นคือการขนส่งออกซิเจน ในกรณีเช่นนี้ บุคคลนั้นจะเป็นโรคที่เรียกว่าโรคเม็ดเลือดรูปเคียว
โครงสร้างรอง- สั่งให้พับโซ่โพลีเปปไทด์เป็นเกลียว (ดูเหมือนสปริงขยาย) การหมุนของเกลียวนั้นแข็งแกร่งขึ้นด้วยพันธะไฮโดรเจนที่เกิดขึ้นระหว่างหมู่คาร์บอกซิลและหมู่อะมิโน กลุ่ม CO และ NH เกือบทั้งหมดมีส่วนร่วมในการก่อตัวของพันธะไฮโดรเจน พวกมันอ่อนแอกว่าเปปไทด์ แต่ทำซ้ำหลายครั้งเพื่อมอบความเสถียรและความแข็งแกร่งให้กับการกำหนดค่านี้ ในระดับโครงสร้างทุติยภูมิมีโปรตีน: ไฟโบรอิน (ไหม, ใยแมงมุม), เคราติน (ผม, เล็บ), คอลลาเจน (เส้นเอ็น)



โครงสร้างระดับอุดมศึกษา- การบรรจุโซ่โพลีเปปไทด์เป็นทรงกลมซึ่งเป็นผลมาจากการก่อตัวของพันธะเคมี (ไฮโดรเจน, ไอออนิก, ไดซัลไฟด์) และการสร้างปฏิกิริยาที่ไม่ชอบน้ำระหว่างอนุมูลของกรดอะมิโนที่ตกค้าง บทบาทหลักในการก่อตัวของโครงสร้างตติยภูมินั้นเล่นโดยปฏิกิริยาที่ชอบน้ำและไม่ชอบน้ำ ในสารละลายที่เป็นน้ำ อนุมูลที่ไม่ชอบน้ำมีแนวโน้มที่จะซ่อนตัวจากน้ำ โดยรวมตัวกันอยู่ภายในทรงกลม ในขณะที่อนุมูลที่ชอบน้ำซึ่งเป็นผลมาจากการให้ความชุ่มชื้น (อันตรกิริยากับไดโพลของน้ำ) มีแนวโน้มที่จะปรากฏบนพื้นผิวของโมเลกุล ในโปรตีนบางชนิดโครงสร้างตติยภูมิจะเสถียรโดยพันธะโควาเลนต์ไดซัลไฟด์ที่เกิดขึ้นระหว่างอะตอมกำมะถันของซิสเตอีนที่ตกค้างสองตัว ในระดับโครงสร้างตติยภูมิจะมีเอนไซม์ แอนติบอดี และฮอร์โมนบางชนิด

โครงสร้างควอเตอร์นารีลักษณะของโปรตีนเชิงซ้อนซึ่งมีโมเลกุลเกิดขึ้นจากสองก้อนขึ้นไป หน่วยย่อยจะยังคงอยู่ในโมเลกุลโดยปฏิกิริยาระหว่างไอออนิก ไม่ชอบน้ำ และไฟฟ้าสถิต บางครั้งในระหว่างการก่อตัวของโครงสร้างควอเทอร์นารี พันธะไดซัลไฟด์เกิดขึ้นระหว่างหน่วยย่อย โปรตีนที่มีการศึกษามากที่สุดซึ่งมีโครงสร้างควอเทอร์นารีคือ เฮโมโกลบิน. มันถูกสร้างขึ้นโดยหน่วยย่อย α สองหน่วย (เรซิดิวกรดอะมิโน 141 หน่วย) และหน่วยย่อย β สองหน่วย (เรซิดิวกรดอะมิโน 146 หน่วย) สิ่งที่เกี่ยวข้องกับแต่ละหน่วยย่อยคือโมเลกุลฮีมที่มีธาตุเหล็ก
หากโครงสร้างเชิงพื้นที่ของโปรตีนเบี่ยงเบนไปจากปกติด้วยเหตุผลบางประการ โปรตีนจะไม่สามารถทำหน้าที่ของมันได้ ตัวอย่างเช่น สาเหตุของ "โรควัวบ้า" (สปองจิฟอร์มเอนเซ็ปฟาโลพาที) คือโครงสร้างที่ผิดปกติของพรีออน ซึ่งเป็นโปรตีนบนพื้นผิวของเซลล์ประสาท
คุณสมบัติของโปรตีน
องค์ประกอบและโครงสร้างของกรดอะมิโนของโมเลกุลโปรตีนเป็นตัวกำหนด คุณสมบัติ. โปรตีนผสมผสานคุณสมบัติพื้นฐานและเป็นกรดเข้าด้วยกัน โดยพิจารณาจากอนุมูลของกรดอะมิโน ยิ่งกรดอะมิโนในโปรตีนมีความเป็นกรดมากเท่าใด คุณสมบัติที่เป็นกรดก็จะยิ่งเด่นชัดมากขึ้นเท่านั้น กำหนดความสามารถในการบริจาคและเพิ่ม H+ ได้ คุณสมบัติบัฟเฟอร์ของโปรตีน; บัฟเฟอร์ที่ทรงพลังที่สุดอย่างหนึ่งคือฮีโมโกลบินในเซลล์เม็ดเลือดแดง ซึ่งรักษาค่า pH ของเลือดให้อยู่ในระดับคงที่ มีโปรตีนที่ละลายน้ำได้ (ไฟบริโนเจน) และมีโปรตีนที่ไม่ละลายน้ำซึ่งทำหน้าที่เชิงกล (ไฟโบรอิน, เคราติน, คอลลาเจน) มีโปรตีนหลายชนิดที่ทำงานทางเคมี (เอนไซม์) มีโปรตีนที่ไม่ใช้งานทางเคมีที่ทนต่อสภาพแวดล้อมต่างๆ และโปรตีนที่ไม่เสถียรอย่างยิ่ง
ปัจจัยภายนอก (ความร้อน, รังสีอัลตราไวโอเลต, โลหะหนักและเกลือของพวกมัน, การเปลี่ยนแปลง pH, การแผ่รังสี, การขาดน้ำ)
สามารถทำให้เกิดการหยุดชะงักของการจัดระเบียบโครงสร้างของโมเลกุลโปรตีนได้ กระบวนการสูญเสียโครงสร้างสามมิติที่มีอยู่ในโมเลกุลโปรตีนที่กำหนดเรียกว่า การเสียสภาพ. สาเหตุของการสูญเสียสภาพธรรมชาติคือการแตกหักของพันธะที่ทำให้โครงสร้างโปรตีนบางชนิดมีความเสถียร ในตอนแรก ความสัมพันธ์ที่อ่อนแอที่สุดจะถูกทำลาย และเมื่อเงื่อนไขต่างๆ เข้มงวดมากขึ้น ความสัมพันธ์ที่แข็งแกร่งยิ่งขึ้นก็จะถูกทำลายลง ดังนั้นก่อนอื่นจึงสูญเสียโครงสร้างควอเทอร์นารี จากนั้นจึงสูญเสียโครงสร้างตติยภูมิและทุติยภูมิ การเปลี่ยนแปลงโครงสร้างเชิงพื้นที่ทำให้เกิดการเปลี่ยนแปลงคุณสมบัติของโปรตีน และเป็นผลให้โปรตีนไม่สามารถทำหน้าที่ทางชีวภาพโดยธรรมชาติได้ หากการสูญเสียสภาพไม่ได้มาพร้อมกับการทำลายโครงสร้างหลักก็อาจเป็นเช่นนั้นได้ ย้อนกลับได้ในกรณีนี้การกู้คืนลักษณะโครงสร้างของโปรตีนจะเกิดขึ้นเอง ตัวอย่างเช่น โปรตีนของตัวรับเมมเบรนจะเกิดการสูญเสียสภาพดังกล่าว เรียกว่ากระบวนการฟื้นฟูโครงสร้างโปรตีนหลังจากการทำให้เสียสภาพ การคืนสภาพ. หากเป็นไปไม่ได้ที่จะฟื้นฟูการกำหนดค่าเชิงพื้นที่ของโปรตีนก็จะเรียกว่าการสูญเสียสภาพธรรมชาติ กลับไม่ได้.
หน้าที่ของโปรตีน
| การทำงาน | ตัวอย่างและคำอธิบาย |
|---|---|
| การก่อสร้าง | โปรตีนมีส่วนร่วมในการก่อตัวของโครงสร้างเซลล์และนอกเซลล์: เป็นส่วนหนึ่งของเยื่อหุ้มเซลล์ (ไลโปโปรตีน, ไกลโคโปรตีน), ผม (เคราติน), เส้นเอ็น (คอลลาเจน) ฯลฯ |
| ขนส่ง | โปรตีนฮีโมโกลบินในเลือดจับออกซิเจนและขนส่งจากปอดไปยังเนื้อเยื่อและอวัยวะทั้งหมด จากนั้นจึงถ่ายโอนคาร์บอนไดออกไซด์ไปยังปอด องค์ประกอบของเยื่อหุ้มเซลล์ประกอบด้วยโปรตีนพิเศษที่ช่วยให้มั่นใจได้ถึงการถ่ายโอนสารและไอออนบางชนิดจากเซลล์ไปยังสภาพแวดล้อมภายนอกและด้านหลังอย่างเข้มงวดและเข้มงวด |
| กฎระเบียบ | ฮอร์โมนโปรตีนมีส่วนร่วมในการควบคุมกระบวนการเผาผลาญ ตัวอย่างเช่น ฮอร์โมนอินซูลินควบคุมระดับน้ำตาลในเลือด ส่งเสริมการสังเคราะห์ไกลโคเจน และเพิ่มการสร้างไขมันจากคาร์โบไฮเดรต |
| ป้องกัน | ในการตอบสนองต่อการแทรกซึมของโปรตีนหรือจุลินทรีย์จากต่างประเทศ (แอนติเจน) เข้าสู่ร่างกายจะมีการสร้างโปรตีนชนิดพิเศษขึ้น - แอนติบอดีที่สามารถจับตัวและทำให้เป็นกลางได้ ไฟบริน ที่เกิดจากไฟบริโนเจน ช่วยห้ามเลือด |
| เครื่องยนต์ | โปรตีนแอกตินและไมโอซินที่หดตัวทำให้กล้ามเนื้อหดตัวในสัตว์หลายเซลล์ |
| สัญญาณ | โมเลกุลโปรตีนที่ฝังอยู่ในเยื่อหุ้มผิวของเซลล์มีความสามารถในการเปลี่ยนโครงสร้างตติยภูมิเพื่อตอบสนองต่อปัจจัยด้านสิ่งแวดล้อม จึงรับสัญญาณจากสภาพแวดล้อมภายนอกและส่งคำสั่งไปยังเซลล์ |
| พื้นที่จัดเก็บ | ตามกฎแล้วจะไม่เก็บโปรตีนในร่างกายของสัตว์ ยกเว้นอัลบูมินไข่และเคซีนในนม แต่ต้องขอบคุณโปรตีนที่ทำให้สารบางชนิดสามารถกักเก็บไว้ในร่างกายได้ ตัวอย่างเช่น ในระหว่างการสลายตัวของฮีโมโกลบิน เหล็กจะไม่ถูกกำจัดออกจากร่างกาย แต่จะถูกเก็บไว้ ก่อตัวเป็นสารประกอบเชิงซ้อนกับโปรตีนเฟอร์ริติน |
| พลังงาน | เมื่อโปรตีน 1 กรัมแตกตัวออกเป็นผลิตภัณฑ์ขั้นสุดท้าย จะมีการปล่อยโปรตีน 17.6 กิโลจูลออกมา ขั้นแรก โปรตีนจะแตกตัวเป็นกรดอะมิโน จากนั้นจึงกลายเป็นผลิตภัณฑ์สุดท้าย ได้แก่ น้ำ คาร์บอนไดออกไซด์ และแอมโมเนีย อย่างไรก็ตาม โปรตีนจะถูกใช้เป็นแหล่งพลังงานเฉพาะเมื่อมีการใช้แหล่งอื่น (คาร์โบไฮเดรตและไขมัน) หมดเท่านั้น |
| ตัวเร่งปฏิกิริยา | หน้าที่ที่สำคัญที่สุดอย่างหนึ่งของโปรตีน จัดทำโดยโปรตีน - เอนไซม์ที่ช่วยเร่งปฏิกิริยาทางชีวเคมีที่เกิดขึ้นในเซลล์ ตัวอย่างเช่นไรบูโลสไบฟอสเฟตคาร์บอกซิเลสกระตุ้นการตรึงของ CO 2 ในระหว่างการสังเคราะห์ด้วยแสง |
เอนไซม์
เอนไซม์, หรือ เอนไซม์เป็นโปรตีนประเภทพิเศษที่เป็นตัวเร่งปฏิกิริยาทางชีวภาพ ต้องขอบคุณเอนไซม์ ปฏิกิริยาทางชีวเคมีจึงเกิดขึ้นอย่างรวดเร็ว ความเร็วของปฏิกิริยาเอนไซม์นั้นสูงกว่าความเร็วของปฏิกิริยาที่เกิดขึ้นจากการมีส่วนร่วมของตัวเร่งปฏิกิริยาอนินทรีย์หลายหมื่นเท่า (และบางครั้งก็หลายล้าน) สารที่เอนไซม์ออกฤทธิ์เรียกว่า วัสดุพิมพ์.
เอนไซม์เป็นโปรตีนทรงกลม คุณสมบัติโครงสร้างเอนไซม์สามารถแบ่งออกเป็นสองกลุ่ม: แบบง่ายและซับซ้อน เอนไซม์อย่างง่ายเป็นโปรตีนเชิงเดี่ยว เช่น ประกอบด้วยกรดอะมิโนเท่านั้น เอนไซม์ที่ซับซ้อนเป็นโปรตีนเชิงซ้อน เช่น นอกจากส่วนของโปรตีนแล้ว ยังมีกลุ่มที่ไม่ใช่โปรตีนอีกด้วย - ปัจจัยร่วม. เอนไซม์บางชนิดใช้วิตามินเป็นปัจจัยร่วม โมเลกุลของเอนไซม์ประกอบด้วยส่วนพิเศษที่เรียกว่าแอคทีฟเซนเตอร์ ศูนย์ที่ใช้งานอยู่- ส่วนเล็ก ๆ ของเอนไซม์ (จากสามถึงสิบสองกรดอะมิโนที่ตกค้าง) ซึ่งการจับกันของสารตั้งต้นหรือสารตั้งต้นเกิดขึ้นเพื่อสร้างสารเชิงซ้อนของเอนไซม์และสารตั้งต้น เมื่อปฏิกิริยาเสร็จสิ้น สารเชิงซ้อนของเอนไซม์-ซับสเตรตจะแตกตัวออกเป็นเอนไซม์และผลิตภัณฑ์ที่ทำปฏิกิริยา เอนไซม์บางชนิดมี (ยกเว้นแอคทีฟ) ศูนย์อัลโลสเตอริก- บริเวณที่ติดตัวควบคุมความเร็วของเอนไซม์ ( เอนไซม์อัลโลสเตอริก).

ปฏิกิริยาของการเร่งปฏิกิริยาด้วยเอนไซม์มีลักษณะเฉพาะคือ 1) ประสิทธิภาพสูง 2) การเลือกสรรและทิศทางการออกฤทธิ์ที่เข้มงวด 3) ความจำเพาะของซับสเตรต 4) การควบคุมที่ละเอียดและแม่นยำ ความจำเพาะของสารตั้งต้นและปฏิกิริยาของปฏิกิริยาเร่งปฏิกิริยาของเอนไซม์อธิบายได้จากสมมติฐานของ E. Fischer (1890) และ D. Koshland (1959)
อี. ฟิชเชอร์ (สมมติฐานการล็อคกุญแจ)แนะนำว่าการกำหนดค่าเชิงพื้นที่ของศูนย์กลางแอคทีฟของเอนไซม์และสารตั้งต้นจะต้องสอดคล้องกันทุกประการ สารตั้งต้นจะถูกเปรียบเทียบกับ “กุญแจ” ซึ่งเป็นเอนไซม์ของ “ล็อค”
D. Koshland (สมมติฐานเกี่ยวกับถุงมือมือ)แนะนำว่าความสอดคล้องเชิงพื้นที่ระหว่างโครงสร้างของสารตั้งต้นและจุดศูนย์กลางที่ใช้งานของเอนไซม์นั้นถูกสร้างขึ้นเฉพาะในช่วงเวลาที่มีปฏิสัมพันธ์ซึ่งกันและกันเท่านั้น สมมติฐานนี้เรียกอีกอย่างว่า สมมติฐานการติดต่อชักนำ.
อัตราการเกิดปฏิกิริยาของเอนไซม์ขึ้นอยู่กับ: 1) อุณหภูมิ 2) ความเข้มข้นของเอนไซม์ 3) ความเข้มข้นของสารตั้งต้น 4) pH ควรเน้นว่าเนื่องจากเอนไซม์เป็นโปรตีน กิจกรรมของพวกมันจึงสูงสุดภายใต้สภาวะปกติทางสรีรวิทยา
เอนไซม์ส่วนใหญ่สามารถทำงานได้ที่อุณหภูมิระหว่าง 0 ถึง 40°C เท่านั้น ภายในขีดจำกัดเหล่านี้ อัตราการเกิดปฏิกิริยาจะเพิ่มขึ้นประมาณ 2 เท่า โดยอุณหภูมิจะเพิ่มขึ้นทุกๆ 10 °C ที่อุณหภูมิสูงกว่า 40 °C โปรตีนจะเกิดการเสียสภาพและการทำงานของเอนไซม์ลดลง ที่อุณหภูมิใกล้ถึงจุดเยือกแข็ง เอนไซม์จะหยุดทำงาน
เมื่อปริมาณของสารตั้งต้นเพิ่มขึ้น อัตราการเกิดปฏิกิริยาของเอนไซม์จะเพิ่มขึ้นจนกระทั่งจำนวนโมเลกุลของสารตั้งต้นเท่ากับจำนวนโมเลกุลของเอนไซม์ เมื่อปริมาณของสารตั้งต้นเพิ่มขึ้นอีก ความเร็วจะไม่เพิ่มขึ้น เนื่องจากศูนย์กลางของเอนไซม์ที่ทำงานอยู่จะอิ่มตัว ความเข้มข้นของเอนไซม์ที่เพิ่มขึ้นนำไปสู่กิจกรรมการเร่งปฏิกิริยาที่เพิ่มขึ้น เนื่องจากโมเลกุลของสารตั้งต้นจำนวนมากขึ้นได้รับการเปลี่ยนแปลงต่อหน่วยเวลา

สำหรับเอนไซม์แต่ละตัวจะมีค่า pH ที่เหมาะสมซึ่งจะแสดงกิจกรรมสูงสุด (เปปซิน - 2.0, อะไมเลสทำน้ำลาย - 6.8, ไลเปสตับอ่อน - 9.0) ที่ค่า pH สูงหรือต่ำ กิจกรรมของเอนไซม์จะลดลง เมื่อค่า pH เปลี่ยนแปลงกะทันหัน เอนไซม์จะเสื่อมสภาพ
ความเร็วของเอนไซม์อัลโลสเตอริกถูกควบคุมโดยสารที่เกาะติดกับศูนย์กลางอัลโลสเตอริก หากสารเหล่านี้เร่งปฏิกิริยาก็จะเรียกว่า ตัวกระตุ้นหากพวกเขาช้าลง - สารยับยั้ง.
การจำแนกประเภทของเอนไซม์
ตามประเภทของการเปลี่ยนแปลงทางเคมีที่พวกมันกระตุ้น เอนไซม์แบ่งออกเป็น 6 คลาส:
- ออกซิรีดักเตส(การถ่ายโอนอะตอมของไฮโดรเจน ออกซิเจน หรืออิเล็กตรอนจากสารหนึ่งไปยังอีกสารหนึ่ง - ดีไฮโดรจีเนส)
- การถ่ายโอน(การถ่ายโอนเมทิล, อะซิล, ฟอสเฟตหรือกลุ่มอะมิโนจากสารหนึ่งไปยังอีกสารหนึ่ง - ทรานซามิเนส)
- ไฮโดรเลส(ปฏิกิริยาไฮโดรไลซิสซึ่งผลิตภัณฑ์ทั้งสองเกิดขึ้นจากสารตั้งต้น - อะไมเลส, ไลเปส)
- ไลเอส(การเติมที่ไม่ใช่ไฮโดรไลติกให้กับสารตั้งต้นหรือการแยกกลุ่มอะตอมออกไปซึ่งในกรณีนี้พันธะ C-C, C-N, C-O, C-S สามารถแตกได้ - ดีคาร์บอกซิเลส)
- ไอโซเมอเรส(การจัดเรียงภายในโมเลกุลใหม่ - ไอโซเมอเรส)
- ไลกาส(การเชื่อมต่อของสองโมเลกุลอันเป็นผลมาจากการก่อตัวของพันธะ C-C, C-N, C-O, C-S - synthetase)
คลาสจะถูกแบ่งออกเป็นคลาสย่อยและคลาสย่อยตามลำดับ ในการจำแนกระหว่างประเทศในปัจจุบัน เอนไซม์แต่ละตัวมีรหัสเฉพาะ ซึ่งประกอบด้วยตัวเลขสี่ตัวคั่นด้วยจุด หมายเลขแรกคือคลาส ตัวที่สองคือคลาสย่อย ตัวที่สามคือคลาสย่อย ตัวที่สี่คือหมายเลขซีเรียลของเอนไซม์ในคลาสย่อยนี้ ตัวอย่างเช่น รหัสอาร์จิเนสคือ 3.5.3.1
ไปที่ การบรรยายครั้งที่ 2"โครงสร้างและหน้าที่ของคาร์โบไฮเดรตและไขมัน"
ไปที่ การบรรยายครั้งที่ 4"โครงสร้างและหน้าที่ของกรดนิวคลีอิก ATP"
ในช่วงครึ่งแรกของศตวรรษที่ 19 นักเคมีจำนวนมาก และในหมู่พวกเขาหลักๆ คือ เจ. วอน ลีบิก ค่อยๆ สรุปว่าโปรตีนเป็นตัวแทนของสารประกอบไนโตรเจนประเภทพิเศษ ชื่อ "โปรตีน" (จากภาษากรีก.
โปรโตส ครั้งแรก) ถูกเสนอในปี พ.ศ. 2383 โดยนักเคมีชาวดัตช์ G. Mulder คุณสมบัติทางกายภาพ โปรตีนในสถานะของแข็งจะมีสีขาว แต่ไม่มีสีในสารละลาย เว้นแต่จะมีกลุ่มโครโมฟอร์ (สี) บางชนิด เช่น เฮโมโกลบิน ความสามารถในการละลายน้ำแตกต่างกันไปมากตามโปรตีนต่างๆ นอกจากนี้ยังเปลี่ยนแปลงไปขึ้นอยู่กับ pH และความเข้มข้นของเกลือในสารละลาย ดังนั้นจึงสามารถเลือกสภาวะที่โปรตีนตัวหนึ่งจะตกตะกอนแบบเลือกสรรเมื่อมีโปรตีนอื่นอยู่ด้วย วิธี "แยกเกลือ" นี้ใช้กันอย่างแพร่หลายเพื่อแยกและทำให้โปรตีนบริสุทธิ์ โปรตีนบริสุทธิ์มักจะตกตะกอนออกจากสารละลายเป็นผลึกเมื่อเปรียบเทียบกับสารประกอบอื่นๆ น้ำหนักโมเลกุลของโปรตีนมีขนาดใหญ่มาก ตั้งแต่หลายพันไปจนถึงหลายล้านดาลตัน ดังนั้นในระหว่างการปั่นแยกด้วยความเข้มข้นสูง โปรตีนจึงตกตะกอนและในอัตราที่ต่างกัน เนื่องจากการมีอยู่ของกลุ่มที่มีประจุบวกและลบในโมเลกุลโปรตีน พวกมันจึงเคลื่อนที่ด้วยความเร็วที่แตกต่างกันและในสนามไฟฟ้า นี่เป็นพื้นฐานของอิเล็กโตรโฟรีซิส ซึ่งเป็นวิธีการที่ใช้ในการแยกโปรตีนแต่ละตัวออกจากสารผสมที่ซับซ้อน โปรตีนยังถูกทำให้บริสุทธิ์ด้วยโครมาโตกราฟี
คุณสมบัติทางเคมี โครงสร้าง. โปรตีนเป็นโพลีเมอร์เช่น โมเลกุลที่สร้างขึ้นเหมือนสายโซ่จากหน่วยโมโนเมอร์หรือหน่วยย่อยที่ทำซ้ำตามบทบาทของพวกมัน ก -กรดอะมิโน. กรดอะมิโนสูตรทั่วไปที่ไหนร อะตอมไฮโดรเจนหรือกลุ่มอินทรีย์บางชนิดโมเลกุลโปรตีน (สายโซ่โพลีเปปไทด์) สามารถประกอบด้วยกรดอะมิโนจำนวนค่อนข้างน้อยหรือโมโนเมอร์หลายพันหน่วย การรวมกันของกรดอะมิโนในสายโซ่เป็นไปได้เนื่องจากแต่ละกลุ่มมีกลุ่มเคมีที่แตกต่างกัน 2 กลุ่ม ได้แก่ หมู่อะมิโนที่มีคุณสมบัติพื้นฐาน
เอ็นเอช 2 และหมู่คาร์บอกซิลที่เป็นกรด COOH ทั้งสองกลุ่มนี้มีความเกี่ยวพันกับ ก -อะตอมคาร์บอน หมู่คาร์บอกซิลของกรดอะมิโนหนึ่งตัวสามารถสร้างพันธะเอไมด์ (เปปไทด์) กับหมู่อะมิโนของกรดอะมิโนอีกตัวหนึ่งได้: หลังจากที่กรดอะมิโนสองตัวถูกเชื่อมโยงกันในลักษณะนี้ สายโซ่สามารถถูกขยายออกไปได้โดยการเติมหนึ่งในสามให้กับกรดอะมิโนตัวที่สอง และต่อๆ ไป ดังที่เห็นได้จากสมการข้างต้น เมื่อเกิดพันธะเปปไทด์ โมเลกุลของน้ำจะถูกปล่อยออกมา ในกรณีที่มีกรดด่างหรือเอนไซม์โปรตีโอไลติกปฏิกิริยาจะเกิดขึ้นในทิศทางตรงกันข้าม: สายโพลีเปปไทด์จะถูกแบ่งออกเป็นกรดอะมิโนโดยเติมน้ำ ปฏิกิริยานี้เรียกว่าไฮโดรไลซิส ไฮโดรไลซิสเกิดขึ้นเอง และจำเป็นต้องใช้พลังงานในการเชื่อมต่อกรดอะมิโนเข้ากับสายโซ่โพลีเปปไทด์
หลังจากที่กรดอะมิโนสองตัวถูกเชื่อมโยงกันในลักษณะนี้ สายโซ่สามารถถูกขยายออกไปได้โดยการเติมหนึ่งในสามให้กับกรดอะมิโนตัวที่สอง และต่อๆ ไป ดังที่เห็นได้จากสมการข้างต้น เมื่อเกิดพันธะเปปไทด์ โมเลกุลของน้ำจะถูกปล่อยออกมา ในกรณีที่มีกรดด่างหรือเอนไซม์โปรตีโอไลติกปฏิกิริยาจะเกิดขึ้นในทิศทางตรงกันข้าม: สายโพลีเปปไทด์จะถูกแบ่งออกเป็นกรดอะมิโนโดยเติมน้ำ ปฏิกิริยานี้เรียกว่าไฮโดรไลซิส ไฮโดรไลซิสเกิดขึ้นเอง และจำเป็นต้องใช้พลังงานในการเชื่อมต่อกรดอะมิโนเข้ากับสายโซ่โพลีเปปไทด์ หมู่คาร์บอกซิลและหมู่เอไมด์ (หรือหมู่อิไมด์ที่คล้ายกันในกรณีของกรดอะมิโนโพรลีน) มีอยู่ในกรดอะมิโนทั้งหมด แต่ความแตกต่างระหว่างกรดอะมิโนถูกกำหนดโดยธรรมชาติของกลุ่มหรือ "สายด้านข้าง" ซึ่งระบุไว้ข้างต้นด้วยตัวอักษร
ร . บทบาทของสายด้านข้างสามารถเล่นได้โดยอะตอมไฮโดรเจนหนึ่งอะตอม เช่น ในกรดอะมิโนไกลซีน หรือโดยกลุ่มขนาดใหญ่บางกลุ่ม เช่น ในฮิสทิดีนและทริปโตเฟน โซ่ข้างบางอันมีความเฉื่อยทางเคมี ในขณะที่บางโซ่มีปฏิกิริยาชัดเจนสามารถสังเคราะห์กรดอะมิโนได้หลายพันชนิด และกรดอะมิโนหลายชนิดเกิดขึ้นในธรรมชาติ แต่กรดอะมิโนเพียง 20 ชนิดเท่านั้นที่ใช้สำหรับการสังเคราะห์โปรตีน ได้แก่ อะลานีน อาร์จินีน แอสพาราจีน กรดแอสปาร์ติก วาลีน ฮิสทิดีน ไกลซีน กลูตามีน กลูตามิก กรด, ไอโซลิวซีน, ลิวซีน, ไลซีน, เมไทโอนีน, โพรลีน, ซีรีน, ไทโรซีน, ธรีโอนีน, ทริปโตเฟน, ฟีนิลอะลานีน และซิสเทอีน (ในโปรตีน ซิสเทอีนอาจมีเป็นไดเมอร์
ซีสตีน) จริงอยู่ โปรตีนบางชนิดมีกรดอะมิโนอื่น ๆ นอกเหนือจากกรดอะมิโนที่พบอยู่ประจำอีก 20 ชนิด แต่เกิดขึ้นจากการดัดแปลงกรดอะมิโนชนิดหนึ่งในยี่สิบชนิดที่ลงไว้หลังจากที่รวมเข้าในโปรตีนแล้วกิจกรรมทางแสง กรดอะมิโนทั้งหมดมี ยกเว้นไกลซีน ก อะตอม -คาร์บอนมีกลุ่มที่แตกต่างกันสี่กลุ่มติดอยู่ จากมุมมองของเรขาคณิต สามารถแนบกลุ่มที่แตกต่างกันสี่กลุ่มเข้าด้วยกันได้สองวิธี และดังนั้นจึงมีการกำหนดค่าที่เป็นไปได้สองแบบ หรือสองไอโซเมอร์ ซึ่งสัมพันธ์กันในฐานะวัตถุหนึ่งกับภาพสะท้อนในกระจก กล่าวคือ เหมือนมือซ้ายไปทางขวา การกำหนดค่าหนึ่งเรียกว่าซ้ายหรือมือซ้าย (ล ) และสิทธิอื่น ๆ หรือ dextrorotatory (ดี ) เนื่องจากไอโซเมอร์สองตัวดังกล่าวแตกต่างกันในทิศทางการหมุนของระนาบของแสงโพลาไรซ์ พบได้ในโปรตีนเท่านั้นล -กรดอะมิโน (ยกเว้นไกลซีน มันสามารถแสดงได้ในรูปแบบเดียวเท่านั้น เนื่องจากสองในสี่กลุ่มของมันเหมือนกัน) และทั้งหมดนี้มีปฏิกิริยาทางแสง (เนื่องจากมีไอโซเมอร์เพียงตัวเดียว)ดี -กรดอะมิโนนั้นหาได้ยากในธรรมชาติ พบได้ในยาปฏิชีวนะบางชนิดและผนังเซลล์ของแบคทีเรียลำดับกรดอะมิโน กรดอะมิโนในสายโซ่โพลีเปปไทด์ไม่ได้จัดเรียงแบบสุ่ม แต่อยู่ในลำดับคงที่ และลำดับนี้เองที่กำหนดหน้าที่และคุณสมบัติของโปรตีน ด้วยการเปลี่ยนลำดับของกรดอะมิโน 20 ชนิด คุณสามารถสร้างโปรตีนต่างๆ จำนวนมากได้ เช่นเดียวกับที่คุณสามารถสร้างข้อความต่างๆ จากตัวอักษรของตัวอักษรได้ในอดีต การระบุลำดับกรดอะมิโนของโปรตีนมักใช้เวลานานหลายปี การตัดสินใจโดยตรงยังคงเป็นงานที่ต้องใช้แรงงานมาก แม้ว่าจะมีการสร้างอุปกรณ์ที่อนุญาตให้ดำเนินการได้โดยอัตโนมัติก็ตาม โดยปกติแล้วจะง่ายกว่าที่จะระบุลำดับนิวคลีโอไทด์ของยีนที่เกี่ยวข้องและอนุมานลำดับกรดอะมิโนของโปรตีนจากยีนนั้น จนถึงปัจจุบัน ลำดับกรดอะมิโนของโปรตีนหลายร้อยชนิดได้ถูกกำหนดไว้แล้ว มักจะรู้จักการทำงานของโปรตีนที่ถอดรหัสและสิ่งนี้ช่วยในการจินตนาการถึงการทำงานที่เป็นไปได้ของโปรตีนที่คล้ายกันที่เกิดขึ้นเช่นในเนื้องอกมะเร็ง
โปรตีนเชิงซ้อน โปรตีนที่ประกอบด้วยกรดอะมิโนเท่านั้นเรียกว่าง่าย อย่างไรก็ตาม บ่อยครั้งอะตอมของโลหะหรือสารประกอบทางเคมีบางชนิดที่ไม่ใช่กรดอะมิโนติดอยู่กับสายพอลิเปปไทด์ โปรตีนดังกล่าวเรียกว่าเชิงซ้อน ตัวอย่างคือฮีโมโกลบิน ซึ่งมีธาตุเหล็กพอร์ไฟริน ซึ่งกำหนดสีแดงและยอมให้ฮีโมโกลบินทำหน้าที่เป็นตัวพาออกซิเจนชื่อของโปรตีนที่ซับซ้อนที่สุดบ่งบอกถึงธรรมชาติของกลุ่มที่แนบมา: ไกลโคโปรตีนมีน้ำตาล, ไลโปโปรตีนมีไขมัน หากกิจกรรมการเร่งปฏิกิริยาของเอนไซม์ขึ้นอยู่กับกลุ่มที่เกาะติดกัน ก็จะเรียกว่ากลุ่มเทียม วิตามินมักมีบทบาทเป็นกลุ่มเทียมหรือเป็นส่วนหนึ่งของกลุ่มเทียม ตัวอย่างเช่น วิตามินเอที่จับกับโปรตีนตัวใดตัวหนึ่งในเรตินาจะเป็นตัวกำหนดความไวต่อแสง
โครงสร้างระดับอุดมศึกษา สิ่งสำคัญไม่ได้อยู่ที่ลำดับกรดอะมิโนของโปรตีนมากนัก (โครงสร้างหลัก) แต่เป็นลำดับของโปรตีนในอวกาศ ตลอดความยาวสายโซ่โพลีเปปไทด์ ไฮโดรเจนไอออนจะก่อตัวเป็นพันธะไฮโดรเจนปกติ ซึ่งทำให้มันมีรูปร่างเป็นเกลียวหรือเป็นชั้น (โครงสร้างรอง) จากการรวมกันของเอนริเก้และชั้นดังกล่าวทำให้เกิดรูปแบบที่กะทัดรัดของลำดับถัดไป: โครงสร้างระดับตติยภูมิของโปรตีน รอบๆ พันธะที่ยึดหน่วยโมโนเมอร์ของสายโซ่ จะสามารถหมุนเป็นมุมเล็กๆ ได้ ดังนั้น จากมุมมองทางเรขาคณิตล้วนๆ จำนวนรูปแบบที่เป็นไปได้สำหรับสายโพลีเปปไทด์ใดๆ จึงมีมากอย่างไม่จำกัด ในความเป็นจริง โปรตีนแต่ละชนิดโดยปกติมีอยู่ในรูปแบบเดียวเท่านั้น ซึ่งถูกกำหนดโดยลำดับกรดอะมิโนของมัน โครงสร้างนี้ไม่เข้มงวดก็เหมือนกับว่า « หายใจ” ผันผวนตามการกำหนดค่าโดยเฉลี่ยที่แน่นอน วงจรถูกพับเป็นรูปแบบที่พลังงานอิสระ (ความสามารถในการผลิตงาน) มีน้อย เช่นเดียวกับสปริงที่ปล่อยออกมาจะบีบอัดเฉพาะในสถานะที่สอดคล้องกับพลังงานอิสระขั้นต่ำเท่านั้น บ่อยครั้งที่ส่วนหนึ่งของโซ่เชื่อมโยงอย่างแน่นหนากับอีกส่วนหนึ่งด้วยไดซัลไฟด์ (เอสเอส) พันธะระหว่างซีสเตอีนตกค้างสองชนิด นี่เป็นส่วนหนึ่งว่าทำไมซีสเตอีนจึงมีบทบาทสำคัญในกรดอะมิโนความซับซ้อนของโครงสร้างของโปรตีนมีมากจนไม่สามารถคำนวณโครงสร้างตติยภูมิของโปรตีนได้ แม้ว่าจะทราบลำดับกรดอะมิโนก็ตาม แต่ถ้าเป็นไปได้ที่จะได้รับผลึกโปรตีน โครงสร้างตติยภูมิของมันสามารถถูกกำหนดได้โดยการเลี้ยวเบนของรังสีเอกซ์
ในโครงสร้าง โปรตีนที่หดตัวและโปรตีนอื่นๆ โซ่จะยาวขึ้นและมีโซ่ที่พับเล็กน้อยหลายอันวางอยู่ใกล้ๆ เกิดเป็นไฟบริล ในทางกลับกันไฟบริลจะพับเป็นเส้นใยที่ใหญ่ขึ้น อย่างไรก็ตาม โปรตีนส่วนใหญ่ในสารละลายจะมีรูปร่างเป็นทรงกลม โดยโซ่จะขดเป็นทรงกลมเหมือนกับเส้นด้ายที่อยู่ในลูกบอล พลังงานอิสระที่มีการกำหนดค่านี้มีน้อยมาก เนื่องจากกรดอะมิโนที่ไม่ชอบน้ำ ("กันน้ำ") ถูกซ่อนอยู่ภายในทรงกลม และกรดอะมิโนที่ชอบน้ำ ("ดึงดูดน้ำ") อยู่บนพื้นผิว
โปรตีนหลายชนิดเป็นสารเชิงซ้อนของสายโพลีเปปไทด์หลายสาย โครงสร้างนี้เรียกว่าโครงสร้างควอเทอร์นารีของโปรตีน ตัวอย่างเช่น โมเลกุลของฮีโมโกลบินประกอบด้วยหน่วยย่อย 4 หน่วย ซึ่งแต่ละหน่วยเป็นโปรตีนทรงกลม
โปรตีนเชิงโครงสร้างเนื่องจากการกำหนดค่าเชิงเส้น ทำให้เกิดเส้นใยที่มีความต้านทานแรงดึงสูงมาก ในขณะที่การกำหนดค่าแบบทรงกลมทำให้โปรตีนสามารถเข้าสู่ปฏิกิริยาเฉพาะกับสารประกอบอื่นๆ ได้ บนพื้นผิวของทรงกลม เมื่อวางโซ่อย่างถูกต้อง โพรงที่มีรูปร่างบางอย่างจะปรากฏขึ้นซึ่งมีกลุ่มสารเคมีที่ทำปฏิกิริยาอยู่ หากโปรตีนที่กำหนดเป็นเอนไซม์ โมเลกุลของสารบางชนิดซึ่งมักจะมีขนาดเล็กกว่าก็จะเข้าไปในช่องดังกล่าว เช่นเดียวกับกุญแจที่เข้าไปในล็อค ในกรณีนี้การกำหนดค่าของเมฆอิเล็กตรอนของโมเลกุลจะเปลี่ยนไปภายใต้อิทธิพลของกลุ่มเคมีที่อยู่ในโพรงและสิ่งนี้บังคับให้มันทำปฏิกิริยาในลักษณะใดลักษณะหนึ่ง ด้วยวิธีนี้เอนไซม์จะกระตุ้นปฏิกิริยา โมเลกุลของแอนติบอดียังมีโพรงซึ่งสารแปลกปลอมหลายชนิดจับกันและทำให้ไม่เป็นอันตราย แบบจำลอง "ล็อคและกุญแจ" ซึ่งอธิบายอันตรกิริยาของโปรตีนกับสารประกอบอื่นๆ ช่วยให้เราเข้าใจความจำเพาะของเอนไซม์และแอนติบอดี เช่น ความสามารถในการทำปฏิกิริยากับสารประกอบบางชนิดเท่านั้น
โปรตีนในสิ่งมีชีวิตประเภทต่างๆ โปรตีนที่ทำหน้าที่เหมือนกันในพืชและสัตว์ต่างสายพันธุ์ จึงมีชื่อเดียวกันก็มีโครงสร้างที่คล้ายคลึงกัน อย่างไรก็ตาม มีลำดับกรดอะมิโนที่แตกต่างกันบ้าง เนื่องจากสปีชีส์แตกต่างจากบรรพบุรุษร่วมกัน กรดอะมิโนบางชนิดในบางตำแหน่งจะถูกแทนที่ด้วยการกลายพันธุ์ของกรดอะมิโนชนิดอื่น การกลายพันธุ์ที่เป็นอันตรายที่ทำให้เกิดโรคทางพันธุกรรมจะถูกกำจัดโดยการคัดเลือกโดยธรรมชาติ แต่การกลายพันธุ์ที่เป็นประโยชน์หรืออย่างน้อยก็อาจยังคงอยู่ได้ ยิ่งทางชีวภาพสองสายพันธุ์อยู่ใกล้กันมากเท่าไร ก็จะพบความแตกต่างในโปรตีนน้อยลงเท่านั้นโปรตีนบางชนิดเปลี่ยนแปลงได้ค่อนข้างเร็ว ส่วนโปรตีนบางชนิดได้รับการอนุรักษ์ไว้เป็นอย่างดี อย่างหลังรวมถึง ตัวอย่างเช่น ไซโตโครม กับเอนไซม์ทางเดินหายใจที่พบในสิ่งมีชีวิตส่วนใหญ่ ในมนุษย์และลิงชิมแปนซี ลำดับกรดอะมิโนของมันจะเหมือนกันและในไซโตโครม กับในข้าวสาลี มีกรดอะมิโนเพียง 38% เท่านั้นที่แตกต่างกัน แม้แต่การเปรียบเทียบระหว่างมนุษย์กับแบคทีเรียก็มีความคล้ายคลึงกันของไซโตโครม กับ(ความแตกต่างส่งผลต่อกรดอะมิโนถึง 65% ที่นี่) ยังคงสามารถเห็นได้ แม้ว่าบรรพบุรุษร่วมของแบคทีเรียและมนุษย์จะอาศัยอยู่บนโลกเมื่อประมาณสองพันล้านปีก่อนก็ตาม ปัจจุบัน การเปรียบเทียบลำดับกรดอะมิโนมักใช้เพื่อสร้างต้นไม้สายวิวัฒนาการ (วงศ์) ซึ่งสะท้อนถึงความสัมพันธ์เชิงวิวัฒนาการระหว่างสิ่งมีชีวิตต่างๆ
การเสียสภาพ โมเลกุลโปรตีนที่สังเคราะห์ขึ้นเมื่อพับแล้วจะได้ลักษณะเฉพาะของมัน อย่างไรก็ตาม โครงสร้างนี้สามารถถูกทำลายได้โดยการให้ความร้อน โดยการเปลี่ยน pH โดยการสัมผัสกับตัวทำละลายอินทรีย์ และแม้กระทั่งโดยการเขย่าสารละลายจนกระทั่งฟองปรากฏบนพื้นผิว โปรตีนที่ถูกดัดแปลงในลักษณะนี้เรียกว่าถูกทำให้เสียสภาพ มันสูญเสียกิจกรรมทางชีวภาพและมักจะไม่ละลายน้ำ ตัวอย่างที่รู้จักกันดีของโปรตีนที่ถูกทำลาย ได้แก่ ไข่ต้มหรือวิปครีม โปรตีนขนาดเล็กที่มีกรดอะมิโนเพียงประมาณร้อยตัวเท่านั้นที่สามารถเปลี่ยนสภาพใหม่ได้ เช่น รับการกำหนดค่าเดิมอีกครั้ง แต่โปรตีนส่วนใหญ่ก็กลายเป็นกลุ่มโซ่โพลีเปปไทด์ที่พันกันและไม่สามารถคืนโครงสร้างเดิมได้ปัญหาหลักประการหนึ่งในการแยกโปรตีนออกฤทธิ์คือความไวต่อการสูญเสียสภาพธรรมชาติอย่างมาก คุณสมบัติของโปรตีนนี้พบว่ามีประโยชน์ในการถนอมอาหาร กล่าวคือ อุณหภูมิสูงจะทำให้เอนไซม์ของจุลินทรีย์เสื่อมสภาพอย่างถาวร และจุลินทรีย์จะตาย
การสังเคราะห์โปรตีน เพื่อสังเคราะห์โปรตีน สิ่งมีชีวิตต้องมีระบบเอนไซม์ที่สามารถรวมกรดอะมิโนหนึ่งเข้ากับอีกกรดหนึ่งได้ จำเป็นต้องมีแหล่งข้อมูลเพื่อพิจารณาว่าควรรวมกรดอะมิโนชนิดใด เนื่องจากมีโปรตีนในร่างกายหลายพันชนิด และแต่ละชนิดประกอบด้วยกรดอะมิโนหลายร้อยชนิดโดยเฉลี่ย ข้อมูลที่ต้องการจึงต้องมีมหาศาลอย่างแท้จริง มันถูกจัดเก็บ (คล้ายกับวิธีการจัดเก็บการบันทึกบนเทปแม่เหล็ก) ในโมเลกุลกรดนิวคลีอิกที่ประกอบเป็นยีน ซม . กรรมพันธุ์ด้วย; กรดนิวคลีอิก.การกระตุ้นเอนไซม์ สายโพลีเปปไทด์ที่สังเคราะห์จากกรดอะมิโนไม่ใช่โปรตีนในรูปแบบสุดท้ายเสมอไป เอนไซม์จำนวนมากถูกสังเคราะห์ขึ้นก่อนเป็นสารตั้งต้นที่ไม่ใช้งานและจะทำงานได้หลังจากที่เอนไซม์ตัวอื่นกำจัดกรดอะมิโนหลายตัวที่ปลายด้านหนึ่งของสายโซ่เท่านั้น เอนไซม์ย่อยอาหารบางชนิด เช่น ทริปซิน ถูกสังเคราะห์ในรูปแบบที่ไม่ใช้งานนี้ เอนไซม์เหล่านี้ถูกกระตุ้นในระบบทางเดินอาหารอันเป็นผลมาจากการกำจัดส่วนปลายของโซ่ออก ฮอร์โมนอินซูลินซึ่งเป็นโมเลกุลในรูปแบบที่ออกฤทธิ์ประกอบด้วยสายสั้นสองสายถูกสังเคราะห์ในรูปแบบของสายโซ่เดียวที่เรียกว่า โปรอินซูลิน จากนั้นส่วนตรงกลางของสายโซ่นี้จะถูกเอาออก และชิ้นส่วนที่เหลือจะจับกันเป็นโมเลกุลของฮอร์โมนที่ทำงานอยู่ โปรตีนเชิงซ้อนจะเกิดขึ้นหลังจากกลุ่มสารเคมีเฉพาะเจาะจงติดกับโปรตีนเท่านั้น และสิ่งที่แนบมานี้มักต้องใช้เอนไซม์ด้วยการไหลเวียนของเมตาบอลิซึม หลังจากให้กรดอะมิโนจากสัตว์ที่มีฉลากไอโซโทปกัมมันตรังสีคาร์บอน ไนโตรเจน หรือไฮโดรเจน ฉลากดังกล่าวจะถูกรวมเข้ากับโปรตีนอย่างรวดเร็ว หากกรดอะมิโนที่มีฉลากหยุดเข้าสู่ร่างกาย ปริมาณของฉลากในโปรตีนจะเริ่มลดลง การทดลองเหล่านี้แสดงให้เห็นว่าโปรตีนที่ได้จะไม่คงอยู่ในร่างกายจนกว่าจะสิ้นสุดชีวิต ทั้งหมดนี้ มีข้อยกเว้นบางประการ อยู่ในสถานะไดนามิก โดยแตกตัวเป็นกรดอะมิโนอยู่ตลอดเวลา แล้วจึงสังเคราะห์อีกครั้งโปรตีนบางชนิดจะสลายตัวเมื่อเซลล์ตายและถูกทำลาย สิ่งนี้เกิดขึ้นตลอดเวลา เช่น มีเซลล์เม็ดเลือดแดงและเซลล์เยื่อบุผิวเรียงรายอยู่บริเวณผิวด้านในของลำไส้ นอกจากนี้การสลายและการสังเคราะห์โปรตีนยังเกิดขึ้นในเซลล์ที่มีชีวิตด้วย น่าแปลกที่ไม่ค่อยมีใครรู้เรื่องการสลายโปรตีนมากกว่าการสังเคราะห์ อย่างไรก็ตาม เป็นที่ชัดเจนว่าการสลายเกี่ยวข้องกับเอนไซม์โปรตีโอไลติกที่คล้ายคลึงกับเอนไซม์ที่สลายโปรตีนให้เป็นกรดอะมิโนในระบบทางเดินอาหาร
ครึ่งชีวิตของโปรตีนต่างๆ จะแตกต่างกันไปตั้งแต่หลายชั่วโมงจนถึงหลายเดือน ข้อยกเว้นเพียงอย่างเดียวคือโมเลกุลคอลลาเจน เมื่อสร้างแล้ว พวกมันจะคงตัวและไม่มีการต่ออายุหรือเปลี่ยนใหม่ อย่างไรก็ตาม เมื่อเวลาผ่านไป คุณสมบัติบางอย่างจะเปลี่ยนไป โดยเฉพาะความยืดหยุ่น และเนื่องจากไม่ได้เกิดใหม่ จึงส่งผลให้เกิดการเปลี่ยนแปลงตามอายุ เช่น ปรากฏริ้วรอยบนผิวหนัง
โปรตีนสังเคราะห์ นักเคมีได้เรียนรู้มานานแล้วว่าจะทำปฏิกิริยาโพลีเมอร์ไรซ์กรดอะมิโน แต่กรดอะมิโนจะถูกนำมารวมกันในลักษณะที่ไม่เป็นระเบียบ ดังนั้น ผลิตภัณฑ์ที่เกิดจากปฏิกิริยาโพลีเมอไรเซชันดังกล่าวจึงมีความคล้ายคลึงกับธรรมชาติเพียงเล็กน้อย จริงอยู่ที่เป็นไปได้ที่จะรวมกรดอะมิโนตามลำดับซึ่งทำให้สามารถรับโปรตีนที่มีฤทธิ์ทางชีวภาพบางชนิดได้โดยเฉพาะอินซูลิน กระบวนการนี้ค่อนข้างซับซ้อน และด้วยวิธีนี้ จึงเป็นไปได้ที่จะได้รับเฉพาะโปรตีนที่มีโมเลกุลประกอบด้วยกรดอะมิโนประมาณร้อยตัวเท่านั้น เป็นการดีกว่าที่จะสังเคราะห์หรือแยกลำดับนิวคลีโอไทด์ของยีนที่สอดคล้องกับลำดับกรดอะมิโนที่ต้องการ และจากนั้นนำยีนนี้เข้าไปในแบคทีเรีย ซึ่งจะผลิตผลิตภัณฑ์ที่ต้องการในปริมาณมากโดยการจำลองแบบ อย่างไรก็ตามวิธีนี้ก็มีข้อเสียเช่นกัน ซม . วิศวกรรมพันธุศาสตร์ด้วย โปรตีนและโภชนาการ เมื่อโปรตีนในร่างกายแตกตัวเป็นกรดอะมิโน กรดอะมิโนเหล่านี้จึงสามารถนำมาใช้สังเคราะห์โปรตีนได้อีกครั้ง ในขณะเดียวกัน กรดอะมิโนเองก็อาจถูกทำลายได้ ดังนั้นจึงไม่สามารถนำกลับมาใช้ใหม่ได้ทั้งหมด เป็นที่ชัดเจนว่าในระหว่างการเจริญเติบโต การตั้งครรภ์ และการรักษาบาดแผล การสังเคราะห์โปรตีนจะต้องเกินกว่าการสลาย ร่างกายสูญเสียโปรตีนบางส่วนอย่างต่อเนื่อง เหล่านี้เป็นโปรตีนของเส้นผม เล็บ และชั้นผิวของผิวหนัง ดังนั้นในการสังเคราะห์โปรตีน สิ่งมีชีวิตแต่ละชนิดจะต้องได้รับกรดอะมิโนจากอาหาร พืชสีเขียวสังเคราะห์จาก CO 2 น้ำและแอมโมเนียหรือไนเตรตล้วนเป็นกรดอะมิโน 20 ชนิดที่พบในโปรตีน แบคทีเรียจำนวนมากยังสามารถสังเคราะห์กรดอะมิโนเมื่อมีน้ำตาล (หรือบางส่วนที่เทียบเท่า) และไนโตรเจนคงที่ แต่ท้ายที่สุดแล้วน้ำตาลก็จะได้รับจากพืชสีเขียว สัตว์มีความสามารถจำกัดในการสังเคราะห์กรดอะมิโน พวกเขาได้รับกรดอะมิโนจากการกินพืชสีเขียวหรือสัตว์อื่น ๆ ในระบบทางเดินอาหารโปรตีนที่ดูดซึมจะถูกแบ่งออกเป็นกรดอะมิโนส่วนหลังถูกดูดซึมและจากโปรตีนเหล่านี้ก็จะถูกสร้างขึ้นโดยมีลักษณะเฉพาะของสิ่งมีชีวิตที่กำหนด โปรตีนที่ถูกดูดซึมจะไม่รวมอยู่ในโครงสร้างของร่างกายเช่นนี้ ข้อยกเว้นเพียงอย่างเดียวคือในสัตว์เลี้ยงลูกด้วยนมหลายชนิด แอนติบอดีของมารดาบางชนิดสามารถส่งผ่านรกไปยังกระแสเลือดของทารกในครรภ์ได้อย่างสมบูรณ์ และผ่านทางน้ำนมของมารดา (โดยเฉพาะในสัตว์เคี้ยวเอื้อง) สามารถถ่ายโอนไปยังทารกแรกเกิดได้ทันทีหลังคลอดความต้องการโปรตีน เป็นที่ชัดเจนว่าเพื่อรักษาชีวิตร่างกายจะต้องได้รับโปรตีนจากอาหารจำนวนหนึ่ง อย่างไรก็ตาม ขอบเขตของความต้องการนี้ขึ้นอยู่กับปัจจัยหลายประการ ร่างกายต้องการอาหารทั้งเป็นแหล่งพลังงาน (แคลอรี่) และเป็นวัตถุดิบในการสร้างโครงสร้าง ความต้องการพลังงานมาเป็นอันดับแรก ซึ่งหมายความว่าเมื่อมีคาร์โบไฮเดรตและไขมันน้อยในอาหาร โปรตีนในอาหารจะไม่ถูกใช้เพื่อการสังเคราะห์โปรตีนของตัวเอง แต่เป็นแหล่งแคลอรี่ ในระหว่างการอดอาหารเป็นเวลานาน แม้แต่โปรตีนของคุณเองก็ยังถูกใช้เพื่อตอบสนองความต้องการพลังงาน หากมีคาร์โบไฮเดรตเพียงพอในอาหารก็สามารถลดการบริโภคโปรตีนได้ความสมดุลของไนโตรเจน โดยเฉลี่ยประมาณ 16% ของมวลโปรตีนทั้งหมดคือไนโตรเจน เมื่อกรดอะมิโนที่มีอยู่ในโปรตีนถูกทำลาย ไนโตรเจนที่มีอยู่ในโปรตีนจะถูกขับออกจากร่างกายทางปัสสาวะ และ (ในระดับที่น้อยกว่า) จะออกทางอุจจาระในรูปของสารประกอบไนโตรเจนต่างๆ ดังนั้นจึงสะดวกที่จะใช้ตัวบ่งชี้ เช่น ความสมดุลของไนโตรเจน เพื่อประเมินคุณภาพของสารอาหารที่เป็นโปรตีน เช่น ความแตกต่าง (เป็นกรัม) ระหว่างปริมาณไนโตรเจนที่เข้าสู่ร่างกายกับปริมาณไนโตรเจนที่ขับออกมาต่อวัน หากได้รับสารอาหารตามปกติในผู้ใหญ่ ปริมาณเหล่านี้จะเท่ากัน ในสิ่งมีชีวิตที่กำลังเติบโตปริมาณไนโตรเจนที่ถูกขับออกมาจะน้อยกว่าปริมาณที่ได้รับนั่นคือ ยอดคงเหลือเป็นบวก หากขาดโปรตีนในอาหาร ความสมดุลจะเป็นลบ หากมีแคลอรี่เพียงพอในอาหาร แต่ไม่มีโปรตีนอยู่ในนั้น ร่างกายจะประหยัดโปรตีน ในเวลาเดียวกัน เมแทบอลิซึมของโปรตีนจะช้าลง และการใช้กรดอะมิโนในการสังเคราะห์โปรตีนซ้ำ ๆ จะเกิดขึ้นอย่างมีประสิทธิภาพสูงสุดเท่าที่จะเป็นไปได้ อย่างไรก็ตาม การสูญเสียเป็นสิ่งที่หลีกเลี่ยงไม่ได้ และสารประกอบไนโตรเจนยังคงถูกขับออกทางปัสสาวะและบางส่วนอยู่ในอุจจาระ ปริมาณไนโตรเจนที่ถูกขับออกจากร่างกายต่อวันระหว่างการอดโปรตีนสามารถใช้เป็นตัวชี้วัดการขาดโปรตีนในแต่ละวันได้ เป็นเรื่องปกติที่จะสรุปได้ว่าการแนะนำปริมาณโปรตีนที่เทียบเท่ากับการขาดสารอาหารนี้เข้าสู่อาหารจะทำให้สามารถคืนสมดุลของไนโตรเจนได้ อย่างไรก็ตามมันไม่ใช่ หลังจากได้รับโปรตีนในปริมาณนี้ ร่างกายจะเริ่มใช้กรดอะมิโนอย่างมีประสิทธิภาพน้อยลง ดังนั้นจึงจำเป็นต้องมีโปรตีนเพิ่มเติมบางส่วนเพื่อคืนสมดุลของไนโตรเจนหากปริมาณโปรตีนในอาหารเกินความจำเป็นในการรักษาสมดุลของไนโตรเจน ก็ดูเหมือนจะไม่มีอันตรายใดๆ กรดอะมิโนส่วนเกินถูกใช้เป็นแหล่งพลังงานเพียงอย่างเดียว ตัวอย่างที่โดดเด่นเป็นพิเศษคือ ชาวเอสกิโมบริโภคคาร์โบไฮเดรตเพียงเล็กน้อยและมากกว่าปริมาณโปรตีนประมาณ 10 เท่าที่จำเป็นต่อการรักษาสมดุลของไนโตรเจน อย่างไรก็ตาม ในกรณีส่วนใหญ่ การใช้โปรตีนเป็นแหล่งพลังงานไม่มีประโยชน์ เนื่องจากคาร์โบไฮเดรตในปริมาณที่กำหนดสามารถผลิตแคลอรี่ได้มากกว่าโปรตีนในปริมาณเท่ากัน ในประเทศยากจน ผู้คนได้รับแคลอรี่จากคาร์โบไฮเดรตและบริโภคโปรตีนในปริมาณน้อยที่สุด
หากร่างกายได้รับแคลอรี่ตามจำนวนที่ต้องการในรูปของผลิตภัณฑ์ที่ไม่ใช่โปรตีน ปริมาณโปรตีนขั้นต่ำเพื่อให้แน่ใจว่าจะรักษาสมดุลของไนโตรเจนได้ประมาณ 30 กรัมต่อวัน โปรตีนจำนวนมากนี้มีอยู่ในขนมปังสี่แผ่นหรือนม 0.5 ลิตร โดยปกติแล้วจำนวนที่มากกว่าเล็กน้อยจะถือว่าเหมาะสมที่สุด แนะนำให้ใช้ 50 ถึง 70 กรัม
กรดอะมิโนที่จำเป็น จนถึงขณะนี้ถือว่าโปรตีนโดยรวม ในขณะเดียวกัน เพื่อให้การสังเคราะห์โปรตีนเกิดขึ้น จะต้องมีกรดอะมิโนที่จำเป็นทั้งหมดอยู่ในร่างกาย ร่างกายของสัตว์นั้นสามารถสังเคราะห์กรดอะมิโนบางชนิดได้ พวกมันถูกเรียกว่าทดแทนได้เพราะไม่จำเป็นต้องมีอยู่ในอาหาร สิ่งสำคัญคือปริมาณโปรตีนโดยรวมที่เป็นแหล่งไนโตรเจนก็เพียงพอแล้ว ดังนั้นหากมีการขาดแคลนกรดอะมิโนที่ไม่จำเป็น ร่างกายก็สามารถสังเคราะห์กรดอะมิโนเหล่านี้ได้โดยที่กรดอะมิโนที่มีอยู่ส่วนเกินจะหมดไป กรดอะมิโน “จำเป็น” ที่เหลือไม่สามารถสังเคราะห์ได้ และต้องส่งเข้าสู่ร่างกายผ่านทางอาหาร สิ่งสำคัญสำหรับมนุษย์ ได้แก่ วาลีน ลิวซีน ไอโซลิวซีน ธรีโอนีน เมไทโอนีน ฟีนิลอะลานีน ทริปโตเฟน ฮิสทิดีน ไลซีน และอาร์จินีน (ถึงแม้อาร์จินีนสามารถสังเคราะห์ในร่างกายได้ แต่ก็จัดเป็นกรดอะมิโนจำเป็นเนื่องจากไม่สามารถผลิตได้ในปริมาณที่เพียงพอในทารกแรกเกิดและเด็กที่กำลังเติบโต ในทางกลับกัน กรดอะมิโนจากอาหารเหล่านี้บางส่วนอาจกลายเป็นสิ่งจำเป็นสำหรับผู้ใหญ่ บุคคล.)รายชื่อกรดอะมิโนที่จำเป็นนี้มีความคล้ายคลึงกันในสัตว์มีกระดูกสันหลังและแมลงอื่นๆ โดยประมาณ คุณค่าทางโภชนาการของโปรตีนมักจะถูกกำหนดโดยการให้อาหารแก่หนูที่กำลังเติบโตและติดตามการเพิ่มน้ำหนักของสัตว์
คุณค่าทางโภชนาการของโปรตีน คุณค่าทางโภชนาการของโปรตีนถูกกำหนดโดยกรดอะมิโนจำเป็นที่ขาดมากที่สุด ลองอธิบายเรื่องนี้ด้วยตัวอย่าง โปรตีนในร่างกายของเรามีโดยเฉลี่ยประมาณ ทริปโตเฟน 2% (โดยน้ำหนัก) สมมติว่าอาหารประกอบด้วยโปรตีน 10 กรัมที่มีทริปโตเฟน 1% และมีกรดอะมิโนที่จำเป็นอื่นๆ เพียงพอ ในกรณีของเรา โปรตีนที่ไม่สมบูรณ์ 10 กรัมจะเทียบเท่ากับโปรตีนที่สมบูรณ์ 5 กรัม ส่วนที่เหลืออีก 5 กรัมสามารถใช้เป็นแหล่งพลังงานได้เท่านั้น โปรดทราบว่าเนื่องจากในทางปฏิบัติแล้วกรดอะมิโนไม่ได้ถูกเก็บไว้ในร่างกาย และเพื่อให้การสังเคราะห์โปรตีนเกิดขึ้น กรดอะมิโนทั้งหมดจะต้องมีอยู่พร้อมๆ กัน จึงสามารถตรวจพบผลของการบริโภคกรดอะมิโนที่จำเป็นได้ก็ต่อเมื่อกรดอะมิโนทั้งหมดครบถ้วนเท่านั้น เข้าสู่ร่างกายไปพร้อมๆ กัน. องค์ประกอบโดยเฉลี่ยของโปรตีนจากสัตว์ส่วนใหญ่ใกล้เคียงกับองค์ประกอบโดยเฉลี่ยของโปรตีนในร่างกายมนุษย์ ดังนั้นเราจึงไม่น่าจะเผชิญกับการขาดกรดอะมิโนหากอาหารของเราอุดมไปด้วยอาหาร เช่น เนื้อสัตว์ ไข่ นม และชีส อย่างไรก็ตาม มีโปรตีน เช่น เจลาติน (ผลิตภัณฑ์จากการทำลายคอลลาเจน) ซึ่งมีกรดอะมิโนที่จำเป็นน้อยมาก โปรตีนจากพืชถึงแม้จะดีกว่าเจลาตินในแง่นี้ แต่ก็มีกรดอะมิโนที่จำเป็นต่ำเช่นกัน มีไลซีนและทริปโตเฟนต่ำเป็นพิเศษ อย่างไรก็ตาม การรับประทานอาหารมังสวิรัติเพียงอย่างเดียวไม่ถือเป็นอันตรายแต่อย่างใด เว้นแต่จะบริโภคโปรตีนจากพืชในปริมาณที่มากกว่าเล็กน้อย ซึ่งเพียงพอที่จะให้กรดอะมิโนที่จำเป็นแก่ร่างกาย พืชมีโปรตีนมากที่สุดในเมล็ด โดยเฉพาะในเมล็ดข้าวสาลีและพืชตระกูลถั่วต่างๆ ยอดอ่อน เช่น หน่อไม้ฝรั่ง ก็อุดมไปด้วยโปรตีนเช่นกันโปรตีนสังเคราะห์ในอาหาร. โดยการเติมกรดอะมิโนจำเป็นสังเคราะห์หรือโปรตีนที่อุดมด้วยกรดอะมิโนจำนวนเล็กน้อยลงในโปรตีนที่ไม่สมบูรณ์ เช่น โปรตีนข้าวโพด คุณค่าทางโภชนาการของโปรตีนอย่างหลังก็จะเพิ่มขึ้นได้อย่างมีนัยสำคัญ กล่าวคือ จึงเพิ่มปริมาณโปรตีนที่บริโภค ความเป็นไปได้อีกอย่างหนึ่งคือการเจริญเติบโตของแบคทีเรียหรือยีสต์บนปิโตรเลียมไฮโดรคาร์บอนโดยเติมไนเตรตหรือแอมโมเนียเป็นแหล่งไนโตรเจน โปรตีนจากจุลินทรีย์ที่ได้รับในลักษณะนี้สามารถทำหน้าที่เป็นอาหารสำหรับสัตว์ปีกหรือปศุสัตว์ หรือมนุษย์สามารถบริโภคได้โดยตรง วิธีที่สามที่ใช้กันอย่างแพร่หลายใช้สรีรวิทยาของสัตว์เคี้ยวเอื้อง ในสัตว์เคี้ยวเอื้องในส่วนแรกของกระเพาะอาหารเรียกว่า กระเพาะรูเมนนั้นอาศัยอยู่โดยแบคทีเรียและโปรโตซัวรูปแบบพิเศษที่เปลี่ยนโปรตีนจากพืชที่ไม่สมบูรณ์ให้เป็นโปรตีนจุลินทรีย์ที่สมบูรณ์ยิ่งขึ้น และในทางกลับกัน หลังจากการย่อยและการดูดซึมก็จะกลายเป็นโปรตีนจากสัตว์ ยูเรียซึ่งเป็นสารประกอบที่มีไนโตรเจนสังเคราะห์ราคาถูกสามารถเติมลงในอาหารสัตว์ได้ จุลินทรีย์ที่อาศัยอยู่ในกระเพาะรูเมนใช้ยูเรียไนโตรเจนเพื่อเปลี่ยนคาร์โบไฮเดรต (ซึ่งมีมากกว่านั้นในอาหาร) ให้เป็นโปรตีน ประมาณหนึ่งในสามของไนโตรเจนทั้งหมดในอาหารสัตว์อาจอยู่ในรูปของยูเรีย ซึ่งโดยพื้นฐานแล้วหมายถึงการสังเคราะห์ทางเคมีของโปรตีนในระดับหนึ่ง ในสหรัฐอเมริกา วิธีการนี้มีบทบาทสำคัญในการได้รับโปรตีนวิธีหนึ่งวรรณกรรม เมอร์เรย์ อาร์., เกรนเนอร์ ดี., เมเยส พี., ร็อดเวลล์ ดับเบิลยู. ชีวเคมีของมนุษย์เล่มที่ 12. ม., 1993อัลเบิร์ตส์ บี, เบรย์ ดี, ลูอิส เจ และคณะ อณูเซลล์ชีววิทยาเล่มที่ 13. ม., 1994
ตั๋ว 2. 1. ปัจจัยทางโภชนาการที่สำคัญของธรรมชาติของไขมันไขมันบางชนิดไม่ได้สังเคราะห์ขึ้นในร่างกายมนุษย์ดังนั้นจึงเป็นปัจจัยทางโภชนาการที่จำเป็น ซึ่งรวมถึงกรดไขมันที่มีพันธะคู่ตั้งแต่ 2 พันธะขึ้นไป (โพลีอีน) - กรดไขมันจำเป็นกรดเหล่านี้บางชนิดเป็นสารตั้งต้นสำหรับการสังเคราะห์ฮอร์โมนในท้องถิ่น - ไอโคซานอยด์ (หัวข้อ 8.10)
วิตามินที่ละลายในไขมันทำหน้าที่ต่าง ๆ : วิตามินเอมีส่วนร่วมในกระบวนการมองเห็นตลอดจนการเจริญเติบโตและการสร้างความแตกต่างของเซลล์ ความสามารถในการยับยั้งการเจริญเติบโตของเนื้องอกบางประเภทได้รับการพิสูจน์แล้ว วิตามินเคมีส่วนร่วมในการแข็งตัวของเลือด วิตามินดีมีส่วนร่วมในการควบคุมการเผาผลาญแคลเซียม วิตามินอี- สารต้านอนุมูลอิสระ ยับยั้งการก่อตัวของอนุมูลอิสระ และต่อต้านความเสียหายของเซลล์อันเป็นผลมาจากการเกิดออกซิเดชันของไขมัน
เอกสาร
2.โครงสร้างและระดับการจัดโครงสร้างของโปรตีน
โครงสร้างโครงสร้างของโปรตีนมีสี่ระดับ: ระดับประถมศึกษา มัธยมศึกษา ระดับอุดมศึกษา และควอเทอร์นารี แต่ละระดับมีลักษณะเฉพาะของตัวเอง
โครงสร้างโปรตีนปฐมภูมิ
โครงสร้างหลักของโปรตีนคือสายโซ่โพลีเปปไทด์เชิงเส้นของกรดอะมิโนที่เชื่อมต่อกันด้วยพันธะเปปไทด์ โครงสร้างปฐมภูมิเป็นระดับที่ง่ายที่สุดในการจัดโครงสร้างของโมเลกุลโปรตีน มีความเสถียรสูงโดยพันธะโควาเลนต์เปปไทด์ระหว่างกลุ่ม α-amino ของกรดอะมิโนตัวหนึ่งและกลุ่ม α-carboxyl ของกรดอะมิโนอีกตัวหนึ่ง [แสดง].
หากกลุ่มอิมิโนของโพรลีนหรือไฮดรอกซีโพรลีนเกี่ยวข้องกับการก่อตัวของพันธะเปปไทด์ก็จะมีรูปแบบที่แตกต่างออกไป [แสดง].
เมื่อพันธะเปปไทด์ก่อตัวในเซลล์ กลุ่มคาร์บอกซิลของกรดอะมิโนตัวหนึ่งจะถูกกระตุ้นในขั้นแรก จากนั้นจึงรวมตัวกับกลุ่มอะมิโนของอีกกลุ่มหนึ่ง การสังเคราะห์โพลีเปปไทด์ในห้องปฏิบัติการนั้นดำเนินการในลักษณะเดียวกันโดยประมาณ
พันธะเปปไทด์เป็นส่วนที่ซ้ำกันของสายโซ่โพลีเปปไทด์ มีคุณสมบัติหลายประการที่ไม่เพียงส่งผลต่อรูปร่างของโครงสร้างหลักเท่านั้น แต่ยังส่งผลต่อการจัดระเบียบสายโซ่โพลีเปปไทด์ในระดับที่สูงขึ้นด้วย:

coplanarity - อะตอมทั้งหมดที่รวมอยู่ในกลุ่มเปปไทด์อยู่ในระนาบเดียวกัน
ความสามารถในการดำรงอยู่ในสองรูปแบบเรโซแนนซ์ (รูปแบบคีโตหรืออีนอล)
ตำแหน่งทรานส์ขององค์ประกอบแทนที่สัมพันธ์กับพันธะ C-N
ความสามารถในการสร้างพันธะไฮโดรเจน และกลุ่มเปปไทด์แต่ละกลุ่มสามารถสร้างพันธะไฮโดรเจนสองพันธะกับกลุ่มอื่นได้ รวมทั้งกลุ่มเปปไทด์ด้วย
ข้อยกเว้นคือกลุ่มเปปไทด์ที่เกี่ยวข้องกับกลุ่มอะมิโนของโพรลีนหรือไฮดรอกซีโพรลีน พวกมันสามารถสร้างพันธะไฮโดรเจนได้เพียงพันธะเดียวเท่านั้น (ดูด้านบน) สิ่งนี้ส่งผลต่อการก่อตัวของโครงสร้างรองของโปรตีน สายโซ่โพลีเปปไทด์ในบริเวณที่มีโพรลีนหรือไฮดรอกซีโพรลีนตั้งอยู่นั้นโค้งงอได้ง่าย เนื่องจากไม่ได้ยึดด้วยพันธะไฮโดรเจนที่สองตามปกติ
ศัพท์เฉพาะของเปปไทด์และโพลีเปปไทด์. ชื่อของเปปไทด์ประกอบด้วยชื่อของกรดอะมิโนที่เป็นส่วนประกอบ กรดอะมิโนสองตัวสร้างไดเปปไทด์ สามตัวสร้างไตรเปปไทด์ สี่ตัวสร้างเตตราเปปไทด์ เป็นต้น เปปไทด์หรือสายพอลิเปปไทด์แต่ละสายทุกความยาวเท่าใดก็ได้มีกรดอะมิโนที่ปลาย N ที่มีหมู่อะมิโนอิสระ และกรดอะมิโนที่ปลาย C หนึ่งตัวที่มีคาร์บอกซิลอิสระ กลุ่ม. เมื่อตั้งชื่อโพลีเปปไทด์ กรดอะมิโนทั้งหมดจะถูกแสดงตามลำดับ โดยเริ่มจากปลาย N แทนที่ด้วยชื่อ ยกเว้นปลาย C ที่เป็นคำต่อท้าย -in ด้วย -yl (เนื่องจากกรดอะมิโนในเปปไทด์ไม่มีอีกต่อไป หมู่คาร์บอกซิล แต่เป็นหมู่คาร์บอนิล) เช่น ชื่อที่ปรากฏในรูป 1 ไตรเปปไทด์ - ลิว ตะกอนฟีนิลอะเลน ตะกอนสาม ใน.
คุณสมบัติของโครงสร้างปฐมภูมิของโปรตีน. ในกระดูกสันหลังของสายโซ่โพลีเปปไทด์ โครงสร้างแข็ง (กลุ่มเปปไทด์แบน) สลับกับบริเวณที่ค่อนข้างเคลื่อนที่ (-CHR) ซึ่งสามารถหมุนรอบพันธะได้ ลักษณะโครงสร้างของสายโซ่โพลีเปปไทด์ดังกล่าวส่งผลต่อการจัดเรียงเชิงพื้นที่
โครงสร้างทุติยภูมิของโปรตีน
โครงสร้างทุติยภูมิเป็นวิธีการพับสายโซ่โพลีเปปไทด์ให้เป็นโครงสร้างที่ได้รับคำสั่งเนื่องจากการก่อตัวของพันธะไฮโดรเจนระหว่างกลุ่มเปปไทด์ของสายโซ่เดียวกันหรือสายโซ่โพลีเปปไทด์ที่อยู่ติดกัน ตามการกำหนดค่า โครงสร้างรองจะแบ่งออกเป็นขดลวด (α-helix) และแบบพับแบบชั้น (β-struction และ cross-β-form)


α-Helix. นี่คือโครงสร้างโปรตีนทุติยภูมิชนิดหนึ่งที่ดูเหมือนเกลียวปกติซึ่งเกิดขึ้นจากพันธะไฮโดรเจนระหว่างเปปไทด์ภายในสายโพลีเปปไทด์เส้นเดียว แบบจำลองโครงสร้างของ α-helix (รูปที่ 2) ซึ่งคำนึงถึงคุณสมบัติทั้งหมดของพันธะเปปไทด์ ได้รับการเสนอโดย Pauling และ Corey คุณสมบัติหลักของ α-helix:
โครงสร้างแบบขดลวดของสายโพลีเปปไทด์ที่มีความสมมาตรแบบขดลวด
การก่อตัวของพันธะไฮโดรเจนระหว่างกลุ่มเปปไทด์ของกรดอะมิโนตัวแรกและตัวที่สี่แต่ละตัว
ความสม่ำเสมอของการหมุนเกลียว
ความเท่าเทียมกันของกรดอะมิโนทั้งหมดที่ตกค้างใน α-helix โดยไม่คำนึงถึงโครงสร้างของอนุมูลด้านข้าง
อนุมูลด้านข้างของกรดอะมิโนไม่มีส่วนร่วมในการก่อตัวของα-helix
ภายนอก α-helix ดูเหมือนเกลียวของเตาไฟฟ้าที่ยืดออกเล็กน้อย ความสม่ำเสมอของพันธะไฮโดรเจนระหว่างกลุ่มเปปไทด์ที่หนึ่งและสี่จะกำหนดความสม่ำเสมอของการหมุนของสายโซ่โพลีเปปไทด์ ความสูงของหนึ่งเทิร์นหรือระยะพิทช์ของ α-helix คือ 0.54 นาโนเมตร ประกอบด้วยกรดอะมิโนตกค้าง 3.6 ตัว กล่าวคือ กรดอะมิโนแต่ละตัวเคลื่อนที่ไปตามแกน (ความสูงของกรดอะมิโนหนึ่งตัว) 0.15 นาโนเมตร (0.54:3.6 = 0.15 นาโนเมตร) ซึ่งช่วยให้เราสามารถพูดถึงความเท่าเทียมกันของกรดอะมิโนที่ตกค้างทั้งหมด ใน α-helix ระยะเวลาสม่ำเสมอของα-helix คือ 5 รอบหรือ 18 กรดอะมิโนที่ตกค้าง ความยาวของคาบหนึ่งคือ 2.7 นาโนเมตร ข้าว. 3. โมเดลพอลลิง-คอเรย์ a-helix
β-โครงสร้าง. นี่คือโครงสร้างทุติยภูมิประเภทหนึ่งที่มีโครงร่างโค้งเล็กน้อยของสายโซ่โพลีเปปไทด์ และถูกสร้างขึ้นโดยพันธะไฮโดรเจนระหว่างเปปไทด์ภายในแต่ละส่วนของสายโซ่โพลีเปปไทด์หนึ่งหรือสายโซ่โพลีเปปไทด์ที่อยู่ติดกัน เรียกอีกอย่างว่าโครงสร้างพับแบบชั้น มีโครงสร้าง β หลายประเภท บริเวณที่มีชั้นจำกัดซึ่งเกิดจากสายโซ่โพลีเปปไทด์สายหนึ่งของโปรตีนเรียกว่ารูปแบบ cross-β (โครงสร้าง β สั้น) พันธะไฮโดรเจนในรูปแบบ cross-β เกิดขึ้นระหว่างกลุ่มเปปไทด์ของลูปของสายโซ่โพลีเปปไทด์ อีกประเภทหนึ่ง - โครงสร้าง β ที่สมบูรณ์ - เป็นลักษณะของสายโซ่โพลีเปปไทด์ทั้งหมดซึ่งมีรูปร่างยาวและยึดไว้ด้วยพันธะไฮโดรเจนระหว่างเปปไทด์ระหว่างสายโซ่โพลีเปปไทด์คู่ขนานที่อยู่ติดกัน (รูปที่ 3) โครงสร้างนี้มีลักษณะคล้ายเครื่องเป่าลมของหีบเพลง นอกจากนี้ โครงสร้าง β ยังมีความหลากหลาย: พวกมันสามารถก่อตัวขึ้นด้วยสายโซ่คู่ขนาน (ปลายขั้ว N ของสายโซ่โพลีเปปไทด์หันไปในทิศทางเดียวกัน) และขั้วตรงข้ามกัน (ปลายขั้ว N หันไปในทิศทางที่ต่างกัน) อนุมูลด้านข้างของชั้นหนึ่งจะถูกวางไว้ระหว่างอนุมูลด้านข้างของอีกชั้นหนึ่ง
ในโปรตีน การเปลี่ยนจากโครงสร้าง α ไปเป็นโครงสร้าง β และด้านหลังเป็นไปได้เนื่องจากการจัดเรียงพันธะไฮโดรเจนใหม่ แทนที่จะสร้างพันธะไฮโดรเจนแบบอินเตอร์เปปไทด์ตามสายโซ่ (เนื่องจากการที่สายโซ่โพลีเปปไทด์ถูกบิดเป็นเกลียว) ส่วนที่เป็นเกลียวจะคลายตัวและพันธะไฮโดรเจนจะปิดระหว่างชิ้นส่วนที่ยาวของสายโซ่โพลีเปปไทด์ การเปลี่ยนแปลงนี้พบได้ในเคราตินซึ่งเป็นโปรตีนของเส้นผม เมื่อสระผมด้วยผงซักฟอกอัลคาไลน์ โครงสร้างขดของ β-keratin จะถูกทำลายได้ง่าย และกลายเป็น α-keratin (ผมหยิกยืดตรง)
การทำลายโครงสร้างรองปกติของโปรตีน (α-helices และ β-โครงสร้าง) โดยการเปรียบเทียบกับการละลายของผลึกเรียกว่า "การละลาย" ของโพลีเปปไทด์ ในกรณีนี้ พันธะไฮโดรเจนจะขาด และสายโซ่โพลีเปปไทด์จะอยู่ในรูปของการพันกันแบบสุ่ม ดังนั้นความเสถียรของโครงสร้างทุติยภูมิจึงถูกกำหนดโดยพันธะไฮโดรเจนระหว่างเปปไทด์ พันธะประเภทอื่นแทบไม่มีส่วนในเรื่องนี้ ยกเว้นพันธะไดซัลไฟด์ตามสายโซ่โพลีเปปไทด์ที่ตำแหน่งของซิสเทอีนที่ตกค้าง เปปไทด์แบบสั้นจะถูกปิดเป็นวัฏจักรเนื่องจากพันธะไดซัลไฟด์ โปรตีนหลายชนิดมีทั้งบริเวณα-ลานและโครงสร้างβ แทบไม่มีโปรตีนธรรมชาติที่ประกอบด้วย α-helix 100% (ยกเว้นพาราไมโอซิน ซึ่งเป็นโปรตีนจากกล้ามเนื้อที่มี 96-100% α-helix) ในขณะที่โพลีเปปไทด์สังเคราะห์มีเกลียว 100%
โปรตีนอื่นๆ มีระดับการขดตัวที่แตกต่างกัน โครงสร้างα-helical ความถี่สูงพบได้ในพาราไมโอซิน ไมโอโกลบิน และฮีโมโกลบิน ในทางตรงกันข้าม ในทริปซิน หรือไรโบนิวคลีเอส ซึ่งเป็นส่วนสำคัญของสายโซ่โพลีเปปไทด์จะถูกพับเป็นโครงสร้าง β แบบชั้นต่างๆ โปรตีนของเนื้อเยื่อพยุง: เคราติน (โปรตีนของเส้นผม ขน) คอลลาเจน (โปรตีนของเส้นเอ็น ผิวหนัง) ไฟโบรอิน (โปรตีนของไหมธรรมชาติ) มีโครงสร้าง β ของสายโซ่โพลีเปปไทด์ ระดับที่แตกต่างกันของเฮลิซิตี้ของสายโพลีเปปไทด์ของโปรตีนบ่งชี้ว่าเห็นได้ชัดว่ามีแรงที่ขัดขวางเฮลิซิตี้บางส่วนหรือ "ทำลาย" การพับตามปกติของสายโพลีเปปไทด์ เหตุผลนี้คือการพับสายโซ่โปรตีนโพลีเปปไทด์ให้กะทัดรัดมากขึ้นในปริมาตรหนึ่งนั่นคือในโครงสร้างระดับตติยภูมิ
โครงสร้างตติยภูมิโปรตีน
โครงสร้างระดับตติยภูมิของโปรตีนคือวิธีการจัดเรียงสายโซ่โพลีเปปไทด์ในอวกาศ ขึ้นอยู่กับรูปร่างของโครงสร้างตติยภูมิโปรตีนส่วนใหญ่แบ่งออกเป็นทรงกลมและไฟบริลลาร์ โปรตีนทรงกลมส่วนใหญ่มักมีรูปร่างเป็นทรงรี และโปรตีนไฟบริลลาร์ (คล้ายเกลียว) จะมีรูปร่างยาว (รูปทรงแท่งหรือแกนหมุน)
อย่างไรก็ตาม การจัดโครงสร้างโครงสร้างตติยภูมิของโปรตีนยังไม่ได้ให้เหตุผลที่คิดว่าโปรตีนไฟบริลลาร์มีเพียงโครงสร้าง β เท่านั้น และโปรตีนทรงกลมมีโครงสร้าง α-helical มีโปรตีนไฟบริลลาร์ที่มีโครงสร้างรองแบบขดลวดแทนที่จะเป็นชั้นและพับ ตัวอย่างเช่นα-keratin และ paramyosin (โปรตีนของกล้ามเนื้อ obturator ของหอย), tropomyosins (โปรตีนของกล้ามเนื้อโครงร่าง) เป็นของโปรตีน fibrillar (มีรูปร่างเป็นแท่ง) และโครงสร้างรองคือα-helix; ในทางตรงกันข้าม โปรตีนทรงกลมอาจมีโครงสร้าง β จำนวนมาก
การทำให้เป็นเกลียวของสายโซ่โพลีเปปไทด์เชิงเส้นลดขนาดลงประมาณ 4 เท่า และบรรจุลงในโครงสร้างตติยภูมิทำให้มีขนาดกะทัดรัดกว่าโซ่เดิมหลายสิบเท่า
พันธะที่ทำให้โครงสร้างตติยภูมิของโปรตีนมีความเสถียร. พันธะระหว่างอนุมูลด้านข้างของกรดอะมิโนมีบทบาทในการรักษาเสถียรภาพของโครงสร้างตติยภูมิ การเชื่อมต่อเหล่านี้สามารถแบ่งออกเป็น:
แข็งแกร่ง (โควาเลนต์) [แสดง].
อ่อนแอ (ขั้วโลกและฟานเดอร์วาลส์) [แสดง].
พันธะจำนวนมากระหว่างอนุมูลด้านข้างของกรดอะมิโนเป็นตัวกำหนดโครงสร้างเชิงพื้นที่ของโมเลกุลโปรตีน
คุณสมบัติการจัดโครงสร้างตติยภูมิโปรตีน. โครงสร้างของโครงสร้างตติยภูมิของสายโพลีเปปไทด์ถูกกำหนดโดยคุณสมบัติของอนุมูลด้านข้างของกรดอะมิโนที่รวมอยู่ในนั้น (ซึ่งไม่มีผลกระทบที่เห็นได้ชัดเจนต่อการก่อตัวของโครงสร้างหลักและรอง) และสภาพแวดล้อมระดับจุลภาคเช่น สิ่งแวดล้อม. เมื่อพับเก็บแล้ว สายโซ่โพลีเปปไทด์ของโปรตีนมีแนวโน้มที่จะอยู่ในรูปแบบที่มีพลัง โดยมีลักษณะเฉพาะคือพลังงานอิสระขั้นต่ำ ดังนั้นกลุ่ม R ที่ไม่มีขั้วซึ่ง "หลีกเลี่ยง" น้ำจึงก่อตัวขึ้นซึ่งเป็นส่วนภายในของโครงสร้างตติยภูมิของโปรตีนซึ่งส่วนหลักของสารตกค้างที่ไม่ชอบน้ำของสายโซ่โพลีเปปไทด์ตั้งอยู่ แทบไม่มีโมเลกุลของน้ำอยู่ตรงกลางของโปรตีนกลม กลุ่ม R ที่มีขั้ว (ชอบน้ำ) ของกรดอะมิโนตั้งอยู่นอกแกนกลางที่ไม่ชอบน้ำและถูกล้อมรอบด้วยโมเลกุลของน้ำ สายโซ่โพลีเปปไทด์โค้งงออย่างประณีตในพื้นที่สามมิติ เมื่อมันโค้งงอ โครงสร้างขดลวดทุติยภูมิจะหยุดชะงัก สายโซ่จะ "แตก" ที่จุดอ่อนซึ่งมีโพรลีนหรือไฮดรอกซีโพรลีนอยู่ เนื่องจากกรดอะมิโนเหล่านี้เคลื่อนที่ได้ง่ายกว่าในสาย ทำให้เกิดพันธะไฮโดรเจนเพียงพันธะเดียวกับกลุ่มเปปไทด์อื่นๆ จุดโค้งงออีกแห่งคือไกลซีนซึ่งมีกลุ่ม R เล็กๆ (ไฮโดรเจน) ดังนั้นกลุ่ม R ของกรดอะมิโนอื่น ๆ เมื่อเรียงซ้อนกันมีแนวโน้มที่จะครอบครองพื้นที่ว่างที่ตำแหน่งของไกลซีน กรดอะมิโนจำนวนหนึ่ง - อะลานีน, ลิวซีน, กลูตาเมต, ฮิสทิดีน - มีส่วนช่วยในการรักษาโครงสร้างเกลียวที่เสถียรในโปรตีน และเช่น เมไทโอนีน, วาลีน, ไอโซลิวซีน, กรดแอสปาร์ติก มีส่วนสนับสนุนการก่อตัวของโครงสร้าง β ในโมเลกุลโปรตีนที่มีโครงสร้างแบบตติยภูมิ มีส่วนต่างๆ อยู่ในรูปของ α-helices (ขดลวด) โครงสร้าง β (เป็นชั้น) และขดลวดสุ่ม เฉพาะการจัดเรียงเชิงพื้นที่ที่ถูกต้องของโปรตีนเท่านั้นที่ทำให้โปรตีนมีความกระตือรือร้น การละเมิดนำไปสู่การเปลี่ยนแปลงคุณสมบัติของโปรตีนและการสูญเสียกิจกรรมทางชีวภาพ
โครงสร้างโปรตีนควอเตอร์นารี
โปรตีนที่ประกอบด้วยสายโพลีเปปไทด์สายเดียวมีโครงสร้างตติยภูมิเท่านั้น ซึ่งรวมถึงไมโอโกลบิน - โปรตีนเนื้อเยื่อของกล้ามเนื้อที่เกี่ยวข้องกับการจับกับออกซิเจน, เอนไซม์จำนวนหนึ่ง (ไลโซไซม์, เปปซิน, ทริปซิน ฯลฯ ) อย่างไรก็ตาม โปรตีนบางชนิดถูกสร้างขึ้นจากสายโพลีเปปไทด์หลายสาย ซึ่งแต่ละสายมีโครงสร้างแบบตติยภูมิ สำหรับโปรตีนดังกล่าว ได้มีการนำแนวคิดเรื่องโครงสร้างควอเทอร์นารีมาใช้ ซึ่งเป็นการจัดระเบียบของสายโพลีเปปไทด์หลายสายที่มีโครงสร้างตติยภูมิให้เป็นโมเลกุลโปรตีนเชิงฟังก์ชันเดี่ยว โปรตีนที่มีโครงสร้างควอเทอร์นารีเรียกว่าโอลิโกเมอร์และสายโพลีเปปไทด์ที่มีโครงสร้างตติยภูมิเรียกว่าโปรโตเมอร์หรือหน่วยย่อย (รูปที่ 4)

ในระดับควอเทอร์นารีขององค์กร โปรตีนยังคงรักษาโครงร่างพื้นฐานของโครงสร้างตติยภูมิ (ทรงกลมหรือไฟบริลลาร์) ตัวอย่างเช่น เฮโมโกลบินเป็นโปรตีนที่มีโครงสร้างควอเทอร์นารีและประกอบด้วยสี่หน่วยย่อย แต่ละหน่วยย่อยเป็นโปรตีนทรงกลม และโดยทั่วไปแล้ว เฮโมโกลบินก็มีโครงสร้างทรงกลมเช่นกัน โปรตีนจากเส้นผมและขนสัตว์ - เคราตินซึ่งเกี่ยวข้องกับโครงสร้างตติยภูมิกับโปรตีนไฟบริลลาร์ มีโครงสร้างไฟบริลลาร์และโครงสร้างควอเทอร์นารี
ความคงตัวของโครงสร้างโปรตีนควอเทอร์นารี. โปรตีนทั้งหมดที่มีโครงสร้างควอเทอร์นารีจะถูกแยกออกในรูปของโมเลกุลขนาดใหญ่แต่ละตัวซึ่งไม่แตกตัวเป็นหน่วยย่อย การติดต่อระหว่างพื้นผิวของหน่วยย่อยเป็นไปได้เพียงเพราะกลุ่มขั้วของกรดอะมิโนที่ตกค้าง เนื่องจากในระหว่างการก่อตัวของโครงสร้างตติยภูมิของสายโซ่โพลีเปปไทด์แต่ละอัน อนุมูลด้านข้างของกรดอะมิโนที่ไม่มีขั้ว (ซึ่งประกอบขึ้นเป็นส่วนใหญ่ กรดอะมิโนที่เป็นโปรตีนทั้งหมด) จะถูกซ่อนอยู่ภายในหน่วยย่อย พันธะไอออนิก (เกลือ) ไฮโดรเจน และในบางกรณี พันธะไดซัลไฟด์จำนวนมากเกิดขึ้นระหว่างกลุ่มขั้ว ซึ่งยึดหน่วยย่อยไว้อย่างแน่นหนาในรูปแบบของสารเชิงซ้อนที่มีการจัดระเบียบ การใช้สารที่ทำลายพันธะไฮโดรเจนหรือสารที่ลดพันธะไดซัลไฟด์ทำให้เกิดการแยกตัวของโปรโตเมอร์และการทำลายโครงสร้างควอเทอร์นารีของโปรตีน ในตาราง ฉบับที่ 1 สรุปข้อมูลเกี่ยวกับพันธะที่ทำให้ระดับต่างๆ ของการจัดระเบียบของโมเลกุลโปรตีนคงที่ [แสดง].
ลักษณะการจัดโครงสร้างของโปรตีนไฟบริลลาร์บางชนิด
การจัดโครงสร้างของโปรตีนไฟบริลลาร์มีคุณสมบัติหลายประการเมื่อเปรียบเทียบกับโปรตีนทรงกลม คุณสมบัติเหล่านี้สามารถเห็นได้ในตัวอย่างของเคราติน ไฟโบรอิน และคอลลาเจน เคราตินมีอยู่ในโครงสร้างα-และβ α-เคราตินและไฟโบรอินมีโครงสร้างรองที่พับเป็นชั้น ๆ อย่างไรก็ตาม ในเคราตินสายโซ่จะขนานกัน และในไฟโบรอินจะมีโครงสร้างตรงกันข้ามกัน (ดูรูปที่ 3) นอกจากนี้เคราตินยังมีพันธะไดซัลไฟด์ระหว่างโซ่ ในขณะที่ไฟโบรอินไม่มีพันธะเหล่านี้ การแตกของพันธะไดซัลไฟด์ทำให้เกิดการแยกสายโซ่โพลีเปปไทด์ในเคราติน ในทางตรงกันข้าม การก่อตัวของพันธะไดซัลไฟด์ในเคราตินจำนวนสูงสุดจากการสัมผัสกับสารออกซิไดซ์จะสร้างโครงสร้างเชิงพื้นที่ที่แข็งแกร่ง โดยทั่วไป ในโปรตีนไฟบริลลาร์ ต่างจากโปรตีนทรงกลม บางครั้งเป็นการยากที่จะแยกแยะระหว่างระดับต่างๆ ขององค์กรอย่างเคร่งครัด หากเรายอมรับ (สำหรับโปรตีนทรงกลม) ว่าโครงสร้างตติยภูมิควรถูกสร้างขึ้นโดยการวางสายโซ่โพลีเปปไทด์หนึ่งสายในอวกาศและโครงสร้างควอเทอร์นารีด้วยสายโซ่หลายสาย ดังนั้นในโปรตีนไฟบริลลาร์สายโซ่โพลีเปปไทด์หลายเส้นก็มีส่วนเกี่ยวข้องอยู่แล้วในระหว่างการก่อตัวของโครงสร้างรอง . ตัวอย่างทั่วไปของโปรตีนไฟบริลลาร์คือคอลลาเจน ซึ่งเป็นหนึ่งในโปรตีนที่มีมากที่สุดในร่างกายมนุษย์ (ประมาณ 1/3 ของมวลของโปรตีนทั้งหมด) พบได้ในเนื้อเยื่อที่มีความแข็งแรงสูงและขยายตัวได้ต่ำ (กระดูก เส้นเอ็น ผิวหนัง ฟัน ฯลฯ) ในคอลลาเจน หนึ่งในสามของกรดอะมิโนที่ตกค้างคือไกลซีน และประมาณหนึ่งในสี่หรือมากกว่านั้นเล็กน้อยคือโพรลีนหรือไฮดรอกซีโพรลีน

สายโพลีเปปไทด์ที่แยกได้ของคอลลาเจน (โครงสร้างหลัก) มีลักษณะเหมือนเส้นขาด ประกอบด้วยกรดอะมิโนประมาณ 1,000 ตัวและมีน้ำหนักโมเลกุลประมาณ 10 5 (รูปที่ 5, a, b) สายโพลีเปปไทด์ถูกสร้างขึ้นจากกรดอะมิโนสามตัวที่ทำซ้ำ (triplet) ที่มีองค์ประกอบต่อไปนี้: gly-A-B โดยที่ A และ B เป็นกรดอะมิโนใดๆ ที่ไม่ใช่ไกลซีน (ส่วนใหญ่มักเป็นโพรลีนและไฮดรอกซีโพรลีน) โซ่คอลลาเจนโพลีเปปไทด์ (หรือ α-chains) ในระหว่างการก่อตัวของโครงสร้างทุติยภูมิและตติยภูมิ (รูปที่ 5, c และ d) ไม่สามารถสร้าง α-helices ทั่วไปที่มีความสมมาตรของขดลวดได้ โพรลีน ไฮดรอกซีโพรลีน และไกลซีน (กรดอะมิโนต้านฮีลิคัล) รบกวนสิ่งนี้ ดังนั้น โซ่ α สามเส้นจึงก่อตัวเป็นเกลียวบิดคล้ายเกลียวสามเส้นพันรอบทรงกระบอก สายโซ่ α 3 เส้นสร้างโครงสร้างคอลลาเจนซ้ำที่เรียกว่าโทรโปคอลลาเจน (รูปที่ 5d) Tropocollagen ในองค์กรคือโครงสร้างระดับตติยภูมิของคอลลาเจน วงแหวนแบนของโพรลีนและไฮดรอกซีโพรลีนที่สลับกันเป็นประจำตามสายโซ่ทำให้มีความแข็งแกร่ง เช่นเดียวกับพันธะระหว่างสายโซ่ระหว่างสายโซ่αของโทรโปคอลลาเจน (ซึ่งเป็นเหตุผลว่าทำไมคอลลาเจนจึงทนต่อการยืดตัว) Tropocollagen เป็นหน่วยย่อยของคอลลาเจนไฟบริล การวางหน่วยย่อยของโทรโปคอลลาเจนในโครงสร้างควอเทอร์นารีของคอลลาเจนเกิดขึ้นในลักษณะเป็นขั้นตอน (รูปที่ 5e)
ความคงตัวของโครงสร้างคอลลาเจนเกิดขึ้นเนื่องจากพันธะระหว่างไฮโดรเจน ไอออนิก และแวนเดอร์วาลส์ และพันธะโควาเลนต์จำนวนเล็กน้อย
คอลลาเจนสายαมีโครงสร้างทางเคมีที่แตกต่างกัน มีโซ่ α 1 หลายประเภท (I, II, III, IV) และโซ่ α 2 ขึ้นอยู่กับว่าα 1 - และα 2 -chains ใดที่เกี่ยวข้องกับการก่อตัวของเกลียวสามเกลียวของ tropocollagen คอลลาเจนสี่ประเภทมีความโดดเด่น:
ประเภทแรก - สองα 1 (I) และหนึ่งโซ่α 2
ประเภทที่สอง - โซ่α 1 (II) สามอัน
ประเภทที่สาม - โซ่α 1 (III) สามอัน
ประเภทที่สี่ - โซ่α 1 (IV) สามเส้น
คอลลาเจนที่พบมากที่สุดคือประเภทแรก: พบในเนื้อเยื่อกระดูก ผิวหนัง เส้นเอ็น; คอลลาเจนประเภทที่ 2 พบได้ในเนื้อเยื่อกระดูกอ่อน เป็นต้น เนื้อเยื่อประเภทหนึ่งสามารถมีคอลลาเจนได้หลายประเภท
การรวมตัวของโครงสร้างคอลลาเจนที่ได้รับคำสั่ง ความแข็งแกร่งและความเฉื่อยทำให้มั่นใจได้ว่าเส้นใยคอลลาเจนมีความแข็งแรงสูง โปรตีนคอลลาเจนยังมีส่วนประกอบของคาร์โบไฮเดรต กล่าวคือ เป็นโปรตีนเชิงซ้อนคาร์โบไฮเดรต
คอลลาเจนเป็นโปรตีนนอกเซลล์ที่เกิดขึ้นจากเซลล์เนื้อเยื่อเกี่ยวพันที่พบในอวัยวะทั้งหมด ดังนั้นด้วยความเสียหายต่อคอลลาเจน (หรือการหยุดชะงักของการก่อตัวของมัน) การละเมิดฟังก์ชั่นการสนับสนุนของเนื้อเยื่อเกี่ยวพันของอวัยวะจึงเกิดขึ้นหลายครั้ง
สายโซ่อัลฟาโพลีเปปไทด์ปิดท้ายด้วยวาลีน-ลิวซีนที่รวมกรดอะมิโน และสายเบตาโพลีเปปไทด์ปิดท้ายด้วยวาลีน-ฮิสทิดีน-ลิวซีนรวมกัน สายโพลีเปปไทด์อัลฟ่าและเบต้าในโมเลกุลฮีโมโกลบินไม่ได้จัดเรียงเป็นเส้นตรง นี่คือโครงสร้างหลัก เนื่องจากการมีอยู่ของแรงภายในโมเลกุล โซ่โพลีเปปไทด์จึงถูกบิดเป็นเกลียวอัลฟาเฮลิกส์ (โครงสร้างทุติยภูมิ) ตามแบบฉบับของโปรตีน เกลียวอัลฟ่า-เฮลิกส์นั้นโค้งงอเชิงพื้นที่สำหรับสายโซ่โพลีเปปไทด์อัลฟ่าและเบต้าแต่ละเส้น ทำให้เกิดเป็นช่องท้องรูปไข่ (โครงสร้างตติยภูมิ) แต่ละส่วนของ alpha-helix helices ของโซ่โพลีเปปไทด์จะถูกทำเครื่องหมายด้วยตัวอักษรละตินตั้งแต่ A ถึง H โซ่โพลีเปปไทด์แบบโค้งระดับอุดมศึกษาทั้งสี่แบบอัลฟ่าและเบต้าโพลีเปปไทด์นั้นตั้งอยู่ในเชิงพื้นที่ในความสัมพันธ์บางอย่าง - โครงสร้างควอเทอร์นารี พวกมันไม่ได้เชื่อมโยงกันด้วยพันธะเคมีที่แท้จริง แต่ด้วยแรงระหว่างโมเลกุล
ปรากฎว่ามนุษย์มีฮีโมโกลบินปกติสามประเภทหลัก: เอ็มบริโอ - U, ทารกในครรภ์ - F และเฮโมโกลบินสำหรับผู้ใหญ่ - A. HbU (ตั้งชื่อตามอักษรตัวแรกของคำว่า มดลูก) เกิดขึ้นในเอ็มบริโอระหว่าง 7 ถึง 12 สัปดาห์ของชีวิต จากนั้นจะหายไปและปรากฏฮีโมโกลบินของทารกในครรภ์ซึ่งหลังจากเดือนที่สามจะเป็นฮีโมโกลบินหลักของทารกในครรภ์ หลังจากนั้น ฮีโมโกลบินสำหรับผู้ใหญ่ทั่วไปจะค่อยๆ ปรากฏขึ้น เรียกว่า HbA ตามตัวอักษรเริ่มต้นของคำภาษาอังกฤษว่า "ผู้ใหญ่" ปริมาณฮีโมโกลบินของทารกในครรภ์จะค่อยๆ ลดลง ดังนั้นในขณะที่คลอดบุตร 80% ของฮีโมโกลบินคือ HbA และเพียง 20% เท่านั้นที่เป็น HbF หลังคลอด ฮีโมโกลบินของทารกในครรภ์ยังคงลดลงอย่างต่อเนื่อง และเมื่ออายุได้ 2-3 ปีก็จะเหลือเพียง 1-2% เท่านั้น ปริมาณฮีโมโกลบินของทารกในครรภ์ในปริมาณเท่ากันนั้นอยู่ในผู้ใหญ่ ปริมาณ HbF ที่เกิน 2% ถือเป็นพยาธิสภาพสำหรับผู้ใหญ่และเด็กอายุมากกว่า 3 ปี
นอกเหนือจากฮีโมโกลบินประเภทปกติแล้ว ปัจจุบันยังมีการทราบตัวแปรทางพยาธิวิทยามากกว่า 50 ชนิด พวกเขาถูกตั้งชื่อครั้งแรกด้วยตัวอักษรละติน ตัวอักษร B ไม่อยู่ในการกำหนดประเภทฮีโมโกลบิน เนื่องจากเดิมเรียกว่า HbS
เฮโมโกลบิน (Hb)- โครโมโปรตีนอยู่ในเซลล์เม็ดเลือดแดงและเกี่ยวข้องกับการขนส่งออกซิเจนไปยังเนื้อเยื่อ เฮโมโกลบินในผู้ใหญ่เรียกว่าฮีโมโกลบินเอ (Hb A) น้ำหนักโมเลกุลประมาณ 65,000 Da โมเลกุล Hb A มีโครงสร้างควอเทอร์นารีและมีหน่วยย่อยสี่หน่วย - สายโซ่โพลีเปปไทด์ (เรียกว่า α1, α2, β1 และ β2 ซึ่งแต่ละหน่วยเกี่ยวข้องกับฮีม
โปรดจำไว้ว่าฮีโมโกลบินเป็นโปรตีนอัลโลสเตอริก โมเลกุลของฮีโมโกลบินสามารถเปลี่ยนจากรูปแบบหนึ่งไปสู่อีกรูปแบบหนึ่งได้ สิ่งนี้จะเปลี่ยนความสัมพันธ์ของโปรตีนกับลิแกนด์ โครงสร้างที่มีความสัมพันธ์กันน้อยที่สุดสำหรับลิแกนด์เรียกว่า tense หรือโครงสร้าง T โครงสร้างที่มีความสัมพันธ์กันมากที่สุดกับลิแกนด์เรียกว่าโครงสร้างแบบผ่อนคลายหรือโครงสร้าง R
โครงสร้าง R- และ T ของโมเลกุลฮีโมโกลบินอยู่ในสภาวะสมดุลแบบไดนามิก:
ปัจจัยด้านสิ่งแวดล้อมต่างๆ สามารถเปลี่ยนสมดุลนี้ไปในทิศทางใดทิศทางหนึ่งได้ หน่วยงานกำกับดูแล Allosteric ที่ส่งผลต่อความสัมพันธ์ของ Hb สำหรับ O2 คือ: 1) ออกซิเจน; 2) ความเข้มข้นของ H+ (pH ปานกลาง); 3) คาร์บอนไดออกไซด์ (CO2); 4) 2,3-ไดฟอสโฟกลีเซอเรต (DPG) การยึดโมเลกุลออกซิเจนเข้ากับหน่วยย่อยของฮีโมโกลบินหน่วยใดหน่วยหนึ่งช่วยส่งเสริมการเปลี่ยนแปลงของโครงสร้างที่ตึงเครียดไปสู่หน่วยย่อยที่ผ่อนคลาย และเพิ่มความสัมพันธ์ต่อออกซิเจนของหน่วยย่อยอื่น ๆ ของโมเลกุลเฮโมโกลบินเดียวกัน ปรากฏการณ์นี้เรียกว่าผลสหกรณ์ ลักษณะที่ซับซ้อนของการจับกันของฮีโมโกลบินกับออกซิเจนนั้นสะท้อนให้เห็นโดยกราฟความอิ่มตัวของฮีโมโกลบิน O2 ซึ่งมีรูปร่างเป็นรูปตัว S (รูปที่ 3.1)

รูปที่ 3.1.เส้นโค้งของไมโอโกลบิน (1) และฮีโมโกลบิน (2) ความอิ่มตัวของออกซิเจน
รูปแบบโมเลกุลเฮโมโกลบินแตกต่างกันในโครงสร้างของสายโซ่โพลีเปปไทด์ ตัวอย่างของฮีโมโกลบินหลายชนิดที่มีอยู่ภายใต้สภาวะทางสรีรวิทยาคือ เฮโมโกลบินของทารกในครรภ์ (HbF)ปรากฏในเลือดในช่วงระยะเอ็มบริโอของการพัฒนามนุษย์ ต่างจาก HbA ตรงที่โมเลกุลประกอบด้วย 2 α- และ 2 γ-chains (นั่นคือ β-chains จะถูกแทนที่ด้วย γ-chains) เฮโมโกลบินดังกล่าวมีความสัมพันธ์กับออกซิเจนสูงกว่า นี่คือสิ่งที่ช่วยให้เอ็มบริโอได้รับออกซิเจนจากเลือดของแม่ผ่านทางรก หลังคลอดไม่นาน HbF ในเลือดของทารกจะถูกแทนที่ด้วย HbA
ตัวอย่างของฮีโมโกลบินที่ผิดปกติหรือทางพยาธิวิทยาคือฮีโมโกลบิน S ที่ได้กล่าวไปแล้ว (ดู 2.4.) ซึ่งพบในผู้ป่วยที่เป็นโรคเม็ดเลือดรูปเคียว ดังที่คุณทราบแล้ว มันแตกต่างจากฮีโมโกลบิน A โดยการแทนที่กลูตาเมตด้วยวาลีนใน β-chains การทดแทนกรดอะมิโนนี้ทำให้ความสามารถในการละลายของ HbS ในน้ำลดลง และความสัมพันธ์กับ O2 ลดลง
อย่างที่คุณทราบ โปรตีนเป็นพื้นฐานของการกำเนิดสิ่งมีชีวิตบนโลกของเรา แต่มันเป็นหยด coacervate ซึ่งประกอบด้วยโมเลกุลเปปไทด์ที่กลายเป็นพื้นฐานสำหรับการกำเนิดของสิ่งมีชีวิต ไม่ต้องสงสัยเลย เนื่องจากการวิเคราะห์องค์ประกอบภายในของตัวแทนของชีวมวลแสดงให้เห็นว่าสารเหล่านี้มีอยู่ในทุกสิ่ง: พืช สัตว์ จุลินทรีย์ เชื้อรา ไวรัส นอกจากนี้พวกมันยังมีความหลากหลายและมีลักษณะเป็นโมเลกุลขนาดใหญ่อีกด้วย
โครงสร้างเหล่านี้มีสี่ชื่อ ซึ่งทั้งหมดเป็นคำพ้องความหมาย:
- โปรตีน;
- โปรตีน;
- โพลีเปปไทด์;
- เปปไทด์
โมเลกุลโปรตีน
จำนวนของพวกเขานับไม่ถ้วนอย่างแท้จริง ในกรณีนี้ โมเลกุลโปรตีนทั้งหมดสามารถแบ่งออกเป็นสองกลุ่มใหญ่:
- ง่าย - ประกอบด้วยลำดับกรดอะมิโนที่เชื่อมต่อกันด้วยพันธะเปปไทด์เท่านั้น
- ซับซ้อน - โครงสร้างและโครงสร้างของโปรตีนนั้นมีลักษณะเฉพาะโดยกลุ่มโปรโตไลติก (เทียม) เพิ่มเติมหรือที่เรียกว่าโคแฟคเตอร์
ในขณะเดียวกัน โมเลกุลเชิงซ้อนก็มีการจำแนกประเภทเป็นของตัวเองเช่นกัน
การไล่ระดับของเปปไทด์เชิงซ้อน
- ไกลโคโปรตีนเป็นสารประกอบที่เกี่ยวข้องอย่างใกล้ชิดระหว่างโปรตีนและคาร์โบไฮเดรต กลุ่มเทียมของเมือกโพลีแซ็กคาไรด์ถูกถักทอเป็นโครงสร้างของโมเลกุล
- ไลโปโปรตีนเป็นสารประกอบเชิงซ้อนของโปรตีนและไขมัน
- Metalloproteins - ไอออนของโลหะ (เหล็ก, แมงกานีส, ทองแดงและอื่น ๆ ) ทำหน้าที่เป็นกลุ่มเทียม
- นิวคลีโอโปรตีนคือการเชื่อมต่อระหว่างโปรตีนและกรดนิวคลีอิก (DNA, RNA)
- ฟอสโฟโปรตีน - โครงสร้างของโปรตีนและกรดออร์โธฟอสฟอริกที่ตกค้าง
- โครโมโปรตีนมีความคล้ายคลึงกับเมทัลโลโปรตีนมากอย่างไรก็ตามองค์ประกอบที่เป็นส่วนหนึ่งของกลุ่มเทียมนั้นมีสีที่ซับซ้อนทั้งหมด (สีแดง - เฮโมโกลบิน, สีเขียว - คลอโรฟิลล์และอื่น ๆ )
ในแต่ละกลุ่มที่พิจารณาโครงสร้างและคุณสมบัติของโปรตีนจะแตกต่างกัน ฟังก์ชั่นที่พวกมันทำนั้นแตกต่างกันไปขึ้นอยู่กับประเภทของโมเลกุล

โครงสร้างทางเคมีของโปรตีน
จากมุมมองนี้ โปรตีนเป็นสายโซ่ยาวขนาดใหญ่ของกรดอะมิโนที่ตกค้างเชื่อมต่อถึงกันด้วยพันธะเฉพาะที่เรียกว่าพันธะเปปไทด์ กิ่งก้านที่เรียกว่าอนุมูลขยายออกมาจากโครงสร้างด้านข้างของกรด โครงสร้างโมเลกุลนี้ถูกค้นพบโดย E. Fischer เมื่อต้นศตวรรษที่ 21
ต่อมามีการศึกษาโปรตีน โครงสร้าง และหน้าที่ของโปรตีนอย่างละเอียดมากขึ้น เห็นได้ชัดว่ามีกรดอะมิโนเพียง 20 ชนิดที่สร้างโครงสร้างของเปปไทด์ แต่สามารถนำมารวมกันได้หลายวิธี จึงมีโครงสร้างโพลีเปปไทด์ที่หลากหลาย นอกจากนี้ในกระบวนการของชีวิตและการปฏิบัติหน้าที่โปรตีนสามารถผ่านการเปลี่ยนแปลงทางเคมีได้หลายอย่าง เป็นผลให้พวกเขาเปลี่ยนโครงสร้างและการเชื่อมต่อประเภทใหม่ทั้งหมดปรากฏขึ้น
หากต้องการทำลายพันธะเปปไทด์ กล่าวคือ เพื่อทำลายโปรตีนและโครงสร้างของสายโซ่ คุณต้องเลือกสภาวะที่เข้มงวดมาก (อุณหภูมิสูง กรดหรือด่าง ตัวเร่งปฏิกิริยา) เนื่องจากความแรงของโมเลกุลสูงคือในกลุ่มเปปไทด์

การตรวจหาโครงสร้างโปรตีนในห้องปฏิบัติการดำเนินการโดยใช้ปฏิกิริยาไบยูเรต - การสัมผัสกับโพลีเปปไทด์ (II) ที่ตกตะกอนใหม่ คอมเพล็กซ์ของกลุ่มเปปไทด์และไอออนทองแดงทำให้มีสีม่วงสดใส
มีองค์กรโครงสร้างหลักอยู่ 4 องค์กร ซึ่งแต่ละองค์กรมีลักษณะทางโครงสร้างของโปรตีนเป็นของตัวเอง
ระดับองค์กร: โครงสร้างหลัก
ดังที่ได้กล่าวไว้ข้างต้น เพปไทด์คือลำดับของเรซิดิวกรดอะมิโนที่มีหรือไม่มีโคเอ็นไซม์รวมอยู่ด้วย ดังนั้น ปฐมภูมิคือโครงสร้างของโมเลกุลที่เป็นกรดอะมิโนตามธรรมชาติ เป็นธรรมชาติอย่างแท้จริง เชื่อมต่อกันด้วยพันธะเปปไทด์ และไม่มีอะไรเพิ่มเติม นั่นคือโพลีเปปไทด์ที่มีโครงสร้างเชิงเส้น นอกจากนี้คุณสมบัติเชิงโครงสร้างของโปรตีนประเภทนี้คือการรวมกันของกรดดังกล่าวมีส่วนสำคัญในการทำหน้าที่ของโมเลกุลโปรตีน ด้วยการมีคุณสมบัติเหล่านี้จึงเป็นไปได้ที่ไม่เพียง แต่จะระบุเปปไทด์เท่านั้น แต่ยังทำนายคุณสมบัติและบทบาทของเปปไทด์ใหม่ที่ยังไม่ได้ค้นพบได้อีกด้วย ตัวอย่างของเปปไทด์ที่มีโครงสร้างหลักตามธรรมชาติ ได้แก่ อินซูลิน เปปซิน ไคโมทริปซิน และอื่นๆ

โครงสร้างรอง
โครงสร้างและคุณสมบัติของโปรตีนในหมวดนี้แตกต่างกันบ้าง โครงสร้างดังกล่าวสามารถเกิดขึ้นได้ในขั้นแรกตามธรรมชาติหรือเมื่อโครงสร้างหลักสัมผัสกับไฮโดรไลซิส อุณหภูมิ หรือสภาวะอื่นๆ อย่างรุนแรง
โครงสร้างนี้มีสามประเภท:
- การเลี้ยวแบบสเตอริโอสม่ำเสมอที่ราบรื่น สม่ำเสมอ สร้างขึ้นจากกรดอะมิโนที่ตกค้าง ซึ่งบิดรอบแกนหลักของการเชื่อมต่อ พวกมันจะถูกยึดไว้ด้วยกันโดยออกซิเจนของกลุ่มเปปไทด์กลุ่มหนึ่งกับไฮโดรเจนของกลุ่มเปปไทด์อีกกลุ่มหนึ่งเท่านั้น นอกจากนี้โครงสร้างยังถือว่าถูกต้องเนื่องจากมีการเลี้ยวซ้ำเท่าๆ กันทุกๆ 4 ลิงก์ โครงสร้างดังกล่าวสามารถเป็นได้ทั้งทางซ้ายหรือทางขวา แต่ในโปรตีนที่รู้จักส่วนใหญ่ไอโซเมอร์แบบ dextrorotatory จะมีอำนาจเหนือกว่า โครงสร้างดังกล่าวมักเรียกว่าโครงสร้างอัลฟ่า
- องค์ประกอบและโครงสร้างของโปรตีนประเภทถัดไปแตกต่างจากโปรตีนรุ่นก่อนหน้าตรงที่พันธะไฮโดรเจนไม่ได้เกิดขึ้นระหว่างสารตกค้างที่อยู่ติดกับด้านหนึ่งของโมเลกุล แต่ระหว่างสารที่อยู่ห่างไกลอย่างมีนัยสำคัญและในระยะทางที่ค่อนข้างใหญ่ ด้วยเหตุนี้ โครงสร้างทั้งหมดจึงอยู่ในรูปของสายโซ่โพลีเปปไทด์ที่มีลักษณะคล้ายงูหลายเส้น มีคุณสมบัติอย่างหนึ่งที่โปรตีนจะต้องแสดงออกมา โครงสร้างของกรดอะมิโนบนกิ่งก้านควรสั้นที่สุดเท่าที่จะเป็นไปได้ เช่น ไกลซีนหรืออะลานีน เป็นต้น โครงสร้างรองประเภทนี้เรียกว่าแผ่นเบต้าสำหรับความสามารถในการเกาะติดกันเพื่อสร้างโครงสร้างร่วมกัน
- ชีววิทยาหมายถึงโครงสร้างโปรตีนประเภทที่สามว่าเป็นชิ้นส่วนที่ซับซ้อน กระจัดกระจายต่างกัน และไม่เป็นระเบียบซึ่งไม่มีภาวะตายตัวและสามารถเปลี่ยนโครงสร้างได้ภายใต้อิทธิพลของสภาวะภายนอก
ไม่มีการระบุตัวอย่างของโปรตีนที่มีโครงสร้างทุติยภูมิตามธรรมชาติ

การศึกษาระดับอุดมศึกษา
นี่เป็นโครงสร้างที่ค่อนข้างซับซ้อนที่เรียกว่า "ทรงกลม" โปรตีนนี้คืออะไร? โครงสร้างของมันขึ้นอยู่กับโครงสร้างรองอย่างไรก็ตามมีการเพิ่มปฏิสัมพันธ์รูปแบบใหม่ระหว่างอะตอมของกลุ่มและดูเหมือนว่าโมเลกุลทั้งหมดจะพับลงดังนั้นจึงมุ่งเน้นไปที่ความจริงที่ว่ากลุ่มที่ชอบน้ำนั้นถูกส่งไปยังทรงกลมโดยตรงและกลุ่มที่ไม่ชอบน้ำ คนข้างนอก
สิ่งนี้จะอธิบายประจุของโมเลกุลโปรตีนในสารละลายคอลลอยด์ของน้ำ มีการโต้ตอบประเภทใดบ้างที่นี่?
- พันธะไฮโดรเจน - ยังคงไม่เปลี่ยนแปลงระหว่างส่วนเดียวกันกับในโครงสร้างทุติยภูมิ
- ปฏิสัมพันธ์ - เกิดขึ้นเมื่อโพลีเปปไทด์ละลายในน้ำ
- แรงดึงดูดของไอออนิกเกิดขึ้นระหว่างกลุ่มของกรดอะมิโน (อนุมูล) ที่มีประจุต่างกัน
- ปฏิสัมพันธ์ของโควาเลนต์ - สามารถเกิดขึ้นระหว่างบริเวณที่เป็นกรดโดยเฉพาะ - โมเลกุลซิสเทอีนหรือหางของมัน
ดังนั้นองค์ประกอบและโครงสร้างของโปรตีนที่มีโครงสร้างตติยภูมิจึงสามารถอธิบายได้ว่าเป็นสายโซ่โพลีเปปไทด์ที่พับเป็นทรงกลมซึ่งคงรักษาและรักษาโครงสร้างให้คงที่เนื่องจากปฏิกิริยาทางเคมีประเภทต่างๆ ตัวอย่างของเปปไทด์ดังกล่าว: ฟอสโฟกลีเซอเรตเคเนส, tRNA, อัลฟา-เคราติน, ซิลค์ไฟโบรอิน และอื่นๆ
โครงสร้างควอเตอร์นารี
นี่เป็นหนึ่งในทรงกลมที่ซับซ้อนที่สุดที่เกิดจากโปรตีน โครงสร้างและหน้าที่ของโปรตีนประเภทนี้มีหลายแง่มุมและเฉพาะเจาะจงมาก
โครงสร้างนี้คืออะไร? สิ่งเหล่านี้คือสายโซ่โพลีเปปไทด์ขนาดใหญ่และเล็กหลายสาย (ในบางกรณีหลายสิบ) ที่เกิดขึ้นอย่างเป็นอิสระจากกัน แต่เนื่องจากปฏิสัมพันธ์เดียวกันกับที่เราพิจารณาสำหรับโครงสร้างระดับตติยภูมิ เปปไทด์ทั้งหมดนี้จึงบิดและพันกัน ด้วยวิธีนี้จะได้ทรงกลมที่มีโครงสร้างที่ซับซ้อนซึ่งอาจประกอบด้วยอะตอมของโลหะ กลุ่มไขมัน และคาร์โบไฮเดรต ตัวอย่างของโปรตีนดังกล่าว: DNA polymerase, เปลือกโปรตีนของไวรัสยาสูบ, เฮโมโกลบินและอื่น ๆ

โครงสร้างเปปไทด์ทั้งหมดที่เราตรวจสอบมีวิธีระบุตัวตนของตัวเองในห้องปฏิบัติการ โดยอาศัยความสามารถสมัยใหม่ในการใช้โครมาโตกราฟี การหมุนเหวี่ยง กล้องจุลทรรศน์อิเล็กตรอนและออปติคัล และเทคโนโลยีคอมพิวเตอร์ระดับสูง
ฟังก์ชั่นที่ดำเนินการ
โครงสร้างและหน้าที่ของโปรตีนมีความสัมพันธ์กันอย่างใกล้ชิด นั่นคือเปปไทด์แต่ละชนิดมีบทบาทเฉพาะ มีเอกลักษณ์เฉพาะตัว นอกจากนี้ยังมีสิ่งที่สามารถดำเนินการสำคัญหลายอย่างพร้อมกันในเซลล์ที่มีชีวิตเดียว อย่างไรก็ตาม หน้าที่หลักของโมเลกุลโปรตีนในสิ่งมีชีวิตสามารถแสดงในรูปแบบทั่วไปได้:
- ให้ความเคลื่อนไหว. สิ่งมีชีวิตเซลล์เดียว หรือออร์แกเนลล์ หรือเซลล์บางชนิดมีความสามารถในการเคลื่อนไหว การหดตัว และการเคลื่อนไหว สิ่งนี้รับประกันได้ด้วยโปรตีนที่ประกอบเป็นโครงสร้างของอุปกรณ์มอเตอร์ ได้แก่ ซีเลีย แฟลเจลลา และเยื่อหุ้มเซลล์ไซโตพลาสซึม หากเราพูดถึงเซลล์ที่ไม่สามารถเคลื่อนไหวได้ โปรตีนก็สามารถทำให้เกิดการหดตัวได้ (ไมโอซินของกล้ามเนื้อ)
- ฟังก์ชั่นทางโภชนาการหรือสำรอง เป็นการสะสมของโมเลกุลโปรตีนในไข่ เอ็มบริโอ และเมล็ดพืช เพื่อเติมเต็มสารอาหารที่ขาดหายไป เมื่อสลายเปปไทด์จะผลิตกรดอะมิโนและสารออกฤทธิ์ทางชีวภาพซึ่งจำเป็นต่อการพัฒนาสิ่งมีชีวิตตามปกติ
- ฟังก์ชั่นพลังงาน นอกจากคาร์โบไฮเดรตแล้ว โปรตีนยังให้ความแข็งแรงแก่ร่างกายอีกด้วย การสลายเปปไทด์ 1 กรัมจะปล่อยพลังงานที่เป็นประโยชน์ 17.6 กิโลจูล ในรูปของกรดอะดีโนซีน ไตรฟอสฟอริก (ATP) ซึ่งถูกใช้ไปในกระบวนการสำคัญ
- การส่งสัญญาณประกอบด้วยการตรวจสอบกระบวนการที่กำลังดำเนินอยู่อย่างระมัดระวัง และการส่งสัญญาณจากเซลล์ไปยังเนื้อเยื่อ จากเซลล์ไปยังอวัยวะ จากเซลล์ไปยังระบบ และอื่นๆ ตัวอย่างทั่วไปคืออินซูลินซึ่งจะกำหนดปริมาณกลูโคสในเลือดอย่างเคร่งครัด
- ฟังก์ชั่นตัวรับ ดำเนินการโดยการเปลี่ยนโครงสร้างของเปปไทด์ที่ด้านหนึ่งของเมมเบรน และให้ปลายอีกด้านหนึ่งมีส่วนร่วมในการปรับโครงสร้างใหม่ ในขณะเดียวกัน สัญญาณและข้อมูลที่จำเป็นจะถูกส่งออกไป ส่วนใหญ่แล้วโปรตีนดังกล่าวจะถูกฝังอยู่ในเยื่อหุ้มเซลล์ของไซโตพลาสซึมและควบคุมสารทั้งหมดที่ผ่านเข้าไปอย่างเข้มงวด พวกเขายังให้ข้อมูลเกี่ยวกับการเปลี่ยนแปลงทางเคมีและกายภาพในสิ่งแวดล้อม
- ฟังก์ชั่นการขนส่งของเปปไทด์ ดำเนินการโดยโปรตีนแชนเนลและโปรตีนขนส่ง บทบาทของพวกเขาชัดเจน - การขนส่งโมเลกุลที่จำเป็นไปยังสถานที่ที่มีความเข้มข้นต่ำจากชิ้นส่วนที่มีความเข้มข้นสูง ตัวอย่างทั่วไปคือการขนส่งออกซิเจนและคาร์บอนไดออกไซด์ผ่านอวัยวะและเนื้อเยื่อโดยโปรตีนฮีโมโกลบิน พวกเขายังดำเนินการส่งสารประกอบที่มีน้ำหนักโมเลกุลต่ำผ่านเยื่อหุ้มเซลล์เข้าสู่ภายใน
- ฟังก์ชั่นโครงสร้าง หนึ่งในหน้าที่ที่สำคัญที่สุดที่ทำโดยโปรตีน โครงสร้างของเซลล์ทั้งหมดและออร์แกเนลล์นั้นได้รับการรับรองโดยเปปไทด์ พวกเขาเหมือนกรอบที่กำหนดรูปร่างและโครงสร้าง นอกจากนี้ยังสนับสนุนและแก้ไขหากจำเป็น ดังนั้นเพื่อการเจริญเติบโตและพัฒนาการ สิ่งมีชีวิตทุกชนิดจึงต้องการโปรตีนในอาหาร เปปไทด์ดังกล่าว ได้แก่ อีลาสติน ทูบูลิน คอลลาเจน แอกติน เคราติน และอื่นๆ
- ฟังก์ชันตัวเร่งปฏิกิริยา มันดำเนินการโดยเอนไซม์ พวกมันเร่งปฏิกิริยาทางเคมีและชีวเคมีในร่างกายจำนวนมากและหลากหลาย หากไม่มีส่วนร่วม แอปเปิ้ลธรรมดาในท้องก็สามารถย่อยได้ภายในเวลาเพียงสองวัน ซึ่งมีแนวโน้มว่าจะเน่าเปื่อยในกระบวนการนี้ ภายใต้อิทธิพลของคาตาเลส เปอร์ออกซิเดส และเอนไซม์อื่น ๆ กระบวนการนี้จะเกิดขึ้นภายในสองชั่วโมง โดยทั่วไปแล้วต้องขอบคุณบทบาทของโปรตีนที่ทำให้แอแนบอลิซึมและแคแทบอลิซึมเกิดขึ้นนั่นคือพลาสติกและ

บทบาทการป้องกัน
มีภัยคุกคามหลายประเภทที่โปรตีนได้รับการออกแบบมาเพื่อปกป้องร่างกาย
ประการแรก สารรีเอเจนต์ที่กระทบกระเทือนจิตใจ ก๊าซ โมเลกุล สารที่มีฤทธิ์หลากหลาย เปปไทด์สามารถโต้ตอบทางเคมีกับพวกมัน เปลี่ยนพวกมันให้อยู่ในรูปแบบที่ไม่เป็นอันตรายหรือเพียงแค่ทำให้พวกมันเป็นกลาง
ประการที่สอง ภัยคุกคามทางกายภาพจากบาดแผล - หากโปรตีนไฟบริโนเจนไม่เปลี่ยนเป็นไฟบรินในบริเวณที่เกิดการบาดเจ็บทันเวลา เลือดจะไม่จับตัวเป็นก้อนซึ่งหมายความว่าจะไม่เกิดการอุดตัน ในทางกลับกันคุณจะต้องใช้เปปไทด์พลาสมินซึ่งสามารถละลายลิ่มเลือดและฟื้นฟูความแจ้งของหลอดเลือดได้
ประการที่สาม ภัยคุกคามต่อภูมิคุ้มกัน โครงสร้างและความสำคัญของโปรตีนที่สร้างภูมิคุ้มกันมีความสำคัญอย่างยิ่ง แอนติบอดี, อิมมูโนโกลบูลิน, อินเตอร์เฟอรอน - ทั้งหมดนี้เป็นองค์ประกอบที่สำคัญและสำคัญของระบบน้ำเหลืองและระบบภูมิคุ้มกันของมนุษย์ อนุภาคแปลกปลอม โมเลกุลที่เป็นอันตราย ส่วนที่ตายแล้วของเซลล์ หรือโครงสร้างทั้งหมดจะต้องได้รับการตรวจสอบทันทีโดยสารประกอบเปปไทด์ นั่นคือเหตุผลที่บุคคลสามารถป้องกันตัวเองทุกวันจากการติดเชื้อและไวรัสธรรมดาได้อย่างอิสระโดยไม่ต้องพึ่งยา
คุณสมบัติทางกายภาพ
โครงสร้างโปรตีนของเซลล์มีความเฉพาะเจาะจงมากและขึ้นอยู่กับการทำงานที่ทำ แต่คุณสมบัติทางกายภาพของเปปไทด์ทั้งหมดจะคล้ายกันและมีลักษณะดังนี้
- น้ำหนักของโมเลกุลสูงถึง 1,000,000 ดาลตัน
- ระบบคอลลอยด์เกิดขึ้นในสารละลายที่เป็นน้ำ ที่นั่นโครงสร้างจะได้รับประจุที่สามารถเปลี่ยนแปลงได้ขึ้นอยู่กับความเป็นกรดของสิ่งแวดล้อม
- เมื่อสัมผัสกับสภาวะที่ไม่เอื้ออำนวย (การฉายรังสี กรดหรือด่าง อุณหภูมิ ฯลฯ) พวกมันสามารถเคลื่อนตัวไปยังระดับอื่น ๆ ของโครงสร้าง กล่าวคือ การเปลี่ยนสภาพธรรมชาติ กระบวนการนี้ไม่สามารถย้อนกลับได้ใน 90% ของกรณี อย่างไรก็ตาม ยังมีการเปลี่ยนแปลงแบบย้อนกลับอีกด้วย
สิ่งเหล่านี้เป็นคุณสมบัติหลักของลักษณะทางกายภาพของเปปไทด์