Tantal i niob otrzymuje się w wyniku redukcji ze związków o wysokiej czystości: tlenków, złożonych soli fluorkowych, chlorków. Przemysłowe metody wytwarzania metali można podzielić na cztery grupy:
Redukcja natritermiczna ze złożonych fluorków;
Redukcja tlenków węglem (metoda karbotermiczna);
Redukcja tlenków glinu (metoda aluminotermiczna);
Redukcja z chlorków wodorem;
Elektroliza stopionych mediów.
Ze względu na wysoką temperaturę topnienia tantalu (~3000 C) i niobu (~2500 C), otrzymuje się je w wyniku redukcji wszystkimi wymienionymi metodami, z wyjątkiem trzeciej, w postaci proszków lub spiekanych gąbek. Zadanie wytworzenia zwartego, ciągliwego tantalu i niobu komplikuje fakt, że metale te aktywnie absorbują gazy (wodór, azot, tlen), których zanieczyszczenia powodują, że stają się kruche. Dlatego konieczne jest spiekanie półproduktów sprasowanych z proszków lub stapianie ich w wysokiej próżni.
Natritermiczna metoda otrzymywania proszków tantalu i niobu
Termiczna redukcja sodu złożonych fluorków K2TaF7 i K2NbF7 jest pierwszą przemysłową metodą produkcji tantalu i niobu. Jest nadal używany. Sód, wapń i magnez, które mają duże powinowactwo do fluoru, nadają się do redukcji związków fluorkowych tantalu i niobu, jak wynika z wartości podanych poniżej:
Glin<^ент Nb Та Na Mg Са
AG298, kJ/g-atom F. . . . -339 -358 -543 -527 -582
Do redukcji wykorzystuje się sód, gdyż fluorek sodu jest rozpuszczalny w wodzie i można go oddzielić przez wypłukanie z proszków tantalu i niobu, natomiast fluorki magnezu i wapnia są słabo rozpuszczalne w wodzie i kwasach.
Rozważmy ten proces na przykładzie produkcji tantalu. Redukcja K2TaF7 sodem przebiega z dużym wydzielaniem ciepła (nawet przy skali obciążenia wsadem do 5 kg), wystarczającym, aby proces przebiegał samoistnie. Po podgrzaniu wsadu w jednym miejscu do temperatury 450-500 C reakcja szybko rozprzestrzenia się po całej masie wsadu i temperatura osiąga 800-900 C. Ponieważ sód topi się w 97 C i wrze w 883 C, oczywiste jest, że ciecz i pary sodu biorą udział w redukcji:
K2TaF7 + 5NaW = Ta + 5NaF + 2KF; K2TaF7 + 5Na(ra3) = Ta + 5NaF + 2KF.
Specyficzne efekty termiczne reakcji (2.18) i (2.19) wynoszą odpowiednio 1980 i 3120 kJ/kg ładunku.
Redukcję przeprowadza się w tyglu stalowym, do którego warstwowo ładuje się kawałki fluorotantalanu potasu i sodu (~120% wymaganej ilości stechiometrycznej), które następnie wycina się specjalnymi nożyczkami. Mieszaninę pokrywa się na wierzchu warstwą chlorku sodu, który tworzy niskotopliwą mieszaninę z KF i NaF. Stopiona sól chroni cząstki przed utlenianiem
proszek tantalu W najprostszej wersji procesu, w celu zapoczątkowania reakcji, ściankę tygla na dnie podgrzewa się płomieniem palnika, aż pojawi się czerwona plama. Reakcja przebiega szybko w całej masie i kończy się w ciągu 1-2 minut. W procesie tym, w wyniku krótkotrwałego poddania produktów działaniu maksymalnej temperatury (800-900 C), otrzymuje się drobne proszki tantalu, które po przemyciu soli zawierają do 2% tlenu.
Gruboziarnisty proszek o niższej zawartości tlenu otrzymuje się poprzez umieszczenie tygla reakcyjnego w szybowym piecu elektrycznym i pozostawienie go w piecu po zakończeniu reakcji w temperaturze 1000°C.
Powstały tantal rozprowadzany jest w postaci małych cząstek w żużlu fluorkowo-chlorkowym zawierającym nadmiar sodu. Po ochłodzeniu zawartość tygla wybija się, rozdrabnia w kruszarce szczękowej i małymi porcjami ładuje do reaktora z wodą, gdzie sód zostaje „ugaszony” i większość soli zostaje rozpuszczona. Następnie proszek przemywa się kolejno rozcieńczonym chlorkiem sodu (aby dokładniej zmyć sole i rozpuścić zanieczyszczenia żelazem i częściowo tytanem). Aby zmniejszyć zawartość tlenków tantalu, proszek czasami dodatkowo przemywa się zimnym rozcieńczonym kwasem fluorowodorowym. Następnie proszek przemywa się wodą destylowaną, sączy i suszy w temperaturze 110-120°C.
Stosując opisaną powyżej metodę, zachowując w przybliżeniu te same reżimy, proszki niobu otrzymuje się poprzez redukcję k2NbF7 sodem. Suszony proszek niobu ma skład,%: Ti, Si, Fe 0,02-0,06; O około 0,5; N do 0,1; Od 0,1-0,15.
Karbotermiczna metoda otrzymywania niobu i tantalu z tlenków
Metoda ta została pierwotnie opracowana do produkcji niobu z Nb2o5.
Niob można zredukować z Nb2os za pomocą węgla w temperaturze 1800–1900 °C w piecu próżniowym:
Nb2Os + 5C = 2Nb + SCO. (2.20)
Ładunek Nb205 + 5C zawiera niewielką ilość niobu i nawet w stanie zbrykietowanym ma niską gęstość (~1,8 g/cm3). Jednocześnie na 1 kg wsadu uwalniana jest duża ilość co (~0,34 m3). Okoliczności te powodują, że prowadzenie procesu według reakcji (2.20) jest nieopłacalne, gdyż wydajność pieca próżniowego jest niska. Dlatego proces przebiega w dwóch etapach:
Etap I - produkcja węglika niobu
Nb203 + 1C = 2NbC + 5CO; (2,2l)
Etap P - produkcja niobu w piecach próżniowych
Nb2Os + 5NbC = 7Nb + 5CO. (2.22)
Zbrykietowany wsad etapu IV zawiera 84,2% (wagowo) niobu, gęstość brykietów wynosi ~3 g/cm3, a powstająca objętość wynosi 0,14 m3 na 1 kg wsadu (~2,5 razy mniej niż w przypadku brykietowanego wsadu etapu IV). ładunek Nb2o5 + sc). Zapewnia to wyższą wydajność pieca próżniowego.
Istotną zaletą procesu dwuetapowego jest także to, że pierwszy etap można prowadzić pod ciśnieniem atmosferycznym w piecach oporowych z rurami grafitowymi (rys. 29).
W celu otrzymania węglika niobu (I etap procesu) brykietuje się mieszaninę Nb2o5 z sadzą i brykiety podgrzewa się w piecu grafitowo-rurowym w atmosferze wodoru lub argonu w temperaturze 1800-1900°C (brykiety przemieszczane są w sposób ciągły wzdłuż piec
Ryż. 29. Schemat pieca oporowego z rurą grafitową:
1 - obudowa; 2 - rurka z włókna grafitowego; 3 - rura grafitowa ekranująca; 4- sadza zasypka termoizolacyjna; 5 - lodówka; 6 - stożki grafitowe kontaktowe; 7 - chłodzona głowica kontaktowa; 8 - właz; 9 - autobusy dostarczające prąd
Na podstawie ich pobytu w gorącej strefie przez 1-1,5 godziny). Rozdrobniony węglik niobu miesza się w młynie kulowym z Nb2o5 pobranym w niewielkim nadmiarze (3-5%) w stosunku do wymaganego w reakcji (2.22).
Wsad jest prasowany w kęsy pod ciśnieniem 100 MPa, które są podgrzewane w piecach próżniowych z grzejnikami grafitowymi (lub próżniowych piecach indukcyjnych z rurą grafitową) w temperaturze 1800-1900 C. Ekspozycja kończy się, gdy ciśnienie resztkowe osiągnie 1,3-0,13 Pa .
Reakcje (2.21) i (2.22) są całkowite. Przechodzą przez pośrednie etapy powstawania niższych tlenków (Nt>o2 i NbO), a także węglika Nb2c. Główne reakcje etapu I:
Nb2Os + C = 2Nb02 + CO; (2.23)
Nb02 + C = NbO + CO; (2.24)
2NbO + 3C = Nb2C + 2CO; (2,25)
Nb2C + C = 2NbC. (2.26)
Reakcje etapu 1:
Nb2Os + 2NbC = 2Nb02 + Nb2C + CO; (2.27)
Nb02 + 2NbC = NbO + Nb2C + CO; (2.28)
NbO + Nb2C = 3Nb + CO. (2.29)
Niob metaliczny otrzymuje się w końcowej reakcji II etapu procesu (2.29). Ciśnienie równowagi co dla reakcji (2,29) w 1800 °C > 1,3 Pa. Dlatego proces należy prowadzić przy ciśnieniu resztkowym mniejszym niż ciśnienie równowagowe dla danej reakcji (0,5-0,13 Pa).
Powstałe spiekane porowate brykiety niobu zawierają%: C 0,1-0,15; Około 0,15-0,30; N 0,04-0,5. Aby uzyskać zwarty metal ciągliwy, brykiety topi się w piecu elektronowym. Innym sposobem jest otrzymywanie proszku z brykietów (poprzez uwodornienie w temperaturze 450 C, mielenie i późniejsze odwodornienie w próżni), prasowanie prętów i spiekanie ich w próżni w temperaturze 2300-2350 C. W procesach topienia próżniowego i spiekania w próżni, tlen i węgiel jest usuwany z kompozycji co, a nadmiar tlenu z kompozycji lotnych niższych tlenków.
Głównymi zaletami metody karbotermicznej jest wysoki uzysk bezpośredni metalu (nie niższy niż 96%) oraz zastosowanie taniego środka redukującego. Wadą tej metody jest złożoność konstrukcji pieców próżniowych wysokotemperaturowych.
Metodą karbotermiczną można również wytwarzać stopy tantalu i niobu z tantalem.
Aluminatermiczna metoda otrzymywania niobu i tantalu z wyższych tlenków
Opracowana w ostatnich latach aluminometryczna metoda wytwarzania niobu poprzez redukcję pięciotlenku niobu glinem ma przewagę techniczną i ekonomiczną w porównaniu z innymi metodami wytwarzania niobu ze względu na niskoetapowy charakter i prostotę wyposażenia.
Metoda opiera się na reakcji egzotermicznej:
3Nb2Os + 10A1 = 6Nb + 5A1203; (2.30)
Dow = -925,3 + 0,1362t, kJ/mol Nb2o5.
Wysoki efekt cieplny właściwy reakcji (2640 kJ/kg wsadu o składzie stechiometrycznym) umożliwia prowadzenie procesu bez zewnętrznego ogrzewania przy wytopie wlewka ze stopu niobu i aluminium. Skuteczna redukcja aluminotermiczna poza piecem jest możliwa, jeśli temperatura procesu jest wyższa niż temperatura topnienia A12®3 = 2030°C) i faza metaliczna (stop Nb +10% AI topi się w temperaturze 2050°C). Przy nadmiarze aluminium we wsadzie o 30 - 40% powyżej ilości stechiometrycznej temperatura procesu osiąga ~2150-2200 C. Ze względu na szybkie występowanie redukcji, wzrost temperatury o około 100-150 C w porównaniu do topienia temperatura faz żużla i metalu jest wystarczająca, aby zapewnić ich rozdzielenie. Przy wspomnianym nadmiarze aluminium we wsadzie otrzymuje się stop niobu z zawartością 8-10% aluminium o ekstrakcji niobu rzeczywistego na poziomie 98-98,5%.
Redukcję aluminotermiczną przeprowadza się w tyglu stalowym z wypełnieniem z kalcynowanych tlenków magnezu lub glinu. Aby ułatwić rozładunek produktów wytapiania, tygiel jest odłączalny. Styki wprowadzane są przez ścianki w celu dostarczenia prądu elektrycznego (20 V, 15 A) do bezpiecznika w postaci drutu nichromowego umieszczonego w ładunku. Inną możliwą opcją jest prowadzenie procesu w masywnym tyglu miedzianym dzielonym, na którego ściankach tworzy się warstwa ochronna.
Do tygla ładuje się mieszaninę dokładnie wysuszonego Nb2o5 i proszku aluminiowego o wielkości cząstek ~100 µm. Aby uniknąć kontaktu z powietrzem, zaleca się umieszczenie tygla w komorze wypełnionej argonem.
Po włączeniu bezpiecznika reakcja przebiega szybko w całej masie ładunku. Powstały wlewek stopowy rozdrabnia się na kawałki i poddaje próżniowej obróbce cieplnej w temperaturze 1800-2000 C w piecu z grzejnikiem grafitowym przy ciśnieniu resztkowym ~0,13 Pa w celu usunięcia większości aluminium (do jego zawartości 0,2%). ). Następnie przeprowadza się wytapianie rafinacyjne w piecu z wiązką elektronów, uzyskując wlewki niobu o wysokiej czystości i zawartości zanieczyszczeń, %: A1< 0,002; С 0,005; Си < 0,0025; Fe < 0,0025; Mg, Mn, Ni, Sn < 0,001; N 0,005; О < 0,010; Si < 0,0025; Ті < < 0,005; V < 0,0025.
Zasadniczo możliwa jest aluminotermiczna produkcja tantalu, ale proces jest nieco bardziej skomplikowany. Specyficzny efekt termiczny reakcji redukcji wynosi 895 kJ/kg ładunku. Ze względu na wysoką temperaturę topnienia tantalu i jego stopów z aluminium, do wsadu do wytapiania wlewka wprowadza się tlenek żelaza (z szybkością otrzymywania stopu o zawartości 7-7,5% żelaza i 1,5% aluminium), a także ogrzewanie dodatek - chloran potasu (sól bertolitu). Tygiel z wsadem umieszcza się w piecu. W temperaturze 925°C rozpoczyna się spontaniczna reakcja. Ekstrakcja tantalu do stopu wynosi około 90%.
Po próżniowej obróbce termicznej i stopieniu wiązką elektronów wlewki tantalu mają wysoką czystość, porównywalną z podaną powyżej dla niobu.
Otrzymywanie tantalu i niobu przez redukcję ich chlorków wodorem
Opracowano różne metody redukcji tantalu i niobu z ich chlorków: redukcja magnezem, sodem i wodorem. Najbardziej obiecujące są niektóre opcje redukcji wodorem, w szczególności omówiona poniżej metoda redukcji par chlorków na ogrzanych podłożach w celu wytworzenia zwartego metalowego pręta.
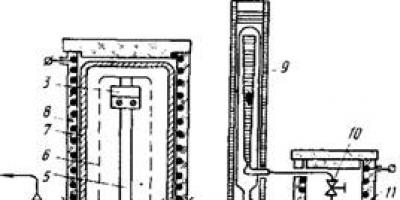
Na ryc. Rysunek 30 przedstawia schemat instalacji do produkcji tantalu poprzez redukcję par TaC15 wodorem na taśmie tantalu podgrzanej do temperatury 1200-1400°C. Para TaCI5 zmieszana z wodorem przepływa z parownika do reaktora, w środku którego znajduje się pasek tantalu, podgrzewany bezpośrednim przepływem prądu elektrycznego do zadanej temperatury. Aby równomiernie rozprowadzić mieszankę parowo-gazową na całej długości taśmy i zapewnić przepływ prostopadły do jej powierzchni, wokół taśmy zamontowane jest sito ze stali nierdzewnej z otworami. Na nagrzanej powierzchni zachodzi reakcja:
TaC15 + 2,5 H2 = Ta + 5 HCl; AG°m k = -512 kJ. (2.31)

Ryż. 30. Schemat instalacji redukcji pięciochlorku tantalu wodorem: 1 - kołnierz reaktora; 2 - izolowane zasilanie elektryczne; 3 - styki zaciskowe; 4 - kondensator nieprzereagowanego chlorku; 5 - taśma tantalowa; 6 - sita z otworami, - 7 - korpus reaktora; 8 - grzejnik reaktora; 9 - podgrzewany rotametr; 10 - zawór iglicowy; 11 - piec elektryczny parownika; 12 - parownik pentachlorku tantalu; 13 - rotametr wodoru
Optymalne warunki osadzania tantalu: temperatura taśmy 1200-1300°C, stężenie TaCI5 w mieszaninie gazowej ~ 0,2 mol/mol mieszaniny. Szybkość osadzania w tych warunkach wynosi 2,5-3,6 g/(cm2·h) (czyli 1,5-2,1 mm/h). Tym samym w ciągu 24 godzin otrzymuje się czysty pręt tantalowy o średniej średnicy 24-25 mm, który można walcowane na arkusze, wykorzystywane do przetapiania w piecu z wiązką elektronów lub przetwarzane na proszki o wysokiej czystości (poprzez uwodornienie, mielenie i odwodornienie proszku). Stopień konwersji chlorków (bezpośrednia ekstrakcja do powłoki) wynosi 20-30%. Nieprzereagowany chlorek zatęża się i wykorzystuje ponownie. Zużycie energii elektrycznej wynosi 7-15 kWh na 1 kg tantalu, w zależności od przyjętego trybu.
Wodór po oddzieleniu par HCl poprzez absorpcję przez wodę można zawrócić do procesu.
Opisaną metodą można również wytwarzać pręty niobowe. Optymalne warunki osadzania niobu: temperatura taśmy 1000-1300 C, stężenie pentachlorku 0,1-0,2 mol/mol mieszaniny gazowej. Szybkość osadzania metalu wynosi 0,7-1,5 g/(cm2-h), stopień konwersji chlorku w metal wynosi 15-30%, zużycie energii elektrycznej wynosi 17-22 kWh/kg metalu. Proces dla niobu komplikuje fakt, że część NbCl5 ulega redukcji w objętości reaktora w pewnej odległości od nagrzanej taśmy do nielotnego NbCl3 osadzonego na ściankach reaktora.
Elektrolityczna metoda wytwarzania tantalu
Tantalu i niobu nie można wyodrębnić metodą elektrolizy z roztworów wodnych. Wszystkie opracowane procesy opierają się na elektrolizie stopionych mediów.
W praktyce przemysłowej metodę tę stosuje się do otrzymywania tantalu. Tak więc od kilku lat metodą elektrolityczną tantalu zajmuje się firma Fensteel (USA), obecnie część tantalu produkowanego w Japonii otrzymywana jest metodą elektrolizy. Szeroko zakrojone badania i testy przemysłowe metody przeprowadzono w ZSRR.
Metoda elektrolitycznego wytwarzania tantalu jest podobna do metody wytwarzania aluminium.
Podstawą elektrolitu są stopione sole K2TaF7 - KF - - KS1, w których rozpuszczony jest tlenek tantalu Ta205. Zastosowanie elektrolitu zawierającego tylko jedną sól K2TaF7 jest praktycznie niemożliwe ze względu na ciągły efekt anodowy przy zastosowaniu anody grafitowej. Elektroliza możliwa jest w kąpieli zawierającej K2TaF7, KC1 i NaCl. Wadą tego elektrolitu jest gromadzenie się w nim soli fluorkowych podczas elektrolizy, co prowadzi do zmniejszenia krytycznej gęstości prądu i wymaga dostosowania składu kąpieli. Wadę tę eliminuje się poprzez wprowadzenie Ta2O5 do elektrolitu. Efektem elektrolizy jest w tym przypadku elektrolityczny rozkład tlenku tantalu z wydzieleniem tantalu na katodzie, a na anodzie tlenu, który reaguje z grafitem anody tworząc CO2 i CO. Dodatkowo wprowadzenie Ta2O5 do roztopionej soli poprawia zwilżanie anody grafitowej roztopem i zwiększa krytyczną gęstość prądu.
Dobór składu elektrolitu opiera się na danych z badań układu trójskładnikowego K2TaF7-KCl-KF (rys. 31). Układ ten zawiera dwie sole podwójne K2TaF7 KF (lub KjTaFg) i K2TaF7 KS1 (lub K3TaF7Cl), dwie trójskładnikowe eutektyki Ei i E2 o temperaturze topnienia odpowiednio 580 i 710 C oraz punkt perytektyczny P w temperaturze 678°C. Kiedy Ta2O5 wprowadza się do stopu, wchodzi on w interakcję z fluorotantalanami, tworząc oksofluorotantalan:
3K3TaF8 + Ta2Os + 6KF = 5K3TaOF6. (2.32)
Podobnie przebiega reakcja z K3TaF7Cl. Tworzenie kompleksów tlenofluorku tantalu determinuje rozpuszczalność Ta2O5 w elektrolicie. Granica rozpuszczalności zależy od zawartości K3TaF8 w stopie i odpowiada stechiometrii reakcji (2,32).
Na podstawie danych dotyczących wpływu składu elektrolitu na wydajność elektrolizy (krytyczna gęstość prądu, wydajność prądowa, ekstrakcja, jakość proszku tantalu) radzieccy badacze zaproponowali następujący optymalny skład elektrolitu: 12,5% (wagowo) K2TaF7, reszta KS1 i KF w stosunku 2:1 (wagowo). Stężenie wprowadzonego Ta2O wynosi 2,5-3,5% (wagowo). W tym elektrolicie, w temperaturach 700-800°C, przy zastosowaniu anody grafitowej, napięcie rozkładu kompleksu oksofluorku wynosi 1,4 V, natomiast dla KF i KS1 napięcia rozkładu wynoszą odpowiednio ~3,4 V i ~4,6 V.

KS I K2TaF,-KCl KJaFf
Ryż. 31. Wykres topliwości układu K2TaF7-KF-KCl
Podczas elektrolizy na katodzie następuje stopniowe wyładowanie kationów Ta5+:
Ta5+ + 2e > Ta3+ + be * Ta0.
Procesy zachodzące na anodzie można przedstawić za pomocą reakcji: TaOF63" - Ze = TaFs + F" + 0; 20 + C = C02; CO2 + C = 2CO; TaFj + 3F~ = TaF|~. Jony TaF|~, reagując z Ta2O wprowadzonym do stopu, ponownie tworzą jony TaOF|~. W temperaturach elektrolizy 700-750°C skład gazu wynosi -95% CO2, 5-7% CO; 0,2-

Spośród konstrukcji elektrolizerów testowanych w ZSRR najlepsze wyniki uzyskano w tych, w których katodą jest tygiel wykonany z niklu (lub stopu niklu i chromu), w środku

Ryc.32. Schemat elektrolizera do produkcji tantalu:
1 - zasyp z podajnikiem Ta205; 2 - wibrator elektromagnetyczny podajnika; 3 - wspornik z mocowaniem anody; 4 - pusta anoda grafitowa z otworami w ścianie; 5 - katoda tyglowa nichromowa; 6 - pokrywa; 7 - szkło termoizolacyjne; 8 - kierownica do podnoszenia siłownika; 9 - wtyczka z prętem do zasilania
Który zawiera wydrążoną anodę grafitową z otworami w ściankach (ryc. 32). Tlenek tantalu jest okresowo podawany do pustej anody za pomocą automatycznego podajnika wibracyjnego. Dzięki tej metodzie podawania eliminuje się mechaniczne zanieczyszczenie osadu katodowego nierozpuszczonym pięciotlenkiem tantalu. Gazy są usuwane poprzez instalację ssącą na pokładzie. Przy temperaturze elektrolizy 700-720 C, ciągłym zasilaniu wanny Ta205 (tj. przy minimalnej liczbie efektów anodowych), gęstości prądu katodowego 30-50 A/dm2 i stosunku DjDк = 2*4, bezpośredniej ekstrakcji tantalu wynosi 87-93%, wydajność obecnie 80%.
Elektrolizę prowadzi się do momentu wypełnienia 2/3 użytecznej objętości tygla osadem katodowym. Pod koniec elektrolizy anoda jest podnoszona, a elektrolit wraz z osadem katodowym schładzany. Do oddzielenia elektrolitu od cząstek proszku tantalu stosuje się dwie metody obróbki produktu katodowego: mielenie z separacją powietrza i czyszczenie próżniowo-termiczne.
Opracowana w ZSRR metoda próżniowo-termiczna polega na oddzieleniu większości soli od tantalu poprzez wytop (stopienie) w atmosferze argonu, a następnie usunięcie pozostałości poprzez odparowanie pod próżnią w temperaturze 900°C. Stopiony i skondensowany elektrolit wraca do elektrolizy.
To poprzez szlifowanie z separacją powietrza 30-70 mikronów, a przy zastosowaniu próżniowej obróbki cieplnej - 100-120 mikronów.
Produkcja niobu z elektrolitów tlenofluorkowo-chlorkowych, takich jak tantal, nie dała pozytywnych wyników, ponieważ podczas wyładowania na katodzie tworzą się niższe tlenki, które zanieczyszczają metal. Prąd wyjściowy jest niski.
Elektrolity beztlenowe są obiecujące w przypadku niobu (a także tantalu). Pentachlorki niobu i tantalu rozpuszczają się w stopionych chlorkach metali alkalicznych, tworząc sole złożone A/eNbCl6 i MeTaCl6. Podczas elektrolitycznego rozkładu tych kompleksów na katodzie wydzielają się grubokrystaliczne osady niobu i tantalu, a na anodzie grafitowej chlor.
Opis i właściwości niobu
Niob– pierwiastek należący do piątej grupy okresowej, liczba atomowa – 41. Elektroniczna formuła niobu— Nb 4d45sl. Graficzna formuła niobu- Nb - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 4d 4 5s 1. Odkryte w 1801 roku - pierwotnie zwane „Columbia”, od nazwy rzeki, w której zostało odkryte. Później zmieniono nazwę.
Niob – metal klosz w kolorze biało-stalowym, posiada plastyczność - łatwo zwija się w arkusze. Struktura elektronowa niobu nadaje mu pewne cechy. Odnotowuje się wskazanie wysokiej temperatury podczas topienia i temperatury wrzenia metalu. Z tego powodu elektroniczny odpływ elektronów jest odnotowywany jako cecha. Nadprzewodnictwo pojawia się tylko w wysokich temperaturach. Do utleniania metal wymaga minimalnej temperatury około 300°C lub wyższej. To tworzy konkret tlenek niobu Nb2O5.
Niob, właściwości który aktywnie oddziałuje z niektórymi gazami. Są to wodór, tlen i azot, pod ich wpływem może zmienić pewne właściwości. Im wyższa temperatura, tym intensywniej absorbowany jest wodór, przez co niob staje się bardziej kruchy, po osiągnięciu punktu kontrolnego 600°C zaczyna zachodzić odwrotna ewolucja i metal odzyskuje utracone właściwości. Następnie rozpoczyna się tworzenie azotku NbN, którego topienie wymaga temperatury 2300 ° C.
Węgiel i zawierające go gazy rozpoczynają interakcję z niobem w wymaganej temperaturze powyżej 1200°C, w wyniku czego powstaje węglik NbC – temperatura topnienia – 3500°C. W wyniku oddziaływania krzemu i boru z metalicznym niobem powstaje bor NbB2 uformowany - temperatura topnienia - 2900°C.

Pierwiastek niob odporny na prawie wszystkie znane kwasy, z wyjątkiem kwasu fluorowodorowego, a zwłaszcza jego mieszaniny z kwasem azotowym. Metal jest wrażliwy na alkalia, zwłaszcza gorące. Po rozpuszczeniu w nich następuje proces utleniania i powstaje kwas niobowy.
Górnictwo i pochodzenie niobu
Zawartość metalu w tonie pożyczonej skały jest stosunkowo niska – tylko 18 g na tonę. Zawartość jest zwiększona w skałach bardziej kwaśnych. Najczęściej spotykany w jednym złożu niob i tantal, ze względu na podobne właściwości chemiczne, które pozwalają im występować w tym samym minerale i uczestniczyć we wspólnych procesach. Często w niektórych minerałach zawierających tytan występuje zjawisko zastępowania - „niob – tytan”.
Znanych jest około stu różnych minerałów zawierających niob. Ale tylko nieliczne są wykorzystywane w przemyśle. Są to pirochlor, loparyt, torolit itp. W skałach ultramaficznych i alkalicznych niob występuje w perowskicie i eudialicie.
Złoża niobu dostępny w Brazylii, Australii, Kanadzie, Kongo, Nigerii i Rwandzie.

Produkcja niobu dość złożony proces składający się z trzech głównych etapów. Najpierw otwiera się koncentrat, następnie niob rozdziela się na czyste związki. Ostatnim etapem są procesy odzysku i rafinacji metalu. Do najpowszechniejszych metod należą metody karbotermiczne, aluminotermiczne i sodowo-termiczne.
Przykładowo, mieszając tlenek niobu i sadzę w wysokich temperaturach w środowisku wodoru, otrzymuje się węglik, następnie mieszając węglik i tlenek niobu w tych samych temperaturach, ale w całkowitej próżni, otrzymuje się metal, z którego można uzyskać różne stopy niobu. Stopy niobu można otrzymać metodami metalurgii proszków, metodą topienia próżniowego i łukiem elektronowym.
Zastosowania niobu
Ze względu na swoje unikalne właściwości niob znajduje zastosowanie w wielu dziedzinach przemysłu. Stopy niobu mają ogniotrwałość, odporność na ciepło, nadprzewodnictwo, właściwości getterowe i antykorozyjne. Ponadto jest dość łatwy w obróbce i spawaniu. Znajduje szerokie zastosowanie w technologiach kosmicznych i lotniczych, radiotechnice i elektrotechnice, przemyśle chemicznym oraz energetyce jądrowej. W lampach generatorowych wykonuje się z niego wiele elementów grzejnych. Do tych celów wykorzystuje się również jego stop z tantalem.

Prostowniki elektryczne i kondensatory elektrolityczne również zawierają pewną ilość tego metalu. Jego zastosowanie w tych urządzeniach wynika z jego charakterystycznych właściwości transmisyjnych i utleniających. Kondensatory zawierające ten metal, przy stosunkowo małych wymiarach, charakteryzują się dużą rezystancją. Wszystkie elementy kondensatora wykonane są ze specjalnej folii. Jest tłoczony z proszku niobu.
Odporność na różne kwasy, wysoka przewodność cieplna i giętkość struktury decydują o jego popularności w chemii i metalurgii, przy tworzeniu różnych urządzeń i konstrukcji. Połączenie pozytywnych właściwości tego ważnego metalu jest pożądane nawet w energetyce jądrowej.
Ze względu na słabe działanie niobu z uranem przemysłowym, w stosunkowo niskich temperaturach (900°C), metal nadaje się do tworzenia warstwy ochronnej w reaktorach jądrowych. Dzięki takiej powłoce możliwe jest stosowanie chłodziw sodowych, z którymi prawie nie wchodzi w interakcję. Niob znacznie wydłuża żywotność pierwiastków uranu, tworząc na ich powierzchni tlenek ochronny przed szkodliwym działaniem pary wodnej.

Właściwości żaroodporne niektórych można poprawić poprzez dodanie stopu niobu. Stopy niobu również sprawdziły się całkiem dobrze. Na przykład jest to stop niob – cyrkon charakteryzujący się niezwykłymi właściwościami. Z takich stopów wykonane są różne części statków kosmicznych i samolotów, a także ich poszycia. Temperatura pracy takiego stopu może sięgać nawet 1200°C.
Niektóre stopy do obróbki stali zawierają węglik niobu, który poprawia właściwości stopu. Stosunkowo niewielki dodatek niobu do stali nierdzewnej zwiększa jej właściwości antykorozyjne i poprawia jakość otrzymywanych spoin. Wiele stali narzędziowych zawiera także niob. Jako kataliza, różne jego związki uczestniczą w procesach sztucznej syntezy organicznej.
Cena niobu
Główną formą sprzedaży na rynku światowym jest sztabki niobu, ale inne formy przechowywania są całkiem możliwe. Na świecie zawsze było zapotrzebowanie niob, cena które do początku 2000 roku utrzymywały się na stabilnym poziomie. Pewny wzrost popytu związany z rozwojem gospodarek wielu krajów oraz wzrost wolumenów produkcji w zakresie innowacyjnych technologii, przemysłu metalurgicznego i chemicznego przyczynił się do gwałtownego wzrostu cen do 2007 roku z 12 do 32 dolarów za kilogram metalu.

W kolejnych latach, w związku z ogólnoświatowym kryzysem w sektorze gospodarczym, aż do roku 2012 nastąpił nieznaczny spadek. Odpowiednio spadła dynamika obrotów handlowych. Jednak do 2012 r. ceny ponownie poszybowały w górę, i to nawet wtedy kup niob było to możliwe jedynie po 60 dolarów za kilogram, a wzrost jeszcze się nie zatrzymał. Kwestia równoważnych, ale bardziej dostępnych substytutów była podnoszona od dawna. I istnieją, ale ich właściwości są wyraźnie gorsze od niobu. Dlatego nadal jest w cenie.
Uralski Państwowy Uniwersytet Górniczy
Na temat: Właściwości niobu
Grupa: M-13-3
Uczeń: Mokhnashin Nikita
1. Ogólne informacje o elemencie
Właściwości fizyczne niobu
Właściwości chemiczne niobu
Niob w stanie wolnym
Tlenki niobu i ich sole
Związki niobu
Wiodące kraje w produkcji niobu
1. Ogólne informacje o elemencie
Ludzkość zna pierwiastek zajmujący 41. komórkę układu okresowego od dawna. Jego obecna nazwa, niob, jest prawie pół wieku młodsza. Tak się złożyło, że element nr 41 został dwukrotnie otwarty. Po raz pierwszy - w 1801 roku angielski naukowiec Charles Hatchet zbadał próbkę prawdziwego minerału przesłaną z Ameryki do British Museum. Z tego minerału wyizolował tlenek nieznanego wcześniej pierwiastka. Hatchet nazwał nowy pierwiastek kolumbium, zwracając w ten sposób uwagę na jego zagraniczne pochodzenie. A czarny minerał nazwano kolumbitem. Rok później szwedzki chemik Ekeberg wyizolował z kolumbitu tlenek innego nowego pierwiastka, zwanego tantalem. Podobieństwo między związkami Kolumbia i tantal było tak duże, że przez 40 lat większość chemików wierzyła, że tantal i kolumb to ten sam pierwiastek.
W 1844 roku niemiecki chemik Heinrich Rose zbadał próbki kolumbitu znalezione w Bawarii. Ponownie odkrył tlenki dwóch metali. Jednym z nich był tlenek znanego już tantalu. Tlenki były podobne i podkreślając ich podobieństwo, Rose nazwała pierwiastek tworzący drugi tlenek niobu imieniem Niobe, córki mitologicznego męczennika Tantala. Jednak Rose, podobnie jak Hatchet, nie była w stanie uzyskać tego pierwiastka w stanie wolnym. Niob metaliczny został po raz pierwszy otrzymany dopiero w 1866 roku przez szwedzkiego naukowca Blomstranda podczas redukcji chlorku niobu wodorem. Pod koniec XIX wieku. Znaleziono jeszcze dwa sposoby uzyskania tego pierwiastka. Najpierw Moissan uzyskał go w piecu elektrycznym, redukując tlenek niobu węglem, a następnie Goldschmidtowi udało się zredukować ten sam pierwiastek za pomocą aluminium. A pierwiastek nr 41 nadal był inaczej nazywany w różnych krajach: w Anglii i USA - Kolumbia, w innych krajach - niob. Międzynarodowa Unia Chemii Czystej i Stosowanej (IUPAC) położyła kres tym kontrowersjom w 1950 roku. Postanowiono zalegalizować wszędzie nazwę pierwiastka „niob”, a nazwą „kolumbit” nadano głównemu minerałowi niobu. Jego wzór to (Fe, Mn) (Nb, Ta)2 O 6.
To nie przypadek, że niob uważany jest za pierwiastek rzadki: rzeczywiście występuje rzadko i w małych ilościach, zawsze w postaci minerałów i nigdy w stanie rodzimym. Ciekawostka: w różnych publikacjach referencyjnych wartość Clarke’a (zawartość w skorupie ziemskiej) niobu jest inna. Tłumaczy się to głównie faktem, że w ostatnich latach w krajach afrykańskich odkryto nowe złoża minerałów zawierających niob. The Chemist's Handbook, tom 1 (M., Chemistry, 1963) podaje następujące liczby: 3,2 10-5% (1939), 1 10-3% (1949) i 2,4,10-3% (1954). Jednak najnowsze dane również są zaniżone: nie uwzględniono tu afrykańskich złóż odkrytych w ostatnich latach. Niemniej jednak szacuje się, że z minerałów znanych już złóż można wytopić około 1,5 miliona ton metalicznego niobu.
Właściwości fizyczne niobu
Niob to błyszczący, srebrnoszary metal.
Niob elementarny jest metalem niezwykle ogniotrwałym (2468°C) i wysokowrzącym (4927°C), bardzo odpornym na wiele agresywnych środowisk. Żadne kwasy, z wyjątkiem kwasu fluorowodorowego, nie mają na niego wpływu. Kwasy utleniające „pasywują” niob, pokrywając go ochronnym filmem tlenkowym (nr 205). Ale w wysokich temperaturach wzrasta aktywność chemiczna niobu. Jeżeli w temperaturze 150...200°C utlenia się tylko niewielka powierzchniowa warstwa metalu, to w temperaturze 900...1200°C grubość warstwy tlenku znacznie wzrasta.
Sieć krystaliczna niobu jest sześcienna skupiona na ciele i ma parametr a = 3,294 Å.
Czysty metal jest plastyczny i można go walcować na cienkie arkusze (do grubości 0,01 mm) na zimno bez wyżarzania pośredniego.
Można zauważyć takie właściwości niobu, jak wysokie temperatury topnienia i wrzenia, niższa praca elektronów w porównaniu do innych metali ogniotrwałych - wolframu i molibdenu. Ostatnia właściwość charakteryzuje zdolność do emisji elektronów (emisja elektronów), która wykorzystywana jest przy zastosowaniu niobu w technologii próżni elektrycznej. Niob ma również wysoką temperaturę przejścia do stanu nadprzewodzącego.
Gęstość 8,57 g/cm 3(20°C); T pl 2500°C; T bela 4927°C; prężność pary (w mm Hg; 1 mm Hg = 133,3 n/m 2) 1.10 -5(2194°C), 1 10 -4(2355°C), 6 10 -4(o godz pl ), 1.10-3 (2539°C).
W zwykłych temperaturach niob jest stabilny w powietrzu. Początek utleniania (odbarwienia) obserwuje się po podgrzaniu metalu do temperatury 200 - 300°C. Powyżej 500° następuje szybkie utlenianie z utworzeniem tlenku Nb2 O 5.
Przewodność cieplna w W/(m·K) w temperaturze 0°C i 600°C wynosi odpowiednio 51,4 i 56,2, a to samo w cal/(cm·s·°C) wynosi 0,125 i 0,156. Specyficzny objętościowy opór elektryczny w temperaturze 0°C 15,22 10 -8om m (15,22 10 -6om-cm). Temperatura przejścia w stan nadprzewodzący wynosi 9,25 K. Niob jest paramagnetykiem. Funkcja pracy elektronu 4,01 eV.
Czysty niob można łatwo przetwarzać pod ciśnieniem na zimno i zachowuje zadowalające właściwości mechaniczne w wysokich temperaturach. Jego wytrzymałość na rozciąganie w temperaturze 20 i 800 °C wynosi odpowiednio 342 i 312 MN/m 2, to samo w kgf/mm 234.2 i 31.2; wydłużenie względne w 20 i 800 ° C wynosi odpowiednio 19,2 i 20,7%. Twardość Brinella czystego niobu wynosi 450, techniczna 750-1800 Mn/m 2. Zanieczyszczenia niektórymi pierwiastkami, zwłaszcza wodorem, azotem, węglem i tlenem, znacznie pogarszają ciągliwość i zwiększają twardość niobu.
3. Właściwości chemiczne niobu
Niob jest szczególnie ceniony ze względu na swoją odporność na substancje nieorganiczne i organiczne.
Istnieje różnica w zachowaniu chemicznym sproszkowanego i kawałkowego metalu. Ten ostatni jest bardziej stabilny. Metale nie mają na to wpływu, nawet po podgrzaniu do wysokich temperatur. Ciekłe metale alkaliczne i ich stopy, bizmut, ołów, rtęć i cyna mogą pozostawać w kontakcie z niobem przez długi czas, nie zmieniając jego właściwości. Nawet tak silne utleniacze jak kwas nadchlorowy, woda królewska, nie wspominając o azotowym, siarkowym, solnym i wszystkich innych, nie mogą z tym nic zrobić. Roztwory alkaliczne również nie mają wpływu na niob.
Istnieją jednak trzy odczynniki, które mogą przekształcić niob metaliczny w związki chemiczne. Jednym z nich jest stop wodorotlenku metalu alkalicznego:
Nb+4NaOH+5O2 = 4NaNbO3+2H2O
Pozostałe dwa to kwas fluorowodorowy (HF) lub jego mieszanina z kwasem azotowym (HF+HNO). Tworzą się w tym przypadku kompleksy fluorkowe, których skład w dużej mierze zależy od warunków reakcji. W każdym razie pierwiastek jest częścią anionu typu 2- lub 2-.
Jeśli weźmiesz sproszkowany niob, jest on nieco bardziej aktywny. Na przykład w stopionym azotanie sodu zapala się nawet, zamieniając się w tlenek. Niob kompaktowy zaczyna się utleniać po podgrzaniu powyżej 200°C, a proszek pokrywa się warstwą tlenku już w temperaturze 150°C. Jednocześnie objawia się jedna z cudownych właściwości tego metalu - zachowuje on swoją plastyczność.
W postaci trocin po podgrzaniu powyżej 900°C spala się całkowicie do Nb2O5. Spala się energicznie w strumieniu chloru:
Nb + 5Cl2 = 2NbCl5
Po podgrzaniu reaguje z siarką. Trudno jest stopować z większością metali. Być może są tylko dwa wyjątki: żelazo, z którego powstają roztwory stałe o różnych proporcjach, i aluminium, które ma związek Al2Nb z niobem.
Jakie właściwości niobu pomagają mu oprzeć się działaniu najsilniejszych kwasów utleniających? Okazuje się, że nie dotyczy to właściwości metalu, ale właściwości jego tlenków. W kontakcie z utleniaczami na powierzchni metalu pojawia się cienka (a zatem niezauważalna), ale bardzo gęsta warstwa tlenków. Warstwa ta staje się barierą nie do pokonania na drodze utleniacza do czystej powierzchni metalu. Tylko niektóre odczynniki chemiczne, w szczególności anion fluoru, mogą przez niego przenikać. W rezultacie metal ulega zasadniczo utlenieniu, ale praktycznie skutki utleniania są niewidoczne ze względu na obecność cienkiej warstwy ochronnej. Pasywność wobec rozcieńczonego kwasu siarkowego wykorzystywana jest do stworzenia prostownika prądu przemiennego. Jest zaprojektowany prosto: płytki platynowe i niobowe zanurza się w 0,05 m roztworze kwasu siarkowego. Niob w stanie pasywowanym może przewodzić prąd, jeżeli jest elektrodą ujemną – katodą, czyli elektrony mogą przechodzić przez warstwę tlenku tylko od strony metalu. Droga elektronów z roztworu jest zamknięta. Dlatego też, gdy przez takie urządzenie przepływa prąd przemienny, przechodzi tylko jedna faza, dla której platyna jest anodą, a niob jest katodą.
metalohalogen niobowy
4. Niob w stanie wolnym
Jest tak piękny, że kiedyś próbowali zrobić z niego biżuterię: jasnoszarym kolorem niob przypomina platynę. Pomimo wysokich temperatur topnienia (2500°C) i wrzenia (4840°C) można z niego łatwo wytworzyć każdy produkt. Metal jest tak plastyczny, że można go obrabiać na zimno. Bardzo ważne jest, aby niob zachowywał swoje właściwości mechaniczne w wysokich temperaturach. To prawda, że podobnie jak w przypadku wanadu, nawet niewielkie domieszki wodoru, azotu, węgla i tlenu znacznie zmniejszają ciągliwość i zwiększają twardość. Niob staje się kruchy w temperaturach od -100 do -200°C.
Otrzymywanie niobu w ultraczystej i zwartej formie stało się możliwe dzięki zastosowaniu technologii w ostatnich latach. Cały proces technologiczny jest skomplikowany i pracochłonny. Zasadniczo dzieli się go na 4 etapy:
1.otrzymywanie koncentratu: żelazoroniobu lub ferrotantaloniobu;
.otwarcie koncentratu - przekształcenie niobu (i tantalu) w pewne nierozpuszczalne związki w celu oddzielenia go od masy koncentratu;
.oddzielanie niobu i tantalu oraz otrzymywanie ich poszczególnych związków;
.produkcja i rafinacja metali.
Pierwsze dwa etapy są dość proste i powszechne, choć pracochłonne. Stopień oddzielenia niobu i tantalu określa trzeci etap. Chęć uzyskania jak największej ilości niobu, a zwłaszcza tantalu, zmusiła nas do poszukiwania najnowocześniejszych metod separacji: selektywnej ekstrakcji, wymiany jonowej i rektyfikacji związków tych pierwiastków za pomocą halogenów. W rezultacie osobno otrzymuje się tlenek lub pentachlorki tantalu i niobu. W ostatnim etapie stosuje się redukcję węglem (sadzą) w strumieniu wodoru w temperaturze 1800°C, następnie podnosi się temperaturę do 1900°C i obniża ciśnienie. Węglik powstający w wyniku interakcji z węglem reaguje z Nb2O5:
2Nb2O5 + 5NbC = 9Nb + 5CO3,
i pojawia się proszek niobu. Jeśli w wyniku oddzielenia niobu od tantalu otrzyma się nie tlenek, ale sól, to poddaje się go działaniu metalicznego sodu w temperaturze 1000°C i otrzymuje się także niob w proszku. Dlatego podczas dalszej przemiany proszku w zwarty monolit prowadzi się przetapianie w piecu łukowym, a do otrzymania monokryształów szczególnie czystego niobu stosuje się wiązkę elektronów i stapianie strefowe.
Tlenki niobu i ich sole
Liczba związków z tlenem w niobie jest niewielka, znacznie mniejsza niż w wanadzie. Wyjaśnia to fakt, że w związkach odpowiadających stopniowi utlenienia +4, +3 i +2 niob jest wyjątkowo niestabilny. Jeśli atom tego pierwiastka zaczyna oddawać elektrony, to ma tendencję do oddawania wszystkich pięciu, aby odsłonić stabilną konfigurację elektronową.
Jeśli porównamy jony o tym samym stopniu utlenienia dwóch sąsiadów w grupie - wanadu i niobu, stwierdzimy wzrost właściwości w kierunku metali. Kwasowy charakter tlenku Nb2O5 jest zauważalnie słabszy niż tlenku wanadu (V). Po rozpuszczeniu nie tworzy kwasu. Dopiero po połączeniu z zasadami lub węglanami ujawnia swoje właściwości kwasowe:
O5 + 3Na2СО3 = 2Na3NbO4 + 3С02
Sól ta – ortonioban sodu – jest podobna do tych samych soli kwasów ortofosforowego i ortowanadowego. Jednak w przypadku fosforu i arsenu forma orto jest najbardziej stabilna, a próba uzyskania ortoniobatu w czystej postaci nie powiodła się. Kiedy stop traktuje się wodą, nie wydziela się sól Na3NbO4, ale metaniolan NaNbO3. Jest to bezbarwny, słabo rozpuszczalny drobnokrystaliczny proszek w zimnej wodzie. W związku z tym w przypadku niobu o najwyższym stopniu utlenienia bardziej stabilna jest nie orto, ale metaforma związków.
Wśród innych związków tlenku niobu (V) z tlenkami zasadowymi znane są diniobiany K4Nb2O7 przypominające pirokwasy i poliniobiany (jako cień kwasów polifosforowych i poliwanadowych) o przybliżonych wzorach K7Nb5O16.nH2O i K8Nb6O19.mH2O. Wspomniane sole, odpowiadające wyższemu tlenkowi niobu, zawierają ten pierwiastek w ramach anionu. Kształt tych soli pozwala uznać je za pochodne niobu. kwasy Kwasów tych nie można otrzymać w czystej postaci, gdyż można je raczej uznać za tlenki związane z cząsteczkami wody. Na przykład forma meta to Nb2O5. H2O, a forma orgo to Nb2O5. 3H2O. Oprócz tego rodzaju związków niob ma inne, w których jest już częścią kationu. Niob nie tworzy prostych soli takich jak siarczany, azotany itp. Podczas interakcji z wodorosiarczanem sodu NaHSO4 lub tlenkiem azotu N2O4 pojawiają się substancje o złożonym kationie: Nb2O2(SO4)3. Kationy w tych solach przypominają kation wanadu z tą tylko różnicą, że tutaj jon jest pięciokrotnie naładowany, a wanad ma stopień utlenienia cztery w jonie wanadylowym. Ten sam kation NbO3+ jest zawarty w składzie niektórych soli złożonych. Tlenek Nb2O5 dość łatwo rozpuszcza się w wodnym roztworze kwasu fluorowodorowego. Z takich roztworów można wyodrębnić sól kompleksową K2. H2O.
Na podstawie rozważonych reakcji możemy stwierdzić, że niob na najwyższym stopniu utlenienia może wchodzić w skład zarówno anionów, jak i kationów. Oznacza to, że pięciowartościowy niob jest amfoteryczny, ale nadal ze znaczną przewagą właściwości kwasowych.
Istnieje kilka sposobów otrzymywania Nb2O5. Po pierwsze, interakcja niobu z tlenem po podgrzaniu. Po drugie, kalcynacja soli niobu w powietrzu: siarczków, azotków lub węglików. Po trzecie, najczęstszą metodą jest odwodnienie hydratów. Uwodniony tlenek Nb2O5 wytrąca się z wodnych roztworów soli stężonymi kwasami. xH2O. Następnie po rozcieńczeniu roztworów tworzy się osad białego tlenku. Odwadnianiu osadu Nb2O5 xH2O towarzyszy wydzielanie ciepła. Cała masa się nagrzewa. Dzieje się tak na skutek przemiany bezpostaciowego tlenku w postać krystaliczną. Tlenek niobu występuje w dwóch kolorach. W normalnych warunkach jest biały, ale po podgrzaniu zmienia kolor na żółty. Jednak gdy tylko tlenek ostygnie, kolor znika. Tlenek jest ogniotrwały (tmelt = 1460°C) i nielotny.
Niższe stopnie utlenienia niobu odpowiadają NbO2 i NbO. Pierwszy z nich to czarny proszek z niebieskim odcieniem. NbO2 otrzymuje się z Nb2O5 poprzez usunięcie tlenu magnezem lub wodorem w temperaturze około tysiąca stopni:
O5 + H2 = 2NbO2 + H2O
W powietrzu związek ten łatwo przekształca się z powrotem w wyższy tlenek Nb2O5. Jego charakter jest raczej tajemniczy, ponieważ tlenek jest nierozpuszczalny ani w wodzie, ani w kwasach. Jednak przypisuje się mu charakter kwaśny na podstawie jego interakcji z gorącymi wodnymi zasadami; jednak w tym przypadku utlenianie zachodzi do jonu pięcionaładowanego.
Wydawałoby się, że różnica jednego elektronu nie jest tak duża, ale w przeciwieństwie do Nb2O5 tlenek NbO2 przewodzi prąd elektryczny. Oczywiście w tym związku występuje wiązanie metal-metal. Jeśli skorzystasz z tej właściwości, to po podgrzaniu silnym prądem przemiennym możesz zmusić NbO2 do oddania tlenu.
Kiedy tracimy tlen, NbO2 zamienia się w tlenek NbO, a następnie cały tlen jest dość szybko oddzielany. Niewiele wiadomo na temat niższego tlenku niobu NbO. Ma metaliczny połysk i wyglądem przypomina metal. Doskonale przewodzi prąd. Jednym słowem zachowuje się tak jakby w jego składzie w ogóle nie było tlenu. Nawet, jak typowy metal, po podgrzaniu gwałtownie reaguje z chlorem i zamienia się w tlenochlorek:
2NbO + 3Cl2=2NbOCl3
Wypiera wodór z kwasu solnego (jakby to w ogóle nie był tlenek, tylko metal taki jak cynk):
NbO + 6HCl = 2NbOCl3 + 3H2
NbO można otrzymać w czystej postaci poprzez kalcynację wspomnianej już soli kompleksowej K2 metalicznym sodem:
K2 + 3Na = NbO + 2KF + 3NaF
Tlenek NbO ma najwyższą temperaturę topnienia ze wszystkich tlenków niobu, 1935°C. Aby oczyścić niob z tlenu, temperaturę podnosi się do 2300 - 2350°C, po czym jednocześnie z parowaniem NbO rozkłada się na tlen i metal. Następuje rafinacja (oczyszczanie) metalu.
Związki niobu
Opowieść o pierwiastku nie byłaby kompletna bez wspomnienia jego związków z halogenami, węglikami i azotkami. Jest to ważne z dwóch powodów. Po pierwsze, dzięki kompleksom fluorkowym możliwe jest oddzielenie niobu od jego odwiecznego towarzysza tantalu. Po drugie, związki te ujawniają nam właściwości niobu jako metalu.
Oddziaływanie halogenów z niobem metalicznym:
Można otrzymać Nb + 5Cl2 = 2NbCl5, wszystkie możliwe pięciohalogenki niobu.
Pentafluorek NbF5 (stopień = 76 °C) jest bezbarwny w stanie ciekłym i w postaci pary. Podobnie jak pięciofluorek wanadu, w stanie ciekłym jest polimeryczny. Atomy niobu są połączone ze sobą poprzez atomy fluoru. W postaci stałej ma strukturę składającą się z czterech cząsteczek (ryc. 2).
Ryż. 2. Struktura NbF5 i TaF5 w postaci stałej składa się z czterech cząsteczek.
Roztwory kwasu fluorowodorowego H2F2 zawierają różne jony złożone:
H2F2 = H2 ;+ H2O = H2
Sól potasowa K2. H2O odgrywa ważną rolę w oddzielaniu niobu od tantalu, ponieważ w przeciwieństwie do soli tantalu jest wysoce rozpuszczalny.
Pozostałe pentahalogenki niobu są jaskrawo zabarwione: NbCl5 żółty, NbBr5 fioletowo-czerwony, NbI2 brązowy. Wszystkie sublimują bez rozkładu w atmosferze odpowiedniego halogenu; w parach są monomerami. Ich temperatury topnienia i wrzenia rosną przy przejściu z chloru do bromu i jodu. Niektóre z metod wytwarzania pentahalogenków to:
2Nb+5I2 2NbI5;O5+5C+5Cl22NbCl5+5CO;.
2NbCl5+5F22NbF5+5Cl2
Pentahalogenki dobrze rozpuszczają się w rozpuszczalnikach organicznych: eterze, chloroformie, alkoholu. Ulegają jednak całkowitemu rozkładowi pod wpływem wody – hydrolizują. W wyniku hydrolizy otrzymuje się dwa kwasy – kwas halogenowodorowy i kwas niobowy. Na przykład,
4H2O = 5HCl + H3NbO4
Gdy hydroliza jest niepożądana, wprowadza się trochę mocnego kwasu i równowaga procesu opisanego powyżej przesuwa się w stronę NbCl5. W tym przypadku pentahalogenek rozpuszcza się bez hydrolizy,
Węglik niobu zyskał szczególną wdzięczność metalurgów. W każdej stali jest węgiel; niob, wiążąc go w węglik, poprawia jakość stali stopowej. Zwykle podczas spawania stali nierdzewnej spoina ma mniejszą wytrzymałość. Wprowadzenie niobu w ilości 200 g na tonę pomaga skorygować ten niedobór. Po podgrzaniu niob, przed wszystkimi innymi metalami stalowymi, tworzy związek z węglem - węglikiem. Mieszanka ta jest dość plastyczna i jednocześnie wytrzymuje temperatury do 3500°C. Już warstwa węglika o grubości zaledwie pół milimetra chroni metale i, co szczególnie cenne, grafit przed korozją. Węglik można otrzymać przez ogrzewanie tlenku metalu lub niobu (V) z węglem lub gazami zawierającymi węgiel (CH4, CO).
Azotek niobu to związek, na który po ugotowaniu nie mają wpływu żadne kwasy, a nawet „wódka królewska”; odporny na wodę. Jedyną rzeczą, z którą można go zmusić do interakcji, jest wrząca zasada. W tym przypadku rozkłada się, uwalniając amoniak.
Azotek NbN jest jasnoszary z żółtawym odcieniem. Jest ogniotrwały (temp. t. 2300°C), ma niezwykłą cechę – w temperaturze bliskiej zera absolutnego (15,6 K, czyli -267,4°C) wykazuje nadprzewodnictwo.
Spośród związków zawierających niob na niższym stopniu utlenienia najlepiej znane są halogenki. Wszystkie niższe halogenki są ciemnymi krystalicznymi ciałami stałymi (od ciemnoczerwonego do czarnego). Ich stabilność maleje wraz ze spadkiem stopnia utlenienia metalu.
Zastosowanie niobu w różnych gałęziach przemysłu
Zastosowanie niobu do tworzenia stopów metali
Stal stopowa niobu ma dobrą odporność na korozję. Chrom zwiększa również odporność stali na korozję, a jest znacznie tańszy niż niob. Czytelnik ten ma jednocześnie rację i nie ma racji. Jestem w błędzie, bo zapomniałem o jednej rzeczy.
Stal chromowo-niklowa, jak każda inna, zawsze zawiera węgiel. Ale węgiel łączy się z chromem, tworząc węglik, który sprawia, że stal jest bardziej krucha. Niob ma większe powinowactwo do węgla niż chrom. Dlatego po dodaniu niobu do stali koniecznie powstaje węglik niobu. Stal stopowa z niobem uzyskuje wysokie właściwości antykorozyjne i nie traci swojej ciągliwości. Pożądany efekt osiąga się, gdy do tony stali doda się zaledwie 200 g niobu metalicznego. Niob nadaje stali chromowo-manganowej wysoką odporność na zużycie.
Wiele metali nieżelaznych jest również stopowych z niobem. Zatem aluminium, które łatwo rozpuszcza się w zasadach, nie reaguje z nimi, jeśli doda się do niego tylko 0,05% niobu. A miedź, znana ze swojej miękkości, i wiele jej stopów wydaje się być utwardzanych niobem. Zwiększa wytrzymałość metali takich jak tytan, molibden, cyrkon, a jednocześnie zwiększa ich żaroodporność i żaroodporność.
Obecnie właściwości i możliwości niobu docenia lotnictwo, inżynieria mechaniczna, radiotechnika, przemysł chemiczny i energetyka jądrowa. Wszyscy stali się konsumentami niobu.
Unikalna właściwość - brak zauważalnych oddziaływań niobu z uranem w temperaturach do 1100°C, a ponadto dobra przewodność cieplna, mały przekrój efektywnej absorpcji neutronów termicznych - uczyniła z niobu poważnego konkurenta dla metali uznawanych w nuklearnej przemysł - aluminium, beryl i cyrkon. Ponadto sztuczna (indukowana) radioaktywność niobu jest niska. Można z niego zatem wykonywać pojemniki do przechowywania odpadów promieniotwórczych lub instalacje do ich wykorzystania.
Przemysł chemiczny zużywa stosunkowo mało niobu, ale można to wytłumaczyć jedynie jego niedoborem. Sprzęt do produkcji kwasów o wysokiej czystości jest czasami wykonany ze stopów zawierających niob, a rzadziej z niobu arkuszowego. Zdolność niobu do wpływania na szybkość niektórych reakcji chemicznych wykorzystuje się np. w syntezie alkoholu z butadienu.
Technologia rakietowa i kosmiczna również stały się konsumentami pierwiastka nr 41. Nie jest tajemnicą, że pewne ilości tego pierwiastka krążą już po orbitach bliskich Ziemi. Niektóre części rakiet i wyposażenie pokładowe sztucznych satelitów Ziemi wykonane są ze stopów zawierających niob i czystego niobu.
Zastosowania niobu w innych gałęziach przemysłu
„Gorące elementy” (tj. części podgrzewane) wykonane są z arkuszy i prętów niobu - anod, siatek, katod ogrzewanych pośrednio i innych części lamp elektronicznych, zwłaszcza lamp generatorowych o dużej mocy.
Oprócz czystego metalu do tych samych celów stosuje się stopy tantalonu i bium.
Niob był używany do produkcji kondensatorów elektrolitycznych i prostowników prądu. Wykorzystuje się tutaj zdolność niobu do tworzenia stabilnej warstwy tlenkowej podczas utleniania anodowego. Warstwa tlenkowa jest stabilna w kwaśnych elektrolitach i przepuszcza prąd tylko w kierunku od elektrolitu do metalu. Kondensatory niobowe z elektrolitem stałym charakteryzują się dużą pojemnością przy małych gabarytach i dużej rezystancji izolacji.
Elementy kondensatorów niobowych wykonane są z cienkiej folii lub porowatych płytek sprasowanych z proszków metali.
Odporność na korozję niobu w kwasach i innych mediach, w połączeniu z wysoką przewodnością cieplną i ciągliwością, czynią go cennym materiałem konstrukcyjnym do urządzeń w przemyśle chemicznym i metalurgicznym. Niob posiada kombinację właściwości spełniających wymagania energii jądrowej dla materiałów konstrukcyjnych.
Do temperatury 900°C niob słabo oddziałuje z uranem i nadaje się do produkcji płaszczy ochronnych uranowych elementów paliwowych reaktorów energetycznych. Można w tym przypadku zastosować chłodziwa ciekłe metaliczne: sodowe lub stop sodu i potasu, z którymi niob nie oddziałuje do temperatury 600°C. Aby zwiększyć przeżywalność uranowych elementów paliwowych, uran domieszkuje się niobem (~ 7% niobu). Dodatek niobu stabilizuje ochronny film tlenkowy na uranie, co zwiększa jego odporność na parę wodną.
Niob jest składnikiem różnych żaroodpornych stopów do turbin gazowych silników odrzutowych. Dodawanie stopu molibdenu, tytanu, cyrkonu, aluminium i miedzi z niobem radykalnie poprawia właściwości tych metali, a także ich stopów. Istnieją żaroodporne stopy na bazie niobu jako materiał konstrukcyjny części silników odrzutowych i rakiet (produkcja łopatek turbin, krawędzi natarcia skrzydeł, końcówek czołowych samolotów i rakiet, poszycia rakiet). Niob i stopy na jego bazie można stosować w temperaturach roboczych 1000 - 1200°C.
Węglik niobu jest składnikiem niektórych gatunków węglika wolframu stosowanych do skrawania stali.
Niob jest szeroko stosowany jako dodatek stopowy do stali. Dodatek niobu w ilości od 6 do 10 razy większej niż zawartość węgla w stali eliminuje korozję międzykrystaliczną stali nierdzewnej i chroni spoiny przed zniszczeniem.
Niob dodawany jest także do różnych stali żaroodpornych (na przykład do turbin gazowych), a także do stali narzędziowych i magnetycznych.
Niob wprowadza się do stali w stopie z żelazem (ferroniobem), zawierającym do 60% Nb. Ponadto w żelazostopie stosuje się ferrotantaloniob w różnych proporcjach tantalu i niobu.
W syntezie organicznej jako katalizatory stosuje się niektóre związki niobu (kompleksowe sole fluorkowe, tlenki).
Zastosowanie i produkcja niobu szybko rośnie, co wynika z połączenia takich właściwości jak ogniotrwałość, mały przekrój poprzeczny do wychwytu neutronów termicznych, zdolność do tworzenia stopów żaroodpornych, nadprzewodzących i innych, odporność na korozję, właściwości gettera, niska funkcja pracy elektronów, dobra urabialność pod niskim ciśnieniem i spawalność. Główne obszary zastosowań niobu to: rakieta, lotnictwo i technologia kosmiczna, radiotechnika, elektronika, inżynieria chemiczna, energia jądrowa.
Zastosowania niobu metalicznego
Części samolotów są wykonane z czystego niobu lub jego stopów; okładziny elementów paliwowych uranowych i plutonowych; pojemniki i rury; do metali ciekłych; części kondensatorów elektrolitycznych; „gorące” oprawy do lamp elektronicznych (do instalacji radarowych) i mocnych lamp generatorowych (anody, katody, siatki itp.); sprzęt odporny na korozję w przemyśle chemicznym.
Inne metale nieżelazne, w tym uran, są stopowe z niobem.
Niob stosowany jest w kriotronach – nadprzewodzących elementach komputerów. Niob jest również znany ze swojego zastosowania w strukturach przyspieszających Wielkiego Zderzacza Hadronów.
Związki międzymetaliczne i stopy niobu
Do produkcji elektrozaworów nadprzewodzących wykorzystuje się cyniczek Nb3Sn oraz stopy niobu z tytanem i cyrkonem.
Niob i stopy z tantalem w wielu przypadkach zastępują tantal, co daje świetny efekt ekonomiczny (niob jest tańszy i prawie dwukrotnie lżejszy od tantalu).
Żelazoniob wprowadza się do nierdzewnych stali chromowo-niklowych w celu zapobiegania ich korozji i zniszczeniu międzykrystalicznym oraz do innych rodzajów stali w celu poprawy ich właściwości.
Niob jest używany do bicia monet kolekcjonerskich. W związku z tym Bank Łotwy twierdzi, że w monetach kolekcjonerskich 1 łata stosuje się niob wraz ze srebrem.
Zastosowanie katalizatora związków niobu O5 w przemyśle chemicznym;
w produkcji materiałów ogniotrwałych, cermetali, materiałów specjalnych. szkło, azotek, węglik, niobiany.
Węglik niobu (t.t. 3480 °C) stopiony z węglikiem cyrkonu i węglikiem uranu-235 jest najważniejszym materiałem konstrukcyjnym prętów paliwowych jądrowych silników odrzutowych na fazę stałą.
Azotek niobu NbN służy do wytwarzania cienkich i ultracienkich warstw nadprzewodzących o temperaturze krytycznej od 5 do 10 K z wąskim przejściem rzędu 0,1 K
Niob w medycynie
Wysoka odporność korozyjna niobu umożliwiła jego zastosowanie w medycynie. Nici niobowe nie powodują podrażnień żywej tkanki i dobrze się do niej przylegają. Chirurgia rekonstrukcyjna z powodzeniem wykorzystuje takie nici do zszywania podartych ścięgien, naczyń krwionośnych, a nawet nerwów.
Zastosowanie w biżuterii
Niob ma nie tylko zestaw właściwości niezbędnych dla technologii, ale także wygląda całkiem pięknie. Jubilerzy próbowali wykorzystać ten biały, błyszczący metal do produkcji kopert zegarków. Stopy niobu z wolframem lub renem czasami zastępują metale szlachetne: złoto, platynę, iryd. To ostatnie jest szczególnie ważne, ponieważ stop niobu z renem jest nie tylko zewnętrznie podobny do metalicznego irydu, ale jest prawie tak samo odporny na zużycie. Pozwoliło to niektórym krajom zrezygnować z drogiego irydu w produkcji grotów lutowniczych do stalówek piór wiecznych.
Wydobycie niobu w Rosji
W ostatnich latach światowa produkcja niobu kształtuje się na poziomie 24-29 tys. ton. Należy zauważyć, że światowy rynek niobu jest w znacznym stopniu zmonopolizowany przez brazylijską firmę SVMM, na którą przypada około 85% światowej produkcji niobu.
Głównym konsumentem produktów zawierających niob (dotyczy to przede wszystkim żelazoroniobu) jest Japonia. Kraj ten importuje rocznie z Brazylii ponad 4 tysiące ton żelazoroniobu. Dlatego też japońskie ceny importowe produktów zawierających niob można z dużą pewnością przyjąć jako zbliżone do średniej światowej. W ostatnich latach można zaobserwować tendencję wzrostową cen żelazoroniobu. Wynika to z rosnącego jego wykorzystania do produkcji stali niskostopowych przeznaczonych głównie na rurociągi naftowe i gazowe. Ogólnie należy zauważyć, że w ciągu ostatnich 15 lat światowe zużycie niobu wzrastało średnio o 4-5% rocznie.
Z żalem musimy przyznać, że Rosja znajduje się na uboczu rynku niobu. Według specjalistów Giredmet na początku lat 90. na terenie byłego ZSRR wyprodukowano i zużyto około 2 tys. ton niobu (w przeliczeniu na tlenek niobu). Obecnie zużycie produktów niobowych przez przemysł rosyjski nie przekracza zaledwie 100 - 200 ton. Należy zauważyć, że na terenie byłego ZSRR powstały znaczne moce produkcyjne niobu, rozproszone w różnych republikach - Rosji, Estonii, Kazachstanie. Ta tradycyjna cecha rozwoju przemysłu w ZSRR postawiła obecnie Rosję w bardzo trudnej sytuacji w zakresie wielu rodzajów surowców i metali. Rynek niobu rozpoczyna się od produkcji surowców zawierających niob. Jego głównym rodzajem w Rosji był i pozostaje koncentrat loparytu produkowany w Lovozersky GOK (obecnie Sevredmet JSC, obwód murmański). Przed rozpadem ZSRR przedsiębiorstwo wyprodukowało około 23 tys. ton koncentratu loparytu (zawartość tlenku niobu wynosi około 8,5%). Następnie w latach 1996-1998 produkcja koncentratów systematycznie malała. Firma kilkakrotnie zatrzymywała się z powodu braku sprzedaży. Obecnie szacuje się, że produkcja koncentratu loparytu w przedsiębiorstwie kształtuje się na poziomie 700 - 800 ton miesięcznie.
Należy zauważyć, że przedsiębiorstwo jest dość ściśle powiązane ze swoim jedynym konsumentem - fabryką magnezu w Solikamsku. Faktem jest, że koncentrat loparytu jest dość specyficznym produktem, uzyskiwanym wyłącznie w Rosji. Technologia jego przetwarzania jest dość skomplikowana ze względu na zawarty w nim kompleks metali rzadkich (niob, tantal, tytan). Ponadto koncentrat jest radioaktywny, dlatego w dużej mierze wszelkie próby wejścia tego produktu na rynek światowy kończyły się fiaskiem. Należy również zaznaczyć, że z koncentratu loparytu nie można otrzymać ferroniobu. W 2000 roku w zakładzie Sevredmet firma Rosredmet uruchomiła eksperymentalną instalację do przerobu koncentratu loparytu w celu wytworzenia m.in. handlowych wyrobów zawierających niob (tlenku niobu).
Głównymi rynkami zbytu produktów niobowych SMZ są kraje spoza WNP: dostawy realizowane są do USA, Japonii i krajów europejskich. Udział eksportu w całkowitej produkcji wynosi ponad 90%. Znaczące moce produkcyjne niobu w ZSRR skoncentrowane były w Estonii – w Stowarzyszeniu Produkcji Chemicznej i Metalurgicznej Sillamae (Sillamae). Teraz estońska firma nazywa się Silmet. W czasach sowieckich przedsiębiorstwo przetwarzało koncentrat loparytu z zakładu wydobywczo-przetwórczego w Łowooziersku, od 1992 r. jego wysyłka została wstrzymana; Obecnie Silmet przetwarza jedynie niewielką ilość wodorotlenku niobu z zakładów magnezu w Solikamsku. Obecnie firma otrzymuje większość surowców zawierających niob z Brazylii i Nigerii. Kierownictwo przedsiębiorstwa nie wyklucza dostaw koncentratu loparytu, jednakże Sevredmet stara się prowadzić politykę jego lokalnego przetwarzania, gdyż eksport surowców jest mniej opłacalny niż gotowych produktów.
Korepetycje
Potrzebujesz pomocy w studiowaniu jakiegoś tematu?
Nasi specjaliści doradzą lub zapewnią korepetycje z interesujących Cię tematów.
Prześlij swoją aplikację wskazując temat już teraz, aby dowiedzieć się o możliwości uzyskania konsultacji.
Istnieje dość duża liczba pierwiastków, które w połączeniu z innymi substancjami tworzą stopy o specjalnych właściwościach użytkowych. Przykładem jest niob, pierwiastek, który początkowo nazywany był „kolumbem” (od nazwy rzeki, w której został po raz pierwszy znaleziony), ale później zmieniono jego nazwę. Niob to metal o dość nietypowych właściwościach, które omówimy bardziej szczegółowo później.
Zdobycie elementu
Rozważając właściwości niobu, należy zauważyć, że zawartość tego metalu w tonie skały jest stosunkowo niewielka i wynosi około 18 gramów. Dlatego po jego odkryciu podjęto sporo prób sztucznego pozyskania metalu. Ze względu na podobny skład chemiczny substancję tę często wydobywa się razem z tantalem.
Złoża niobu znajdują się niemal na całym świecie. Przykładem są kopalnie w Kongo, Rwandzie, Brazylii i wielu innych krajach. Jednak pierwiastka tego nie można nazwać powszechnym; w wielu regionach praktycznie nie występuje nawet w niskich stężeniach.
Stosunkowo niewielkie stężenie substancji w skale ziemskiej pogarszają trudności napotykane przy jej otrzymywaniu z koncentratu. Warto wziąć pod uwagę, że niob NBS można otrzymać wyłącznie ze skał nasyconych tantalem. Poniżej przedstawiono cechy procesu produkcyjnego:
- Na początek do zakładu dostarczana jest skoncentrowana ruda, która przechodzi kilka etapów oczyszczania. Podczas produkcji niobu powstałą rudę rozdziela się na czyste pierwiastki, w tym tantal.
- Końcowy proces przetwarzania obejmuje rafinację metalu.
Pomimo trudności napotykanych przy wydobyciu i przeróbce omawianej rudy, z roku na rok wielkość produkcji omawianego stopu znacznie wzrasta. Wynika to z faktu, że metal ma wyjątkowe właściwości użytkowe i jest szeroko stosowany w wielu różnych gałęziach przemysłu.
Tlenki niobu
Dany pierwiastek chemiczny może stać się podstawą różnych związków. Najpopularniejszym jest pięciotlenek niobu. Wśród cech tego połączenia można zauważyć następujące punkty:
- Tlenek niobu jest białym, krystalicznym proszkiem o kremowym zabarwieniu.
- Substancja nie rozpuszcza się w wodzie.
- Powstała substancja zachowuje swoją strukturę po zmieszaniu z większością kwasów.
Cechy pięciotlenku niobu obejmują również następujące właściwości:
- Zwiększona siła.
- Wysoka ogniotrwałość. Substancja wytrzymuje temperatury do 1490 stopni Celsjusza.
- Po podgrzaniu powierzchnia utlenia się.
- Reaguje z chlorem i może być redukowany przez wodór.
Wodorotlenek niobu jest najczęściej używany do produkcji gatunków stali wysokostopowych, które charakteryzują się dość atrakcyjnymi właściwościami użytkowymi.
Fizyczne i chemiczne właściwości
Niob ma właściwości chemiczne podobne do tantalu. Rozważając główne cechy niobu, należy zwrócić uwagę na następujące punkty:
- Odporny na różnego rodzaju korozję. Stopy otrzymane poprzez wprowadzenie tego pierwiastka do kompozycji charakteryzują się wysokimi właściwościami antykorozyjnymi.
- Omawiany pierwiastek chemiczny ma wysoką temperaturę topnienia. Jak pokazuje praktyka, większość stopów ma temperaturę topnienia przekraczającą 1400 stopni Celsjusza. komplikuje to proces przetwarzania, ale sprawia, że metale są niezbędne w różnych dziedzinach działalności.
- Podstawowe właściwości fizyczne charakteryzują się także łatwością spawania powstałych stopów.
- W ujemnych temperaturach struktura elementu pozostaje praktycznie niezmieniona, co pozwala zachować właściwości użytkowe metalu.
- Specjalna budowa atomu niobu decyduje o właściwościach nadprzewodzących materiału.
- Masa atomowa wynosi 92,9, wartościowość zależy od charakterystyki kompozycji.
Główną zaletą substancji jest jej ogniotrwałość. Dlatego zaczęto go stosować w wielu różnych gałęziach przemysłu. Substancja topi się w temperaturze około 2500 stopni Celsjusza. Niektóre stopy topią się nawet w rekordowej temperaturze 4500 stopni Celsjusza. Gęstość substancji jest dość wysoka i wynosi 8,57 gramów na centymetr sześcienny. Warto wziąć pod uwagę, że metal charakteryzuje się paramagnetycznością.
Następujące kwasy nie wpływają na sieć krystaliczną:
- siarkowy;
- sól;
- fosfor;
- chlor
Nie wpływa na metale i wodne roztwory chloru. Przy pewnym uderzeniu w metal na jego powierzchni tworzy się warstwa tlenku dielektrycznego. Dlatego metal zaczęto wykorzystywać do produkcji miniaturowych kondensatorów o dużej pojemności, które również są wykonane z droższego tantalu.
Zastosowania niobu
Wytwarzana jest szeroka gama produktów niobowych, z których większość jest związana z produkcją samolotów. Przykładem jest zastosowanie niobu do produkcji części instalowanych podczas montażu rakiet lub samolotów. Ponadto można wyróżnić następujące zastosowania tego pierwiastka:
- Produkcja elementów z których wykonywane są instalacje radarowe.
- Jak już wspomniano, stop ten może być stosowany do produkcji tańszych pojemnościowych kondensatorów elektrycznych.
- Z omawianego elementu powstają także katody i anody z folii, co wiąże się z dużą wytrzymałością cieplną.
- Często można znaleźć projekty potężnych lamp generatorowych, które mają wewnątrz siatkę. Aby siatka ta wytrzymała wysokie temperatury, jest wykonana z danego stopu.
Wysokie właściwości fizyczne i chemiczne determinują zastosowanie niobu w produkcji rur do transportu ciekłych metali. Ponadto stopy są wykorzystywane do produkcji pojemników do różnorodnych celów.
Stopy z niobem
Rozważając tego typu stopy należy wziąć pod uwagę, że pierwiastek ten jest często wykorzystywany do produkcji żelazoroniobu. Materiał ten znajduje szerokie zastosowanie w przemyśle odlewniczym, a także przy produkcji powłok elektronicznych. Zawiera:
- żelazo;
- niob z tantalem;
- krzem;
- aluminium;
- węgiel;
- siarka;
- fosfor;
- tytan.
Stężenie głównych pierwiastków może zmieniać się w dość szerokim zakresie, co decyduje o wydajności materiału.
Alternatywny stop żelazoroniobu można nazwać niobem 5VMC. Przy jego produkcji jako pierwiastki stopowe stosuje się wolfram, cyrkon i molibden. W większości przypadków żywica ta wykorzystywana jest do produkcji półproduktów.
Podsumowując, zauważamy, że w niektórych krajach do produkcji monet wykorzystuje się niob. Wynika to z dość wysokiego kosztu materiału. Dzięki masowej produkcji stopów zawierających niob jako główny pierwiastek powstają unikalne wlewki.
Zastosowanie niobu do tworzenia stopów metali
Stal stopowa niobu ma dobrą odporność na korozję. Chrom zwiększa również odporność stali na korozję, a jest znacznie tańszy niż niob. Czytelnik ten ma jednocześnie rację i nie ma racji. Jestem w błędzie, bo zapomniałem o jednej rzeczy.
Stal chromowo-niklowa, jak każda inna, zawsze zawiera węgiel. Ale węgiel łączy się z chromem, tworząc węglik, który sprawia, że stal jest bardziej krucha. Niob ma większe powinowactwo do węgla niż chrom. Dlatego po dodaniu niobu do stali koniecznie powstaje węglik niobu. Stal stopowa z niobem uzyskuje wysokie właściwości antykorozyjne i nie traci swojej ciągliwości. Pożądany efekt osiąga się, gdy do tony stali doda się zaledwie 200 g niobu metalicznego. Niob nadaje stali chromowo-manganowej wysoką odporność na zużycie.
Wiele metali nieżelaznych jest również stopowych z niobem. Zatem aluminium, które łatwo rozpuszcza się w zasadach, nie reaguje z nimi, jeśli doda się do niego tylko 0,05% niobu. A miedź, znana ze swojej miękkości, i wiele jej stopów wydaje się być utwardzanych niobem. Zwiększa wytrzymałość metali takich jak tytan, molibden, cyrkon, a jednocześnie zwiększa ich żaroodporność i żaroodporność.
Obecnie właściwości i możliwości niobu docenia lotnictwo, inżynieria mechaniczna, radiotechnika, przemysł chemiczny i energetyka jądrowa. Wszyscy stali się konsumentami niobu.
Unikalna właściwość - brak zauważalnych oddziaływań niobu z uranem w temperaturach do 1100°C, a ponadto dobra przewodność cieplna, mały przekrój efektywnej absorpcji neutronów termicznych - uczyniła z niobu poważnego konkurenta dla metali uznawanych w nuklearnej przemysł - aluminium, beryl i cyrkon. Ponadto sztuczna (indukowana) radioaktywność niobu jest niska. Można z niego zatem wykonywać pojemniki do przechowywania odpadów promieniotwórczych lub instalacje do ich wykorzystania.
Przemysł chemiczny zużywa stosunkowo mało niobu, ale można to wytłumaczyć jedynie jego niedoborem. Sprzęt do produkcji kwasów o wysokiej czystości jest czasami wykonany ze stopów zawierających niob, a rzadziej z niobu arkuszowego. Zdolność niobu do wpływania na szybkość niektórych reakcji chemicznych wykorzystuje się np. w syntezie alkoholu z butadienu.
Technologia rakietowa i kosmiczna również stały się konsumentami pierwiastka nr 41. Nie jest tajemnicą, że pewne ilości tego pierwiastka krążą już po orbitach bliskich Ziemi. Niektóre części rakiet i wyposażenie pokładowe sztucznych satelitów Ziemi wykonane są ze stopów zawierających niob i czystego niobu.
Zastosowania niobu w innych gałęziach przemysłu
„Gorące elementy” (tj. części podgrzewane) wykonane są z arkuszy i prętów niobu - anod, siatek, katod ogrzewanych pośrednio i innych części lamp elektronicznych, zwłaszcza lamp generatorowych o dużej mocy.
Oprócz czystego metalu do tych samych celów stosuje się stopy tantalonu i bium.
Niob był używany do produkcji kondensatorów elektrolitycznych i prostowników prądu. Wykorzystuje się tutaj zdolność niobu do tworzenia stabilnej warstwy tlenkowej podczas utleniania anodowego. Warstwa tlenkowa jest stabilna w kwaśnych elektrolitach i przepuszcza prąd tylko w kierunku od elektrolitu do metalu. Kondensatory niobowe z elektrolitem stałym charakteryzują się dużą pojemnością przy małych gabarytach i dużej rezystancji izolacji.
Elementy kondensatorów niobowych wykonane są z cienkiej folii lub porowatych płytek sprasowanych z proszków metali.
Odporność na korozję niobu w kwasach i innych mediach, w połączeniu z wysoką przewodnością cieplną i ciągliwością, czynią go cennym materiałem konstrukcyjnym do urządzeń w przemyśle chemicznym i metalurgicznym. Niob posiada kombinację właściwości spełniających wymagania energii jądrowej dla materiałów konstrukcyjnych.
Do temperatury 900°C niob słabo oddziałuje z uranem i nadaje się do produkcji płaszczy ochronnych uranowych elementów paliwowych reaktorów energetycznych. Można w tym przypadku zastosować chłodziwa ciekłe metaliczne: sodowe lub stop sodu i potasu, z którymi niob nie oddziałuje do temperatury 600°C. Aby zwiększyć przeżywalność uranowych elementów paliwowych, uran domieszkuje się niobem (~ 7% niobu). Dodatek niobu stabilizuje ochronny film tlenkowy na uranie, co zwiększa jego odporność na parę wodną.
Niob jest składnikiem różnych żaroodpornych stopów do turbin gazowych silników odrzutowych. Dodawanie stopu molibdenu, tytanu, cyrkonu, aluminium i miedzi z niobem radykalnie poprawia właściwości tych metali, a także ich stopów. Istnieją żaroodporne stopy na bazie niobu jako materiał konstrukcyjny części silników odrzutowych i rakiet (produkcja łopatek turbin, krawędzi natarcia skrzydeł, końcówek czołowych samolotów i rakiet, poszycia rakiet). Niob i stopy na jego bazie można stosować w temperaturach roboczych 1000 - 1200°C.
Węglik niobu jest składnikiem niektórych gatunków węglika wolframu stosowanych do skrawania stali.
Niob jest szeroko stosowany jako dodatek stopowy do stali. Dodatek niobu w ilości od 6 do 10 razy większej niż zawartość węgla w stali eliminuje korozję międzykrystaliczną stali nierdzewnej i chroni spoiny przed zniszczeniem.
Niob dodawany jest także do różnych stali żaroodpornych (na przykład do turbin gazowych), a także do stali narzędziowych i magnetycznych.
Niob wprowadza się do stali w stopie z żelazem (ferroniobem), zawierającym do 60% Nb. Ponadto w żelazostopie stosuje się ferrotantaloniob w różnych proporcjach tantalu i niobu.
W syntezie organicznej jako katalizatory stosuje się niektóre związki niobu (kompleksowe sole fluorkowe, tlenki).
Zastosowanie i produkcja niobu szybko rośnie, co wynika z połączenia takich właściwości jak ogniotrwałość, mały przekrój poprzeczny do wychwytu neutronów termicznych, zdolność do tworzenia stopów żaroodpornych, nadprzewodzących i innych, odporność na korozję, właściwości gettera, niska funkcja pracy elektronów, dobra urabialność pod niskim ciśnieniem i spawalność. Główne obszary zastosowań niobu to: rakieta, lotnictwo i technologia kosmiczna, radiotechnika, elektronika, inżynieria chemiczna, energia jądrowa.
Zastosowania niobu metalicznego- Części samolotów są wykonane z czystego niobu lub jego stopów; okładziny elementów paliwowych uranowych i plutonowych; pojemniki i rury; do metali ciekłych; części kondensatorów elektrolitycznych; „gorące” oprawy do lamp elektronicznych (do instalacji radarowych) i mocnych lamp generatorowych (anody, katody, siatki itp.); sprzęt odporny na korozję w przemyśle chemicznym.
- Inne metale nieżelazne, w tym uran, są stopowe z niobem.
- Niob stosowany jest w kriotronach – nadprzewodzących elementach komputerów. Niob jest również znany ze swojego zastosowania w strukturach przyspieszających Wielkiego Zderzacza Hadronów.
- Do produkcji elektromagnesów nadprzewodzących stosuje się cyniczek Nb 3 Sn oraz stopy niobu z tytanem i cyrkonem.
- Niob i stopy z tantalem w wielu przypadkach zastępują tantal, co daje świetny efekt ekonomiczny (niob jest tańszy i prawie dwukrotnie lżejszy od tantalu).
- Żelazoniob wprowadza się do nierdzewnych stali chromowo-niklowych w celu zapobiegania ich korozji i zniszczeniu międzykrystalicznym oraz do innych rodzajów stali w celu poprawy ich właściwości.
- Niob jest używany do bicia monet kolekcjonerskich. W związku z tym Bank Łotwy twierdzi, że w monetach kolekcjonerskich 1 łata stosuje się niob wraz ze srebrem.
- katalizator Nb 2 O 5 w przemyśle chemicznym;
- w produkcji materiałów ogniotrwałych, cermetali, materiałów specjalnych. szkło, azotek, węglik, niobiany.
- Węglik niobu (t.t. 3480 °C) stopiony z węglikiem cyrkonu i węglikiem uranu-235 jest najważniejszym materiałem konstrukcyjnym prętów paliwowych w jądrowych silnikach odrzutowych na fazę stałą.
- Azotek niobu NbN służy do wytwarzania cienkich i ultracienkich warstw nadprzewodzących o temperaturze krytycznej od 5 do 10 K z wąskim przejściem rzędu 0,1 K
Wysoka odporność korozyjna niobu umożliwiła jego zastosowanie w medycynie. Nici niobowe nie powodują podrażnień żywej tkanki i dobrze się do niej przylegają. Chirurgia rekonstrukcyjna z powodzeniem wykorzystuje takie nici do zszywania podartych ścięgien, naczyń krwionośnych, a nawet nerwów.
Zastosowanie w biżuteriiNiob ma nie tylko zestaw właściwości niezbędnych dla technologii, ale także wygląda całkiem pięknie. Jubilerzy próbowali wykorzystać ten biały, błyszczący metal do produkcji kopert zegarków. Stopy niobu z wolframem lub renem czasami zastępują metale szlachetne: złoto, platynę, iryd. To ostatnie jest szczególnie ważne, ponieważ stop niobu i renu nie tylko wygląda podobnie do metalicznego irydu, ale jest prawie tak samo odporny na zużycie. Pozwoliło to niektórym krajom zrezygnować z drogiego irydu w produkcji grotów lutowniczych do stalówek piór wiecznych.
Niob jako materiał nadprzewodzący pierwszej generacjiZadziwiające zjawisko nadprzewodnictwa, gdy wraz ze spadkiem temperatury przewodnika następuje w nim gwałtowny zanik oporu elektrycznego, po raz pierwszy zaobserwował holenderski fizyk G. Kamerlingh-Onnes w 1911 roku. Pierwszym nadprzewodnikiem okazała się rtęć, ale nie to, ale niob i niektóre międzymetaliczne związki niobu miały stać się pierwszymi ważnymi technicznie materiałami nadprzewodzącymi.
W praktyce istotne są dwie cechy nadprzewodników: wartość temperatury krytycznej, w której następuje przejście w stan nadprzewodnictwa oraz krytyczne pole magnetyczne (Kamerlingh Onnes zaobserwował także utratę nadprzewodnictwa przez nadprzewodnik pod wpływem odpowiednio silnego pola magnetycznego ). W 1975 roku międzymetaliczny związek niobu i germanu o składzie Nb 3 Ge stał się rekordzistą pod względem najwyższej temperatury krytycznej. Jego temperatura krytyczna wynosi 23,2°K; Jest to wyższa temperatura wrzenia wodoru. (Większość znanych nadprzewodników staje się nadprzewodnikami dopiero w temperaturze ciekłego helu).
Zdolnością do przejścia w stan nadprzewodnictwa charakteryzują się także cyniak niobu Nb 3 Sn, stopy niobu z aluminium i germanem czy też z tytanem i cyrkonem. Wszystkie te stopy i związki są już wykorzystywane do produkcji nadprzewodzących solenoidów, a także niektórych innych ważnych urządzeń technicznych.
- Jeden z aktywnie stosowanych nadprzewodników (temperatura przejścia nadprzewodzącego 9,25 K). Związki niobu mają temperaturę przejścia w stan nadprzewodnictwa do 23,2 K (Nb 3 Ge).
- Najczęściej stosowanymi nadprzewodnikami przemysłowymi są NbTi i Nb 3 Sn.
- Niob jest również stosowany w stopach magnetycznych.
- Stosowany jako dodatek stopowy.
- Azotek niobu służy do produkcji bolometrów nadprzewodzących.
Wyjątkowa odporność niobu i jego stopów z tantalem w przegrzanych parach cezu-133 sprawia, że jest to jeden z najbardziej preferowanych i najtańszych materiałów konstrukcyjnych do generatorów termionowych dużej mocy.